第九章_共价键和分子间作用力
分子间四大作用力

分子间四大作用力分子之间的相互作用力对于物质的性质和行为有着重要的影响。
在自然界中,有四种主要的分子间作用力,分别是离子键、共价键、氢键和范德华力。
下面将详细介绍这四种作用力及其在化学和生物学领域的重要性。
离子键是一种形成于正负电荷之间的强大电吸引力。
它是由于正离子(如钠离子)和负离子(如氯离子)之间的相互吸引而形成的。
这种类型的键通常在由金属和非金属元素组成的离子晶体中存在。
离子键具有高熔点和高沸点,因为需要消耗大量的能量才能克服离子之间的强电吸引力。
离子键在化学反应和物质的性质中起到重要作用,例如在盐的形成和溶解中。
共价键是由两个或多个原子共享电子而形成的。
它是最常见的化学键,主要存在于分子中。
共价键可以形成单键、双键或三键,这取决于原子之间共享的电子对数目。
共价键通常比离子键弱一些,因此具有较低的熔点和沸点。
共价键在有机分子的形成和化学反应中起到重要作用,例如在蛋白质和糖的构建过程中。
氢键是一种特殊的化学键,它通常形成在含有氢原子和电负性较高的氧、氮或氟原子之间。
它是由于氢原子与这些电负性较高的原子之间的电荷分布差异而产生的。
氢键通常比共价键和离子键弱一些,但比范德华力强。
氢键在生物分子(如DNA双链和蛋白质结构)的稳定性和生物学活性中起到重要作用。
范德华力是一种弱的、瞬时的电荷-电荷相互作用力。
它是由于分子之间电子云的瞬时极化而产生的。
范德华力通常是各种分子间相互作用力中最弱的一种。
然而,当许多范德华力作用在一起时,它们可以累积到足以影响物质的性质和行为。
范德华力在液体的表面张力、分子间吸引和气体中颗粒聚集等方面起到重要作用。
总之,离子键、共价键、氢键和范德华力是四个主要的分子间作用力。
它们的强度和性质不同,对物质的性质和行为起到不同的影响。
了解这些作用力对于理解化学和生物学中的各种现象和过程至关重要。
在实际应用中,我们可以利用这些作用力来设计合成新材料、开发新药物和优化化学反应。
化学键分子间作用力汇总

化学键分子间作用力汇总分子间作用力是指分子之间的相互作用力,包括化学键和非化学键。
化学键是指原子之间通过共用或转移电子而形成的强力相互作用力,而非化学键是指分子间的弱力相互作用力。
本文将对各种化学键和分子间作用力进行详细介绍。
一、共价键共价键是指两个原子通过共享电子而形成的键。
共价键的形成是靠原子之间的电子重新排布来完成的,形成的键通常是比较强的。
共价键通常有以下几种类型:1.单共价键:两个原子共享一个电子对,形成一对电子。
单共价键通常是较强的键,常见于碳、氢、氧、氮等元素之间的化学键。
2.双共价键和三共价键:当两个原子之间的电子不能通过单共价键满足,还可以通过双共价键或三共价键来共享更多的电子对。
双共价键和三共价键常见于含碳的有机化合物中。
3.金属键:金属键是指金属元素之间的共价键。
金属键通常是非常强大的键,具有很高的熔点和电导率。
二、离子键离子键是指通过正负离子之间的吸引力而形成的键。
离子键的形成通常发生在金属与非金属元素之间,非金属元素通常会通过转移电子成为带电离子,金属元素通常会失去电子成为带正电离子。
离子键通常是很强的键,因此离子化合物具有高熔点和良好的导电性。
三、金属键金属键是指金属元素之间的共价键。
金属键的形成是由于金属元素的特殊电子结构导致的,金属元素没有固定的价电子,而是形成了电子云。
这种电子云的形成使得金属元素之间的共价键成为了金属键。
金属键通常是非常强大的键,有很高的熔点和电导率。
四、氢键氢键是一种特殊的化学键,是指一个带有氢原子的分子与另一个带有强电负性原子(如氮、氧、氟等)的分子之间的相互作用力。
氢键比较弱,通常只有3-10%的共价键强度,但由于氢原子的小尺寸和高电荷密度,使得氢键对分子间的相互作用有很大的贡献。
氢键是生物和化学体系中很重要的分子间作用力,它对于分子的几何构型、物理性质和化学反应具有重要影响。
除了上述的化学键外,还有一些非化学键的分子间作用力:1.范德华力:范德华力是非极性分子之间的相互作用力,是由于分子中存在的临时性偶极引起的。
医用基础化学共价键和分子间作用力

共价键的概念和原理
概念
共价键是指通过共享电子,形成两个非金属原 子之间的化学键。它决定了分子的结构和性质。
原理
共价键的形成是原子为了完成最外层电子的稳 定,共同贡献电子形成的。它的长度和强度决 定于关联原子的尺寸和电负性之间的差异,越 小的差异和越小的原子,如氢,就越容易形成 共价键。
医用基础化学共价键和分 子间作用力
本演示将向您介绍医用基础化学中的共价键和分子间作用力,以及它们在药 物研发中的作用,是一次深入探讨化学原理的旅程。
化学的定义和重要性
1 定义
化学是一门研究物质结构、性质和变化的科学,不仅能帮助我们理解自然界中的现象, 还是研制医药和提高生活质量的重要基石。
2 重要性
3
微观世界的探索
最新技术和准确的分子计算方法,使我们可以深入探索分子的微观世界并开发具有高度 定制化的分子。
医用基础化学中的研究现状和未来发展趋 势
ห้องสมุดไป่ตู้
研究现状
随着药物研发中新的技术和方法的兴起,共价键和 分子间作用力的研究正在变得越来越重要。
未来趋势
新的计算机模拟和理论方法的发展,将加速我们对 分子之间细微交互的理解,这将有助于实现更好、 更安全和更高效的药物研发。
分子间作用力与生物学
从病毒的感染到人类DNA的复制,生物化学发现了 许多重要的分子间作用力。
共价键和分子间作用力在药物研发中的 作用
1
药效和毒性研究
药效和毒性,大多数药物的目标和副作用研究涉及到分子间相互作用力的调整和使用。
2
药物的发现与研发
通过这些知识,药物研发人员可以更好地设计药物分子,以便在人体内精确定位和交互, 提高药效并减少毒性。
共价键与分子间作用力

微粒之间的相互作用力 共价键
第二课时
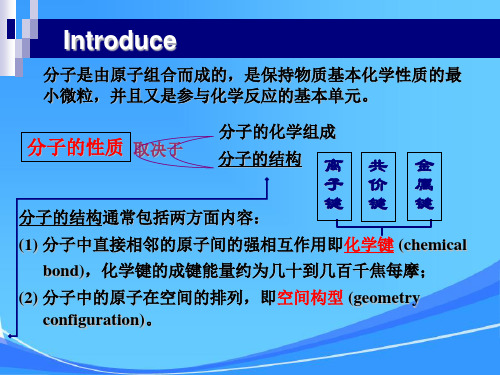
直接相邻的原子或离子间强烈的相互作用 化学键:___________________________________。
使带相反电荷的阴、阳离子结合的相互作用 离子键:____________________________________。 阴阳离子通过静电作用形成的化合物 离子化合物:________________________________。
分子间作用力(范德华力、氢键)与化学键 的比较
化学键 概念 范围 相邻原子间强烈的相 互作用 分子内或某些晶体内 分子间作用力 分子间微弱的相 -1 mol
约几到几十 kJ· -1 mol
主要影响分子晶体的 物理性质
性质影响 主要影响物质的化学 性质,同时影响离子 ,原子,金属晶体的 熔沸点
共价分子中各原子有一定的连接方式,分子有一定 的空间结构,可用球棍模型、比例模型表示其空间结构。
5、共价分子的空间构型
一般对称的几何形状:
直线形、正三角形、正四面体。 如直线型分子CO2、CS2、C2H2 ; 正三角形分子BF3; 正四面体分子CCl4、CH4等。
CO2分子的空间结构
CS2
BF3
作用范围 分子内原子间
作用力强 弱 影响的性 质 较 强
分子之间
主要影响 化学性质
与化学键相比 弱的多 主要影响物理性 质(如熔沸点)
课堂练习
离子键、共价键、分子间作用力都是微粒间 的作用力。下列物质中,只存在一种作用力 的是 ( B )
A.干冰
D.I2
B.NaCl
E.H2SO4
C.NaOH
分子间作用力如何影 响物质的物理性质?
新键形成 H Cl 释放能量 Cl
共价键与分子间作用力

共价键与分子间作用力共价键和分子间作用力是化学中两个重要的概念,它们对物质的性质和行为起着决定性的作用。
本文将重点介绍共价键和分子间作用力的概念、类型、特点以及它们在化学反应和物质性质中的应用。
共价键是两个非金属原子间由电子对共享而形成的一种化学键。
在共价键中,原子不会失去或得到电子,而是共享电子,以满足各自的外层电子壳。
共价键的形成能力取决于原子的电负性差异。
电负性是一个原子吸引其共享电子的能力,与原子核的吸引力有关。
共价键分为偶极共价键和非极共价键两种类型。
偶极共价键是指共价键中的电子对更多地靠近一个原子,使其带有相对正电荷,另一个原子则带有相对负电荷。
非极共价键是指共价键两端的原子相对电荷均相等,电子对靠近两个原子中间。
具体来说,如果两个原子电负性相等,那么形成的是非极共价键;如果两个原子电负性差异较大,那么形成的是偶极共价键。
除了共价键,分子间作用力也是分子间相互作用的重要力量。
分子间作用力指的是靠近的两个分子之间的相互作用力。
它是由于分子间的静电相互作用、分子之间的取向相互作用和分子之间的诱导相互作用所导致的。
静电相互作用是一种非共价相互作用力,其中相互作用的分子带有正电荷或负电荷。
根据库仑定律,两个带电荷的物体之间的引力或斥力与它们之间的距离和电荷量成正比。
因此,静电相互作用力对于离子之间的相互作用是非常重要的。
取向相互作用是由于两个极性分子之间的分子极性导致的相互吸引。
极性分子的极性取决于分子中的原子电负性差异。
在这种情况下,正极和负极之间的相互作用力具有较大的分子之间作用力。
诱导相互作用是由于无极性分子中的电子云的瞬间分布的改变而引起的。
当一个原子或分子靠近另一个无极性原子或分子时,它的电子云会更集中地分布在远离相互作用区域的一侧。
这将导致另一个原子或分子的电子云在与之相对的另一侧更加分散。
因此,在周围电子云的引导下,两个无极性分子之间会发生诱导相互作用,由此产生相互作用力。
除了静电相互作用、取向相互作用和诱导相互作用外,范德华力也是一种分子间作用力。
共价键及分子间作用力
243
N---N 110
946
Br- Br 228
193
C- H 109
414
I- I 267
151
O- H 96
464
4、键角(bond angle)
键角:分子中同一原子形成的两个化学键间的夹角。
: : :
C l 124 o 21 '
111 o18 ' C = O Cl
N
H
H F 107o18'
l/pm E/(kJ·mol-1)
l/pm E/(kJ·mol-1)
H- F 92
570
H- H 74
436
H- Cl 127
432
C- C 154
346
H- Br 141
366
C--C 134
602
H- I 161
298
C---C 120
835
F- F 141
159
N- N 145
159
Cl- Cl 199
核间距 R0为74 pm。
共价键的本质——原子轨道重叠,核间电子概率密度大吸引原 子核而成键。
二、价键理论基本要点与共价键的特点
1、价键理论基本要点:
(1)两原子靠近时,自旋方向相反的未成 对的价电子可以配对,形成共价键
(2)自综旋方上向所相反述的,单电价子健配对理形论成共认价为键后共,价就不键能是再和 通其过他自原子旋中相的单反电的子配电对子。 配对和原子轨道的 最原大子重中单叠电而子数形决成定了的共,价键使的体数目系—达共价到键能的饱量和最性。
大 大
较低,较稳定
π键 ““肩碰肩””
与轨道对称轴相互平行方向 两块冬瓜状,节面对称
共价键分子间作用力

注意:发生物理变化需克服分子间作用力 (如碘的升华),发生化学变化需破坏化学 键,因为化学变化的本质是旧键的断裂,新 键的形成,如 水的分解需破坏共价键
离子键和共价键的比较
离子键
共价键
成键微粒
阴、阳离子
原子
成键本质
静电作用
共用电子对
表示法
以NaCl为例
Na+ [ ··Cl··]-
成键元素 活泼金属元素、活泼 的非金属元素之间
范德瓦耳斯,荷兰物理学 家。他首先研究了分子间 作用力,因此,这种力也将水加热到100℃,水便会沸腾;而要使水 分解成氢气和氧气,却需要将水加热至1000℃这样的高温 才会有水部分分解。由此我们能得出什么结论?
H-O-H分解需要破坏共价键;而水沸腾需要克 服分子间作用力,它们所需的能量不同,说明 了分子间作用力比化学键弱
球棍模型
H2O V型
比例模型
NH3 三角锥型 CH4 正四面体
CO2 直线型
P14 “观察与思考”
有机化合物中碳原子的成键方式
4 4
成键
碳碳单键、 碳碳双键和碳碳叁键
决定
碳链 碳环
返回
我们知道,分子内相邻原子之间存在着强 烈的相互作用。那么,分子之间是否也有相 互作用呢?
三、分子间作用力
1、概念:分子间存在将分子__聚__集__在__一__起__的作用力 2、特点:比化学键_弱___得多 3、对物质性质的影响:分子间作用力影响由分子构 成的物质的_熔__、__沸__点___和__溶__解__性_____。
二、电子式的写法:
(各原子最外层一般都要达到2个或8个电子的稳定结构) 注意:差多少个稳定就配多少对,少的原子写在中间
结构式:在化学上常用一根短线来表示一对共用电子
分子间作用力的四种形成方式

分子间作用力的四种形成方式分子间作用力是分子之间相互作用的力量,它是物质存在和物质性质产生的基础。
分子间作用力的形成方式有四种,分别是范德华力、氢键、离子键和共价键。
一、范德华力范德华力是分子间最常见的一种作用力,它是由于分子内部电子的运动导致的。
分子中的电子在空间中的运动会引起电荷分布的不均匀,从而形成一种瞬时的偶极矩。
这种偶极矩会与附近的分子偶极矩相互作用,产生吸引力,即范德华力。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
二、氢键氢键是指分子中氢原子与氧、氮、氟等高电负性原子之间的相互作用。
氢键的形成需要具备三个条件:①氢原子与较电负的原子之间的键能较强,如氢原子与氮原子之间的键能;②氢原子与较电负的原子之间的距离适当,一般在1.5-2.5埃之间;③氢键的形成需要在分子中存在较为稳定的空间构型。
氢键的强度介于共价键和离子键之间,它对物质的性质起到重要的影响。
三、离子键离子键是指由正离子和负离子之间的静电作用力形成的化学键。
在离子键中,正离子和负离子之间相互吸引,形成离子晶体的结构。
离子键的强度较大,使离子晶体具有高熔点、高硬度和良好的导电性等性质。
离子键的形成需要具备两个条件:①正离子和负离子之间的电荷差异较大;②正离子和负离子之间的距离较近。
四、共价键共价键是指由两个非金属原子共享电子而形成的化学键。
在共价键中,原子之间通过电子的共享而相互吸引。
共价键的强度较大,使得共价化合物具有较高的熔点和沸点。
共价键的形成需要满足两个条件:①原子之间的电负性差异较小;②原子之间的距离适当。
共价键的形成可以是单一共价键、双键或者三键,共价键的类型决定了化合物的性质。
分子间作用力的四种形成方式分别是范德华力、氢键、离子键和共价键。
这些作用力对物质的结构和性质具有重要的影响,深入了解分子间作用力的形成方式有助于我们更好地理解物质的性质和相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1) 按原子轨道重叠方式不同共价键分为
键 (sigma bond) : 两个原子的原子轨道(s-s、px-s、px-px)
沿着键轴方向以“头碰头”的方式重叠形成的共价键。
键(pi bond) : 是两个原子的原子轨道(py-py、pz-pz)沿键
轴方向以“肩并肩”的方式重叠形成的共价键。
s-s、px-s、px-px
“头碰头” 沿键轴呈圆柱型对
称分布
可单独存在
牢固
ቤተ መጻሕፍቲ ባይዱ
π键
py-py、pz-pz “肩并肩” 垂直于键轴呈 镜面反对称分布 不可单独存在 ,只 与σ键共存于 共价双键和叁键中
不牢固,易断裂
课堂练习
(四) 共价键的类型
试指出下列共价键中各有几个σ键和π键? A. C—C, B. C C, C. C C
三、杂化轨道理论 (hybridization orbital theory) 基本要点:
• 1 杂化与杂化轨道的概念 • 2 杂化类型与分子的几何构型 • 3 等性杂化与不等性杂化
第一节 共价键和共价化合物
二、 键参数(bond parameter)(键能、键长、键角)
1、键能(bond energy, E):
在一定温度和标准压力下断裂1mol共价键所需能量
一般地,键能越大,化学键越牢固,分子也就越稳定。
离解能(D):在一定温度和标准压下将1mol理想气态分子离 解成理想气态原子所需要的能量。
3、共价键的方向性
一、 现代价键理论 (Valence bond theory,VB法)
共价键的形成将尽可能沿着原子轨道最大程度重叠的方向
进行。成键两原子轨道重叠愈多,形成的共价键愈牢固。
举例:HCl分子的形成
(a) 有效重叠
(b) 无效重叠 (c) 无效重叠
一、 现代价键理论 (Valence bond theory,VB法)
记为 H+ ←∶NH3
非极性共价键与极性共价键
(3) 按共用电子对是否偏移可分为:
非极性共价键 (nonpolar covalent bond)
▪ 同种原子形成的共价键。 ▪ 例如H2、O2、N2等分子形成非极性共价键。
极性共价键 (polar covalent bond)
▪ 不同种的原子形成的共价键。 ▪ 例如NH3分子中N-H键,H2O分子的O-H键等。
解: 1、碳碳单键为σ键; 2、碳碳双键中1个为σ键,另外1个为π键; 3、碳碳叁键中1个为σ键,另外2个为π键。
正常共价键与配位键
(2) 按共用电子对来源不同可分为: 正常共价键:成键两原子各提供1个单电子形成共价键。 特殊共价键:配位键(coordinate bond)
成键原子一方有孤对电子; • 形成条件 另一方有空轨道。 • 记为 B ←∶A
键(s-s)、 (s-px)
s-s
头碰头重叠
s-px
键( px - px)
头碰头重叠
键 py-py 或 pz-pz
肩并肩重叠
N2分子形成示意图
1s 2s
2p
在具有双键或叁键的两个原子之间,有且仅有一个键。
键和 键的比较
共价键类型 成键轨道
轨道重叠方式 轨道重叠部分
分布
存在情况
稳定性
σ键
二、 键参数
3、键角(bond angle) 分子中两个相邻化学键之间的夹角
键长和键角是描述分子几何构型的两要素
例如:CO2 ,键长116.2pm,键角180°,直线型。 NH3:键长101.9pm,键角107°18′,三角锥型。
116.2pm
O
180°
C
107°18′
N
OH
101.9pm
H
H
第一节 共价键和共价化合物
二、 键参数
2、键长(bond length) 分子内成键两原子核间的平均距离
一些共价键键能和键长
H-F H-Cl H-Br H-I 键长/pm 92 127 141 161
键能 /kJmol-1 570 432 366 298
在两个确定的原子之间,若形成不同的化学键,其键长 越短,键能就越大,分子就越稳定。
如 H· + ·H → H∶H 或H-H 分子中的通过共用电子对连接的化学键称为共价键。
第一节 共价键和共价化合物
一、 现代价键理论 (Valence bond theory,VB法) (一)氢分子的形成和共价键的本质
[本质]两个自旋相反的单电子所处原子轨道有效的、最大程度 的重叠,使电子云密集于两核之间,增强了核对电子的吸引力, 降低了核之间的斥力,使系统能量降低,形成共价键。
一、 现代价键理论 (Valence bond theory,VB法)
(二) VB法要点
1、电子配对原理:两原子接近时,自旋相反的未成对价电子 可以两两配对形成共价键。
2、共价键的饱和性:一个原子有几个未成对电子便可与几个 自旋相反的单电子配对成键。
(1)He 原子没有单电子,不能形成He2 分子; (2)O原子有2个单电子,可以形成H2O、O2分子; (3)N原子有3个单电子,可以形成N2 、NH3分子。
第九章 共价键和分子间作用力
第一节 共价键和共价化合物 一、现代价键理论 二、键参数 三、轨道杂化理论 四、价层电子对互斥理论 五、分子轨道理论
第二节 分子间作用力
第九章 共价键和分子间作用力
原子 化学键 分子 分子间作用力 宏观物质 ➢ 化学键(chemical bond):
分子中相邻的两个或多个原子之间强烈的相互作用力。
离子键(ionic bond) 共价键(covalent bond) 金属键(metallic bond) ➢ 分子间作用力: 分子之间弱的相互作用力。 范德华力(van der Waals force)
氢键(hydrogen bond)等。
第一节 共价键和共价化合物
共价键电子理论: 1916年美国化学家Lewis提出 要点: 认为两个或多个原子可以相互“共有”一对或多对 电子,以达到稀有气体原子最外层2或8电子层结构(或称 Lewis结构)而形成稳定的分子。
H2(g) = H(g) + H(g)
DH-H = 436 kJ·mol-1 = EH-H
H2O(g) = OH(g) + H(g) OH (g) = O (g) + H(g)
DH-OH = 502 kJ·mol-1 DH-O = 423.7 kJ·mol-1
EHO
502 423.7 2
462.8(k J mol1 )
