医学研究登记备案信息系统使用指南
研究者发起的临床研究质量管理体系建设

研究者发起的临床研究质量管理体系建设作者:张卿高源黄轶刚张长青张力来源:《上海医药》2024年第05期摘要我國研究者发起的临床研究(investigator-initiated trial, IIT)数量持续增加,同时其研究质量问题也逐渐凸显。
如何建设和优化医疗卫生机构IIT质量管理体系,提升研究质量,成为医疗卫生机构管理者关注的焦点之一。
本文梳理国际/我国质量管理标准,结合IIT质量管理实践,提出应将质量管理的基本原则、要求和方法应用于医疗卫生机构IIT质量管理体系建设。
医疗卫生机构管理者须根据IIT的特点建设与IIT相适宜的质量管理体系,以保障受试者的权益和安全,确保研究数据的真实性和可靠性。
关键词研究者发起的临床研究质量管理体系质量管理标准中图分类号:R197; R951 文献标志码:C 文章编号:1006-1533(2024)05-0009-05引用本文张卿,高源,黄轶刚,等. 研究者发起的临床研究质量管理体系建设[J]. 上海医药, 2024, 45(5): 9-13; 76.基金项目:上海市卫生健康委员会卫生健康政策研究课题(2023HP40);上海申康医院发展中心“临床三年行动计划”项目(SHDC2022CRS048、SHDC2023CRS030);上海申康医院发展中心管理研究项目(2023SKMR-30);上海市科学技术委员会“科技创新行动计划”软科学研究项目(23692113100)The construction of quality management system for investigator-initiated trialsZHANG Qing1, GAO Yuan1, HUANG Yigang2, ZHANG Changqing2, ZHANG Li1(1. Clinical Research Center, Tongji Hospital, Tongji University, Shanghai 200065,China; 2. Department of Orthopedics,Shanghai Sixth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200233, China)ABSTRACT The number of investigator-initiated trial (IIT) has increased continuously in our country and meanwhile the quality of their studies is gradually becoming prominent. How to construct and optimize quality management system (QMS) of IIT and improve IIT quality has become one of the focuses of managers in the medical and health institutions. This article sorts out international and domestic quality management standards including principles, requirements and methods,analyzes the application in the IIT-QMS construction, and proposes applicability, reference significance and specificity of the quality management standards for IIT-QMS construction. These standards would guide medical and health institutions to construct the effective QMS in order to ensure the rights and safety of subjects and the authenticity and reliability of research data.KEY WORDS investigator-initiated trial; quality management system; quality management standards近年来,在国家“全面加强临床医学研究”,鼓励医疗卫生机构积极开展临床研究的政策支持下[1-2],研究者发起的临床研究(investigator-initiated trial, IIT)蓬勃发展。
浙江省药物临床试验机构监督检查指南

浙江省药物临床试验机构监督检查指南为规范浙江省药物临床试验机构监督检查,根据《药物临床试验机构管理规定》《药物临床试验质量管理规范》《浙江省药物临床试验机构监督管理办法(试行)》,制定本指南。
一、适用范围本指南适用于浙江省辖区内的药物临床试验机构首次监督检查、日常监督检查和有因检查。
机构内部自查、质控可以参考本指南。
二、检查内容检查内容分为药物临床试验组织管理机构、伦理委员会、专业和项目管理四个部分,包含对备案条件、机构运行管理、项目实施等方面的检查内容,共103个检查项目。
首次监督检查内容包括药物临床试验组织管理机构、伦理委员会和专业;日常监督检查包括药物临床试验组织管理机构、伦理委员会、专业和项目管理;有因检查根据具体情形开展针对性检查。
三、检查程序监督检查按照《浙江省药物临床试验机构监督管理办法(试行)》的相关程序开展。
检查结束后,检查组应告知被检查机构于10个工作日内将整改报告报送组织检查单位。
组织检查单位可对检查组的缺陷分级和检查结果进行调整,但需记录理由,并由经办人向检查组反馈调整结果。
组织检查单位在收到检查报告和整改报告后20个工作日内完成审核并出具监督检查意见,并将检查情况和监督检查意见录入国家药品监督管理局“药物和医疗器械临床试验机构备案管理信息系统”(以下简称“国家备案平台”)和浙江省药品监督管理局“药物临床试验机构监管平台”(以下简称“省监管平台”)。
对检查发现不符合机构或专业备案条件的,由省级药品监管部门提请国家药品监督管理局取消该机构或专业备案。
涉及违法行为的,依法查处,并向省级卫生健康主管部门通报。
四、检查缺陷分级检查项目分为关键项目(标示为“★”)、主要项目(标示为“▲”)和一般项目(无标示),不符合相应检查项目的缺陷等级分别为“严重缺陷”、“主要缺陷”和“一般缺陷”。
关键项目和主要项目应有而实际无对应内容的,检查组可直接判定为“严重缺陷”、主要缺陷”;如关键项目和主要项目内容不完善,检查组可视具体检查情况判定缺陷等级。
医学研究登记备案信息系统填报指南

医学研究登记备案信息系统填报指南一、填报指南概述二、填报人员准备1.准备相关材料:研究计划书、研究者承诺书、伦理委员会批准文件等;2.熟悉研究项目的相关规定和要求;3.确定填报人员身份,例如主要研究者、研究团队成员等。
三、填报步骤详解1.登录系统:打开医学研究登记备案信息系统网页,进入登录界面;2.注册账号:如果是第一次登录,需要点击注册按钮进行账号注册;3.填写用户信息:根据系统提示,填写用户基本信息,例如姓名、职务、所在单位等;4.研究项目申报:点击申报按钮,进入研究项目申报界面;a.填写基本信息:按照系统要求,填写研究项目的基本信息,包括项目名称、研究类型、起止时间等;b.填写研究目的和背景:简要说明研究项目的目的和背景;c.填写研究方法:详细描述研究项目采用的方法和步骤;d.填写研究人员信息:按照系统要求,填写主要研究者和研究团队成员的信息;e.填写伦理委员会批准信息:填写伦理委员会批准研究项目的时间和编号;g.上传相关文件:按照系统要求,上传研究计划书、研究者承诺书、伦理委员会批准文件等相关材料;5.提交申报:确认填写无误后,点击提交按钮,完成研究项目的申报;6.申报审批:等待系统进行研究项目申报的审批流程,根据系统消息或邮件通知查询申报结果。
四、填报注意事项2.确保填写信息的准确性和完整性,避免漏填或填写错误;3.上传的相关材料应符合系统要求的格式和大小,确保文件的清晰可读;4.在填报过程中遵守相关研究伦理规范和要求,确保研究项目的合法性和科学性;总结:医学研究登记备案信息系统填报是一个重要的流程,需要研究人员注意填写信息的准确性和完整性,遵守伦理规范和要求。
正确填报信息能够提高研究项目的规范性和可信度,为医学研究的进展和发展提供有力支持。
国家医学研究登记备案信息系统操作说明

国家医学研究登记备案信息系统操作说明一、系统登录1.打开浏览器,输入系统网址。
2.在登录界面输入用户名和密码,点击登录按钮。
3.首次登录系统的用户需要进行密码修改,并设置安全问题和答案。
二、项目登记备案1.登录系统后,点击“项目管理”菜单,选择“项目登记备案”。
2.填写项目基本信息,包括项目名称、项目类型、负责人姓名、申请单位等。
3.填写项目详细信息,包括研究目的、研究内容、研究方法等。
4.填写研究人员信息,包括姓名、从事医学研究年限、研究经历等。
5.填写研究机构信息,包括机构名称、机构地址、机构负责人等。
7.提交项目登记备案申请。
三、项目审核1.登录系统后,点击“项目管理”菜单,选择“待审核项目”。
2.系统会列出待审核的项目列表。
3.点击相应项目,查看项目详细信息。
4.根据规定的审核标准,对项目进行审核。
5.审核通过的项目,可以选择通过或者退回修改。
6.填写审核意见,点击提交审核结果。
四、项目修改1.登录系统后,点击“项目管理”菜单,选择“待修改项目”。
2.系统会列出待修改的项目列表。
3.点击相应项目,查看项目详细信息。
4.根据审核意见,对项目进行修改。
5.修改后的项目需要重新提交审核。
五、项目备案1.登录系统后,点击“项目管理”菜单,选择“待备案项目”。
2.系统会列出待备案的项目列表。
3.点击相应项目,查看项目详细信息。
4.根据审核意见和修改情况,对项目进行备案。
5.填写备案意见和备案编号,点击备案提交。
六、项目查询和统计1.登录系统后,点击“项目统计”菜单,选择“项目查询与统计”。
2.输入相关查询条件,如项目名称、负责人姓名等。
3.系统会根据条件查询项目列表。
4.可以根据需要导出查询结果。
七、用户管理1.登录系统后,点击“系统管理”菜单,选择“用户管理”。
2.可以对用户进行添加、删除、修改等操作。
八、系统设置1.登录系统后,点击“系统管理”菜单,选择“系统设置”。
2.可以对系统参数进行设置,如备案申请有效期、审核标准等。
福建省卫生健康委员会关于开展医疗卫生机构临床研究项目备案工作的通知

福建省卫生健康委员会关于开展医疗卫生机构临床研究项目备案工作的通知文章属性•【制定机关】福建省卫生健康委员会•【公布日期】2020.09.09•【字号】闽卫科教函〔2020〕459号•【施行日期】2020.09.09•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】卫生医药、计划生育其他规定正文福建省卫生健康委员会关于开展医疗卫生机构临床研究项目备案工作的通知闽卫科教函〔2020〕459号各设区市卫健委、平潭综合实验区社会事业局,委直属各单位,福建医科大学、中医药大学各附属医院:为进一步加强临床研究管理,促进临床研究规范有序发展,根据《涉及人的生物医学研究伦理审查办法》(国家卫生和计划生育委员会令第11号)《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)《医疗卫生机构开展临床研究项目管理办法》(国卫医发〔2014〕80号)及国家卫生健康委有关要求,从本通知下发起,对全省医疗卫生机构开展的临床研究项目开展全面备案管理,现就有关要求通知如下:一、备案范围全省各级各类医疗卫生机构由本机构研究者发起的、非以产品注册为目的的临床研究项目。
二、备案程序临床研究项目备案采取线上方式。
医学研究登记备案信息系统网址:http://114.255.48.20(以下简称系统),于2020年9月1日开放运行,具体操作详见系统首页指南。
(一)干细胞临床研究项目备案。
按照《福建省卫生健康委员会福建省药品监督管理局关于印发福建省干细胞临床研究机构与项目备案实施细则(试行)的通知》(闽卫科教〔2019〕98号)执行。
(二)体细胞临床项目备案。
在新的管理要求出台前,2020年1月1日起尚无受试者入组的体细胞临床研究,参照《干细胞临床研究管理办法(试行)》管理,具体备案流程参照闽卫科教〔2019〕98号执行。
(三)其他临床研究项目。
项目负责人按照要求填报有关项目信息,由医疗卫生机构按规定组织开展学术和伦理等相关审查后,提交本机构执业登记的卫生健康行政部门。
山东省病原微生物实验室及实验活动备案管理系统使用说明

具体操作界面如下图所示(图41)
主要用于查找本部门和上级部门的文档,并可对本部门的文档进行“修改"、“更新”操作。设定好查询条件后,可查询相应的数据结果。查询界面如下图所示:(图42)
6
主要用于规范备案编号的编码说明,请按照具体的编码规则对备案文档进行编号。(图43)
2.
提供实验室用户业务功能导航,包括业务中心,档案分类两大子功能。(图8)
业务中心:是系统中主要的业务处理模块。包括“上传备案申请”、“申请及通知查询"、“备案通知"功能。
档案文件:用于分类查看以往的档案记录。包括“当前单位文档”、“卫生厅(局)文档"。
左侧边栏的黑三角框,用户点击后,可将左侧导航栏收起,以获得更大的主界面窗口。再次点击该三角,导航栏会再次弹出。
实验室用户根据注册提示填写必要的注册信息,请确保用户信息的真实和完整,尤其是所属卫生局(单位),请慎重选择。按照页面提示录入信息,填写完毕后,点击“提交注册信息”按钮。
用户注册成功后,自动弹出界面,如下图所示(图3):
如果注册未成功,请按照系统给出的错误提示,修改相应的错误信息后,继续注册.
带*的选项为必填项,请用户认真填写。
实验室用途和检测项目类别,可点击该条目,弹出多项选择矿.按住“ctrl”键,同时点击符合用户需要的类别,点击红色按钮或双击,该选项在右侧窗口中即可,选择完成后点击确定.如下图所示(图11和图12)
3
文件没有审核前,或审核不通过时,用户可在操作栏下点击“修改”按钮进行修改。系统会自动弹出如下页面,用户可根据页面提示修改信息,点击相应文件后的“删除”按钮,可删除已上传文件,文件删除后,可重新选择要上传文件,点击“上传”,上传完成后,点击保存按钮。(见图17和图18)
医疗器械注册管理信息系统备案子系统使用说明

医疗器械注册管理信息系统备案子系统使
用说明
使用说明
一、系统运行环境要求
浏览器版本:支持IE8、IE9、IE10
屏幕分辨率要求:×像素及以上,建议根据个人电脑设置成最大
二、浏览器设置
为了保证能正常使用本系统的页面打印功能以及记住账号功能,请做以下设置:
添加本站点为信任站点步骤如下:
IE浏览器→工具→选项→安全→受信任的站点→站点→添加
删除浏览历史记录步骤如下:
IE浏览器→工具→选项→常规→退出时删除浏览历史记录(W)
设置“每次访问页面时”检查最新版本步骤如下:
IE浏览器→工具→选项→常规→设置→临时文件→每次访问页面时(E)
三、企业端用户注册
首次使用该系统的企业,通过用户注册功能完成注册如果企业用户登陆时忘记密码,请点击忘记密码功能,并输入用户注册时所填写的邮箱和用户名,便可找回
为了保证系统正常使用和使用安全,请系统用户牢记用户名和密码,切勿将用户名和密码等信息透露给他人
四、备案业务主要流程
备案申报用户需在线填写“备案表”,可按《第一类医疗器械产品目录》中的“产品名称”进行填写,系统提供下拉菜单选择功能;可手动填写产品目录之外的产品名称。
国家医学研究登记备案信息系统操作说明
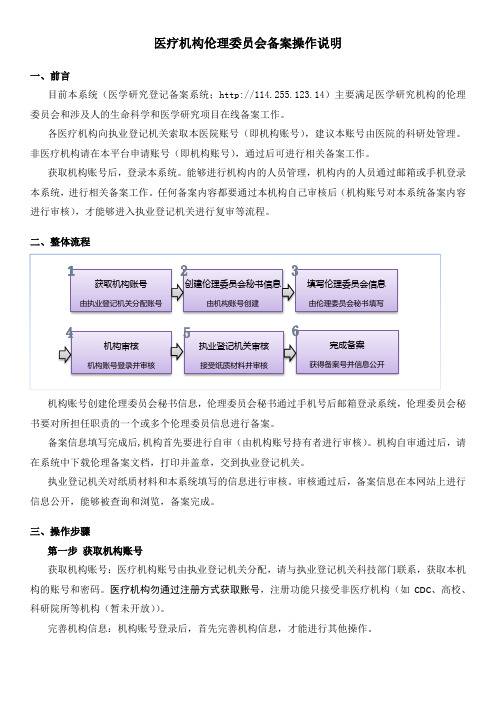
医疗机构伦理委员会备案操作说明一、前言目前本系统(医学研究登记备案系统;http://114.255.123.14)主要满足医学研究机构的伦理委员会和涉及人的生命科学和医学研究项目在线备案工作。
各医疗机构向执业登记机关索取本医院账号(即机构账号),建议本账号由医院的科研处管理。
非医疗机构请在本平台申请账号(即机构账号),通过后可进行相关备案工作。
获取机构账号后,登录本系统。
能够进行机构内的人员管理,机构内的人员通过邮箱或手机登录本系统,进行相关备案工作。
任何备案内容都要通过本机构自己审核后(机构账号对本系统备案内容进行审核),才能够进入执业登记机关进行复审等流程。
二、整体流程机构账号创建伦理委员会秘书信息,伦理委员会秘书通过手机号后邮箱登录系统,伦理委员会秘书要对所担任职责的一个或多个伦理委员信息进行备案。
备案信息填写完成后,机构首先要进行自审(由机构账号持有者进行审核)。
机构自审通过后,请在系统中下载伦理备案文档,打印并盖章,交到执业登记机关。
执业登记机关对纸质材料和本系统填写的信息进行审核。
审核通过后,备案信息在本网站上进行信息公开,能够被查询和浏览,备案完成。
三、操作步骤 第一步 获取机构账号获取机构账号:医疗机构账号由执业登记机关分配,请与执业登记机关科技部门联系,获取本机构的账号和密码。
医疗机构勿通过注册方式获取账号,注册功能只接受非医疗机构(如CDC 、高校、科研院所等机构(暂未开放))。
完善机构信息:机构账号登录后,首先完善机构信息,才能进行其他操作。
创建伦理委员会秘书信息 由机构账号创建填写伦理委员会信息由伦理委员会秘书填写机构审核机构账号登录并审核获取机构账号由执业登记机关分配账号执业登记机关审核接受纸质材料并审核完成备案获得备案号并信息公开第二步创建伦理委员会秘书创建机构伦理秘书:完善机构信息后,在系统左侧菜单中,点击“人员管理”下的“伦理委员会秘书”菜单,进入“人员管理”界面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医学研究登记备案信息系统使用指南医学研究是指为了推动医学科学的发展和进步,更好地服务于人类健康,开展的系统性、实证性的科研活动。
为了规范和管理医学研究活动,保护研究参与者的权益,各国都设立了医学研究登记备案制度。
医学研究登记备案信息系统是管理和记录医学研究项目的平台。
本文将为大家介绍医学研究登记备案信息系统的使用指南。
一、系统登录与注册
1.访问医学研究登记备案信息系统的官方网站,点击登录按钮。
二、项目登记
1.登录后,点击项目登记,填写研究项目的基本信息,如项目名称、负责人、研究类型等。
2.填写研究项目的详细信息,包括研究目的、方法、样本容量、研究周期等。
3.提交项目登记申请,等待系统审核。
三、项目审批
1.系统管理员会对项目进行审批,审核通过后,项目状态变为“已批准”。
2.如果项目需要修改或补充材料,系统管理员会发送通知给负责人,负责人可以在系统中查看通知,并进行相应的修改。
四、项目执行
1.在项目执行过程中,可以随时登录系统更新项目进展情况。
2.如果项目中出现了重大变更,如研究方法、样本容量的修改等,需要申请项目修改,并经过系统管理员的审批。
五、项目结题
1.项目完成后,负责人可以在系统中申请项目结题。
2.填写项目结题的相关材料,如研究报告、原始数据等。
3.提交项目结题申请,等待系统管理员的审核。
六、数据管理
1.在项目执行过程中,可以在系统中上传和管理研究数据。
2.上传的研究数据需要符合科学、合法和道德的要求,保护研究参与者的隐私。
七、结果发布
1.在项目结题并通过系统管理员的审核后,可以在系统中发布研究结果。
2.发布的研究结果应当真实、可靠,并符合科学伦理要求。
八、查询与导出
1.登录系统后,可以根据项目名称、负责人等条件进行查询。
2. 查询结果可以导出为Excel表格或PDF文件,方便后续分析和使用。
九、用户管理
1.系统管理员可以管理用户账号,包括添加新用户、删除用户、修改用户权限等。
2.普通用户可以修改个人信息、修改密码等操作。
以上就是医学研究登记备案信息系统的使用指南。
通过系统的使用,可以更好地管理和规范医学研究项目,提高研究质量和透明度。
同时,通过系统的记录和查询功能,可以方便后续的数据分析和结果比对。
希望本文对大家了解医学研究登记备案信息系统有所帮助。
