血细胞分离技术
外周血细胞分离的方法有几种

外周血中除红细胞外,还有粒细胞、单核细胞和淋巴细胞及血小板等,通常是分离这些血细
胞的重要来源。
其分离方法有四种:自然沉降法、差异沉降法、氯化铵分离法、Ficoll分离法。
自然沉降法:
将无菌抗凝血放入试管中,在37℃水浴中静置,自然沉降1-2h,可见到红细胞下沉,并有明显分层,上层血浆中富含有大量的和淋巴细胞,下层主要为红细胞。
此方法简便但各层中
的细胞种类多,不纯。
血浆中虽以粒细胞、淋巴细胞为主,但也含有血小板,大单核细胞和
少量红细胞。
下层虽以红细胞为主,但也有上述各种细胞,此法适用于淋巴细胞转化试验。
差异沉降法:
用6%的右旋糖酐或3%的明胶溶液无菌消毒后,分装于中试管中,由于这些物质能使红细胞
形成“串状”,比粒细胞、淋巴细胞沉降速度快,因而可使红细胞与白细胞、淋巴细胞分离开。
其方法如下:用6%的右旋糖酐溶液5-10ml,经抗凝血5ml加入上层中混合后静置于37℃水
浴中30-60min,即可见红细胞下沉,上层富含大量粒细胞和淋巴细胞,下层为红细胞,使两
者易于分离开,取上层可用于粒细胞、淋巴细胞培养和实验,下层可用于红细胞培养和实验,经PBS洗3次后即可加入培养基培养,可用于天然白细胞干扰素的诱生和生产。
此法分离的细胞纯度也不高。
氯化铵分离法:
0.83%氯化铵(NH4CL)可使红细胞破裂,通常将分离获得的粒细胞。
淋巴细胞中混有的少
量的红细胞用0.83%氯化铵进行裂解,以排除红细胞的干扰。
另外,此法也适合大量粒细胞、淋巴细胞的分离制备,在天然白细胞干扰素诱生和生产中已被广泛应用。
血细胞样品分离操作规程

血细胞样品分离操作规程1. 引言本操作规程旨在规范血细胞样品分离的操作流程,保证分离的准确性和可靠性。
2. 材料和设备以下是进行血细胞样品分离所需的材料和设备:- 血样采集针头- 血样采集管- 血样分离试剂- 血样离心机- 血细胞分离管- 1 mL离心管3. 操作步骤请按照以下步骤进行血细胞样品分离:步骤1:血样采集1. 准备好血样采集针头和血样采集管。
2. 选择合适的采集部位,并用消毒棉球清洁皮肤。
3. 将血样采集针头插入皮肤,顺着血管方向将血样采集管连接到针头上。
4. 慢慢抽取足够的血量,并注意避免气泡进入采样管。
5. 采集完成后,拔出针头,将血样采集管标记并送至实验室。
步骤2:血样分离1. 在离心机中安装好血样离心管。
2. 将采集好的血样倒入血样离心管中。
3. 加入适量的血样分离试剂。
4. 将血样离心管放入离心机,以适当的转速离心一段时间。
5. 离心结束后,将血细胞分离管接到离心机出口处,同时打开离心机供气装置,将血细胞沉积到血细胞分离管中。
步骤3:血细胞储存1. 将血细胞分离管中的血细胞转移至1 mL离心管中。
2. 将1 mL离心管密封,并标明样品信息。
3. 将1 mL离心管置于低温冰箱中储存,或按照实验需要进行后续操作。
4. 注意事项1. 操作前要求严格遵守无菌操作规范,以避免污染血样。
2. 血样离心时,必须保持离心机平稳,避免移动或震动。
3. 操作过程中要注意安全,避免针头刺伤和离心机事故。
以上即为血细胞样品分离的操作规程,希望能对您有所帮助!如有任何问题,请随时咨询。
血细胞分离机

04
血细胞分离机的的发展趋势及前景
血细胞分离机的技术发展趋势
高通量
• 提高处理能力:满足临床和科研的需求 • 降低成本:通过技术创新降低设备成本
智能化
• 自动识别和优化:提高设备运行效率 • 远程监控和诊断:降低设备维护成本
无菌化
• 一次性耗材:减少感染风险 • 无菌技术:提高细胞分离的可靠性
血细胞分离机市场需求及预测
主要应用场景
• 血液病的治疗:白血病、淋巴瘤、骨髓增生异常综合症等 • 器官移植:肾脏、肝脏、心脏等 • 干细胞采集及再生医学:造血干细胞、神经干细胞、间充质干细胞等
血细胞分离机的工作原理及操作流程
工作原理
• 离心式:利用离心力将不同密度的细胞分离 • 过滤式:通过特定孔径的滤膜将细胞分离 • 免疫磁性式:利用免疫磁珠与目标细胞结合,再通过磁场将细胞分离
05
血细胞分离机的伦理及法律问题
血细胞分离机的伦理问题及争议
伦理问题
• 知情同意:确保患者在充分了解的情况下使用血细胞分离机 • 隐私保护:保护患者的个人信息和隐私 • 生命尊严:尊重患者的意愿和生命尊严
争议
• 技术应用:血细胞分离机在新兴领域的应用可能引发伦理争议 • 监管政策:政府对血细胞分离机的监管政策需要不断完善 • 伦理教育:提高医务人员和相关从业人员的伦理意识和素质
03
血细胞分离机的临床应用及效果
血细胞分离机在血液病治疗中的应用
应用
• 白血病:分离和纯化白血病细胞,用于疾病研究和治疗 • 淋巴瘤:分离和纯化淋巴瘤细胞,用于疾病研究和治疗 • 骨髓增生异常综合症:分离和纯化异常细胞,用于疾病研究和治疗
效果
• 提高治疗效果:为患者提供个性化的治疗方案,提高治疗效果 • 降低副作用:通过纯化细胞,降低化疗药物的副作用 • 提高生活质量:改善患者的生活质量,提高治愈率
血细胞分离培养方法和步骤-2

血细胞分离培养方法和步骤-2收集浑浊带分离获得的淋巴细胞,用无钙、镁离子的PBS洗3次后,再用培养基洗1次后计数,分瓶培养。
此法分离获得淋巴细胞纯度高。
分离液的制备:9% Ficoll(20℃下相对密度约1.020)24份与33.4%泛影葡胺(用泛影钠或Conray400也可,在20℃下相对密度约1.200)10份混合后,将其相对密度调至1.077金额可获得淋巴细胞分离液,于12 1℃高压蒸汽灭菌30min,室温保存备用。
若配制高相对密度的分离液用加入高浓度泛影葡胺来调整,若配制低相对密度的分离液用稀释的F icoll来调整。
(二)淋巴器官中淋巴细胞的分离:从脾脏、淋巴结、扁桃体或胸腺等器官中制备淋巴细胞悬液,在免疫学研究中是经常用到的。
方法如下。
无菌取上述淋巴器官,若为扁桃体,应将扁桃体在剥离外表的结缔组织和血块后,在含高浓度抗生素的洗液中4℃浸泡2-4h,以防污染。
将淋巴器官剪成碎块,用镊子压挤碎块,或在金属丝网上研磨,用洗液冲洗,或用玻璃匀浆器研磨,制成悬液。
自然下沉10min后,吸取上层细胞悬液,弃去下层沉淀的组织块,1500 r/min离心,取沉淀物,用无钙、镁离子的PBS洗2次后,混悬于培养基中,分瓶培养。
用上述分离法所获得的拎包细胞,可用于白细胞黏附移动试验、转化试验、细胞毒试验,同时可用于细胞因子的诱生和制备,或扩增外周血造血细胞、树突细胞、淋巴因子激活杀伤细胞(LAK细胞)、Tδ细胞等,供细胞移植用。
(三)人脐带血细胞分离培养:人脐带血来源方便,采集容易,对母婴均无伤害。
近年来研究表明,脐带血的血浆中富含许多高水平的造血活性物质,具有刺激和促进骨髓造血干/祖细胞增殖、分化和再植能力的功能,是造血生长因子的重要来源。
脐带血中富含类似于骨髓的造血干细胞,其中CFU-G、BFU-E、CFU-GM近似或高于正常成人骨髓和外周血中的造血干/祖细胞,比骨髓更原始,具有很强的自我复制和再植能力。
血细胞分离机的作用

血细胞分离机的作用
血细胞分离机是一种用于分离血液中的不同成分的医疗设备。
它通过特定的程序和离心技术,将血液中的红细胞、白细胞、血小板等成分分离出来,用于治疗各种疾病和进行科学研究。
血细胞分离机的作用包括:
1.成分分离:通过血细胞分离机,可以将血液中的各种成分分离出来,如红
细胞、白细胞、血小板等,用于不同疾病的治疗和诊断。
2.去除病理性细胞:血细胞分离机可以去除血液中的病理性细胞,如肿瘤细
胞、细菌、病毒等,从而达到治疗疾病的目的。
3.输血:血细胞分离机可以用于输血,将适量的血液成分输给患者,以补充
其血容量或改善其血液成分。
4.制备免疫细胞:血细胞分离机可用于制备免疫细胞,如淋巴细胞、单核细
胞等,用于免疫治疗和肿瘤治疗。
5.制备细胞培养基:通过血细胞分离机分离出的不同细胞成分,可用于制备
细胞培养基,用于细胞培养和生物医学研究。
总之,血细胞分离机在医疗和科研领域中发挥着重要作用,能够有效地分离血液中的不同成分,为各种疾病的治疗和诊断提供帮助。
血细胞分离技术
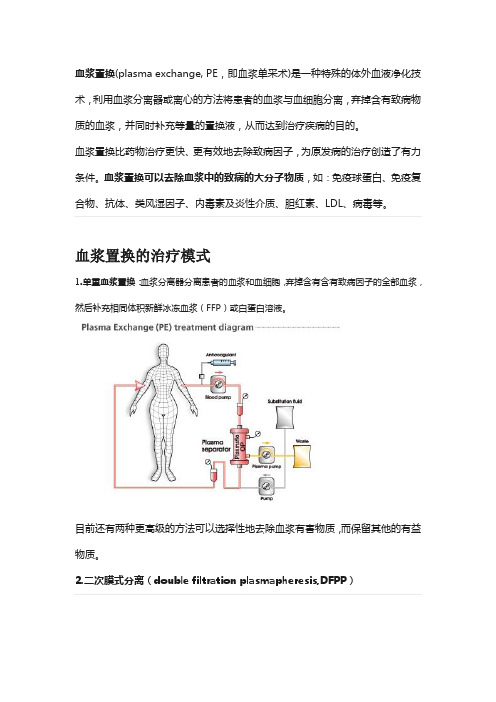
血浆置换(plasma exchange, PE,即血浆单采术)是一种特殊的体外血液净化技术,利用血浆分离器或离心的方法将患者的血浆与血细胞分离,弃掉含有致病物质的血浆,并同时补充等量的置换液,从而达到治疗疾病的目的。
血浆置换比药物治疗更快、更有效地去除致病因子,为原发病的治疗创造了有力条件。
血浆置换可以去除血浆中的致病的大分子物质,如:免疫球蛋白、免疫复合物、抗体、类风湿因子、内毒素及炎性介质、胆红素、LDL、病毒等。
血浆置换的治疗模式1.单重血浆置换:血浆分离器分离患者的血浆和血细胞,弃掉含有含有致病因子的全部血浆,然后补充相同体积新鲜冰冻血浆(FFP)或白蛋白溶液。
目前还有两种更高级的方法可以选择性地去除血浆有害物质,而保留其他的有益物质。
2.二次膜式分离(double filtration plasmapheresis,DFPP)首先是用一级血浆分离器分离患者的血浆和血细胞,然后再用孔径较小的二级滤器分离出大分子致病物质(如:球蛋白和免疫复合物),而保留宝贵的白蛋白等中分子物质。
3.血浆吸附(plasma adsorption,PA)血浆分离器分离患者的血浆和血细胞,然后血浆再经过吸附柱,选择性地去除有害物质分。
血浆置换的临床应用目前血浆置换可应用于临床上多种疾病,具体如下:1.肾脏风湿疾病:抗肾小球基底膜病(抗GBM病)、血栓性血小板减少性紫癜、冷球蛋白血症、ANCA相关性小血管炎、肾移植后超急性或急性抗体介导的排异反应、肾移植后FSGS复发、噻氯匹定/氯吡格雷相关的血栓性微血管病、SLE及狼疮性肾炎、类风湿关节炎,溶血性尿毒症综合征等。
2.脓毒血症和多器官功能障碍综合征3.神经系统疾病:格林-巴利综合征、重症肌无力、慢性炎性脱髓鞘多发性神经病、儿童自身免疫性神经精神障碍合并链球菌感染、IgG/IgA相关脱髓鞘多发性神经病,急性播散性脑脊髓膜炎、多发性硬化。
4.代谢性疾病:家族性高胆固醇血症、甲亢危象、淀粉样变性。
血细胞的分离方法(中性粒细胞、嗜碱性粒细胞、外周淋巴细胞和单

血细胞的分离方法(中性粒细胞、嗜碱性粒细胞、外周淋巴细胞和单血细胞由红细胞,白细胞,血小板等组成.实验中常用白细胞来做研究,如炎症渗出,细胞迁移,识别等都涉及到白细胞.白细胞又分为:粒细胞,淋巴细胞,单核细胞等.它们具有不同的功能.实验中常需要分离血细胞方能进行。
这里主要论述人外周白细胞的分离,主要是中性粒细胞(Neutrophi l),淋巴细胞(Lymphocyte),单核细胞(Monocyte)的分离。
其它骨髓,脾淋巴细胞等分离可参,不同种属间请注意分离液的选择。
细胞分离中需要注意的几个问题1.如果您要做细胞培养,记住实验中所用的试剂(分离液,洗涤液等)、器械等都要是无菌消毒的,并注意实验中的无菌操作。
2. 离心转速单位及时间:目前国外的文献报道基本上用g为单位,注意g和转速(rpm)的换算。
3.离心温度:有的要求室温,有的要求4摄氏度。
实验的操作要求尽可能熟练,连贯。
4.在用Ficoll分离单个核细胞(PBMC)时,通常含有少量的红细胞,对于一般的实验影响不大,如果实验要求较高,可采取裂解液(有的需要无菌),并注意裂解时间控制,以免影响单个核细胞的活性。
5. 在用Percoll配不连续梯度时(一般用高渗NaCl),注意各成份体积的准确性,否则密度与预期的不一样,影响分离效果。
6.用全血离心效果比全血稀释后再离心效果差,稀释一般等体积稀释一倍。
7.分离液与样本的体积比:一般应小于1:2(即一般为1体积分离液,2体积样本,不宜超过2体积,小于2体积均可)8.洗涤液的成分:不同文献报道不一,有的使用PBS,有的为Hank’s,KRP等,可自己选定。
主要是离子浓度及成份的不同,有的含有 Mg2+, Ca2+。
9. 细胞活性:0.2%台盼蓝染色3-5分钟,镜下观察计数死亡细胞(蓝染)。
中性粒细胞分离的方法1、标准方法:Ficoll-泛影钠(Ficoll-Hypaque)密度梯度及红细胞裂解法1)取一50ml聚乙烯管,无菌采集人外周静脉血,加4.4ml3.8%或5%的柠檬酸盐液定容至40ml。
红细胞分离

红细胞分离红细胞分离是指将人体外周血中的红细胞与其他细胞分离出来的一种生物学技术,广泛应用于临床病理诊断、血库工作、药物研制、基础研究等领域。
本文将探讨红细胞分离的原理、方法与应用。
一、红细胞分离的原理血细胞的分离是根据细胞的理化特性进行的,不同类型的细胞在大小、密度、电荷、抗原等方面存在差异。
红细胞的密度为1.09g/cm³,体积大约为6.8×10^-14L,根据不同的特性,可以采用离心、梯度离心、免疫学、磁性等方法进行红细胞的分离。
离心法:利用高速离心原理,根据细胞悬浮液中细胞的大小、密度、形态等差异,将不同的细胞分离出来。
将血液标本加入离心管中,设置不同的离心速度和离心时间,红细胞向下聚集,最后在离心管底部收集分离出来的红细胞。
梯度离心法:利用不同密度溶液的层状堆叠,形成密度逐渐递增的梯度离心液,在离心过程中,细胞会沉在感应浓度的不同介质处,形成分层,最终得到不同的红细胞、白细胞或血小板等。
免疫学:红细胞是具有血型抗原的细胞,利用不同的血型抗体制备特异性的抗体,可以针对血型进行免疫细胞分离。
红细胞表面覆盖有各自不同的特异性抗原,如ABO 系统的A、B、O抗原和Rh系统的D抗原等,利用特异性抗体与红细胞表面抗原结合,然后用离心等方法将被特异性抗体结合的红细胞分离出来。
磁性:利用磁性微珠载体上的抗体,可以通过磁力浓缩、磁力分离工艺,将红细胞与其他细胞进行选择性、高效的分离。
将磁珠Ⅰ(红细胞选择性抗原的特异性抗体)加入样品中,溶液在空间上形成薄膜。
以生物磁珠Ⅱ进行捕获后,用磁盘吸附方式进行分离。
二、红细胞分离的方法红细胞分离的方法有多种,其中离心法、梯度离心法、免疫学和磁性等方法是常用的,以下介绍部分红细胞分离的方法。
1. 离心法(1)常规离心分离法:将血样加入离心管中,设置适当的离心速度与时间,最后在离心管底部收集分离出来的红细胞。
(2)微量红细胞分离法:将血液标本加入微量离心管内,加入适量的淀粉,进行混匀后,离心到沉淀形成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十八章血细胞分离技术(Separation technique of the blood cell)一、原理在体外进行细胞免疫检测时,首先必须进行淋巴细胞的分离。
分离淋巴细胞的方法很多,但不管采用哪种方法,均要求分离的淋巴细胞纯度高、产量多,而且不丧失活性,同时也要求分离技术简单、操作方便。
外周血液中红细胞和白细胞的比例在几百甚至上千比一,两类细胞的大小和密度不同,其沉降速度也就不同。
红细胞的自然沉降率较快,加入高分子量的聚合物,如明胶、右旋糖酐等还可以加速其凝聚。
利用自然沉降法、密度梯度离心法或二者结合,可以将淋巴细胞从血液中分离出来。
这种分离出的淋巴细胞一般包括单核细胞。
除去单核细胞,可以利用单核细胞的吸附功能,如铁颗粒、玻璃面或尼龙网等,除去(或分离)单核细胞,从而提纯淋巴细胞。
二、采血(一)材料与试剂1.抗凝剂(1)肝素:肝素是含硫酸基的粘多糖,常用其钠盐或钾盐,它能阻止凝血酶原转化为凝血酶,进而抑制纤维蛋白原形成纤维蛋白,从而阻止血液凝固。
常用的肝素溶液浓度为1 000U/ml,市售肝素多为100U~126U/mg。
(2)乙二胺四乙酸(EDTA):是一种螯合剂。
用生理盐水配制成4%的溶液备用。
· 1 ·(3)阿氏液(Alsever液),配方如下:枸橼酸钠(Na3C6H5O7·5H2O)0.80g枸橼酸0.0325g葡萄糖 2.05g氯化钠0.42gH2O 加至100.00ml混匀溶解后,114.3℃高压蒸汽灭菌10min备用。
阿氏液中既含有枸橼酸钠抗凝剂,又含有细胞生存的营养,所以它既可做抗凝剂,又可做血细胞的保存液。
2.针头根据不同动物和采血部位,采用不同型号的针头,用前必须灭菌或消毒。
3.采血容器注射器或三角瓶等。
4.采血动物。
(二)操作方法1.采血法各种动物采血方法不一。
马、牛、羊等大动物一般从颈静脉采血,猪从颈静脉、前腔静脉或耳静脉采血,家禽由翼下静脉或心脏采血,兔由心脏或耳静脉采血,犬由颈静脉或四肢静脉采血,豚鼠由心脏采血,小白鼠则可断尾或剪断腋下血管或剪断眼球采血。
2.抗凝采集血液最关键的问题是抗凝,采用什么方法进行抗凝,则根据实验的要求和条件而定。
最常用的方法如下:(1)肝素抗凝:采血时,使每ml血液含15U~20U肝素即可。
计算采集的血液量,按1 000U/ml的量加入肝素,直接放入采血容器中,采血时,边采血边轻轻摇动,使抗凝剂和血液混匀。
对于采少量的血液或小动物采血,可直接用注射器抽取一定量的肝素液,再采血直接抗凝。
(2)EDTA抗凝:采血前,用灭菌生理盐水将EDTA配制成4%溶液,然后按预采血液的量,以每ml血液加入1mg~2mg的EDTA的液体量于采血容器内。
采血,并不断摇动采血容器,使之混匀。
(3)玻璃珠法:预先将适量的玻璃珠(根据采血量多少而定)清洗后,装入采血容器中,灭菌后备用。
采血过程中,边采边摇采血瓶,以使小玻璃珠在血液中滚动,以机械地除去纤维蛋白,使血液不能凝固。
本法虽较麻烦,但对淋巴细胞的活性影响最小,且可减少血小板的混杂。
(4)阿氏液采血:以阿氏液和采血量以1︰1比例采集血液,边采边轻轻摇动采血瓶,使之混匀。
用阿氏液采血,除了抗凝外,多用于红细胞的保存。
一般在4℃条件下,阿氏液中保存的红细胞2周其活性和特性不变。
· 2 ·三、红细胞的分离技术(一)材料与试剂1.肝素等抗凝剂2.3%明胶液取明胶3g,溶于0.9%灭菌盐水100ml中,114.3℃灭菌10min,冷却后4℃冰箱保存。
临用时,37℃预热10min。
3.阿氏液(二)操作方法1.采血抗凝,即为红细胞。
由于红细胞与白细胞的比例相差悬殊,一般白细胞混杂在其中,忽略不计。
2.根据红细胞的用途,可做进一步的处理。
如计算红细胞,可直接稀释计数。
如需做补体结合反应,或其它溶红细胞反应,则需将红细胞进行充分的清洗,以除去附着在红细胞膜表面的血浆。
一般用等渗的稀释液连续清洗,2 000r/min离心10min,重复3~4次。
3.如需储藏备用,则以阿氏液做抗凝剂采血,混匀后置4℃冰箱保存,可保存2周,其活性尚可。
四、淋巴细胞的分离技术(一)材料与试剂1.淋巴细胞分层液有两种:(1)聚蔗糖—泛影葡胺液:聚蔗糖(polysucrose solution),商品名Ficoll,分子量400 000,多配制成40±1%(W/V)水溶液,也有干粉出售。
应用时,用蒸馏水配制9%溶液。
泛影葡胺溶液(Meglumini diatrizoici),商品名Vrografin,结构式为3,5—二乙酰氨基2,4,6三碘苯甲酸1—去氧—甲氨基山梨醇。
含量为60%或75%,每安瓶为20ml装,常用于人的脏器造影。
应用时,取60%泛影葡胺原液20ml,加双蒸馏水15.38ml,即为33.9%泛影葡胺。
· 3 ·1.077±0.001聚蔗糖—泛影葡胺的配制:9%聚蔗糖液24份33.9%泛影葡胺液10份混合即可。
必要时,可测比重。
需要备用,可用G5漏斗过滤除菌或114.3℃高压灭菌15min,4℃保存。
一般可保存3个月。
如要配制不同比例的分层液,可按下列公式计算:式中dm为分层液的比重,d1和d2分别为9%聚蔗糖和33.9%泛影葡胺的比重,V1和V2分别为它们的体积。
如需配制1.077比重的聚蔗糖—泛影葡胺的分层液,则9%的聚蔗糖和33.9%的泛影葡胺的比例应为100︰46.3。
(2)泛影葡胺—右旋糖酐(dextran)液34%泛影葡胺液10份60%右旋糖酐液12.5份混合,即为比重1.07~1.09的分层液。
分装于棕色瓶中,4℃冰箱保存备用。
2.3%的明胶液称取明胶3g,溶于0.9%的灭菌生理盐水,终体积100ml,114.3℃高压灭菌10min,冷却后4℃冰箱保存,临用时37℃预热10min。
3.Hank’s液。
(二)操作方法1.取抗凝血,自然沉降,如是马属动物的血液,可直接直立试管架上,让其自然沉降1h,取上层血浆。
如是牛、羊血液,由于其血沉速度非常慢,可加等量3%明胶液,混匀后让其自然沉降,1h后取上层血浆。
2.2 000r/min离心10min,弃上清。
3.沉淀用Hank’s液混悬后,再2 000r/min离心10min。
4.重复步骤3一次,再用细胞营养液将白细胞制成悬液。
此液含有整个白细胞群,包括粒细胞、淋巴细胞、单核细胞和部分红细胞。
可供白细胞计数用。
5.取2ml细胞分层液于离心管内,同时用毛细吸管吸取约2ml的血浆(自然沉降1h的上层血浆)轻轻加入分层液上,直接加抗凝血也可。
6.以水平转子离心机2 000r/min离心20min。
离心后,可见分成多层,最下层是红细胞,中间层是分层液,最上层是血浆。
在血浆层与分层液之间是一薄层较致密的白色层,即为单个核细胞层。
7.用毛细吸管插入到单个核细胞层并吸取该层,放入另一试管中。
· 4 ·8.以Hank’s液洗涤、离心,最后配制成适当的白细胞浓度。
必要时可计数。
(三)注意事项1.血浆或血液加入分层液中时要小心,缓慢不要打乱液层、不要摇动。
也可以将分层液加入到血浆的上层。
2.保持淋巴细胞的活性是非常重要的,所以一般情况下,是现采血,马上进行分离。
3.经过分层液分离的淋巴细胞层,实际上是单个核细胞层,包括单核细胞,不包括粒细胞。
欲分离出纯的淋巴细胞,则按下法除去单核细胞,或收获单核细胞。
五、单核细胞分离技术(一)铁粉吸附法1.材料及试剂(1)铁粉或羰基铁粉(Atomergic chemetals)99%的纯度,颗粒小于60µm (Goodfellow Metals)。
(2)强磁铁(马蹄形)。
(3)一块小棒状磁铁(约1cm长)。
(4)毛细吸管等。
2.操作方法(1)称取一定量的铁粉,一般为10g,用100ml生理盐水洗涤4次,去除任何可溶性有毒物质。
在倒去盐水时,用强磁铁吸住铁粉。
(2)用50ml生理盐水混悬铁粉。
摇匀后,分装于10个瓶中,包扎瓶口,121℃灭菌20min,拿出后立即轻轻摇匀,防止铁粉结块,储藏备用。
(3)临用前,倒去瓶中的生理盐水,加入适量的单个核细胞悬液(3ml~5ml,细胞总数为8×107个/瓶)。
37℃温育45min,中间不时晃动,使铁粉悬浮起来。
(4)加入一块小磁铁棒于瓶中,让其吸住铁粉以及附着在铁粉上的细胞。
(5)倒出悬液,此悬液主要是淋巴细胞,离心,收集。
(6)在铁粉瓶内倒入一定量的Hank’s液,用力振摇后,以强磁铁吸附,几分钟后,倒出液体。
(7)2 000r/min离心液体,管底即为单核细胞。
(二)玻璃板吸附法· 5 ·将分离的单个核细胞倾于无菌洁净的玻璃平皿内,置37℃30 min~40min,用毛细吸管轻轻吸取悬液,即为淋巴细胞。
用适量的Hank’s液冲洗平皿,收获即为单核细胞悬液。
六、T淋巴细胞的分离技术(一)原理混合单个核细胞悬液在通过尼龙毛柱时,B细胞、浆细胞、单核细胞和一些辅助细胞被选择性粘附于尼龙毛上,而多数T细胞则通过尼龙毛柱,这是获得富含T细胞群的有效方法。
(二)材料及试剂1.尼龙毛(Femwall Laboratories,LP-1 Leukoqak leukocyte Filters)。
2.烧杯、铝箔、漏斗、一次性手套等。
3.装填尼龙毛柱,一次性注射器。
4.取自然沉降的上层血浆,过聚蔗糖—泛影葡胺分层液后,获取的血浆和分层液之间的单个核细胞层。
(三)操作方法1.尼龙毛的清洗与干燥(1)戴上已经洗去滑石粉的一次性手套,将尼龙毛(1包或2包,每包35g)放入烧杯中,加入蒸馏水或去离子水,用铝箔盖上烧杯并煮沸约10min。
(2)冷却至常温,倒入漏斗内,使水滴干。
(3)重复(1)、(2)步骤6次。
(4)将尼龙毛摊在铺有纱布的方盘内,37℃温箱干燥2~3天后,贮藏在带盖的方盘内。
2.装尼龙毛柱(1)取50ml玻璃注射器,拔去注射芯,在注射器头上套一段带夹子的胶管。
(2)将尼龙毛梳理,并适当折叠,以适应注射器的直径,填入注射器内,约20ml的体积。
(3)将填好尼龙毛的注射器连同注射器芯一起包好,高压灭菌。
3.细胞分离(1)将注射器固定在支架上,倒入37℃的细胞培养液,关闭阀门一定时间,· 6 ·然后打开阀门,放掉细胞培养液,以清洗几次尼龙毛,关上阀门。
(2)将要分离的细胞液用预先加温的培养液稀释成适当的浓度,约5.00×107个细胞/ml。
(3)将细胞液倒入注射器内,使之没过尼龙毛柱。
盖上注射器,37℃温育45min至1h。
(4)打开下口,缓慢放流(1滴/min),收集于离心管中。
(5)离心,即获所需的T淋巴细胞。
