常见晶体模型及晶胞算87911
常见晶体模型及晶胞计算
晶胞中微粒个数的计算,求化学式
小结:高考常见题型
1、(2013·江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。
X与Y所形成化合物晶体的晶胞如右图所示。 ①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。
Mg、Zn、Ti 每个晶胞含 个原子 六方最密堆积的配位数 =12 2
④面心立方最密堆积(铜型)
Cu、Ag、Au 面心立方堆积的配位数 =12 每个晶胞含 个原子 4
面心立方最密堆积的空间占有率
=74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积的典型代表
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与Na+间的最短距离是多少?
a/2
a/2
=
练习
CsCl的晶体结构
(1)每个Cs+( Cl-)周围等距且紧邻的Cl- (Cs+)有 个, Cs+( Cl-)的配位数为 。
8
8×1/8=1
6
——晶胞为体心立方体
8
(2)每个Cs+ ( Cl-)周围 等距且紧邻的Cs+ ( Cl-)有 个。
1
3
6
4
2
A
5
密置层
配位数为4
配位数为6
返
A
B
A
B
A
返
第三层的另一种排列方式,是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
(完整版)常见晶胞模型

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
常见晶体模型与晶胞计算 Word版含解析

常见晶体模型与晶胞计算1.典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻4个碳以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C 组成且六原子不在同一平面内(4)每个C 参与4条C —C 键的形成,C 原子数与C —C 键数之比为1∶2SiO 2(1)每个Si 与4个O 以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n (Si)∶n (O)=1∶2(3)最小环上有12个原子,即6个O,6个Si分子晶体干冰(1)8个CO 2分子构成立方体且在6个面心又各占据1个CO 2分子(2)每个CO 2分子周围等距且紧邻的CO 2分子有12个离子晶体NaCl 型(1)每个Na +(Cl -)周围等距且紧邻的Cl -(Na +)有6个,每个Na +周围等距且紧邻的Na +有12个(2)每个晶胞中含4个Na +和4个Cl -CsCl 型(1)每个Cs+周围等距且紧邻的Cl -有8个,每个Cs +(Cl-)周围等距且紧邻的Cs+(Cl-)有6个(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-金属晶体简单立方堆积典型代表Po ,配位数为6,空间利用率52%面心立方最密堆积又称为A 1型或铜型,典型代表Cu 、Ag 、Au ,配位数为12,空间利用率74%体心立方堆积又称为A 2型或钾型,典型代表Na 、K 、Fe ,配位数为8,空间利用率68%六方最密堆积又称为A3型或镁型,典型代表Mg 、Zn 、Ti ,配位数为12,空间利用率74%2.晶胞中微粒的计算方法——均摊法【重难点指数】★★★【重难点考向一】常见晶胞类型和结构特点【典型例题1】(1)【2015·高考全国卷Ⅰ,37(5)】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:石墨烯晶体金刚石晶体①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
常见晶体模型及晶胞计算

常见晶体模型及晶胞计算引言晶体是由周期性排列的原子、离子或分子构成的固体材料。
晶体的周期性排列导致了其具有一些特殊的性质,例如独特的光学、电学和热学性质。
为了研究晶体的这些性质,科学家提出了各种模型来描述晶体的结构。
在本文中,我们将介绍几种常见的晶体模型,并讨论晶胞计算的方法。
晶体模型1.金属晶体模型金属晶体模型是最简单的晶体模型之一、金属晶体由金属原子构成,没有共价键或离子键。
金属晶体的特点是具有密堆结构,例如面居中立方(fcc)或体居中立方(bcc)结构。
这些结构可以用简单的立方晶胞来描述,其中原子位于晶格点上。
2.离子晶体模型离子晶体是由正负离子构成的晶体。
离子晶体的特点是具有离子键,即正离子和负离子之间的静电相互作用力。
离子晶体的结构可以用通常称为离子晶胞的基本单元来描述。
离子晶胞中包含正离子和负离子,并且具有充分保持电中性的结构。
3.共价晶体模型共价晶体由共价键相互连接的原子或离子组成。
共价键是由共用电子对形成的,这些电子对由每个原子的价电子共享。
共价晶体的结构可以用共价晶胞来描述,其中原子或分子通过共价键连接。
晶胞计算晶胞计算是研究晶体结构的一种方法。
具体来说,晶胞计算是为了确定晶体的晶胞参数,即晶体中原子、离子或分子的排列和间距。
晶胞计算通常包括以下步骤:1.数据收集:这是晶胞计算的第一步。
通过使用X射线衍射、中子衍射或电子衍射等实验技术,收集晶体的衍射数据。
2.数据分析:在收集到晶体的衍射数据后,需要对这些数据进行分析。
这包括确定晶胞中原子的位置和间距。
一般采用的方法是使用维护衍射方程来进行数据分析。
3.模型构建:在完成数据分析后,可以构建晶胞模型。
这可以通过使用复结构拓扑方法或使用分子动力学模拟等方法来实现。
4.晶胞参数优化:晶胞参数的优化是为了获得最佳的晶胞参数。
这可以通过使用晶体学软件进行计算和优化来实现。
5.结果解释:最后一步是对晶胞计算结果进行解释和分析。
这可以包括确定晶体中原子、离子或分子的排列和结构,并进一步研究晶体的性质。
高三化学课件常见的晶胞模型

(4)设金属原子的摩尔质量为M g/mol,
则晶胞密度ρ为
体心六方晶胞
g/cm3
/
n
m
ρ=
=
−7 3 =
−
(×10 )
(×10 7)3
Hale Waihona Puke 2×10213=
g/cm
3
二、金属晶体
3、面心立方最密堆积(A 1 型或铜型)
典型代表 Ca Al Cu Ag Au Pd Pt
(4)金属镁形成的晶体中,每个镁原子周围与其距离最近的原子有6个。(×)
三、分子晶体
1、干冰(CO 2 )
2、冰(H 2 O)
3、碘晶体
(1)每个水分子最多与相邻的4个水分子,以氢键相连接
(2)含1 mol H2O的冰中,最多可形成2 mol“氢键”
碘晶体晶胞(长方体)
(3)1 mol液态水中氢键数小于2NA
四、离子晶体
1、氯化钠(型)
(1)每个晶胞中含4个Na+和4个Cl-
(2)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个
每个Na+周围等距且紧邻的Na+有12个
ClNa+
在氯化钠晶胞中,
与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为 正八面体
四、离子晶体
2、氯化铯(型)
则a=2r
简单六方晶胞
V球=
4
3
πr3 V晶胞=a3
空间利用率=V球/V晶胞×100%=52%
二、金属晶体
2、体心六方堆积(A 2 型或钾型)
典型代表 Li Na K Ba W Fe
(1)晶胞内含原子个数为 2
(2)配位数为 8
高考新突破物质结构与性质选修大题常见晶体模型及晶胞计算PPT学习教案

cm。
a
cm,该晶体密度为
常数可表示为
58.5 B.8a3d
(2)晶 胞 的 边 长 为acm, 求 NaCl晶 体的密 度。
()
a/2
a/2
117 D.a3d
ρ=
M / NA×晶胞所含粒子数 晶胞的体积
=
58.5 / NA×4 a3
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与 Na+间的最短距离是多少?
第5页/共32页
CsCl的晶体结构——晶胞为体心立方
(1)每个Cs+( Cl-)周围等体
距且紧邻的Cl- (Cs+)有8 个, Cs+( Cl-)的配位数为 8 。
(2)每个Cs+ ( Cl-)周围
等距且紧邻的Cs+ ( Cl-)有 6 个。
(3)每个晶胞中含 1 个Cs+、含8×1/8=1个Cl-,故每 个晶胞中含有 1 个“CsCl”结构单元; N(Cs+) ︰
4 第2页/共32页
离子晶体
NaCl的晶体结构 ——简单立方体
(1)每 个 Na+( Cl-)周 围 等
距 且 紧 邻 的 Cl- (Na+)有
个,构成
,
Na+( Cl-)的 配 位 数 为 。
6
正 八面体
Cl N-a+
6
(2)每个Na+周围等距且
12
紧邻的Na+有 个。 (3)每个晶胞中平均有 4
X与 Y所 形 成 化 合物 晶体的 晶胞如 右图所 示。
① 在 1个 晶 胞 中,X离 子的 数目为
。
② 该 化 合 物 的化学 式为 。
晶胞计算.ppt

晶胞计算.ppt⼀、典型的各种晶体结构特点离⼦晶体、分⼦晶体和原⼦晶体——-晶胞中微粒的计算及化学式推导晶胞中微粒的计算思考:处于晶胞顶点上、棱上、⾯上的离⼦分别被多少个晶胞共⽤?TO⽬录TO总结处于晶胞顶点上粒⼦被8个晶胞共⽤处于晶胞棱上粒⼦被4个晶胞共⽤处于晶胞⾯上粒⼦被2个晶胞共⽤氯化钠晶体模型—⾯⼼⽴⽅体⾯⼼体⼼棱上顶点氯离⼦钠离⼦观察:氯化钠晶体中钠离⼦和氯离⼦分别处于晶胞的什么位置?顶点和⾯⼼是氯离⼦棱上和体⼼是钠离⼦氯化钠晶体结构思考:与⼀个钠离⼦相邻最近且距离相等的氯离⼦有多少个?距离是多少?(图⽰距离为a)TO模型TO⽬录123456a6个a氯化钠晶体结构思考:与⼀个钠离⼦相邻最近且距离相等的钠离⼦有多少个?距离是多少?(图⽰距离为a)TO模型TO⽬录a12345678910111212个2a氯化铯晶体(体⼼⽴⽅体)氯化铯的⼩晶胞铯离⼦:氯离⼦:观察:氯化铯晶体中氯离⼦和铯离⼦分别处于晶胞的什么位置?对每个⼩⽴⽅体⽽⾔,若铯离⼦位于顶点,则氯离⼦位于体⼼,反之依然⼆氧化碳晶体—⾯⼼⽴⽅体观察后回答题:1、⼆氧化碳分⼦处于⽴⽅体的什么位置?2、⼀个⽴⽅体中含有多少个⼆氧化碳分⼦?代表⼀个⼆氧化碳分⼦顶点和⾯⼼8×1/8+6×1/2=4同⼀平⾯内⼆氧化碳分⼦的位置观察:在同⼀平⾯上与⼀个⼆氧化碳分⼦距离最近的⼆氧化碳分⼦有多少个?TO三维位置TOCO2晶体4个321距离最近的分⼦的位置TO⽬录思考:三维⽴体中,与⼀个⼆氧化碳分⼦距离最近的⼆氧化碳有⼏个?12个返回基本单元:六元环⾦刚⽯晶体TO⽬录观察,⼀个碳原⼦与多少个碳原⼦相连,多少个碳原⼦形成⼀个环?⼀个碳被⼏个环共有?碳原⼦与键数⽐是?与4个碳相连,呈空间正四⾯体形6个碳原⼦形成⼀个环⼀个碳被12个环共有碳原⼦与键数⽐是(1:2)每个硅连4个氧原⼦,每个氧原⼦连2个硅原⼦,最⼩环为12元环⼀个硅原⼦被12个环共有⼀个氧原⼦被6个环共有⼆氧化硅晶体⽯墨晶体⽯墨晶体结构⽯墨的晶体结构俯视图层状结构的基本单元⽯墨的层状结构TO⽬录TO层移动可移动的电⼦:碳原⼦与键数⽐是(2:3)⽯墨的层间移动可⾃由移动的电⼦:TO结构⽯墨晶体TO结构⽯墨晶体⽯墨的六⽅晶胞⽤隧道扫描显微镜放⼤后的⽯墨层状结构TO⽬录⼆、晶胞中含微粒个数⽐的计算⽅法:2、在顶点:1、在内部:3、在⾯上:4、在棱上处于内部的离⼦,完全属于该晶胞,该离⼦按1计⼊晶胞。
高考化学一轮复习考点备考1132五类常见晶体模型与晶胞计算课件

Fe2+: 4 S22-: 4
➢转解析
三、反思归纳
晶体结构的相关计算
1.晶胞质量=晶胞占有的微粒的质量=晶胞占有的微粒数×NMA。
晶胞占有的微粒体积
2.空间利用率=
晶胞体积
。
3.金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为 a)
(1)面对角线长= 2a。
(2)体对角线长= 3a。
(3)体心立方堆积 4r= 3a(r 为原子半径)。
二、典例剖析
4.按要求完成以下题目 (1)(2018·课标全国Ⅰ)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,
8×7+4×16
阿伏加德罗常数的值为NA,则Li2O的密度为___N_A(__0._46_6_5_×_1_0_-7_)_3___g·cm-3(列∶4∶2。
2021/4/17
高考化学一轮复习考点备考1132五类常见晶体模型与晶 胞计算课件
8
本节内容结束
2021/4/17
高考化学一轮复习考点备考1132五类常见晶体模型与晶 胞计算课件
9
同学们,你们要相信梦想是价值的源泉,相信成 功的信念比成功本身更重要,相信人生有挫折没 有失败,相信生命的质量来自决不妥协的信念,
考试加油。
(4)面心立方堆积 4r= 2a(r 为原子半径)。
四、试题备选
某晶体的一部分如图所示,这种晶体中 A、B、C 三种粒子数之比是( B )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A :6×112=12
B:6×14+3×16=2
C :1
解析显/隐
解析 A 粒子数为 6×112=12;B 粒子数为 6×14+3×16=2,C 粒子数为 1;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
练习
-的距离为 a cm,该晶体密度为
(1)设NaCl晶胞的边长为acm,则
示晶为胞中Na+和Cl-的最近距离(( 即小)立
方体的边长)为 a/2 cm,则晶胞中 同种离子的最近距离为 a/2 cm。
(2)晶胞的边长为acm,求NaCl晶 体的密度。
ρ
=
M / NA×晶胞所含粒子数 晶胞的体积
③六方最密堆积(镁型)Mg、Zn、Ti
六方最密堆积的配位数 =12 每个晶胞含 2 个原子
④面心立方最密堆积(铜型)Cu、Ag、Au 面心立方堆积的配位数 =12
每个晶胞含 4 个原子
面心立方最密堆积的空间占有率 =74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积 的典型代表
空间利用率
配位数
思考:NaCl、CsCl同属AB型离子晶体, NaCl晶体中 Na+的配位数与CsCl晶体中Cs+的配位数是否相等?
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有 8 个, Ca2+配 位数为 8 。
(2)每个F-周围等距且紧 邻的Ca2+有 4 个, F-配位 数为 4 。
FCa2+
②该化合物的化学式为 ZnS 。
2、Cu单质的晶体的晶胞结构如下图。若Cu原子的半径
是r cm,则Cu单质的密度的数)
立方晶胞中原子个数
31
42
84
73
棱上:1/4
51
62
1
1
2返
顶点:1/8 体心:1 面上:1/2
返
返
返
2 1 A3
4
配位数为4 非密置层
常见晶体模型及晶胞计算
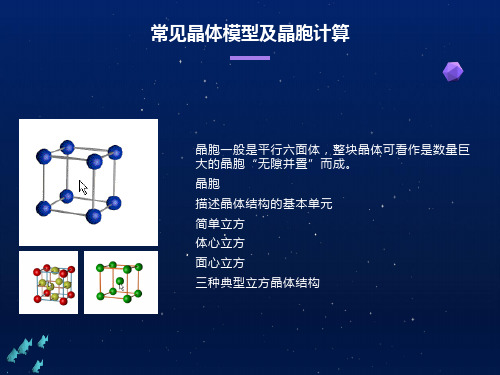
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的 晶胞“无隙并置”而成。
三种典型立方晶体结构
简单立方
体心立方
面心立方
晶胞中微粒的计算方法——均摊法
原则:晶胞任意位置上的一个原子如果是被n个图形晶胞 所共有,那么,每个晶胞对这个原子分得的份额是1/n。
=
58.5 / NA×4 a3
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与 Na+间的最短距离是多少?
CsCl的晶体结构——晶胞为体心立方体
(1)每个Cs+( Cl-)周围等距 且紧邻的Cl- (Cs+)有 8 个, Cs+( Cl-)的配位数为 8 。 (2)每个Cs+ ( Cl-)周围 等距且紧邻的Cs+ ( Cl-)有 6 个。 (3)每个晶胞中含 1 个Cs+、含8×1/8=1个Cl-,故每 个晶胞中含有 1 个“CsCl”结构单元; N(Cs+) ︰ N( Cl-) = 1︰1 ,化学为 CsCl 。
(3)每个晶胞中含 4 个Ca2+、含 8 个F-, Ca2+和 F-的个数比是 1︰2 。
3、金属晶体:
①简单立方堆积 唯一金属——钋 简单立方堆积的配位数 =6
每个晶胞含 1 个原子
球半径为r 正方体边长为a r=2/a
空间利用率=
晶胞含有原子的体积 晶胞体积
×100%
=2r
②体心立方堆积(钾型)K、Na、Fe 体心立方堆积的配位数 =8 每个晶胞含 2 个原子
离子晶体
NaCl的晶体结 ——简单立方体 (1构)每个Na+( Cl-)周围等 Cl
距且紧邻的Cl- (Na+)有 N-a+
6 个,构成 正八面体 , Na+( Cl-)的配位数为 6 。
(2)每个Na+周围等距且
紧邻的Na+有 12 个。 (3)每个晶胞中平均有 4 个Na+, 4 个Cl-,故每个晶 胞中含有 4 个“NaCl”结构单元; N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。
简单立方
Po(钋)
52%
6
体心立方 (钾型)
K、Na、Fe
68%
8
六方最密 (镁型)
Mg、Zn、Ti
74%
12
面心立方最密 (铜型)
Cu, Ag, Au
74%
12
晶胞
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式
(1)长方体(立方体):
N=N顶角×1/8 + N棱上×1/4 + N面上×1/2 + N体内
(2)非长方体(非立方体):
视具体情况分析。
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心 在每个CO2周围等距离且相距最近 的CO2共有 12 个。 在每个小立方体中平均分摊到的CO2 分子数为:(8×1/8 + 6×1/2) = 4 个
2
1
3
A
6
4
5
配位数为6 返 密置层
12
6
3
A
54
B
A
B A
返
第三层的另一种排列 方式,是将球对准第一层 的 2,4,6 位,不同 于 AB 两层的位置,这是 C 层。
12
6
3
54
12
6
3
54
12
6
3
54
A
C B A
C
返
B A
(二) 确定配位数
(三) 晶体的密度及微粒间距离 的计算
练习
1、(2013·江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部 排满电子,且最外层电子数为2。元素Y基态原子的 3p 轨道上有4个电子。
X与Y所形成化合物晶体的晶胞 如右图所示。
①在1个晶胞中,X离子的数目 为4 。
