水的电离与溶液的pH值PPT课件
第二节水的电离和溶液的PH

2024-09-04
目 录
水的电离与离子积常数影响KW因素分析影响水电离平衡的因素分析溶液酸碱性与 pH 值关系
01
水的电离与离子积常数
统一的化学用语: C(H+)H2O 表示水电离的氢离子浓度C(H+)HCI 表示HCI电离的氢离子浓度C(H+) 表示溶液中总的氢离子浓度
水的离子积常数 Kw
Kw = C(H⁺) × C(OH⁻)
溶液中总的氢离子浓度
溶液中总的氢氧根离子浓度
02
影响KW因素分析
温度升高,促进水的电离
随着温度的升高,水分子的热运动加剧,使得更多的水分子能够克服电离能,从而发生电离,导致KW值增大。
温度降低,抑制水的电离
当温度降低时,水分子的热运动减缓,电离过程受到抑制,导致KW值减小。
水是一种极弱的电解质,在电离过程中会生成氢离子和氢氧根离子,其电离方程式为:H₂O ⇌ H⁺ + OH⁻。
水的电离过程
在一定温度下,水的电离会达到一个动态平衡状态,即水的电离速率与氢离子和氢氧根离子的结合速率相等。存在平衡就应该有平衡常数
水的电离平衡
水的电离过程及表达式
离子积常数Kw是化学平衡常数的一种形式, 开始时用于描述在一定温度下,纯水中氢离子和氢氧根离子的浓度乘积。其表达式为:Kw = C(H⁺) × C(OH⁻) 后来实验发现这个公式不仅适用于纯水,也使用与稀得电解质溶液
温度对KW的影响
25℃ Kw=1.0×10-14
03
影响水电离平衡的因素分析
温度升高,促进水的电离
随着温度的升高,水分子的热运动加剧,使得更多的水分子能够克服电离能,从而发生电离,导致水电离程度增大。
人教版高中化学选修4第三章第二节 水的电离和溶液的酸碱性 课件(共21张PPT)

知识小结:溶液稀释的PH计算有关规律
1、强酸(碱)每稀释10倍,pH值向7靠拢 一个单位。
2、弱酸(碱)每稀释10倍,pH值向7靠拢 不到一个单位 3、 pH=6或8时,不可忽略水的电离,只能 接近7; 酸碱溶液无限稀释,pH只能接近7:酸不 能等于或大于 7;碱不能等于或小于7。 4.酸(碱)溶液稀释时,OH-(H+)的物 质的量浓度将增大。
方法二:用pH计测定
三、pH的计算 酸性溶液,直接求pH 碱性溶液,先求pOH(或c(H+)),再求pH 混合溶液,先判断酸碱性, 再根据以上方法求 无限稀释接近7
➢pH计算1—— 强酸的稀释
例题:在25℃时,pH值等于3的盐酸溶液稀释到原来的 100倍,pH 值等于多少?
解: [H+]=
=1.0 ×10-5mol/L
➢pH计算4—— 强酸与强酸混合
例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4 的硫酸溶液等体积混合pH值等于多少?
解:pH=-lg[H+] =-lg(1×10—1+1×10—4)/(1+1) =-lg5×10—2 =2-lg5 =1.3
关键:抓住氢离子进行计算!
➢pH计算5—— 强碱与强碱混合
关键:碱过量抓住氢氧根离子进行计算!
pH计算8 弱酸强碱或强酸弱碱混合
(1)PH为12 的NaOH溶液和PH为2的醋酸溶液等体积相 混合,则混合液呈__酸___性
(2)PH为12的氨水和PH为2的盐酸等体积相混合,则混 合液呈 __碱____性
(3)PH为2的盐酸和PH为12的某碱等体积相混合,则混 合液PH_大__于__等__于__7
√ 6、pH值相同的强酸和弱酸中[H+] 物质的量的浓
高中化学人教版选修4 3.2水的电离和溶液的酸碱性--2ph计算 课件
C(H+) =
=
=1 ×10-4mol/L =1 ×10-10mol/L
pH=-lgC(H+) =10
关键:抓住氢氧根离子进行计算!
练习
溶液的稀释
pH=3的稀盐酸加水稀释100倍 pH=2的稀硫酸加水稀释100倍
稀释后 溶液pH
5 4
pH=11的NaOH溶液加水稀释100倍
9
pH=12的Ba(OH)2溶液加水稀释100倍
pH=7 (25℃)
碱性溶液: c(H+)<c(OH—)
pH>7 (25℃)
(一般不特别说明均指常温25℃)
2、pH=-lgC(H+)
相关计算:稀释不变性、酸以氢、碱以氢氧根、酸碱
比谁狠。
3、pH的测定
pH计算9 pH= 2的盐酸和pH= 13的氢氧化钠混合,
(1)若使混合后的溶液呈中性,则V酸/V碱=? (2)混合后溶液的pH=3 V酸/V碱=? (3)混合后溶液的pH=11 V酸/V碱=?
同pH的酸稀释相同的倍数,强酸和弱酸变化幅度大的是?
练习 A
常温下溶液的pH
0
酸性增强 碱性增强
1
2
3
4
5
中性
6 7
8
9
10
11
12
13
14
C(H+) C(OH-)
100 10-1 10-2 10-3 10-4
10-14 结论:
10-13 10-12
1.强酸(或强碱)每稀释10倍,
10-11 10-10
练习
1、有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH
的 变 化值 依 次 增 大 , 则 HX、 HY、 HZ的 酸 性 由 强 到弱 的 顺 序 是
化学课件——水的电离和溶液pH值

水的电离和溶液pH值水的电离和溶液的pH值是电解质溶液的重点和难点,同时也是高考化学试题的热点。
分析多年的高考化学试题,我们不难发现:水的电离和溶液pH值这一知识点试题每年考并且常考常新。
因此,有必要认真加以训练。
相关知识点1、电解质溶液的酸碱性跟水的电离密切相关。
实验证明,水是一极弱电解质,能微弱电离:H2O+H2OH3O++OH-可简写为:H2OH++OH-。
此电离平衡易受外界条件(温度、电解质等)影响,但遵循平衡移动原理。
实验还证明,在溶液中,在一定温度下,[H+]与[OH-]的乘积是一常数,即[H+]·[OH-]=Kw。
Kw简称为水的离子积。
它是一温度函数,随温度升高而增大。
25℃时,Kw=1×10-14,100℃,Kw=1×10-12。
2、电解质溶液的酸碱性取决于[H+]与[OH-]的相对大小。
在常温下,中性溶液[H+]=[OH-]=1×10-7mol/L,酸性溶液[H+]>[OH-];[H+]>1×10-7mol/L;碱性溶液[H+]<[OH-],[H+]<1×10-7mol/L。
3、电解质稀溶液的酸碱性可用pH值大小来统一量度,其定义式:pH=-1g[H+],同样可定义:pH=-1g[OH-],在常温下,pH+pOH=14。
4、电解质溶液pH值的测定:(1)酸碱指示剂是测定溶液的pH值范围。
常用指示剂有:甲基橙、石蕊、酚酞,并熟记它们的变色范围。
(2)pH试纸是粗确测定溶液的pH 值,应掌握其操作步骤。
(3)测定溶液pH值最精确的方法是用pH计。
解题指导1、解答水电离的相关试题时应注意:(1)运用平衡移动原理来分析水的电离平衡移动—定性判断;(2)运用溶液中[H+]·[OH-]=Kw和水电离出的[H+]=[OH-]掌握相关运算—定量计算。
(3)正确处理矛盾的主要方面与次要方面的关系,比如,在处理溶液的稀释、电离与水解等关系时,一定要抓住主要矛盾。
水的电离和溶液的PH ppt课件

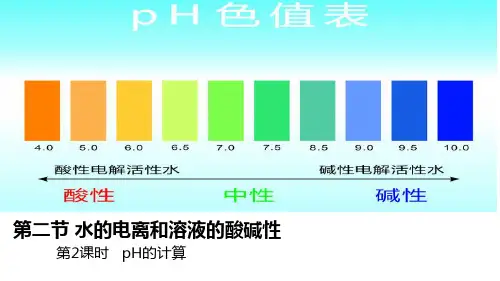
①溶液呈酸性: c(H+)>10-7 ,pH<7 ②溶液呈中性: c(H+)= 10-7 ,pH= 7 ③溶液呈碱性: c(H+)<10-7 ,pH>7
①pH越小,溶液酸性越强;pH越大,溶液碱性越强。(pH的范围通常是 0~14) ②当c(H+)或c(OH-)<1 mol/L时用pH表示酸碱性比较方便。 ③当c(H+)或c(OH-)≧1 mol/L时直接用它们的浓度表示酸碱性。
常温下,浓度为0.01 mol·L-1的NaOH溶液中,由水电离的c(H+)和c(OH-)各是多少?
NaOH === Na+ + OH(1) c(H+) c总(H+) = c水(H+)
(2) c(OH-) c总(OH-)= c碱(OH-) + c水(OH-) ≈ c碱(OH-) = 0.01 mol·L-1
Kw的应用 总结归纳 (1)酸溶液中Kw=c酸(H+)·c水(OH-) (忽略水电离出的H+的浓度)。 (2)碱溶液中Kw=c水(H+)·c碱(OH-) (忽略水电离出的OH-的浓度)。 (3)由水电离出的c(H+)与水电离出的c(OH-)一定相等。
溶液的酸碱性与PH
如何判断溶液酸碱性?
溶液的酸碱性 思考与讨论 根据常温时水的电离平衡,运用平衡移动原理分析下列问题。
作物 水稻 玉米 棉花 大豆 小麦
pH 5.5~7.0 6.5~7.5 6.0~6.8 6.5~7.5 6.2~7.5
作物 洋葱 西瓜 柑橘 茶树 水仙花
pH 6.0~7.0 6.0~7.0 5.0~7.0 5.0~5.5 6.0~6.5
PH的测试和调控的意义
4.在环保领域,酸性或碱性废水的处 理常常利用中和反应,在中和处理的 过程中可用pH自动测定仪进行监测和 控制。
第二节溶液的酸碱性和PH值课件资料

第⼆节溶液的酸碱性和PH值课件资料第⼆节溶液的酸碱性和PH 值⼀、⽔的电离⼀般实验显⽰,纯⽔是不导电的,但实验表明,纯⽔也有微弱的导电性,说明⽔也是有微弱的电离,是⼀种弱电解质。
在纯⽔中存在着这样的电离平衡H 2O H + + OH -达平衡状态时 2[][]H OH K H O +-=(4-4) K W = K ·[H 2O] = [H +]·[OH -] (4-5) K W 称为⽔的离⼦积常数,简称为⽔的离⼦积。
,在25℃时,K W = 1.00×10-14. (4-6)⽔的电离是吸热反应,⽔的离⼦积随温度升⾼⽽稍有增加,但K w 随温度变化不⼤(见表4-4所⽰),通常取值为1.0×10-14。
表4-3 不同温度时⽔的离⼦积T (K )273 283 298 323 373 K w 1.139×10-15 2.290×10-15 1.008×10-145.474×10-14 5.5×10-13 在25℃时,在1升⽔中仅有1.00×10-7mol 的⽔发⽣了离解。
⽔的离⼦积虽然是在纯⽔中测定得到的,但经实验验证,不仅在纯⽔中,其他溶液中,[H +]与[OH -]乘积也等于⽔的离⼦积。
并且不论酸性溶液或碱性溶液中都同时存在着H +和OH -,所以,室温下,⽤式(4-5)可以计算任何⽔溶液中的[H +]或[OH -]。
⼆、溶液的酸碱性和pH(⼀)溶液的酸碱性与[H +]的关系K w 反映了⽔溶液中[H +]和[OH -]的关系。
若溶液中的[H +]=[OH -],则该溶液称为中性溶液;若溶液中的[H +]>[OH -],则称该溶液为酸性溶液;若溶液中的[H +]<[OH -],则称该溶液为碱性溶液。
由于[H +][OH -]=K w ,室温时K w =1.0×10-14,则溶液的酸碱性与[H +]和[OH -]的关系可表⽰为:[H +] = [OH -] = 10-7时,中性[H +] ﹥ 10-7﹥ [OH -] 时,酸性[H +] ﹤10-7﹤ [OH -] 时,碱性溶液中[H+]越⼤,其[OH-]越⼩,酸性越强,碱性越弱;[H+]越⼩,其[OH-]越⼤,酸性越弱,碱性越强。
课件《水的电离》PPT_完美课件_人教版1
0×10-9mol/L的碱性性溶液,
生活中,人们洗发时使用的护发素,主要功能也是调节头发的pH使之达到适宜的酸碱度。
红色 黄色 1mol/L的NaOH溶液中,求c(OH—) , c(H+),由水电离出的c(H+)水,c(OH—)水分别是多少?
橙 H2O
H+ + OH-
甲基橙 KW = c(H+) .
2.电离平衡常数:K 电离= c(H+) ×c(OH-)
c(H2O)
因为水的电离极其微弱,在室温下1L(即55.56mol) 水中只有1×10-7mol水电离,电离前后水的物质的量几乎 不变, C(H2O)的浓度为常数,这样上式可以表示为:
c(H+) . c(OH-) = K电离× c(H2O)
3.水的离子 积常数,简 称为离子积
H2O + H2O c(H+)=10-pH
25℃ 100 ℃ 0×10-5mol/L的酸性性溶液,
H3O+ + OH-
1. 水是一种极弱的电解质
纯水的组成微粒有哪些?
水分子电离过程示意图
+
+
H2O + H2O
H3O+ + OH-
可简写为: H2O
H+ + OH-
当达到电离平衡时,电离产物H+和OH-浓度 之积与未电离的H2O的浓度之比也是一个常数:
应用 5
在科学实验 和工业生产中, 溶液pH的控制 常常是影响实验 结果或产品质量、 产量的一个关键 因素。
课堂小结
1.水是一种极弱的电解质,能发生微弱的电离。 2.常温下,水的离子积常数:
KW = c(H+) . c(OH-) =10-14
4.2.2水的质子自递和溶液的PH值PPT
3.常温下上述三种溶液中,[H+][OH-]是否始终等于1×1014?
抑制水电离 促进水电离
增大[H+](加酸或强酸酸式盐) 增大[OH-](加碱) 降低温度 升高温度 减小[H+](加含CO32-、S2-的盐) 减小[OH-](加含NH4+、Fe3+的盐)
任何水溶液中(不论是在中性溶液还是在酸、碱性溶 液),H+和OH-总是同时存在,并且Kw满足以下条件。
常温下(25℃),任何稀的水溶液中总满足: Kw=[H+][OH-]=1×10-14
二 溶液的pH值
当溶液中[H+]和[OH-]较小时,可用其对数的负值(负对数)即 pH值或pOH值表示其酸碱性,即:
pH=-lg[H+]=-lg10-13=13
Байду номын сангаас
pH值的测定
酚 酞
酸碱指示剂
pH试纸
pH计
pH与人体
• 人体体液pH维持在7.35-7.45之间 • pH>7.45,碱中毒 • pH<7.35,酸中毒
目 录
PART
01
水的质子自递
PART
02
溶液的pH值
一 水的质子自递
H+
H2O + H2O ⇌OH− + H3O+ (H2O ⇌OH− + H+ )
发生在水分子之间的质子转移,称为水的质子自递反应。
H+
H2O + H2O ⇌OH− + H3O+
(H2O ⇌OH− + H+ )
1×10-7 1×10-7
pH=-lg[H+]或pOH=-lg[OH-]
【课件】水的电离和溶液的酸碱性课件2022-2023学年高二上学期化学人教版(2019)选择性必修1
c(H+)__<____
__>____7
1×10-7 mol·L-1
注意: C(H+)与C(OH-)的大小关系才是判断溶液 酸碱性的依据。
四、pH值测定方法 pH试纸法、pH计法、酸碱指示剂法等。 1.定量测定: (1)pH试纸法
常用的pH试纸有广泛pH试纸和精密pH试纸, 广泛pH试纸可以识别的pH差约为__1___。
c(H+)、c(OH-)
大小比较
常温/25 ℃
数值
pH
中性溶液 c(H+)___=___c(OH-) c(H+)=c(OH-)= ___=___7
1×10-7 mol·L-1
酸性溶液 c(H+)___>___c(OH-)
c(H+)__>____
__<____7
1×10-7 mol·L-1
碱性溶液 c(H+)___<___c(OH-)
1、酸或碱溶液抑制水的电离时:
溶液中c(H+)、c(OH-)较小的数值是水电离出来
的。如下表:
c(H+)/
溶液(25 ℃) mol·L-1
c(OH-)/
mol·L-1
水电离出来的
c(H+)或 c(OH-)
mol·L-1
pH=2 的盐 酸
pH=13 的 NaOH 溶液
10-2 10-13
_1_0_-_1_2 1_0_-_1_
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L, 则此时溶液中的C(OH-) = 8×10-9 mol/L 。
练习4、某溶液中由水电离出来的C(OH-)=10-12mol/L,
则该溶液中的溶质不可能是( C )
A、HCl
B、NaOH,
C、NH4Cl
水的离子积和溶液的PH值ppt课件
[交流与共享]
• 石灰水中,是哪一种粒子使指示剂变色呢? 为什么?
• Ca(OH)2=Ca2++2OH–
• NaOH=Na++OH–
KOH=K++OH–
[答案揭秘]
• 电离时都生成氢氧根离子
19
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
24
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
化学与“特异功能”
25
杀 卖鬼 金见 创血 纸 巫街头师卖在艺病人人用房刀内拍打烧手香臂念或咒大作腿法,,然后手在持刀宝口剑上在喷水, 空用 取 儿中抓刀再一出乱在 揭条疫舞臂 下黑鬼,或 纸色,用腿 来(扔“上 请或在割 观其神一他众一仙下颜看个一,色,剪把立)伤好抓刻纸口的”冒贴一黄的出点在血也伤裱方珠没口纸法。 有上人由这 了,身病时 ,过上人艺 连一,身人 刀会上 痕然也后没将有。宝然剑后蘸卖水艺后人砍开在始向纸观人众上推,销纸这人种立金创刻纸被, 砍出斑斑血迹。说鬼是被家杀庭了必,备病。也就算治好了。 这原里来用,的卖黄艺裱人纸的是手用臂酚或酞大染腿过预的先,用清酚水酞实涂际过, 是刀碱口水上,喷酚过酞碱遇水见后碱砍就在会腿变上成就血像红“色杀,鬼秘见密血” 就一在样这冒里出。血珠。纸是预先用白矾水(呈酸性) 浸过的,贴上去红色会立刻消失
5
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
生活中的酸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:某盐酸溶液,欲PH值增1或减1,问C(H+) 怎样变化?
结论:强酸溶液,PH值每增加1个单位,C(H+)变为原浓 度的1/10倍; PH值每减少1个单位,C(H+)变为原浓度的10倍
5.强酸、强碱的稀释及过度稀释的PH计算
例1.在10mL10-4mol/LHCl溶液中加水至100mL时,溶 液的PH值是___________ ;若水至105mL时,溶液 5 的PH值____________________ 。 PH→7 但略小于7
4.溶液的酸、碱性和PH的关系(25℃)
PH→C(H+)→酸性
PH→C(H+) →酸性
思考:在100℃时,溶液PH=7,该溶液呈什么性?
100 ℃ 时,→C(H+)· C(OH-)=10-12→中性时 PH=6<7,故该溶液呈碱性。
四、有关溶液PH的计算
1.求强酸溶液的PH
例1:求1×10-3mol/LHCl溶液的 PH 例2:求1×10-3mol/LH2SO4溶液的PH
PH 3 2
10-1
1
2
-0.3
4
6
-0.6 -0.78
4.溶液的酸、碱性和PH的关系(25℃)
中性:C(H+)=C(OH-)=1×10-7mol/L
PH=7
酸性:C(H+)>C(OH-) C(H+)>1×107mol/L 碱性:C(H+)<C(OH-) C(H+)<1×107mol/L
PH<7
PH>7
2.PH=-lgC(H+)的图象
PH
+3
+2
+1
·
· · ·
1 5
·
10
0
-1 -2 -3
C(H+) y=lgx
3.PH值的常用范围(25℃)
10-14mol/L≤C(H+) ≤1mol/L
10-14mol/L≤C(OH-) ≤1mol/L
原因:为了简便,否则不简便
C(H+) 10-3 10-2
例2:将PH=1和PH=3的盐酸溶液等体积混合, 求该混合溶液的PH值。
四、有关溶液PH的计算 3.求混合溶液的PH (2)求强碱与强碱混合溶液的PH
例1:10mL0.1mol/LNaOH与20mL0.2mol/L Ba(OH)2混合,求该混合溶液的PH值。
例2:将PH=11和PH=13的NaOH溶液等体积混 合,求该混合溶液的PH值。
四、有关溶液PH的计算 3.求混合溶液的PH
(3)求强酸与强碱混合溶液的PH
例1:10mL0.1mol/LHCl与10mL0.2mol/LNaOH 混合,求该混合溶液的PH值。
例2:将PH=6的HCl和PH=10的NaOH溶液等体 积混合,求该混合溶液的PH值。
四、有关溶液PH的计算 4.PH值变化 C(H+)变化
三、溶液的酸碱性与PH的关系
1.溶液的PH值
定义:溶液的酸碱性强弱用C(H+)的负对数来表示的值。 数学表达式:PH=-lgC(H+) 例:C(H+)=10-7mol/L 例:C(H+)=10-5mol/L 例:C(H+)=10-9mol/L 例:C(H+)=1mol/L PH=-lgC(H+)=-lg10-7=7 PH=-lgC(H+)=-lg10-=5 PH=-lgC(H+)=-lg10-9=9 PH=-lgC(H+)=-lg1=0
例2.在10mLPH=10的NaOH溶液中加水至1000mL时,溶 8 液的PH值是___________ ;若加水至106mL时,溶液 的PH值____________________ 。 PH→7 但略大于7
比较下列各组酸稀释后的PH大小:
1.PH均为1的盐酸和硫酸用蒸馏水稀释相 同倍数,则前PH___后PH 2.浓度均为1mol/L的盐酸和硫酸用蒸馏 水稀释相同倍数,则前PH____后PH 3.PH均为1的盐酸和醋酸用蒸馏水稀释相 同倍数,则前PH___后PH 4.浓度均为1mol/L的盐酸和醋酸用蒸馏 水稀释相同倍数,则前PH____后PH
四、有关溶液PH的计算
2.求强碱溶液的PH
例1:求0.1mol/LNaOH溶液的PH
例2:求0.1mol/LBa(OH)2溶液的PH
四、有关溶液PH的计算 3.求混合溶液的PH (1)求强酸与强酸混合溶液的PH
例1:10mL0.1mol/LHCl与20mL0.2mol/LHCl 混合,求该混合溶液的PH值。
第三章
第二节
电离平衡
水的电离和溶液的PH (第2课时)
三、溶液的酸碱性与PH的关系
引言:溶液的酸碱性强弱,可以用溶液中 氢离子浓度的大小来表示。
例:C(H+)=1或2或3mol/L的酸性溶液。
例:C(H+)=1×10-7或1.34×10-3mol/L的溶液。
对溶液中氢离子极小的溶液,化学上常用 PH值来表示溶液的酸碱性强弱。
