初三化学氧化还原反应基础知识清单
初中化学氧化还原反应知识点总结

初中化学氧化还原反应知识点总结氧化还原反应是化学反应中的一种重要类型,常常涉及物质的电子转移。
在初中化学学习中,我们需要掌握氧化还原反应的基本概念、常见类型、判断方法以及反应的影响因素等知识点。
1. 氧化还原反应的基本概念:氧化是指物质失去电子,还原是指物质获得电子。
在氧化还原反应中,存在电子的转移,即电子从被氧化物质转移到还原物质上。
2. 氧化还原反应的常见类型:a. 金属与非金属氧化物的反应:金属氧化物与非金属氧化物反应时,一般产生盐和水。
例如:2Na + Cl2 → 2NaCl。
b. 金属与非金属的直接反应:金属与非金属直接反应会生成盐。
例如:Mg + Br2 → MgBr2。
c. 过渡金属的氧化还原反应:过渡金属可以具有多种化合价,可发生氧化还原反应。
例如:Fe2+ + Cr2O72- → Fe3+ + Cr3+。
d. 元素的氧化还原反应:元素本身也可以参与氧化还原反应。
例如:2Na +Cl2 → 2NaCl。
3. 判断氧化还原反应的方法:a. 氧化数的变化:氧化数表示元素在化合物中所带的电荷数,反应中氧化数发生变化则为氧化还原反应。
氧化数的增加为氧化,氧化数的减少为还原。
b. 氢和氧原子数的变化:如果反应物中的氢原子数和氧原子数不平衡,说明发生了氧化还原反应。
c. 电子的转移:当反应中发生电子的转移时,即一个物质失去电子(氧化),另一个物质获得电子(还原),可以确定为氧化还原反应。
4. 影响氧化还原反应的因素:a. 温度:温度的升高有助于反应剧烈进行,促进氧化还原反应。
b. 浓度:浓度的增加可以增大反应速度,加速氧化还原反应的进行。
c. 催化剂:适量添加催化剂可以提高氧化还原反应的速度,降低活化能。
d. 光照:光照可以改变某些物质的氧化还原性质,促进反应的进行。
5. 氧化还原反应的常见应用:a. 电池:电池是利用氧化还原反应将化学能转化为电能的装置,如常见的锌碳电池和铅酸蓄电池。
b. 腐蚀:金属在氧气和水的存在下发生氧化还原反应,导致金属腐蚀。
氧化还原反应知识点总结

氧化还原反应知识点总结氧化还原反应是化学中非常重要的一种反应类型,也是化学中最常见的一种反应。
在氧化还原反应中,原子、离子或者分子之间的电子转移是关键,使得氧化剂得到电子,而还原剂失去电子。
本文将从氧化还原反应的定义、特点、常见类型及应用等方面进行总结。
一、氧化还原反应的定义及特点氧化还原反应又被称为电子转移反应,是指化学反应中原子、离子或者分子之间电子的转移过程。
氧化剂是一种能够接受电子的物质,它在反应中被还原;还原剂是一种能够失去电子的物质,它在反应中被氧化。
氧化还原反应中的电子转移一般伴随着原子的形态变化,因此在氧化还原反应中,原子数目保持不变。
1.电子转移:氧化还原反应中,电子的转移是关键步骤。
当一个物质失去电子时,它被氧化;当一个物质得到电子时,它被还原。
2.氧化剂和还原剂:氧化剂是一种能够接受电子的物质,它在反应中被还原,即电荷数目减少。
还原剂是一种能够失去电子的物质,它在反应中被氧化,即电荷数目增加。
3.氧化数:在氧化还原反应中,通过氧化数可以确定物质的氧化程度。
氧化数是一个与电荷数目相关的指标,氧化剂的氧化数变小,还原剂的氧化数变大。
4.双电子转移反应:大多数氧化还原反应都是双电子转移反应,即一个物质失去两个电子,而另一个物质获得这两个电子。
二、氧化还原反应的常见类型根据氧化还原反应的类型不同,可以将其分为以下几类:1.金属与非金属的反应:金属与非金属发生氧化还原反应,通常是金属失去电子而被氧化,非金属接受电子而被还原。
例如,2Na+Cl2->2NaCl。
2.非金属元素间的反应:非金属元素在反应中能同时发生氧化和还原过程。
例如,2H2+O2->2H2O。
3.金属氧化物的还原:金属氧化物与还原剂反应,金属氧化物被还原成金属,而还原剂被氧化。
例如,Fe2O3+3CO->2Fe+3CO24.单质的氧化:一些物质直接与氧气反应,发生氧化还原反应。
例如,C+O2->CO25.氧化剂数目的改变:氧化剂数目的改变也是氧化还原反应的一种类型。
氧化还原反应知识点
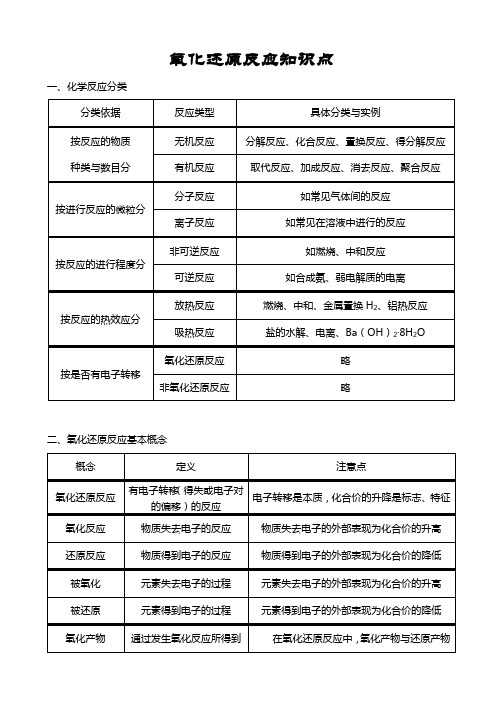
氧化还原反应知识点一、化学反应分类二、氧化还原反应基本概念的生成物可以是同一种产物,也可以是不同的产物;氧化(还原)产物可以只有一种产物,也可以有多种产物。
还原产物通过发生还原反应所得到的生成物氧化剂 得到电子的反应物常见氧化剂:活泼的非金属单质、高价金属阳离子、高价或较高价含氧化合物、过氧化物 还原剂 失去电子的反应物常见还原剂:活泼或较活泼的金属、一些非金属单质、较低价态的化合物氧化性 得到电子的能力 物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子数目无关。
还原性 失去电子的能力友情提示:1、基本概念间的关系2、氧化还原反应与四大无机反应间的关系本质 表象(标志)三、氧化还原反应的配平与表示 1、配平方法:标价态——标出反应前后化合价发生变化的元素的化合价。
列变化——列出化合价升、降的元素与对应的数值。
求倍数——依据得失电子守恒求出化合价升降数值的最小倍数。
配系数——先由升降倍数配平发生氧化还原的物质系数,再由质量守恒和电荷守恒配平其它物质系数。
查守恒——检查反应式是否满足质量守恒和电荷守恒。
2、特殊反应的配平技巧:归中反应(或氧化产物与还原产物为同种物质)——先按氧化还原反应的配平方法配平氧化剂和还原剂的系数,再依据质量守恒配平氧化(还原)产物的系数。
歧化反应(或氧化剂与还原剂为同种物质)——先按氧化还原反应的配平方法配平氧化产物和还原产物的系数,再依据质量守恒配平氧化(还原)剂的系数。
部分氧化还原反应——先按氧化还原反应的配平方法配平两剂和两产物的系数,再依据质量守恒修改部分氧化还原的物质的系数。
缺项配平——先按氧化还原反应的配平方法配平氧化剂和还原剂的系数,再依据质量守恒配平氧化(还原)产物的系数,最后依据质量守恒计算缺少的原子种类和数目,补上缺项的物质和系数。
3、氧化还原反应的表示方法:四、氧化还原反应的规律1、守恒律——氧化还原反应中,化合价升高总数=化合价降低总数=失电子总数=得电子总数=转移电子部类;反应物中电荷总数=生成物中电荷总数(数值相等,电性相同);反应物中的原子种类和个数=生成物中原子种类和个数。
初中化学氧化还原反应知识点

初中化学氧化还原反应知识点关键信息:1、氧化还原反应的定义:____________________________2、氧化还原反应的特征:____________________________3、氧化还原反应的本质:____________________________4、常见的氧化剂和还原剂:____________________________5、氧化还原反应的表示方法(双线桥法和单线桥法):____________________________6、氧化还原反应的规律(守恒规律、强弱规律、价态规律等):____________________________1、氧化还原反应的定义11 氧化还原反应是在反应前后元素的化合价具有相应的升降变化的化学反应。
这种化合价的变化是由于电子的转移(得失或偏移)引起的。
111 氧化反应是指物质失去电子(化合价升高)的反应;还原反应则是指物质得到电子(化合价降低)的反应。
112 在一个化学反应中,如果既有氧化反应又有还原反应,我们就称之为氧化还原反应。
2、氧化还原反应的特征21 化合价的升降是氧化还原反应的外在特征。
通过观察反应中元素化合价的变化,可以判断一个反应是否为氧化还原反应。
211 化合价升高的元素所在的物质发生氧化反应,化合价降低的元素所在的物质发生还原反应。
212 但需要注意的是,有化合价变化的反应不一定都是氧化还原反应,如某些同素异形体之间的转化。
3、氧化还原反应的本质31 氧化还原反应的本质是电子的转移。
电子转移包括电子的得失和电子的偏移。
311 在离子化合物中,电子的转移表现为电子的得失;而在共价化合物中,电子的转移表现为电子的偏移。
312 电子的转移导致了化合价的升降,从而表现出氧化还原反应的特征。
4、常见的氧化剂和还原剂41 常见的氧化剂包括氧气、氯气、高锰酸钾、过氧化氢等。
这些物质在反应中能够得到电子,使其他物质被氧化。
411 氧气在很多氧化反应中是常见的氧化剂,例如金属的氧化。
氧化还原反应的知识总结

氧化还原反应知识总结:一、氧化还原反应的“六对”基本概念氧化反应与还原反应,是两个完全相反又必定同时发生的过程,因此氧化还原反应的有关概念都是“成对”出现。
下面以Fe+CuSO4=FeSO4+Cu为例说明有关的“六对”概念。
1、从反应的宏观表现看化合价的升与降:有元素化合价升高必有元素的化合价降低,且升降总数必相等。
上例中:Fe元素的化合价升高了2,Cu元素的化合价降低了2。
[注意]①发生化合价升降的元素可以是一种或多种;②可以是不同物质中的不同元素(如上例),或不同物质中的同种元素(如2H2S+S6=3S+2H20),③也可以是同种物质中的不同元素(如2KMnO4=K2MnO4+MnO2+O2f、 C + CO2=2CO ),或同种物质中的同种元素(Cl2+H2O=HCI+HCIO )④反应中是否有元素的化合价发生改变,是判断一个反应是否属于氧化还原反应的标志。
2、从反应的本质看一一电子的得与失:某元素的原子若失去电子则化合价升高,得到电子则化合价降低,且得失电子总数必相等。
上例中:每个Fe原子失去两个电子,铁元素的化合价从0价升高到+2价,每个Cu原子得到2个电子,铜元素的化合价从+2价降低到0 价。
[注意]在氧化还原反应中电子的得失可以用双线桥或单线桥表示。
3、从反应物角度看一一氧化剂与还原剂:含有得电子元素(化合价降低)的反应物是氧化剂,含有失电子元素(化合价升高)的反应物是还原剂。
上例中,CuS04是氧化剂,Fe是还原剂。
[注意]若得、失电子的元素在同一种反应物中,则它既是氧化剂又是还原剂。
4、从生成物角度看——氧化产物与还原产物:含有得到电子(化合价降低了)元素的生成物是还原产物,含有失去电子(化合价升高了)元素的生成物是氧化产物。
上例中,Cu是还原产物,FeS04是氧化产物。
[注意]若一种生成物中同时有含得、失电子的元素,则它既是氧化产物又是还原产物。
5、从变化的过程看氧化反应与还原反应:元素失去电子(化合价升高)的反应是氧化反应,元素得到电子(化合价降低)的反应是还原反应。
初中化学中的氧化还原反应知识点总结

初中化学中的氧化还原反应知识点总结氧化还原反应是化学中的一个重要概念,也是初中化学的基础知识之一。
在氧化还原反应中,物质发生电子的转移,其中一种物质失去电子被氧化,另一种物质获得电子被还原,因此称为氧化还原反应。
1. 氧化还原反应的定义氧化还原反应指的是化学反应中,物质中的电子的转移过程。
在这个过程中,一个物质失去电子而被氧化,另一个物质获得电子而被还原。
比如,当铜与硫酸反应时,铜离子会失去两个电子变成铜离子,硫酸中的非金属硫元素会获得这两个电子变成硫气。
这个反应可以表示为:Cu + H2SO4 -> CuSO4 + SO2 + H2O。
2. 氧化还原反应中的氧化剂和还原剂在氧化还原反应中,氧化剂是指能够接受电子,使其他物质发生氧化的物质。
而还原剂则是指能够捐赠电子,使其他物质发生还原的物质。
在上例中,硫酸起到了氧化剂的作用,因为它接受了铜离子的电子;而铜起到了还原剂的作用,因为它输送了电子给硫酸中的硫元素。
3. 氧化还原反应中的电子损失与电子获得在氧化还原反应中,有氧化反应和还原反应两个过程。
氧化反应发生时,物质丢失了电子,电子的数量减少,被氧化的物质在化学方程式中作为反应物的右边。
还原反应发生时,物质获得了电子,电子的数量增加,被还原的物质在化学方程式中作为反应物的左边。
4. 氧化还原反应的特征氧化还原反应有以下特征:(1) 电子的转移:在氧化还原反应中,物质之间发生了电子的转移,其中一个物质失去了电子,被氧化,另一个物质获得了电子,被还原。
(2) 发生在同一反应中:氧化和还原反应同时发生在相同的反应中,不能单独进行。
(3) 可以通过化学方程式表示:氧化还原反应可以用化学方程式表示,其中氧化剂和还原剂在方程式中分别作为反应物和生成物。
(4) 电荷守恒:在氧化还原反应中,电子的转移必须满足电荷守恒定律,即电子的损失和获得的数量必须相等。
5. 氧化还原反应的应用氧化还原反应在日常生活和实验室中有广泛的应用。
氧化还原反应知识点总结
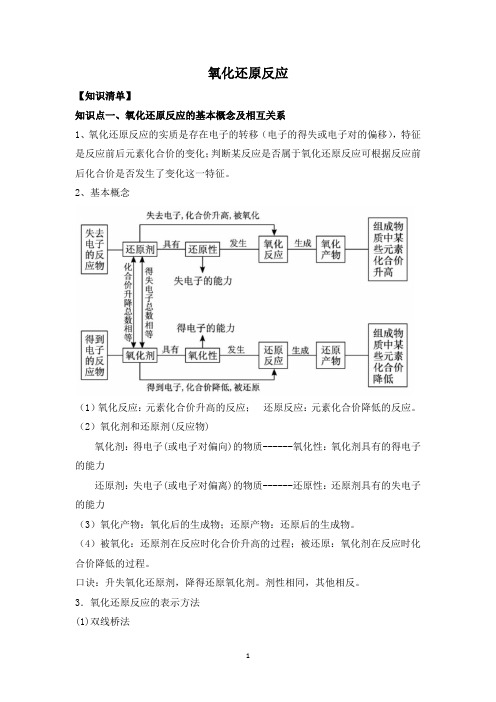
氧化还原反应【知识清单】知识点一、氧化还原反应的基本概念及相互关系1、氧化还原反应的实质是存在电子的转移(电子的得失或电子对的偏移),特征是反应前后元素化合价的变化;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2、基本概念(1)氧化反应:元素化合价升高的反应;还原反应:元素化合价降低的反应。
(2)氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力(3)氧化产物:氧化后的生成物;还原产物:还原后的生成物。
(4)被氧化:还原剂在反应时化合价升高的过程;被还原:氧化剂在反应时化合价降低的过程。
口诀:升失氧化还原剂,降得还原氧化剂。
剂性相同,其他相反。
3.氧化还原反应的表示方法(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得到”与“失去”,且得失电子总数应相等。
如:(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
4.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
知识点二、常见的氧化剂和还原剂(1)常见的氧化剂:①活泼的非金属单质:F2、O2、O3、Cl2等;②含有高价态元素的化合物:HNO3、KMnO4、K2Cr2O7、浓H2SO4等;③某些金属元素的高价态离子:Fe3+、Cu2+等;④其它:H2O2、Na2O2、HClO等。
(2)常见的还原剂:①活泼的金属单质:K、Na、Fe、Mg等;②含有低价态元素的化合物:H2S、HI、CO2、SO2、H2SO3等;③某些非金属单质:H2、C等。
总结氧化还原反应知识点

总结氧化还原反应知识点一、氧化还原反应的基本概念氧化还原反应(简称氧化还原反应)是化学反应的一种基本类型,是指在化学反应中,电子从一个物质转移到另一个物质的过程。
通常情况下,其中一种物质失去电子,被称为氧化剂;另一种物质得到电子,被称为还原剂。
氧化还原反应也可以根据电子的转移情况来看,一种叫做“氧化为电子给出体,还原为电子接收体”的化学反应。
氧化还原反应的基本方程式可以用以下形式表示:A + B → A+ + B-。
其中,A被氧化,B被还原。
在实际的化学实验中,氧化还原反应可以用电子方程式来表示,如下所示:Fe2+ → Fe3+ + e-氧化还原反应中,氧化剂和还原剂的含义也需要进行解释。
氧化剂是指在氧化还原反应中能接受电子的物质,它本身被还原;还原剂则是指在氧化还原反应中能够失去电子的物质,它本身被氧化。
氧化还原反应通常还涉及到氧化数的变化,氧化数是指元素的电负度,是指物质中的一个原子本身是否能够捐出或者接收多少电子。
在氧化还原反应中,氧化数会发生变化,具体的变化规律是:氧化剂氧化还原反应中的其他物质时,其氧化数减小,而还原剂氧化其他变数时,其氧化数增加。
二、氧化还原反应的特征1. 电子转移:氧化还原反应是指在化学反应中,电子从一个物质转移到另一个物质的过程。
通常情况下,其中一种物质失去电子,被称为氧化剂;另一种物质得到电子,被称为还原剂。
2. 氧化数变化:在氧化还原反应中,物质的氧化数会发生变化。
氧化剂氧化还原反应中的其他物质时,其氧化数减小,而还原剂氧化其他变数时,其氧化数增加。
这是氧化还原反应的重要特征之一。
3. 产生氧化还原反应:氧化剂在氧化还原反应中本身会被还原,还原剂在氧化还原反应中本身会被氧化。
4. 物质消失和新物质的生成:氧化还原反应会伴随物质的消失和新物质的生成,是一种化学反应的基本类型。
以上这些特征是氧化还原反应的主要特征,了解这些特征有助于我们更好地理解氧化还原反应的性质和规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学氧化还原反应基础知识清单化学氧化还原反应是初中化学学科中的重要内容之一,也是复杂而有趣的化学现象。
通过氧化还原反应,我们可以了解到物质之间的电子转移、氧化态的变化、电子的流动等重要概念。
下面是初三化学氧化还原反应的基础知识清单,希望能够帮助同学们更好地掌握这一部分内容。
1. 定义和概念
- 氧化还原反应是指物质中的原子、离子或分子的氧化态发生变化的化学反应。
- 在氧化还原反应中,发生氧化的物质称为还原剂,发生还原的物质称为氧化剂。
- 氧化是指物质失去电子或增加氧原子数,还原是指物质获得电子或减少氧原子数。
2. 氧化还原反应的基本原理
- 氧化还原反应基于电子的转移。
原子、离子或分子之间的电子转移导致了氧化态的变化。
- 在反应中,电子从氧化剂转移到还原剂。
- 氧化剂接受电子,所以其氧化态减小;还原剂失去电子,所以其氧化态增大。
3. 氧化还原反应的常见类型
3.1 单质的氧化反应
- 单质和氧气反应产生氧化物的过程称为氧化反应。
- 例如:2Mg + O2 → 2MgO
3.2 金属的还原反应
- 金属离子接受电子还原成金属的过程称为还原反应。
- 例如:Cu2+ + 2e- → Cu
3.3 非金属的还原反应
- 非金属氧化物和金属还原剂发生反应的过程称为还原反应。
- 例如:2Na + Cl2 → 2NaCl
3.4 化合物的还原反应
- 化合物中的正离子失去电子转化成原子或负离子,称为还原反应。
- 例如:2AgCl → 2Ag + Cl2
4. 氧化还原反应中的电子、氧化数和反应平衡
- 氧化还原反应中的电子转移可以通过氧化数进行分析。
氧化数是
用来描述原子在某一化合物或离子中带电情况的数值。
- 氧化数的变化反映了氧化还原反应中的电子转移。
- 氧化还原反应符合质量守恒和电荷守恒定律。
反应前后,各种原
子的总氧化数不变。
5. 氧化和还原的判断
- 氧化是指物质失去电子或增加氧原子数。
通过比较物质中某元素的氧化数变化,可以判断该元素是否被氧化。
- 还原是指物质获得电子或减少氧原子数。
通过比较物质中某元素的氧化数变化,可以判断该元素是否被还原。
通过了解以上基础知识,我们对初三化学氧化还原反应有了更清晰的认识。
希望同学们在学习中能够运用这些知识,更好地理解化学氧化还原反应的本质和应用。
