金属间化合物的晶体结构资料.
金属间化合物的晶体结构

金属间化合物的晶体结构一、经典离子理论根据经典离子理论,金属和非金属之间的化学键是通过电荷间的吸引力形成的。
在金属间化合物中,金属离子以正电荷形式存在,而非金属离子以负电荷形式存在。
这种离子之间的吸引力使得金属离子和非金属离子结合在一起,形成晶体。
二、NaCl型结构NaCl型结构是金属间化合物中最典型的晶体结构之一、它由正交晶系的结构单元组成,其中金属离子和非金属离子交替排列。
每个正电荷的金属离子周围都有6个负电荷的非金属离子,每个负电荷的非金属离子周围也有6个正电荷的金属离子。
这种排列方式使得晶体具有高度规则和紧密堆积的结构。
例如,氯化钠(NaCl)和氟化钙(CaF2)都属于NaCl型结构。
三、CsCl型结构CsCl型结构也是金属间化合物中一个常见的晶体结构。
它由正交晶系的结构单元组成,其中一个金属离子和一个非金属离子位于体心立方(BCC)晶胞中。
这种排列方式使得晶体具有比NaCl型结构更紧密的堆积。
例如,氯化铯(CsCl)和溴化银(AgBr)都属于CsCl型结构。
四、ZnS型结构ZnS型结构是金属间化合物中另一个重要的晶体结构。
它由正交晶系中的结构单元组成,其中一个金属离子和一个非金属离子位于面心立方(FCC)晶胞中。
这种排列方式使得晶体具有更高的密度和更紧密的堆积。
例如,硫化锌(ZnS)和硫化铜(Cu2S)都属于ZnS型结构。
五、其他晶体结构除了上述三种常见的晶体结构,金属间化合物还可以具有其他类型的晶体结构。
例如,磷化锗(GeP)具有立方体结构,亚硫酸铁(FeSO4∙7H2O)具有单斜晶体结构。
这些不同的晶体结构导致了金属间化合物的物理和化学性质的差异。
总结:金属间化合物的晶体结构对其性质具有重要影响。
经典离子理论认为金属离子和非金属离子之间的离子吸引力是形成金属间化合物的化学键。
NaCl型结构、CsCl型结构和ZnS型结构是金属间化合物中最常见的晶体结构。
此外,金属间化合物还可以具有其他类型的晶体结构。
金属间化合物的晶体结构

12、Cu3Ti型结构
化学式: A3B ;
—A —B
12、 Cu3Ti型结构 —A —B
—A —Bຫໍສະໝຸດ 8、L21型结构 化学式: A2BC; 结 构:L21型—体心正方晶系;
—A —B —C
9、C11b型结构
化学式: AB2; 结 构:C11b型—体心正方晶系;
—A —B
10、hcp型结构
10、hcp型结构
11、DO19型结 构
化学式: A3B ;
—A —B
11、DO19型结 构 —A —B
1、面心立方结构
[001]
a
[100]
a
a
[010]
2、L12型结构
化学式:A3B; 结 构:L12型—面心正方晶系;
—A —B
[001]
c
[100]
a
a
[010]
3、L10型结构
化学式:AB; 结 构:L10型—面心正方晶系; 特点:[001]方向上是由仅含 A原子组成的原子面与仅含B原子的原子面交替重叠 堆垛而成,所以[100]、[010]方向上的点阵常数与[001]方向的不一样,把[001]视 为c轴,其他两轴为a轴;
—A —B
[001]
c
[100]
a
a
[010]
4、DO22型结构
化学式:A3B; 结 构:DO22型—面心正方晶系;
—A —B
5、体心立方结 构
6、B2型结构
化学式:AB; 结 构:B2型—体心正方晶系;
—A —B
7、DO3型结构
化学式: A3B ; 结 构:DO3型—体心正方晶系;
金属间化合物的晶体结构ppt课件.pptx
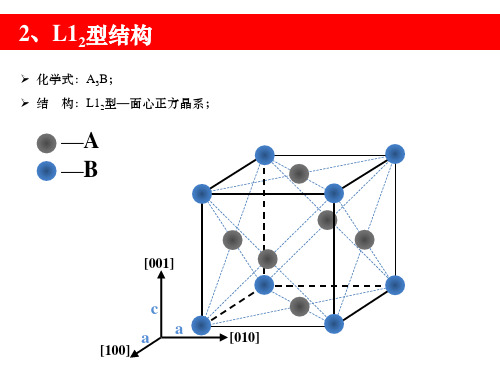
➢ 化学式:A3B; ➢ 结 构:L12型—面心正方晶系;
—A —B
[001]
c aa
[100]
[010]
3、L10型结构
➢ 化学式:AB; ➢ 结 构:L10型—面心正方晶系; ➢ 特点:[001]方向上是由仅含A原子组成的原子面与仅含B原子的原子面交替重叠
堆垛而成,所以[100]、[010]方向上的点阵常数与[001]方向的不一样,把[001]视 为c轴,其他两轴为a轴;
—A —B
[001]
c aa
[100]
[010]
4、DO22型结构
➢ 化学式:A3B; ➢ 结 构:DO22型—面心正方晶系;
—A —B
5、体心立方结 构
6、B2型结构
➢ 化学式:AB; ➢ 结 构:B2型—体心正方晶系;
—A —B
7、DO3型结构
➢ 化学式: A3B ; ➢ 结 构:DO3型—体心正方晶系;
—A —B
8、L21型结构
➢ 化学式: A2BC; ➢ 结 构:L21型—体心正方晶系;
—A —B —C
9、C11b型结构
➢ 化学式: AB2; ➢ 结 构:C11b型—体心正方晶系;
—A —B
10、hcp型结构
10、hcp型结构
11、DO19型结 构
➢ 化学式: A3B ;
—A —B
11、DO19型结 构
—A —B
12、Cu3Ti型结构
➢ 化学式: A3B ;
—A —B
12、 Cu3Ti型结构
—A —B
金属间化合物

钢中的过渡族金属元素之间形成一系列金属间化合物,即是指金属与金属、金属与准金属形成的化合物。其中最主要的有σ相和Lσves相,它们都属于拓扑密排(TcP)相,它们由原子半径小的一种原子构成密堆层,其中镶嵌有原子半径大的一种原子,这是一种高度密堆的结构。它们的形成除了原子尺寸因素起作用外,也受电子浓度因素的影响。
Laves相 在二元系中,Layes相是化学式为AB2型的复杂立方或复杂六方点阵的金属间化合物,其组元A的原子半径和组元B的原子半径的比值ra/rb约1.2。Laves相的晶体结构有三种类型:(1)MgCu2型为复杂立方系。(2)MgZn2为复杂六方系。(3)MgNi2为复杂六方系。电子浓度影响到LaYeS相的晶体结构类型。过渡族金属元素之间的Laves相随着元素原子序数增高,Laves相的晶体类型发生了由复杂立方点阵→复杂六方点阵→复杂立方点阵的转变。并且Laves260相的“平均族数”不超过8。在合金钢中,Laves相是具有复杂六方点阵的MgZn2型,它们是MoFe2、wFe2、NbFe2和TiFe2。在多元合金钢中,原子尺寸较小的锰、铬和镍可取代Laves相中铁原子的位置,原子尺寸较大的合金元素处于A原子的位置,形成化学式为(w,Mo,Nb)(Fe,Ni,Mn,cr)2的复合Laves相。Layes相出现在复杂成分的耐热钢中,是现代耐热钢中的一个强化相。
合金元素在钢的转变中的作用
合金元素对钢的临影响钢中的转变,改变钢的组织,以得到不同的性能。
cr- Mn 19%~24%Cr(800℃) 6.84~6.78
Cr—Fe 43.5%~49%Cr(600 C) 7.1~7.O
Cr-Co 56.6%~61%Cr 7.3~7.2
M0一Fe 47%~50%Mo(1400℃) 7.23~7.1 7
金属间化合物要点

以密排六方结构为 基的长程有序结构 长周期超点阵 laves相 σ相 χ相 Cr3Si(β-W)相 μ 相等
Cu3Au型(L12型) CuPt型(L11型) CuAuⅠ型(L10型)等 CuZn型(B2型) Fe3Al型(D03型) Cu2MnAl型(L21型)等
Mg3Cd型(D019型)等
CuPt型(L11型)
2.2.1几何密排相特点
以面心立方结构为基 的长程有序结构
➢ CuAuⅠ型(L10型)
化学式为AB。原 面心立方(001)面 被仅由Cu原子组成的 原子面及仅由Au原子 组成的原子面交替重 叠堆垛而成。典型的 例子有
➢ 定义:由不规则的四面体填充空间的密堆结构 。 ➢ 类型:laves相,σ相,χ相,β-W相等。 ➢ 特点:晶体中的间隙完全由不规则的四面体间隙
组成,没有八面体间隙,配位数>12,致密度> 0.74;原子间距极短 ,原子间电子交互作用强烈, 对称性低,滑移系少,塑性差。
2.2.1几何密排相特点
以面心立方结构为基 的长程有序结构
金属间化合物
晶体结构、结构稳定性 及电子理论
1定义
金属间化合物是指由两个或更多的金属组元或 类金属组元按比例组成的具有金属基本特性和不同 于其组元的长程有序晶体结构的化合物。
TiAl(L10)
2晶体结构分类
几何密排相 拓扑密排相
几何密排相
金属 间化 合物
拓扑密排相
以面心立方结构为 基的长程有序结构
MgZn2结构 原子半径小的Zn原子
形成四面体,原子半径大 的Mg原子占据四面体间隙 之中,本身构成一个四面 体骨架。每个Zn原子与6 个Mg原子和6个Zn原子相 邻,Zn原子的配位数为12; 每个Mg原子与4个Zn原子 和12个Mg原子相邻,Mg 原子的配位数为16。
1-3-1 金属的晶体结构

2
一、典型金属的晶体结构
最常见的金属晶体结构有三种:面心立方结 构、体心立方结构和密排六方结构。 本节主要讨论原子的排列方式、晶胞内原子 数、点阵常数、原子半径、原子配位数、致密度 和原子间隙大小。 下面分别加以讨论:
3
1、原子排列方式
1) 球体的紧密堆积
① 单一质点的等大球体最紧密堆积,如纯金属晶体。 ② 几种质点的不等大球体的紧密堆积,如离子晶体。
16
2) 密排六方结构
属于六方紧密堆积,以ABABAB…的方式堆积, 从结构中可分析出六方晶胞。 具有这种结构的金属:Be、Mg、Zn、Cd、 -Ti和-Co。
3) 体心立方结构
属于体心立方紧密堆积,原子是以体心立方空间 点阵的形式排列,可分析出体心立方晶胞。
具有这种结构的金属:V、-Fe、Nb、Mo、 Cr和W。
3、晶胞中的原子数
1) 简单立方结构 (SC / Simple cubic)
1 8 1 8
20
2) 体心立方结构
(bcc / Body-centered cubic)
3) 面心立方结构
(fcc / Face-centered cubic)
1 8 1 2 8
1 1 8 6 4 8 2
第三层堆积的特征: 有两种完全不同的堆积方式。 a. 堆积在单层空隙位置 从垂直图面的方向观察,第三层球的位置正好与 第一层相重复。如果继续堆第四层,其又与第二 层重复,第五层与第三层重复,如此继续下去, 这种紧密堆积方式用ABABAB……的记号表示。
六方紧密堆积hcp (ABAB…)
对应ABAB……紧密堆积方式,其球体
r(Ag)=0.288nm, r(Al)=0.286nm,但都不能形成连续 (无限)固溶体,为什么? 3、(1)叙述形成固溶体的影响因素; (2)形成连续固溶体的充分必要条件是什么?
六方钙钛矿结构

六方钙钛矿结构
六方钙钛矿结构是一种特殊的晶体结构,由钙、钛和其他元素及其官能团在结构上形成的共生关系。
这种结构由六方对称性堆积晶体点状结构组成,其真实结构是由金属间化合物覆盖在晶体表面形成的六方空分子的结构。
钙原子位于晶体表面上方,钛原子位于晶体表面下方,氧原子填充六方体晶体表面中间。
六方钙钛矿结构具有良好的机械性能和电学性能,在几乎所有材料工程领域都有应用。
与多晶硅和其它传统单晶材料相比,由钙钛矿结构构成的晶体表面非常光滑,可以有效地减少高强度的晶体晶粒缺陷,从而改善材料的力学性能和抗热性能。
此外,钙钛矿结构还具有较高的原子密度,可以抑制空间等位原子的迁移,从而使材料的韧性增强并导致抗裂破能力的提高。
六方钙钛矿结构也具有良好的耐腐蚀性和气环境耐受性,因此在高温、高压及危险环境中,可以使材料具有较长的使用寿命和稳定性。
此外,它还具有良好的电学性能和热电性能,可以使电子加热晶体表面和产生脉冲延迟用于无线电电力系统。
不过,六方钙钛矿结构也存在一些缺点,例如材料的裂变容易性,因为他们的结构中有非常细小的有序转换区,相对容易被外界的外力扰乱,从而表现
出裂变的倾向。
但这个缺陷在工程实践中可以通过控制晶体晶粒结构装置和尺寸来解决。
以上内容仅供参考,如需更多信息,建议查阅相关文献或咨询材料学专家。
金属间化合物的定义

金属间化合物是指由两个或两个以上的金属元素构成的化合物,它们的原子之间通过共享电子对而形成了化学键。
这些化合物通常具有不同于其组成金属的物理和化学性质。
金属间化合物可以根据它们的晶体结构进行分类,其中一些常见的类型包括:
1. 正常价化合物:这类化合物的形成是由于金属原子之间的电子转
移,以达到稳定的电子结构。
例如,在FeCl2 中,铁原子失去两个电子,而氯原子获得两个电子,形成了具有离子键的化合物。
2. 电子化合物:这类化合物的形成是由于金属原子之间的共享电子
对,以形成稳定的电子结构。
例如,在Al2Cu 中,铝原子和铜原子共享电子对,形成了具有共价键的化合物。
3. 间隙化合物:这类化合物是由较小的金属原子填入较大金属原子
的晶格间隙中形成的。
例如,在Fe3C 中,碳原子填入了铁原子的晶格间隙中,形成了具有复杂结构的化合物。
金属间化合物在材料科学中具有重要的应用,例如在合金设计、催化剂、电子材料和磁性材料等领域。
它们的特殊性质可以通过改变组成元素、晶体结构和制备方法等来调控,以满足不同的应用需求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7、DO3型结构
➢ 化学式: A3B ; ➢ 结 构:DO3型—体心正方晶系;
—A —B
8、L21型结构
➢ 化学式: A2BC; ➢ 结 构:L21型—体心正方晶系;
—A —B —C
9、C11b型结构
➢ 化学式: AB2; ➢ 结 构:C11b型—体心正方晶系;
—A —B
10、hcp型结构
堆垛而成,所以[100]、[010]方向上的点阵常数与[001]方向的不一样,把[001]视 为c轴,其他两轴为a轴;
—A —B
[001]
c aa
[100]
[010]
4、DO22型结构
➢ 化学式:A3B; ➢ 结 构:DO22型—面心正方晶系;
—A —B
5、体心立方结 构
6、B2型结构
➢ 化学式:AB; ➢ 结 构:B2型—体心正方晶系;
10、hcp型结构
11、DO19型结 构
➢ 化学式: A3B ;
—A —B
11、DO19型结 构
—A —B
12、Cu3Ti型结构
➢ 化学式: A3B ;
—A —B
12、 Cu3Ti型结构
—A —B
1、面心立方结构Biblioteka [001]a aa
[100]
[010]
2、L12型结构
➢ 化学式:A3B; ➢ 结 构:L12型—面心正方晶系;
—A —B
[001]
c aa
[100]
[010]
3、L10型结构
➢ 化学式:AB; ➢ 结 构:L10型—面心正方晶系; ➢ 特点:[001]方向上是由仅含A原子组成的原子面与仅含B原子的原子面交替重叠
