第3章 氨基酸
中职生物化学第1章绪论、第3章蛋白质化学

H H H OH
肽键
甘氨酰甘氨酸
N末端
C末端
牛核糖核酸酶
• 3.生物活性肽 如缩宫素、生长 素、谷胱甘肽(GSH)等
H2O2 2H2O
2GSH
GSH过氧 化物酶
GSSG
ห้องสมุดไป่ตู้
NADP+
GSH还原酶
NADPH+H+
㈡蛋白质的一级结构 蛋白质多肽链中氨基酸的排列顺
序称为蛋白质的一级结构。也是 蛋白质的基本结构
β-转角
β-折迭
α-螺旋
无规卷曲
㈡蛋白质分子的三级结构 (具有生物学功能)
C 端
N端
㈢蛋白质分子的四级结构
• 有些蛋白质分子含有二条或多条多 肽链,每一条多肽链都有完整的三 级结构,称为蛋白质的亚基
• 蛋白质分子中各亚基的空间排布及 亚基接触部位的布局和相互作用, 称为蛋白质的四级结构
血 红 蛋 白
分子生物学时代称为功能生物化学 50年代提出DNA双螺旋结构模型 60年代确定了遗传信息传递的中心
法则,我国首先人工合成了牛胰岛 素 70年代建立了重组DNA技术 80年代发现了核酶 现代开始实施人类基因计划
二、生物化学与健康的关系 古代应用实例:
脚气病→槟榔(VitB1)
雀目(夜盲症)→猪肝(VitA)
的 四 级 结 构
亚基单独存在没有活性,聚合一 起形成四级结构,才具有生物活 性
如过氧化氢酶由四个相同亚基构 成
如血红蛋白含2个α-亚基和2个 β-亚基
蛋白质的空间结构决定其特定 的生物学功能
• 疯牛病中的蛋白质构象改变 • 疯牛病是由朊病毒蛋白引起的一
组人和动物神经退行性病变 • 正常的PrP富含α-螺旋,称为
氨基酸简写和密码子表
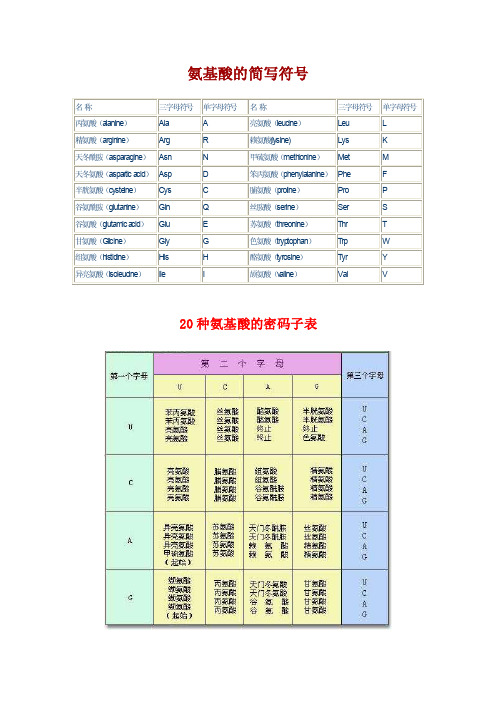
氨基酸的简写符号20种氨基酸的密码子表(1)非极性疏水性氨基酸:甘、丙、缬、亮、异亮氨基酸、苯丙、脯氨酸(亚氨基酸)(7种)。
(2)极性中性氨基酸:色氨酸、酪、丝、苏、半胱氨酸、蛋氨酸(甲硫氨基酸)、谷氨酰胺、天冬酰胺(8种)。
(3)酸性氨基酸:谷、天冬氨酸(2种)。
(4)碱性氨基酸:赖、精、组氨酸(3种)。
教你如何用WORD文档(2012-06-27 192246)转载▼标签:杂谈1. 问:WORD 里边怎样设置每页不同的页眉?如何使不同的章节显示的页眉不同?答:分节,每节可以设置不同的页眉。
文件――页面设置――版式――页眉和页脚――首页不同。
2. 问:请问word 中怎样让每一章用不同的页眉?怎么我现在只能用一个页眉,一改就全部改了?答:在插入分隔符里,选插入分节符,可以选连续的那个,然后下一页改页眉前,按一下“同前”钮,再做的改动就不影响前面的了。
简言之,分节符使得它们独立了。
这个工具栏上的“同前”按钮就显示在工具栏上,不过是图标的形式,把光标移到上面就显示出”同前“两个字来。
3. 问:如何合并两个WORD 文档,不同的页眉需要先写两个文件,然后合并,如何做?答:页眉设置中,选择奇偶页不同与前不同等选项。
4. 问:WORD 编辑页眉设置,如何实现奇偶页不同比如:单页浙江大学学位论文,这一个容易设;双页:(每章标题),这一个有什么技巧啊?答:插入节分隔符,与前节设置相同去掉,再设置奇偶页不同。
5. 问:怎样使WORD 文档只有第一页没有页眉,页脚?答:页面设置-页眉和页脚,选首页不同,然后选中首页页眉中的小箭头,格式-边框和底纹,选择无,这个只要在“视图”――“页眉页脚”,其中的页面设置里,不要整个文档,就可以看到一个“同前”的标志,不选,前后的设置情况就不同了。
6. 问:如何从第三页起设置页眉?答:在第二页末插入分节符,在第三页的页眉格式中去掉同前节,如果第一、二页还有页眉,把它设置成正文就可以了●在新建文档中,菜单―视图―页脚―插入页码―页码格式―起始页码为0,确定;●菜单―文件―页面设置―版式―首页不同,确定;●将光标放到第一页末,菜单―文件―页面设置―版式―首页不同―应用于插入点之后,确定。
人教版高中生物选择性必修3生物技术与工程课后习题 第3章 第4节 蛋白质工程的原理和应用

第4节蛋白质工程的原理和应用基础巩固1.下列关于蛋白质工程的说法,正确的是( )A.蛋白质工程无需构建基因表达载体B.蛋白质工程需要限制性内切核酸酶和DNA连接酶C.对蛋白质的改造是通过直接改造相应的mRNA来实现的D.蛋白质工程的流程和天然蛋白质合成的过程是相同的答案:B解析:蛋白质工程是指以蛋白质分子的结构规律及其与生物功能的关系作为基础,通过改造或合成基因,来改造现有蛋白质,或制造一种新的蛋白质,故需要构建基因表达载体,也需要限制性内切核酸酶和DNA连接酶。
蛋白质工程要对基因改造后再合成蛋白质,与天然蛋白质的合成过程不同。
2.科学家为提高玉米中赖氨酸的含量,计划将天冬氨酸激酶第352位的氨基酸由苏氨酸变成异亮氨酸,将二氢吡啶二羧酸合成酶中第104位的氨基酸由天冬酰胺变成异亮氨酸,这样就可以使玉米叶片和种子中游离赖氨酸的含量分别提高5倍和2倍。
下列对蛋白质的改造,操作正确的是( )A.直接通过分子水平改造蛋白质B.直接改造相应的mRNAC.对相应的基因进行操作D.重新合成新的基因答案:C3.下列各项不属于蛋白质工程研究内容的是( )A.分析蛋白质分子的精细结构B.对蛋白质进行有目的地改造C.分析氨基酸的化学组成D.按照人的意愿将天然蛋白质改造成新的蛋白质答案:C解析:蛋白质工程不需要分析氨基酸的化学组成,因为组成蛋白质的氨基酸的基本元素都是C、H、O、N,元素组成不会影响设计新的蛋白质。
4.蛋白质工程中对蛋白质分子进行设计时,主要包括( )①进行少数氨基酸的替换②从氨基酸的排列顺序出发设计全新的蛋白质③直接改变蛋白质的空间结构A.①③B.①②C.①②③D.②③答案:B5.下列关于蛋白质工程和基因工程的比较,错误的是( )A.基因工程原则上只能生产自然界已存在的蛋白质,而蛋白质工程可以对现有蛋白质进行改造,或制造一种新的蛋白质B.蛋白质工程是在基因工程的基础上发展起来的,蛋白质工程最终还是要通过改造或合成基因来完成C.当得到可以在一定条件下延长保存时间的干扰素后,在相关酶、氨基酸和适宜的温度、pH条件下,干扰素可以大量自我合成D.基因工程和蛋白质工程产生的变异都是可遗传的答案:C6.水蛭素是由65个氨基酸缩合而成的凝血酶特异性抑制剂,在临床上可用来治疗血栓疾病。
(完整)生物化学名词解释

生物化学名词解释第一章蛋白质的结构与功能1。
肽键:一分子氨基酸的氨基和另一分子氨基酸的羧基通过脱去水分子后所形成的酰胺键称为肽键。
2. 等电点:在某一pH溶液中,氨基酸或蛋白质解离成阳离子和阴离子的趋势或程度相等,成为兼性离子,成点中性,此时溶液的pH称为该氨基酸或蛋白质的等电点。
3. 模体:在蛋白质分子中,由两个或两个以上具有二级结构的肽段在空间上相互接近,形成一个特殊的空间构象,并发挥特殊的功能,称为模体。
4. 结构域:分子量较大的蛋白质三级结构常可分割成多个结构紧密的区域,并行使特定的功能,这些区域被称为结构域.5。
亚基:在蛋白质四级结构中每条肽链所形成的完整三级结构。
6. 肽单元:在多肽分子中,参与肽键的4个原子及其两侧的碳原子位于同一个平面内,称为肽单元。
7. 蛋白质变性:在某些理化因素影响下,蛋白质的空间构象破坏,从而改变蛋白质的理化性质和生物学活性,称之为蛋白质变性。
第二章核酸的结构与功能1。
DNA变性:在某些理化因素作用下,DNA分子稳定的双螺旋空间构象破环,双链解链变成两条单链,但其一级结构仍完整的现象称DNA变性.2。
Tm:即溶解温度,或解链温度,是指核酸在加热变性时,紫外吸收值达到最大值50%时的温度.在Tm时,核酸分子50%的双螺旋结构被破坏。
3. 增色效应:核酸加热变性时,由于大量碱基暴露,使260nm处紫外吸收增加的现象,称之为增色效应.4. HnRNA:核内不均一RNA。
在细胞核内合成的mRNA初级产物比成熟的mRNA分子大得多,称为核内不均一RNA。
hnRNA在细胞核内存在时间极短,经过剪切成为成熟的mRNA,并依靠特殊的机制转移到细胞质中.5。
核酶:也称为催化性RNA,一些RNA具有催化能力,可以催化自我拼接等反应,这种具有催化作用的RNA分子叫做核酶。
6. 核酸分子杂交:不同来源但具有互补序列的核酸分子按碱基互补配对原则,在适宜条件下形成杂化双链,这种现象称核酸分子杂交.第三章酶1. 酶:由活细胞产生的具有催化功能的一类特殊的蛋白质。
高二化学鲁科版(2019)选择性必修3第2章 第4节羧酸 氨基酸和蛋白质第2课时 课件(59张)

课前自主学习
学习任务一 氨基酸和多肽 任务驱动: 组成人体的氨基酸有多种,大约有二十多种,它们是组成蛋白质的重要成分。 在氨基酸中,有八种氨基酸人体不能合成,必须要从食物中摄取。
1.氨基酸的概念 氨基酸是_氨__基__取代了_羧__酸__分子中烃基上的氢原子形成的取代羧酸,其官能团 为—__N_H_2_、_—__C_O_O_H_。 α-氨基酸:分子中_氨__基__和_羧__基__连在同一个碳原子上的氨基酸,其结构可
杀菌、消毒
重金属盐(例如硫酸铜)溶液能使 蛋白质变性
【易错提醒】(1)并非所有的蛋白质都发生显色反应,只有含有苯环的蛋白质 才具有此性质。 (2)轻金属盐或铵盐的浓溶液才能使蛋白质发生盐析,稀溶液能够促进蛋白质 的溶解。 (3)重金属盐溶液无论浓稀均能使蛋白质变性。
【补偿训练】 下列有关蛋白质的说法不正确的是 ( )
C.服用适量的泻药
D.服用大量食盐水
【解析】选A。鸡蛋清或牛奶中含有大量蛋白质,能代替人体中的蛋白质与重金
属盐作用而解毒。
3.(2020·南昌高二检测)某蛋白质充分水解后能分离出有机物R,R可与等物质
的量的KOH或盐酸完全反应。3.75 g R与50 mL 1 mol·L-1的NaOH溶液完全中和,
C.4种
D.5种
【解析】选C。甘氨酸(H2NCH2COOH)和苯丙氨酸(
)
发生分子间脱水生成的二肽有:
,
由上述可知,分子间的氨基与羧基脱水生成的二肽有4种。
2.下面是蛋白质分子结构的一部分,其中标出了分子中不同的键,当蛋白质发 生水解反应时,断裂的键是 ( )
A.① B.② C.③ D.④ 【解析】选C。蛋白质水解时,肽键(
高一人教版生物必修1知识点总结第一到第五章)

高一人教版生物必修1知识点总结第一到第五章)高一人教版生物必修1知识点总结第一到第五章)高一人教版生物必修1知识点总结!一、相关概念、细胞:是生物体结构和功能的基础单位。
除了病毒以外,所有生物都是由细胞构成的。
细胞是地球上最基础的生命系统生命系统的结构层次:细胞→组织→器官→系统(植物没有系统)→个体→种群→群落→生态系统→生物圈二、病毒的相关知识:1、病毒(Virus)是一类没有细胞结构的生物体。
主要特征:①、个体微小,一般在10~30nm之间,大多数必须用电子显微镜才能看见;②、仅具有一种类型的核酸,DNA或RNA,没有含两种核酸的病毒;③、专营细胞内寄生生活;④、结构简单,一般由核酸(DNA或RNA)和蛋白质外壳所构成。
2、依据寄生的宿主不同,病毒可分为动物病毒、植物病毒和细菌病毒(即噬菌体)三大类。
依据病毒所含核酸种类的不同分为DNA病毒和RNA病毒。
3、常见的病毒有:人类流感病毒(引起流行性感冒)、SARS病毒、人类免疫缺陷病毒(HIV)[引起艾滋病(AIDS)]、禽流感病毒、乙肝病毒、人类天花病毒、狂犬病毒、烟草花叶病毒等。
第二节细胞的多样性和统一性一、细胞种类:依据细胞内有无以核膜为界限的细胞核,把细胞分为原核细胞和真核细胞二、原核细胞和真核细胞的比较:1、原核细胞:细胞较小,无核膜、无核仁,没有成形的细胞核;遗传物质(一个环状DNA分子)集中的区域称为拟核;没有染色体,DNA 不与蛋白质结合,;细胞器只有核糖体;有细胞壁,成分与真核细胞不同。
2、真核细胞:细胞较大,有核膜、有核仁、有真正的细胞核;有一定数目的染色体(DNA与蛋白质结合而成);一般有多种细胞器。
3、原核生物:由原核细胞构成的生物。
如:蓝藻、细菌(如硝化细菌、乳酸菌、大肠杆菌、肺炎双球菌)、放线菌、支原体等都属于原核生物。
4、真核生物:由真核细胞构成的生物。
如动物(草履虫、变形虫)、植物、真菌(酵母菌、霉菌、粘菌)等。
高三生物第3章 体液调节(含答案)
第3章体液调节1、人们发现的第一种激素是什么?促胰液素2、胰腺的外分泌部分泌胰液时,受哪种激素的调节?促胰液素3、甲状腺激素的功能?调节体内有机代谢,促进生长发育,提高神经的兴奋性。
4、生长激素的功能?调节生长发育5、肾上腺分为?皮质、髓质6、肾上腺皮质分泌的激素及其作用?醛固酮、皮质醇。
调节水盐代谢和有机物代谢。
7、肾上腺髓质分泌的激素?肾上腺素。
8、肾上腺素的功能?提高机体的应激能力;促进新陈代谢,增加产热;促进肝糖原分解使血糖升高9、雄激素的化学本质?固醇能否口服?能口服10、氨基酸类衍生物的激素?甲状腺激素,肾上腺素等(可口服)。
11、多肽和蛋白质类的激素?促激素释放激素,促激素,抗利尿激素,胰岛素,胰高血糖素(不可口服)12、生长激素由哪种内分泌腺合成?垂体13、分泌胰高血糖素的细胞?胰岛A细胞14、分泌胰岛素的细胞?胰岛B细胞15、血糖的来源?(1)食物中的糖类消化吸收。
(2)肝糖原分解(3)脂肪等非糖物质转化16、血糖的去路?入组织细胞进行氧化分解合成肝糖原,肌糖原转变为甘油三酯,某些氨基酸17、饭后半小时,血糖升高,此时血糖的主要来源?食物中糖类的消化吸收18、正常人的血糖含量是多少?3.9—6.1mmol/L19、将动物的胰腺摘取磨碎能获取胰岛素吗?不能,因为胰腺外分泌部分泌的胰液中含有蛋白酶,能将胰岛素水解掉。
20、在血糖平衡调节过程中,胰岛A细胞膜上的受体可接受的信息分子有哪些?神经递质,胰岛素,葡萄糖。
21、垂体分泌促甲状腺激素的活动受促甲状腺激素释放激素,甲状腺激素(激素名称)的影响?22、甲状腺激素含量增多会抑制下丘脑分泌哪种激素?促甲状腺激素释放激素甲状腺激素增多时,会抑制垂体对哪种激素的分泌?促甲状腺激素这种调节机制属于什么调节?负反馈调节23、甲状腺激素分泌的过程中既存在分级调节,也存在反馈调节。
24、下丘脑,垂体和甲状腺功能的分级调节系统也称为?下丘脑—垂体—甲状腺轴。
第三章第六节遗传密码
4.简并性: ①.简并现象: 色氨酸(UGG)和甲硫氨酸(AUG)例外,仅一个三联体密码; 其余氨基酸都有一种以上的密码子。 ②.61 个为有意密码,起始密码为GUG 、AUG(甲硫氨酸)。
3 个为无意密码,UAA 、UAG 、UGA 为蛋白质合成终止
信号。 ③.简并现象的意义:(生物遗传的稳定性)
第六节
一、遗传密码
遗传密码与蛋白质的翻译
遗传密码(genetic code) :是生物蛋白质合成的密码, 是遗传信息的单位,由A、U、C、G组成。
遗传密码又是如何翻译呢?
首先是以DNA的一条链为模板合成与它互补的 mRNA ,根据碱基互补配对的规律,在这条mRNA链 上,A变为U,T变为A,C变为G,G变为C。 因此,这条mRNA上的遗传密码与非模板DNA链 是一样的,所不同的只是U代替了T。然后再由mRNA 上的遗传密码翻译成多肽链中的氨基酸序列。
(一)核糖体
核糖体是合成蛋白质的中心,是rRNA与核糖体蛋白结合起来的小颗粒, 直径为14-30nm。核糖体包含大小不同的两个亚基,由镁离子Mg++结合 起来的三维结构,一般呈不倒翁形(图3-29)。
原核生物与真核生物核糖体的区别:
区别 大亚基 小亚基 rRNA 多肽 原核生物 50S 30S 大亚基:5S、23S 小亚基:16S 大亚基:31 小亚基:21 真核生物 60S 40S 大亚基: 5S 、5.8S 、28S 小亚基:18S 大亚基:49 小亚基:33
⑵.阿委瑞(Avery O.T.,1944)试验:用生物化学方法
证明结论:遗传物质DNA 是转化因子。 2.噬菌体的侵染与繁殖 赫尔歇(Hershey)等用同位素32 P 和35 S 验证DNA 是遗传物质。
高中生物新教材选择性必修三同步讲义 第3章 第3节 基因工程的应用
第3节基因工程的应用[学习目标] 1.举例说出基因工程在农牧业、医药卫生和食品工业等方面的应用。
2.乳腺生物反应器的制备过程。
一、基因工程在农牧业方面的应用1.转基因抗虫植物(1)方法:从某些生物中分离出具有抗虫功能的基因,将它导入作物中培育出具有抗虫性的作物。
(2)成果:转基因抗虫棉花、玉米、大豆、水稻和马铃薯等。
2.转基因抗病植物(1)背景:许多栽培作物由于自身缺少抗病基因,因此用常规育种的方法很难培育出抗病的新品种。
(2)方法:科学家将来源于某些病毒、真菌等的抗病基因导入植物中,培育出了转基因抗病植物。
(3)成果:转基因抗病毒甜椒、番木瓜和烟草等。
3.转基因抗除草剂植物(1)背景:杂草常常危害农业生产,而大多数除草剂不仅能杀死田间杂草,还会损伤作物,导致作物减产。
(2)方法:将降解或抵抗某种除草剂的基因导入作物,可以培育出抗除草剂的作物品种。
(3)成果:转基因抗除草剂玉米、大豆、油菜和甜菜等。
4.改良植物的品质5.提高动物的生长速率(1)基因:外源生长激素基因。
(2)成果:转基因鲤鱼。
6.改善畜产品的品质(1)基因:肠乳糖酶基因。
(2)成果:转基因牛分泌的乳汁中,乳糖的含量大大降低,而其他营养成分不受影响。
判断正误(1)转入外源生长素基因的转基因动物,生长速率更快()(2)转基因抗虫棉的Bt抗虫蛋白基因能抗病毒、细菌、真菌()(3)“转基因植物”是指植物体细胞中出现了新基因的植物()答案(1)×(2)×(3)×解析(1)转入外源生长激素基因(而非生长素基因)的转基因动物,生长速率更快。
(2)抗虫棉能抵抗棉铃虫的侵害,提高棉花的产量和品质,但不能抵抗病毒、细菌、真菌。
(3)体细胞中出现了新基因的植物不一定是转基因植物,基因突变也可能出现新基因,这样的植物不能称为转基因植物。
任务一:转基因植物和动物的培育1.从环境保护角度出发,分析转基因抗虫棉与普通棉相比在害虫防治方面的优越性。
第一章、氨基酸的结构及性质PPT
3)半胱氨酸(Cys) 它的个性不仅表现在其侧链 有一定的大小和具有高度的化学反应活性,还 在于两个 Cys 能形成稳定的带有二硫(桥)键 的胱氨酸。二硫键不仅可以在肽链内,也可以 在肽链间存在。更有甚者,同样的一对二硫键 能具有不同的空间取向。
Page 19
半胱氨酸
-OOC-CH-CH2-SH + HS-CH2-CH-COO-
苯丙氨酸 (Phe,F)
Page 11
酪氨酸 (Tyr,Y)
色氨酸 (Trp,W)
3、杂环氨基酸
Page 12
组氨酸 (His, H)
脯氨酸 (Pro, P)
说明:关于杂环氨基酸和杂环亚氨基酸
色氨酸 (Trg,W)
芳香族氨基酸
组氨酸 ( His, H)
Page 13
杂环氨基酸
脯氨酸 ( Pro, P)
脯氨酸和羟脯氨酸能溶于乙醇或乙醚中, 且 二者极易溶于水而潮解。
Page 28
2. 氨基酸的旋光性
●除甘氨酸外,氨基酸均含有一个手性-碳原子, 都具有旋光性。 ●比旋光度是氨基酸的重要物理常数之一,是鉴别各种氨基酸的重要依据。
Page 29
氨基酸的构型-都有 D-型和 L-型 2 种立体异构体
L-(-)甘油醛
氨基酸与水合茚三酮共热,发生氧化脱氨反应,生成NH3与酮酸。 水合茚三酮变为还原型茚三酮。 加热过程中酮酸裂解,放出CO2,自身变为少一个碳的醛。水合 茚三酮变为还原型茚三酮。 NH3与水合茚三酮及还原型茚三酮脱水缩合,生成蓝紫色化合物。
Page 47
反应要点 A.该反应由NH2与COOH共同参与 B.茚三酮是强氧化剂 C.该反应非常灵敏,可在570nm测定吸光值 D. 测定范围:0.5~50µg/ml E.脯氨酸与茚三酮直接生成黄色物质(不释放
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• His is the sole amino acid that the pKa of the R group is near 7
• 二、不常见氨基酸: 存在于某些蛋白质, 由常见氨基酸修饰而 来。 • 4-hydro-Pro, 5-hydroLys, 酪氨酸碘化衍生 物三碘甲腺原氨酸等 • p128
还可与苯异硫氰酸酯在弱碱性条件 下生成苯氨基硫甲酰(PTC) 衍生物,进一步在硝基甲烷中 与三氟乙酸反应生成PTH衍生物 无色,层析分离,鉴定N末端 氨基酸,Edman反应p137
• 4. Schiff反应p138
• • • •
5.脱氨基反应:酶促反应,形成alpha酮酸 二、羧基反应 1、成酯: 2、成酰氯:
使得pH降低几个单位,接近7 而对使用HCl滴定没有影响 故甲醛滴定是与氨基反应 加酚酞变红。
• 第四节:氨基酸参与的化学反应 • 一、alpha氨基参与的反应 • 1. 与亚硝酸:生成氮气和羟基羧酸
van Slyke氨基酸 定量测定基础
• 2. 与酰化试剂反应p136
• 重要,保护氨基,esp丹磺酰氯p136 • 3. 烃基化反应:与DNFB24-二硝基氟苯反应生成 DNP-氨基酸,鉴定N末端氨基酸:
• Amino acids are weak polyprotic acids: The dissociation of amino acids is affected by pH. At low pH, both the amino and carboxyl groups are protonated, thus the molecule has a net positive charge. With the pH increase, the carboxyl group is first to dissociate, yielding the neutral zwitterionic molecules. The further increase in pH causes both groups dissociation, yielding a net negatively charged molecule.
• 2. 电荷和兼性分子:氨基酸在中性pH时,羧基-COO-, 氨基则NH4+。这时,氨基酸分子含有一个正电荷和 一个负电荷,谓之兼性分子(zwitterion) • 3. 旋光性:这些氨基酸中,除Glycine外,其余所有 这些氨基酸中, 这些氨基酸中 外 氨基酸均具有旋光性,蛋白质中所有氨基酸均为L构 型。大部分属于 α-氨基酸。其中,脯氨酸属于 大部分属于L-α 氨基酸 其中,脯氨酸属于 氨基酸。 属于L大部分属于 亚氨基酸, 甘氨酸则属于 氨基酸 则属于α 氨基酸。 α-亚氨基酸,而甘氨酸则属于α-氨基酸。一般可溶 亚氨基酸 解于水,胱氨酸和酪氨酸外。熔点高,>200degree, 高于同级别的胺。 • 4.氨基酸简写符号:见p124
• 第三节:氨基酸酸碱化学特征 • 一、兼性离子形式 • 熔点高,导致水介电常数升高,乙醇等降低,与一 般有机物都不同。原因:推测与其结构有关。在晶 体或水溶液里以兼性分子或偶极子形式存在。产生 离子晶格,静电吸引作为主要作用力。二苯胺则主 离子晶格 要为范德华力
• 二、 基本概念 • The concept of acid and base, Bronsted-Lowry define acid as the proton donors and base as the proton acceptors. So those that do not dissociate completely in water are referred as weak acids and weak bases.
•第三章 氨基酸
• Protein are essential for life,amino acids are the building blocks of protein. • There many many proteins, only 20 common amino acids. • The feature of amino acids for protein blocks is focused on: • The ability to polymerize; novel acid-base properties; diverse structure and chemical functions of the side chain; chirality.
• 三、 非蛋白氨基酸: Gamma-aminobutyric, GABA, histamine, and serotonin, all are neurotransmitters • Adrenaline, a hormone, Ornithine, a metabolic intermediate(p129)
weak acid
conjugate base
Acid, H+ donor
两性电解质
Base, H+ acceptor
两步解离的解离常数Ka:
多元酸Ka 按照酸性 递降而编
Ka1, Ka2分别代表alpha C原子上-COOH和-N+H3的解离常数
• 三、 pH对酸碱解离的影响:The dissociation of acids and bases is affected by ambient pH. Extensively, for any acids or bases, the relationship between the conjugated components is: pH=pKa + log[proton acceptor]/[proton donor] • This equation is called Henderson-Hasselbalch equation. The pKa values of weak acids can be determined by titration.
第七节 氨基酸混合物分离
• 一、分配层析基本原理 • 1、概念:层析(chromatography):包含两个相,即固 定相和流动相,混合物组分在两个相中分配不同, 故可以分离不同的物质的分离方法。这种分配情况 可以使用分配系数来描述。 • 分配系数:一种溶质在在两种一定的互不相溶的溶 剂中分配时,在一定温度下达到平衡后,溶质在两 相中浓度比值为一常数Kd=CA/CB • The methods important for amino acids include separations based on partition properties and separations based on electrical charge. • 2、系统:可以在液相-液相,液相-固相,液相-气相
第一节:氨基酸-蛋白质构建分子
• 一、蛋白质水解:酸(6N HCl 20h)、碱(5N NaOH, 消旋物)、酶,协同。 • 二、alpha-氨基酸一般结构 • 蛋白质中分离出来的只有20种氨基酸,共同点 • 1. Amino acids contain a central tetrahedral carbon atom. Four covalent bonds linked to the alpha-carbon atom. One carboxyl group, one amino group and 1 side chain called R group that determines the specific features of a specific amino acid.
• 第六节:氨基酸的光学、 光谱特性 • 1、光学活性:氨基酸构 型以D-甘油醛作为参照物。 蛋白质水解产物均为L型, 但自然界有D型。 • Thr, Ile, Hydroxy-Pro, Hydroxy-Lys具有两个不 对称C原子,故有4个光 学异构体p143。胱氨酸为 内消旋物。p144
• 氨基酸旋光度大小与pH相关p143Figure,原因是pH影 响氨基和羧基的解离状态。 • 二、光谱特征 • 1、紫外吸收:20种氨基酸,可见、电磁波段没有吸 收,红外、远紫外(<200nm)均有,在200-400nm紫外 区,只有芳香族氨基酸才有。 • 2、NMR(Nuclear Magnetic Resonance Spectra) ) p148
• 所有R基团不解离氨基酸的滴定曲线类似于Glycine。 各种氨基酸pKa见p133;R基可解离,相当于三元酸:
但His的咪唑基的 pKa在6.0附近, 越是接近7,越有 缓冲能力
• 四. 氨基酸等电点 氨基酸等电点:pH可改变氨基酸溶液带电状况。 定义:In the curve, the pH where the amino acid has zero net charge, is defined as the isoelectric point, the pI. pI=(pK1 + pK2)/2 for most amino acids.
• 3、脱羧基
• 4、叠氮反应:
氨基保护后产生反应 用于多肽合成的羧基活化
• 三、共同参与的反应 • 1. Ninhydrin反应p139:在弱酸性溶液与a-氨基酸共热, 生成紫色物质,用于鉴定氨基酸,也用于定量,在 570nm线性好。生成的CO2也可以定量。
• Pro, hydroxy-Pro生成黄色物质,不释放NH3,在 440nm最大光吸收 • 2. 成肽反应
• 四、侧链R基:羟基、酚基、巯基、吲哚、咪唑、胍 基、甲硫基,侧链的氨基和羧基等均参与各种反应 p140-142. • 值得注意的是p142:Cys与二硫硝基苯甲酸反应,形 成硫硝基苯甲酸,412nm强烈光吸收,定量测定蛋白 质中游离巯基数目。 • 巯基的氧化生成—S-S—可以被巯基乙醇和DTT还原。 • 蛋白质技术使用时,被DTT打开的—SH基团容易再 被氧化,可以使用碘乙酸或碘乙酰胺保护
