同济大学物理热力学ppt
2024版大学物理热力学基本概念ppt课件

大学物理热力学基本概念ppt课件CONTENTS•热力学基本概念与定义•热力学第一定律•热力学第二定律•理想气体状态方程与麦克斯韦关系式•热力学函数与性质•非平衡态热力学简介热力学基本概念与定义01热力学系统与环境热力学系统所研究的对象,与周围环境有物质、能量交换的封闭体系。
环境与系统发生相互作用的周围物质的总称。
边界系统与环境的分界面。
状态参量与过程量状态参量描述系统状态的物理量,如体积V、压强p、温度T等。
过程量描述系统状态变化过程的物理量,如热量Q、功W等。
平衡态与准静态过程平衡态系统在没有外界影响时,其内部各部分的状态参量达到稳定且不随时间变化的状态。
准静态过程系统从一个平衡态变化到另一个平衡态时,经历的一系列非常接近平衡态的过程。
热力学第零定律与温度概念热力学第零定律如果两个系统与第三个系统各自处于热平衡,则这两个系统也必定处于热平衡。
温度概念表征物体冷热程度的物理量,是热力学系统的重要状态参量之一。
在热平衡时,两个系统具有相同的温度。
热力学第一定律02系统内部所有微观粒子各种运动形式的能量总和,包括分子动能、分子势能、原子内部能量、原子核内部能量等。
力在力的方向上移动距离的乘积,宏观表现为系统对外做功或外界对系统做功。
系统与外界之间因温差而传递的能量,是热传递过程中所传递内能的多少。
热力学能功热量热力学能、功和热量热力学第一定律表达式表达式ΔU=W+Q,其中ΔU表示系统内能的增量,W表示外界对系统做的功,Q表示系统吸收的热量。
符号法则外界对系统做功,W取正值;系统对外界做功,W取负值。
系统吸收热量,Q取正值;系统放出热量,Q取负值。
等温过程在等温过程中,理想气体的内能不变,吸收的热量全部用来对外做功。
理想气体等温过程特点pV=nRT,其中p表示压强,V表示体积,n表示物质的量,R表示气体常数,T表示热力学温度。
理想气体等温过程方程温度保持不变的热力学过程。
理想气体绝热过程特点在绝热过程中,理想气体的内能变化完全取决于外界对系统做的功或系统对外界做的功。
大学物理热力学PPT课件

02
对应态原理
不同物质在相同的对应状态下具有相同 的热力学性质。对应态参数包括对比压 强、对比体积和对比温度。
03
范德华方程与对应态 原理的应用
预测真实气体的性质,如液化温度、临 界参数等。
真实气体行为描述
压缩因子
描述真实气体与理想气体偏差程度的物理量,定义为Z = pV/nRT。对于理想气体,Z = 1;对于真实气体,Z ≠ 1。
细管电泳等。
固体熔化与升华过程分析
固体熔化
升华过程
熔化与升华的应用
固体在加热过程中,当温度达到 熔点时开始熔化,由固态转变为 液态。熔化过程中吸收热量,温 度保持不变。
某些物质在固态时可以直接升华 为气态,而无需经过液态阶段。 升华过程中也吸收热量,但温度 同样保持不变。
熔化与升华是物质相变的重要过 程,对于理解物质的热力学性质 和相变规律具有重要意义。同时, 在实际应用中也具有广泛用途, 如金属冶炼、材料制备等领域。
阿马伽分体积定律
混合气体的总体积等于各组分气体分体积之和,即V_total = V_1 + V_2 + ... + V_n。
理想气体混合物的性质
各组分气体遵守理想气体状态方程,且相互之间无化学反应。
范德华方程与对应态原理
01
范德华方程
对真实气体行为的描述,考虑了分子体 积和分子间相互作用力,形式为(p + a/V^2)(V - b) = RT,其中a、b为与物 质特性相关的常数。
维里方程
描述真实气体行为的另一种方程形式,考虑了高阶分子间 相互作用项,形式为pV = nRT(1 + B/V + C/V^2 + ...), 其中B、C等为维里系数。
大学物理 热力学 教学完整PPT课件

精选PPT课件
12
3 热力学第一定律
(1) 热力学第一定律的数学形式
Q(EE)A
2
1
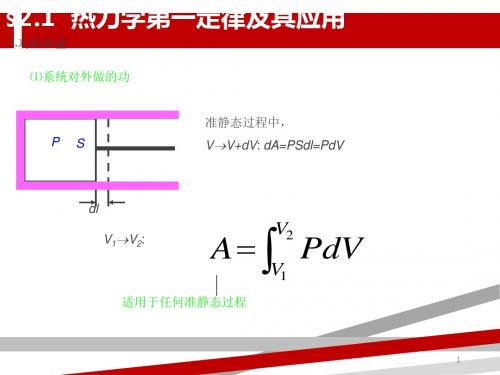
微变过程: dQdEdA
准静态过程:dQdEPdV
理想气体:
dQM 2i RdTPdV
系 统 从 外 界 吸 收 热 量 时 ,Q 0 ,反 之 Q 0
系统对外界 ,A作 0,反 功之 时 A0
系统的内 精选,PE PT2课能 件 E1 增 0,反 加 E 之 2 时 E1013
理想气体
EM
2i RT其中iR:::理理 理想想 想气气 气体体 体分摩 普子尔 适的质 恒自量 量由度
精选PPT课件
T
:理想气体绝对温度 9
① 内能 E 是状态函数
内能变化 △E 只与初末状态
有关,与所经过的过程无关,
可以在初、末态间任选最简便
的过程进行计算。 ② 改变内能的方式 (2) 热量的计算
等体摩尔热容:1摩尔理想气体在等容过程中温度变化
1K时,吸收或放出的热量。(无相变和化学反应)
C C V QT T 12M C VdTM C V T
等压摩尔热容:1摩尔理想气体在等压过程中温度变化
1K时,吸收或放出的热量。(无相变和化学反应)
C C P Q 精选 PPTT T 1课2M 件 C PdTM C PT
做功 热传递
热量:物体间由于温度差别而转移的能量
热量的传递称为传热。传热有三种方式:
热传导、对流精选、PPT热课件辐射。
10
Q cM (T 2T 1)c M T c物质的比热容
摩尔热容:1摩尔物质在某一过程中温度变化1K时,
吸收或放出的热量。
摩尔热容:C c QT T 12M C d TM C T 注意:热量也是过程量
同济大学,物理B,第9章-热力学

23
例、容积 V1=32L 的氧气瓶储有压强为 p1=1.317107Pa 的氧
气,规定氧气压强降到 p2=1.031 106Pa 时需充气,以免阀门 打开时混入空气而需洗瓶,若车间每天需 p=1.031
105Pa ,V=400L的氧气,问需几天充气?
解: T不变,设每天用去m 质量的气体 m MpV
常见的一些现象:
1、一壶水开了,水变成了水蒸气。 2、温度降到0℃以下,液体的水变成了固体的冰块。 3、气体被压缩,压强增大。 4、物体被加热,物体的温度升高。
热现象
1
热学是研究与热现象有关的规律的科学。
热现象是物质中大量分子无 规则运动的集体表现。
热现象是一种宏观现象。一 切与物体冷热程度有关的物理性 质及状态变化的现象。
E 表示系统内能的增量。
热力学第一定律微分式: dQ dE dW
35
符号规定:
1、系统吸收热量Q为正,系统放热Q为负。 2、系统对外作功W为正,外界对系统作功W为负。
3、系统内能增加E为正,系统内能减少E为负。
第一类永动机: 不需要外界提供能量,但可以 继续不断地对外做功的机器。
热力学第一定律:
1、摄氏温标: t ℃
标准状态下
冰点和沸点之差的百 分之一规定为1 ℃ 。
水的冰点 —— 0 ℃ 水的沸点 —— 100℃
2、热力学温标: T K
绝对零度: T = 0 K
t = - 273.15 ℃
11
水三相点(气态、液态、固态的共存状态)273.16 K
换算关系: T 273.15 t
12
32
注意:内能是状态量,通过做功或传热使系统的状 态(内能)发生变化。功和热量都是过程量,在改 变系统内能的效果上相当,而引起系统内能变化的 方式不同。
大学物理热力学1.ppt
于是
7 ( T T ) Q b a 2 1 1 Q ( 5 2 ln 2 ) T 5 T 1 b a
7 ( 1 T T ) a/ b 1 ( 5 2 ln 2 ) 5 T T a/ b
其中
T P P V 1 a a c 1 T P P V 2 b b b 2
Note:
[思考]
①在卡诺循环中,两条等温线下的面积是否相等?为什么?
②两条绝热线下的面积是否相等?物理意义?
28
[例2-2]1mol理想气体作卡诺循环,T1=400k,T2=300k,在400k的等温线上起始体积 V1=0.001m3,终止体积V2=0.005m3,求气体在每一循环中①从高温热源吸收的热量Q1; ②所做净功A;③传给低温热源的热量Q2。
解: P a b T1 T2 c V V1 V2 ①
M V 2 Q Q A RT ln 1 ab ab 1 M V mol 1
d
O
0 . 005 1 8 . 31 400 ln 0 . 001 3 5 . 35 10 ( J )
29
②
A T 1 2 Q T 1 1 T 300 3 2 A Q ( 1 ) 5 . 35 10 ( 1 ) 1 T 400 1 3 1 . 1 2 Q Q 1 1 T2 1 T1
卡诺热机:
⒒致冷机的致冷系数
卡诺致冷机:
Q Q 2 2 w Q Q A 1 2 T2 w T1 T2
35
⒈理想气体的状态变化遵从PV2=B的规律(B为正常数),则当体积由V1膨胀至2V1时,气体 对外做功A= 。
M dQ CdT Mmol
大学物理热力学(一)课件

第八章 热力学
前言
热力学是从能量守恒和转化的角度来研究热运动规律的。 在热力学中,常把所研究的物体系统称为热力学系统或简称系统.
热力学系统可以是气体,也可以是固体、液体,不论是固体、液体 还是气体,热力学系统都是由大量粒子构成的.
在热力学中,往往不考虑系统整体的机械运动,而是从能量的观点 出发,研究在系统状态变化过程中有关热功转换的关系和条件等问题。
dE dT
E i RT
2
若气体是理想气体:dE
i 2
RdT
,代入上式有:
i
CV
R 2
(4)
(4)式表明:理想气体的定体摩尔热容是一个与分子自由度有关的 量,而与气体的温度无关。
i
CV
R 2
(4)
3
对单原子气体分子:CV
R 2
5
双原子分子:
CV
R 2
三原子分子或三原子以上分子: CV 3R
5
(1)
(2)
V
(1)等体吸热过程中,外界传给系统的热量,全部用来增加系统 的内能,而系统不对外做功;
(2)等体放热过程中,系统向外界放热是以减少自己内能为代价 的。
2、等温过程
E i RT
2
特点:在系统状态变化过程中 T=C,dT=0 对理想气体而言,内能是温度的单值函数:
dE
i 2
RdT
0
热一律在等温过程中的表达式为: Q 0,W 0,等温膨胀(1)
热力学(一)
主讲 于一
回顾
理想气体的内能
En
n
n
i 2
KT
(8.1)
i
i
E mol
N0
2
KT
2024版大学物理热学ppt课件

供了理论指导。
02
热力学在环保领域的应用
通过热力学分析和优化,降低能源消耗和减少污染物排放,促进环境保
护和可持续发展。
03
热力学在新能源领域的应用
热力学原理在太阳能、风能、地热能等新能源的开发和利用中发挥重要
作用,推动能源结构的转型和升级。
THANKS
感谢观看
气体输运现象及粘滞性、热传导等性质
粘滞性
气体在流动时,由于分子间的动量交换,会 产生阻碍流动的粘滞力。气体的粘滞性与温 度、压强有关。
热传导
气体中热量从高温部分传向低温部分的现象 称为热传导。热传导是由于分子间的碰撞传 递能量实现的。气体的热传导系数与温度、
压强有关。
04 固体、液体与相 变现象
大学物理热学ppt课件
目录
• 热学基本概念与定律 • 热力学过程与循环 • 气体动理论与分子运动论 • 固体、液体与相变现象 • 热辐射与黑体辐射理论 • 热学在生活和科技中应用
01 热学基本概念与 定律
温度与热量
温度
表示物体冷热程度的物理量, 是分子热运动平均动能的标志。
热量
在热传递过程中所传递内能的 多少。
制冷机原理
利用工作物质在低温下吸热并在高温下放热,实现制冷效果的装置。制冷机通过消耗一定的机械能或电能, 将热量从低温物体传递到高温物体。常见的制冷机有冰箱、空调和冷库等。
热力学第二定律与熵增原理
热力学第二定律
热量不可能自发地从低温物体传递到高温 物体而不引起其他变化。热力学第二定律 揭示了自然界中能量转换的方向性和不可 逆性。它是热力学基本定律之一,对热力 学理论的发展和应用具有重要意义。
太阳能利用技术探讨
太阳能集热器
大学物理热力学基本概念-PPT

绝热 Q=0
等温(准静态)
Q A
pVln V2 V1
30
练习1. 理想气体绝热自由膨胀,去掉隔板实现平衡后压强 p=?
解1:
由绝热方程
V p0 ( 2
)
pV
p
p0 2
解2: 绝热过程
自由膨胀
p1V1 p2V2
Q0
E 0
A0
p2
p0 2
T 0
T2 T1
哪一个解对?为什么?
绝热方程对非静态过程不适用
答案:(D)
32
大学物理热力学基本概念
重点: 内能、功、热量、摩尔热容,泊松比 热力学第一定律 热力学第一定律应用于理想气体等体、等压、等温 过程,绝热过程,和各种循环过程。 卡诺循环 热机效率和制冷系数 热力学第二定律
难点: 热力学概率,热力学第二定律的统计意义
2
前言 热学发展历史的两大特征: •技术——物理——技术模式 •两种研究方法——两种理论
3)相互关系:互相补充,相辅相成 热力学- 宏观理论,基本结论来自实验事实,普遍可靠,
但不能解释其本质 解释 验证
统计物理- 微观理论,揭示热现象本质
热力学第一定律 的创始人
热力学第二定律 的创始人
4
§20.1 热力学基本概念
一、热力学系统 外界 大量粒子组成的宏观、有限的体系称为热力学系统。 与其比邻的环境称为外界
CV
i 2
R
Cp
i
2 2
R
单双 多
3 R 5 R 3R
2
2
5R
7 R
4R
2
2
CT
Ca 0
泊松比
i2 i
5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热机效率:
W Q2 1 Q1 Q1
Q2 Q2 W Q1 Q2
致冷系数:
卡诺循环效率:
T2 1 T1
Q2 T2 w Q1 Q2 T1 T2
卡诺致冷系数:
热力学第二定律
开尔文表述:不可能从单一热源吸取热量使之完全
变为有用的功而不产生其他影响。
克劳修斯表述:不可能把热量从低温物体传到高温
Q W E
Q0
例、以下状态方程的微分式各表示什么过程?
1 2
m pdV RdT M m Vdp RdT M
等压过程(dP=0) 等容过程(dV=0) 等温过程(dT=0)
3
pdV Vdp 0
m pV RT M
m pdV Vdp RdT M
T1 To V1 2Vo
1 P1 Po 2
PoVo P 1V1
(2)绝热压缩
P 1V1T1 P 2V2T2
2Vo
1
To Vo T2
1
o
1
T2 2 To
1.67 1
1
T T2 T0 2
2
1.671
1T 2 1 273 160 K
1 To
例、 0.1摩尔的单原子理想气体经历如图所示的过程。 (1)证明A和B的温度相同;(2)过程中系统净吸 热多少?(3)哪一状态的温度最高? (4)过程中 系统吸热多少? 5Pa) P ( 10 PV 证: P V
A A
TA
B B
TB
2
A
TA PAV A 1.5 1 1 1 TB PBVB 0.5 3
T= 恒量 ,dE =0
等压过程的热力学第一定律: 等温过程系统作功和吸热:
dQT dW
m V2 m P1 Q W RT ln RT ln M V1 M P2
等温过程系统内能的增量:
E 0
4、绝热过程
dQ 0
绝热过程的热力学第一定律:
0 dWQ dEQ
绝热过程内能增量:
等压过程的热力学第一定律:
dQ p dE pdV
等压过程系统的吸热:
m i2 Qp R (T2 T1 ) M 2
等压过程系统内能的增量:
m i E R (T2 T1 ) M 2
m 等压过程系统作功: W P (V2 V1 ) R (T2 T1 ) M
3、等温过程
PV 2 P 4 P
2
M T 2P 2 4P mR
dT M ( 4 P 4 ) 0 dP mR
P 1
V 2 P 4 2
2 10
3
, 110
5
例、m千克理想气体的循环过程如图所示,其中CA 为绝热过程,A点(T , V1),B(TB,V2)均为已 知,求(1)C点的状态参量。(2)循环效率。
m i EQ R (T2 T1 ) M 2 m i WQ R (T2 T1 ) M 2
绝热过程的功:
PV C1
绝热方程:
TV
1
C2 C3
P T
循环过程:
1
循环过程: 系统经历一系列的变化过程又回 到初始状态的过程。 循环特征:经历一个循环过程后,内能不变。
例、器壁与活塞构成一绝热容器,中间被一隔板隔开, 分成相等的两部分,左边有1摩尔标准状态的氦气,另 一边为真空。现抽去隔板,待平衡后再缓缓向左推动活 塞,把气体压缩到原来的体积。求氦气的温度改变?
解:设初态:Po,Vo,To (1)自由膨胀
W 0,Q 0 E 0 T 0
例. 如图,T1、T2为等温线,ab为绝热线,理想 气体由c经cb压缩到b,该过程热容 (A)C>0 (C)C=0 (B)C<0 (D)不能确定
C
Qcb
T
T >0
P
T1 b T2
Qcb Wcb E
Q ab Wab E 0
Wab <0 Wcb <0 Q cb Wcb Wab < 0
E Wab
a
c V
(B)
1、等容过程 V= 恒量 , dV= 0
等容过程的热力学第一定律: 等容过程系统作功:
dW PdV 0
dQV dE
W 0
m i R (T2 T1 ) 等容过程系统内能的增量: E M 2
等容过程系统的吸热:
m i QV R (T2 T1 ) M 2
2、等压过程
P= 恒量 , dP= 0
解:
TV
1 1
1
TV
1 c 2
T A
B
V1 Tc T V 2
Vc V2
m V pc RT M V
1 1 2
C V
m pcVc RTc M
Q AB
m V2 W RT ln M V1
1 m m iR V1 QBC CV Tc T T 1 M M 2 V 2 1 V 1 i V 1 QBC 2 1 1 V2 QAB 2 ln V1
P
A
B
C D
解: (1) WAB WAC WAD
(2)等压过程 等温过程
V T E AB 0 E AC 0 绝热过程 E AB WAB 0
QAD 0 QAB WAB E AB
V1
V2 V
(3) QAB QAC QAD
QAC WAC
例、符号“+”,“-”,“0”分别表示P、V、T 的增加,减少,不变。填写以下表格。
物体而不引起其他变化。
卡诺定理
1、在相同的高温热源与相同的低温热源之间工作
的一切可逆机,不论用什么工作物质,效率相等。
2、在相同的高温热源与相同的低温热源之间工作
的一切不可逆机的效率不可能高于可逆机的效率。
例、 问等压,等温,绝热 三个过程中:
(1)比较各过程作功多少? (2)比较各过程内能变化多少? (3)比较各过程吸热多少?
热力学复习
热力学第一定律:
包括热现象在内的能量守恒 和转换定律。
Q ( E2 E1 ) W
dQ dE d W
P-V 图上过程曲 线以下的面积
W pdV
V1
V2
m i E RT2 T1 M 2
m Q Cm dT M
Q ( E2 E1 ) W
例. 一定量理想气体经历ACB过程时吸热200J,则经 P(1.0×105Pa) 历ACBDA过程时吸热多少? A D 4 解: 由热力学第一定律
WACB QACB EACB QACB 200 J
( p AVA pBVB TA TB E ACB 0)
1
C B
1
B 1 2 3 V(10-3m3)
TA TB
E AB 0
Q W AB直线下面积
Q 2J
P PA PA PB V V A V A VB
P 1 .5 1 .5 0 .5 V 1 1 3
V 2 P 4
m PV RT M
WBD 0
O
4
V(10-3m3)
WDA p A (VA VD ) 1200J
WACBDA WACB WBD WDA 1000 J (外界对系统作功)
E ABCDA 0 (ABCDA过程始末状态为同一点)
QACBDA WACBDA 1000J (放热过程)
T V P 等压 + + 0 等温 0 + 等容 + 0 +
绝热
W E
Q
-
+
-
+#43; -
+ + + 0
例、哪个过程的Q、E、W均为负值。
(A)等容降压 (B)等温膨胀
(C)绝热膨胀
(D)等压压缩
( D )
压缩 W 0
p nkT , p不变,n增加 T减小, E 0
