高二化学化学平衡的移动PPT优秀课件
合集下载
化学平衡的移动PPT

编号 步骤1 现象 结论1 步骤2 现象 结论2
①
②
滴加饱和FeCl3
红色变深
滴加1mol/L KSCN
红色变深
增大反应物的浓度,平衡向正反应方向移动
滴加NaOH溶液
产生红褐色沉淀,溶液红色变浅
滴加NaOH溶液
减小反应物的浓度,平衡向逆反应方向移动
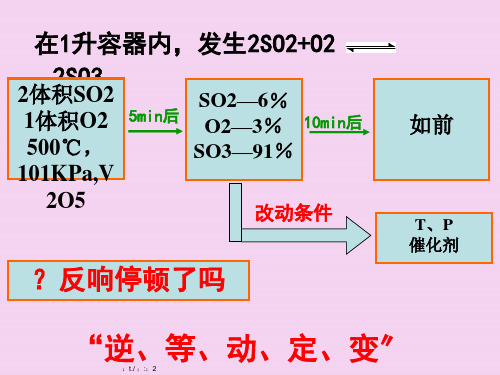
回顾:影响化学反应速率的外界条件主要有哪些?
v
v
V’ (正)
感谢各位的仔细聆听
第2课时 化学平衡的移动
V’ (正)= V’ (逆)
V(正) V(正)= V(逆) V’ (逆)
V(逆)
0
t
增大反应物的浓度
V’ (逆)
V’ (正)= V’ (逆)
V(正) V(正)= V(逆) V’ (正)
V(逆)
0
t
增大生成物的浓度
平衡正向移动
平衡逆向移动
回顾:影响化学反应速率的外界条件主要有哪些?
v
V(正)
V(正)= V(逆)
结论: 其他条件不变的情况下 升高温度,化学平衡向吸热反应方向移动; 降低温度,化学平衡向放热反应方向移动。
结论
升高温度
v
V’ (吸)
V’ (正)= V’ (逆)
V(正)
V’ (放)
V(正)= V(逆)
V(逆)
0
t
平衡向吸热方向移动
降低温度
v
V(正)
V(正)= V(逆)
V(逆)
0
V’ (放)
V’ (正)= V’ (逆)
黄色
平衡逆向移动
结论:增大生成物的浓度,平衡向逆反应方向移动
减小c(H+) 黄色加深 C(CrO42-)增大
2.2.1化学平衡状态课件高二上学期化学人教版选择性必修12

下列说法可以证明反应N2+3H2 平衡状态的是 (AC)
2NH3 已达
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
下列说法中可以充分说明反应:
P(气)+Q(气)
小结:化学平衡状态的宏观标志:变量不变即平衡。当反应过程中的“可变量” 不变时,说明反应达到平衡。混合气体的 n总 、p总、ρ、M,气体的体积分数。 分析时需观察反应前后各物质的状态和系数,再结合公式进行判断。
定: c(B) 或 n(B) 或 ω(B) 一定 变: 条件改变→平衡改变
在一定条件下,某容器内充入N2和H2合成氨,以下叙述中错
误的是( )
BD
A、开始反应时,正反应速率最大,逆反应速率为零。
B、随着反应的进行,正反应速率减小,最后降为零。
C、随着反应的进行,正反应速率减小,逆反应速率增大,最 后相等。
定 看现象:各组分的浓度保持不变
①各组成成分的质量、物质的量、体积保持不变
②各组成成分的含量保持不变(质量分数、物质的量分数、 体积分数)
③压强、平均摩尔质量、混合气体的密度、颜色等
“变者”不变是平衡
利用“v正=v逆≠0”判断化学平衡状态 在一定温度下,发生可逆反应:A(g)+3B(g)
2C(g),下述说
不可逆反应:在一定条件下,进行得很彻底或可逆程度很小的反应。
1.下列为可逆反应的是 ( BC )
A. 氢气与氧气点燃可化合成水,水电解可生成氢气和氧气,因此氢气与 氧气的反应是可逆反应
A. 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三 氧化硫又有分解
【化学】化学平衡的移动ppt课件
假设a<b,即正反响方向是气体分子数目增大的反响, 增大压强,平衡逆向挪动。
三、温度对化学平衡的影响
2.根据图2 -21的数据, 分析温度改 动是如何影 响合成氨的 平衡的?
N2+3H2
2NH3 △<0
三、温度对化学平衡的影响
Co2++4Cl- 粉△红>色0
CoCl42-
蓝色
三、温度对化学平衡的影响
练习与实际
6.在一密闭容器中,反响aA(g) bB(g)
达平衡后,坚持温度不变,将容器体积增
加一倍,当到达新的平衡时,B的浓度是原
来的60%,那么
()
A.平衡向正反响方向挪动了 B.物质A的转化率减小了 C.物质B的质量分数添加了 D.a>b
化学平衡形状只需在一定的条件下才干坚持。当外界条件改动时, 原有平衡形状被破坏,一段时间后会到达新的平衡形状。化学平衡的挪 动,就是改动外界条件,破坏原有的平衡形状,建立起新的平衡形状的 过程。
升高(降低)体系温度,平衡朝着吸(放) 热方向挪动。
早在1888年,法国科学家勒夏 特列就发现了这其中的规律, 并总结出著名的勒夏特列原理, 也叫化学平衡挪动原理:改动 影响化学平衡的一个要素,平 衡将向可以减弱这种改动的方 向挪动。
四、催化剂对化学平衡的影响
催化剂降低了反响的活 化能,正反响的活化能降低, 逆反响的活化能也降低,正 反响的活化分子百分数添加 几倍,逆反响的活化分子百 分数也添加几倍,正逆反响 速率添加的倍数相等,加催 化剂,不能使平衡发生挪动, 只影响到达平衡的时间。
练习与实际
1.某一化学反响,反响物和生成物都是气体, 改动以下条件一定能使化学平衡向正反响方向挪 动2的.是压强变化不( 会使)以下化学反响的平衡发生 A.挪增动大的反是响物浓( 度 ) B.减小反响容器的体积 C.A.增Fe大2O生3(成g)物+浓3C度O(g) D.升2F高e(反s)响+温3C度O2(g)
2.2.4 化学平衡图像(课件)高二化学(人教版2019选择性必修1)

一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
练1:对于反应 mA(g)+ nB(g) ⇌ pC(g)+ qD(g)
(1)T1___<__T2,正反应为_放__热___反应。 (2) p1__<__p2,正反应为气体体积_增__大___ 的反应
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
Q>0
T
Q<0
二、速率-压强(或温度)(v-T/P)图像
2.v-P图像
以mA+nB ⇌ pC+qD;△H=QkJ/mol为例
vv
正
v逆
P1
P2
P
m+n>p+q
vv
逆
v正
P1
P2
P
m+n<p+q
二、速率-压强(或温度)(v-T/P)图像
2.v-P图像
以mA+nB ⇌ pC+qD;△H=QkJ/mol为例
图像
分析
结论
t1时v′正突然增大,v′逆逐渐增大; t1时其他条件不变,增 v′正>v′逆,平衡向正反应方向移动 大反应物的浓度
t1时v′正突然减小,v′逆逐渐减小; t1时其他条件不变,减 v′逆>v′正,平衡向逆反应方向移动 小反应物的浓度
一、速率-时间(v-t)图像
2.“连续”的v-t图像
t1时v′逆突然增大,v′正逐渐增大; t1时其他条件不变,增 v′逆>v′正,平衡向逆反应方向移动 大生成物的浓度
B%
T2P2
T1P2
T1P1
t
判断m+n与p+q的关系? 正反应是放热还是吸热?
m+n<p+q
