第四章滴定法概述介绍
滴定分析法概论
例:Al3+ +
一定过量EDTA标液 剩余EDTA Zn2+标液 EBT
返滴定
n(EDTA)总 - n(EDTA )过量 = n(Al)
( c ·V) (EDTA)总 - (c·V )(Zn) = (c·V )(Al)
例:固体CaCO3 + 一定过量HCl标液
mA 1000 MA
=CBVB
a b
mA VB
1000=CB
MA
a b
T
B/
A
=
CBMA 1000
a b
CB
=
TB/A 1000 MA
ba
例4 试计算0.02023mol/L K2Cr2O7溶液对Fe和 Fe2O3旳滴定度。
解:Cr2O72- + 6Fe2+ +14 H+ =2Cr3+ + 6Fe3+ +7H2O
剩余HCl标液 NaOH原则溶液
返滴定
例 : Cl- + 一定过量AgNO3 原则溶液 剩余AgNO3 原则溶 NH4SCN原则溶液 返滴定 Fe3+ 指示剂
淡红色[Fe(SCN)]2+
(3)间接滴定法 经过另外旳化学反应,以滴定法定量进行。 合用于不能与滴定剂起化学反应旳物质
例:Ca2+
CaC2O4沉淀 H2SO4
VT
VT单位为 L
mA
a t
CT
VT
M
A
/1000
注意:化学反应配平;单位换算 VT单位为 mL
例3 用Na2B4O7·10H2O标定HCl溶液旳浓 度,称取0.4806g硼砂,滴定至终点时消耗
滴定分析法概论

第四章 滴定分析概论§4.1概述定量分析的任务是测定物质中组分的含量。
定量分析的分析方法有滴定分析法、重量分析法和仪器分析法等。
一、定量分析的一般要求根据定量分析的任务和特点,定量分析的一般要求是: 1、测定结果的准确度准确度高是定量分析的最基本要求。
对于常量组分(≥10%)一般要求测定误差不超过0.2% 对于半微量组分(1%~10%) 对于微量组分(0.01%~1%)2、测定结果应具有代表性测定所用试样只是待测物质中的很小部分,这些少量物质称为分析试样或样品。
3、分析方法应可靠和可行4、分析结果应正确计算和合理报告(1)、被测组分的化学表示形式 a 以被测组分实际存在形式表示。
如测得食盐试样中Cl 含量后,以NaCl%表示分析结果。
b 以氧化物或元素形式表示(实际存在形式不清楚)如硅酸盐水泥Fe Al Ca Mg 、、、含量常以2323Fe O Al O CaO MgO 、、、的含量表示。
分析铁矿石以23%%Fe Fe O 或表示。
c 金属材料和有机分析中,常以元素形式(如Fe 、Zn 、N 、P )的含量表示。
d 电解质溶液的分析,以所存在的离子形式表示含量。
(2)、被测组分含量的表示方法 a 固体试样常量组分常以质量分数表示BB sm W m =微量组分以1g g μ-⋅或6(10)-,1ng g -⋅9(10)-,1pg g -⋅12(10)-表示。
b 液体试样 ①物质的量浓度:Bn V⋅-1单位mol L②质量摩尔浓度:⋅-1单位mol kg (kg 溶剂的质量)③质量分数:待测组分的质量除以试样的质量,即B m m 试样。
④体积分数:B V V 试液表示。
⑤摩尔分数:待测组分的物质的量除以试液的物质的量,量钢为1即B n n 试液 ⑥质量浓度:常以11111mg L g L g mL ng mL pg mL μμ-----⋅⋅⋅⋅⋅、或、、等表示。
对于极稀的水溶液,视其密度为1,此时1mg L -⋅(或1g mL μ-⋅),与11()mg kg g g μ--⋅⋅在数值上相等,但概念不同。
《分析化学》-图文课件-第四章

如果cKa2≥10Kw,c/Ka1≥10,即[HCO3-]≈cHCO3-,则水解 离的H+忽略,Ka1与[HCO3-]相加时可忽略,则上式可简化为
(4-7)
第二节 溶液的酸碱度和pH值的计算
【例4-5】
计算0.10 mol·L-1 NaHCO3溶液的pH值。 解:已知H2CO3的Ka1=4.12×10-7,Ka2=5.62×10-11,符合cKa2≥10Kw, c/Ka1≥10。 根据式(4-7)得
因此,同浓度的NH3和CO3-2的碱性:CO3-2>NH3。
第二节 溶液的酸碱度和pH值的计算
一、 溶液的酸碱度
溶液的酸碱度是指溶液中氢离子、氢氧根离子的活度,常用 pH、pOH表示。它与溶液的浓度在概念上是不相同的,但当溶 液浓度不太大时,可用浓度近似地代替活度。溶液酸碱度的表达 式为
(4-3) 当温度为25 ℃时,水溶液Kw=[H+]·[OH-]=10-14,所 以 pH+pOH=pKw=14。 由此可见,pH值越小,酸度越大,溶液的酸性越强;pH越 大,酸度越小,溶液的碱性越强。同理,pOH越小,碱度越大, 溶液碱性越强;pOH越大,碱度越小,溶液的酸性越强。
实际上,酸碱半反应在水溶液中并不能单独进行,一种酸给 出质子的同时,溶液中必须有一种碱来接受。这是因为质子的半 径很小,电荷的密度比较高,游离的质子在水溶液中很难单独存 在。根据酸碱质子理论,各种酸碱反应实质上是共轭酸碱对之间 水合质子的转移过程。例如:
第一节 酸碱滴定法概述
在上述的反应中,溶剂水接受HAc所给出的质子,形成水合质 子H3O+,溶剂水也就起到碱的作用。同样,碱在水溶液中的解离, 也必须有溶剂水参加。以NH3在水溶液中的解离反应为例,NH3分 子中的氮原子上有孤对电子,可接受质子形成NH4+,这时,H2O 便起到酸的作用给出质子。具体反应如下:
第四章(I) 络合滴定法概述、络合平衡

M’
Y’
(MY)’
利于主反应进行
不利于主反应进行
注:副反应的发生会影响主反应发生的程度 副反应的发生程度以副反应系数加以描述
14
络合平衡
副反应存在时,主反应发生的程度表示式:
MY K MY
' ' ' '
M Y
这里,M’既包括未参与主反应的M,也包括参与副反应的 ML、ML2…以及M(OH)、M(OH)2…; Y’则表示未参与主反应的所有滴定剂;
M M ML ML2 ... MLn M M M L 1 M L2 2 ... M Ln n
x0 1 L 1 L 2 ... L n
2 n
1
x1
M+Y H+ HY H+ H2Y H+ H+ H6Y 酸效应引起的副反应 MY 主反应
当溶液中不存在其他金属离子时,则:
Y' H 6Y H 5Y Y 1 aY aY ( H ) Y Y x0
这里,x0表示多元酸H6Y中Y的摩尔分数。
1 1 L 2 L n L
2 n
1. M的络合效应系数
L ,a M(L) ,副反应程度 高
注: L 可能指 NH3-NH4Cl 这样的缓冲溶液、辐助配位剂、掩 蔽剂,也可能是高pH时的OH-。
L OH a M ( L ) a M ( OH )
M M
n
aM aM( L ) aM( A ) 1
共存离子(干扰离子)效应系数aY(N):
Y' Y NY aY ( N ) 1 K NY N Y Y
第四章 滴定分析概论

第四章 滴定分析概论一、内容提要本章讨论了滴定分析法的特点和分类,标准溶液的配制和对基准物质的要求,并重点讨论了滴定分析的相关计算。
滴定分析法具有操作简便、测定快速、结果准确等特点,按化学反应类型分类,一般滴定分析法可分为酸碱滴定法、沉淀滴定法、配位滴定法、氧化还原滴定法等。
适合于滴定分析的化学反应必须满足下述要求:即反应必须定量完成;反应速度快;有简便可靠的确定终点的方法。
滴定方式有直接滴定法、返滴定法、置换滴定法、间接滴定法等。
滴定剂可用基准物质直接配制,对非基准物质配制的滴定剂应使用基准物质或其它标准溶液标定。
基准物质必须具有足够的纯度、物质的组成与化学式应完全符合、物质的性质稳定、物质与被测组分按一定的反应式进行完全反应、物质应能溶于适当的溶剂等条件。
标准溶液的浓度常用物质的量浓度和滴定度来表示。
物质的量浓度C 指单位体积溶液中所含溶质的物质的量n,单位为mol/L 。
滴定度T T/A :指每毫升滴定剂相当于被测物的克数,单位为g/mL 。
滴定分析的计算依据:滴定剂T 与被测组分A 作用完全达计量点时,两者的物质的量n T 与 n A 之间的关系应符合化学反应式的计量关系,即: tT+aA = bB+Ccn T ∶n A = t ∶a此为滴定分析的计算基础,由此关系式可得出滴定剂浓度与被测定溶液的关系式:测定剂浓度与被测定物质的质量及百分含量的关系式:物质的量浓度与滴定度的关系式:1000/A T A T MC t a T ⋅⋅=T T A A V C taV C ⨯=⨯%1001000%⨯=WM V C ta A A TT VnC =1000A T T A M V C t a m ⋅=二、习题(一)是非题()1. 滴定中使用的标准溶液称为滴定剂。
()2. 标准溶液的直接配制必须使用基准物质。
()3. 标准溶液的直接配制,其优点是准确,因它是通过标定的。
()4. 用于滴定分析的化学反应必须定量完成,反应定量完成的程度要达到99%以上。
第四章滴定分析法概述ppt课件

推导:TA/B= (a / b ) ·cB ·MA ·10-3
aA + bB = cC +dD
nB
b a
nA
cBVB
b a
mA MA
VB用mL,需 103
cBVB 103
b a
mA MA
TA / B
mA VB
cBMA
a b
103
cBMA 1000
a b
cB
2024/3/16
1000TA / B MA
2024/3/16
⑸滴定终点(Titration End Point, ep表示):
滴定分析中,常加入一种指示剂,通过指示剂颜色的变 化作为化学等当点到达的指示信号,停止滴定,这一点称 为滴定终点。
⑹滴定误差 (End Point Error, Et表示)
滴定终点(实测值)与化学计量点(理论值)不一致,由此 所造成测定结果的误差,又称滴定误差。
酸钾标准溶液作用的C2O42- 起反应,定量生成 CaC2O4 ,可通 过间接测定 C2O42- ,而测定 Ca2+ 的含量。
Ca2+ + C2O42- = CaC2O4
CaC2O4 + H2SO4 = CaSO4 + H2C2O4
5H2C2O4+2KMnO4+3H2SO4 = 10CO2 +2MnSO4+K2SO4 + 8H2O
2024/3/16
五、基准物质和标准溶液
⑴基准物质: 能用于直接配制和标定标准溶液的物质。
⑵标准溶液:已知准确浓度的试剂溶液。 (常用四位有效数字表示)
⑶基准物质要求:试剂与化学组成一致;纯度高;稳定; 摩尔质量大(?);滴定反应时无副反应。
5第四章 定量分析基础
Na2S2O3 标液
第五节 标准溶液
一、 标准溶液浓度的表示方法
1. 物质的量浓度(简称浓度) 单位体积溶液所含溶质的物质的量(nB)。
nB cB V
单位为 mol· L-1。 V :溶液的体积。 应指明基本单元:原子、分子、离子、电子或它们
的组合。
2.滴定度 指每毫升标准溶液相当于被测物质的质量。 以符号TX/S表示,单位:g · mL-1 例:测定铁含量的KMnO4标准溶液,其浓度可表示
一、 计算原理 滴定分析是用标准溶液滴定被测物质的溶液。如 果根据滴定反应所选取的特定组合作为反应物的基本 单元,则滴定到化学计量点时,标准物质和被测物质 的物质的量相等。这就是“等物质的量反应规则”,
这也是定量计算的基础。
二、基本单元的选择:
1.酸碱反应:以得失一个H+的粒子或粒子的特 定组合作为反应物的化学计量基本单元。
2.氧化还原反应:以得失1个电子的粒子或粒子的 特定组合作为反应物的化学计量基本单元。 反应
2MnO4-+5C2O42-+16H+=
2Mn2+ +1 0CO2+8H2O Cr2O72-+6Fe2++14H+= 2Cr3+ +Fe3++7H2O I2+2S2O32-=2I-+S4O62- 1/2I2 、 Na2S2O3 1/6 K2Cr2O7、 Fe
溶液的稀释 C浓V浓 = C稀V稀
• 2、固体物质A与溶液B之间反应的计算
•n •n
A
=mA/MA = CBVB
B
• CBVB=mA/MA
• 3、求待测组分的质量分数和质量浓度
• 4、有关滴定度的计算
补充题
1.准确量取H2O2样品溶液25.00mL,置于 250mL容量瓶中,加水至刻度,混匀。 再准确吸出25.00ml,加硫酸酸化, 用C(1/5KMnO4)=0.1366mol/L的高锰 酸钾标准溶液滴定,消耗35.86mL, 试计算样品中H2O2的百分含量。 (3.33g/100ml)
第四章__滴定分析概述
定时消耗标准溶液的体积也不应太小。
3、配制和标定溶液时用的量器(如滴定管、移液管和容量
瓶等),必要时需进行校正。
4、标定后的标准溶液应妥善保存。
第四节 滴定分析的计算
一、滴定分析计算的根据和常用公式
aA + bB(滴定剂) = cC + dD nA : nB = a:b nA = nB×a/b
cA× VA = cB× VB×a/b
(二) 标定溶液浓度的有关计算
例 4 要求在标定时用去 0.20mol/LNaOH溶液 20-25ml, 问应称取基准试剂邻苯二甲酸氯钾(KHP)多少克?如 果改用二水草酸作基准物质,又应称取多少? 解: nKHP = nNaOH nH2C2O4· 2H2O = (1/2)nNaOH 由此可计算得: 需KHP称量范围为: 0.80-1.0g, 需二水草酸称量范围为:0.26-0.32g。
(三)物质的量浓度与滴定度间的换算
例 5 :设 HCl 标准溶液的浓度为 0.1919mol/L ,试计算此标
准溶液的滴定度为多少?
解:THCl=0.1919×36.46/1000=0.006997 g/ml
例6 试计算0.02000mol/L K2Cr2O7溶液对Fe和Fe2O3的滴 定度。 解:
三、滴定方式
1. 直接滴定法 2. 返滴定法 3. 置换滴定法 4. 间接滴定法
例如:固体CaCO3的测定,可先加入一定量的
过量盐酸标准溶液,加热使试样完全溶解,冷 却以后,再用NaOH标准液返滴定剩余的HCl 量。
CaCO3+2HCl(过量) HCl(剩余) + NaOH
CaCl2+CO2 +H2O NaCl + H2O
水化学分析——4 配位滴定法
第四章 配位滴定法
5) EDTA与1~4价金属离子都能形成易溶性的配合物
EDTA与金属离子形成的配合物大多带电荷,因此能够溶于水 中。满足配位滴定的基本要求。但是由于配位反应速度大多数 较快,这就要求在进行配位滴定中设法提高配位滴定的选择性, 以便有针对性地测定其中的某一种金属离子。
M (L)
[M '] [M ]
[M ] [ML] [ML2 ] …+[MLn ] [M ]
M (L) 越大,表示副反应越严重。如果M没有副反应,则 M (L) 1 。
第四章 配位滴定法
如果金属离子与配位剂(L)形成1:n型配合物MLn,则:
M (L) 仅仅是[L]的函数。
第四章 配位滴定法
Ag
(
NH
3
)
2
中
的NH3被CN-置换。
Ag
(
NH
3
)
2
2CN
Ag
(CN
)
2
2 NH 3
➢金属离子M与配位剂
Y反应,形成的配合物
为1:n型(MLn)时, 其配位反应是逐级进行
的,相应的逐级稳定常
数用K1、K2、K3、…、 Kn表示。
第四章 配位滴定法
同一级的 K稳 与K不稳 不是倒数关系,其第一级稳定常数是第n级 不稳定常数的倒数,第二级稳定常数是第n-1级不稳定常数的 倒数,依此类推。 在许多配位平衡的计算中,常使用逐级累积稳定常数,用符号 β表示:
Y
=
[Y
]
[HYຫໍສະໝຸດ ] [Y ]+[H6Y ] [Y ] [NY ] [Y ] [Y ] [Y ]
化学分析:第四章 酸碱滴定法(1)
证明;当多元酸的各级pKA相差足够大
∆pKa≥5时 多元酸可以被分步滴定
例 用NaOH分步滴定多元酸 1、 H2A+OH- = H2O+HA2、 HA-+OH- = H2O+A2-
酸ha失去质子变为碱a到质子形成酸ha这种酸与碱相互依存的关系称为共轭关系hahaha质子与溶剂结合形成溶剂合质子在水中
第四章 酸碱滴定法
内容提要: 1、酸碱溶液平衡原理(质子理
论,分布系数,pH值的计算) 2、酸碱指示剂 3、滴定曲线 4、滴定终点误差 5、非水溶液中的酸碱滴定
第一节 概述
酸碱滴定法是以酸碱反应为基础的滴定分析 方法,应用十分广泛, 其特点是: 1、反应速度快; 2、反应过程简单,副反应少; 3、可从酸碱平衡关系估计反应进行的程度; 4、滴定过程中[H+]发生改变,有多种指示剂
pH=pKa1 [H3PO4]=[H2PO4-] pH=pKa2 [H2PO4-]=[HPO42-] pH=pKa3 [HPO42-]=[PO43-]
由图可见:
pKa2»pKa1 H2PO4-占优势区域宽, 当[H2PO4-]达最大时, 其余型体的浓度极低;
pKa3»pKa2 HPO42-占优势区域宽, 当pH=9.9,δ2≈1
Ka
a
a A H3O aHA
Ka值越大,离解程度越大,给出质
子的能力越强,酸的酸性越强
碱的强度:用碱的离解常数Kb 来衡量
A- + H2O = HA + OH-
Kb
aHA
a OH
aA
Kb值越大,碱的碱性愈强,
得到质子的能力越强
共轭酸碱对的Ka与Kb的关系 一元弱酸、弱碱:
Ka
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室常用试剂分类
级别
中文名
1级
优级纯
2级
分析纯
3级
化学纯
生化试剂 BR 咖啡色
生化及医用化学
英文标志 GR 标签颜色 一般分析
注意标准试剂、高纯试剂、专用试剂的区别
分析化学
定量分析
定性分析
化学分析法 仪器分析法
重量分析法 滴定分析法
分析化学分类: 定性分析——鉴定物质所含的组分 定量分析——测定各组分相对含量 定量分析 化学分析法——物质的化学反应和相互定量关 系为基础 仪器分析法——以物质的物理性质或物理化学 性质为基础利用专门的仪器进行测定,适于微量 组分的分析。
返滴定法
例:固体CaCO3 + 一定过量HCl标液 剩余HCl标液 NaOH标准溶液 返滴定
返滴定法 例 : Cl- + 一定过量AgNO3 标准溶液 剩余AgNO3标准溶液 NH4SCN标准溶液 返滴定 Fe3+ 指示剂 淡红色[Fe(SCN)]2+
铝和EDTA反应速度慢,加入一定量过量的EDTA,并加热,使反应完全, 冷却后,用锌标准溶液滴定过剩的EDTA。 在石灰(固体)样品中加入过量盐酸标准溶液,再用氢氧化钠标准溶液 滴定剩余盐酸,测定石灰石中碳酸盐的含量。 在酸性溶液中,用硝酸银滴定氯离子,缺乏合适的指示剂。此时,可以 加入一定量过量的硝酸银标准溶液使氯离子反应完全,再用NH4SCN标 准溶液返滴定过量的银,以Fe3+为指示剂,当出现Fe(SCN)2+的淡红色时 即为终点。
滴定分析法
已知准确浓度的试剂 c,V aA + bB → gG + dD
待测
标准溶液
待测物溶液
20mL 碱溶液 标准盐 酸溶液 20mL 碱溶液
滴定分析基本术语
滴定(Titration):滴加标准溶液的操作过程。 化学计量点(Stoichiometric point):滴加标准 溶液与待测组分按化学计量关系完全反应之 点。 指示剂(Indicator):滴定分析中能发生颜色改 变而指示终点的试剂 滴定终点(End point):指示剂颜色变化的突变 点。
终点误差(Error of end point) :实际分析操 作中滴定终点与化学计量点之间的差别。 大小取决于化学反应的完全程度和指示剂额 选择是否恰当。
二、滴定分析法特点
仪器设备简单、低廉。 简便、快速,适于常量分析 准确度高 适于常量分析(组分含量≥ 1% )
aq中若有其他组分共存,应不干扰主反应,掩蔽 或分离以消除干扰。
Chapter 4
第四章 滴定分析法概述
Brief induction of Titrimetric Analysis
常用滴定分析仪器
量筒
移液管
吸量管
酸式滴定管
容量瓶
烧杯
锥形瓶
滴定分析中的体积测量 常用容量分析仪器:
容量瓶 (量入式) 移液管 (量出式) 滴定管 (量出式)
分析化学中常用的量和单位
五、滴定分析方式
1. 直接滴定法(涉及一个反应) 完全满足滴定分析反应的条件可用直 接滴定法 ① 滴定剂与被测物之间的反应式为: 反应按计量关系定量完成,无副反应发生, 而且进行完全 >= 99.9%) aA+b( B cC+dD ② 滴定到化学计量点时, 反应速率快。对于速度慢的反应,应采取适 a 摩尔 A 与 b 当措施提高其反应速率。 3~5min 摩尔 B 作用完全 ③如 滴定终点易确定。如有合适指示剂 HCl标准溶液滴定NaOH溶液
是以质子传递反应为基础的 一种滴定分析法。
① 酸碱滴定法(中和法)
OH- + H+ = H2O
② 沉淀滴定法(容量沉淀法)
如银量法: Ag++ Cl- = AgCl (白)
以沉淀反应为基础的一 种滴定分析法。
③ 配合滴定法(络合滴定法)
Mn+ + Y4- = MY4-n
是以络合反应为基础的 一种滴定分析法。
2.非直接滴定 ①返滴定(back titration) ②置换滴定(replacement titration)
③间接滴定(indirect titration)
①返滴定法 先准确加入过量标准溶液,使与试液中的 待测物质或固体试样进行反应,待反应完成以 后,再用另一种标准溶液滴定剩余的标准溶液 的方法。
②置换滴定法
先用适当试剂与待测物质反应,定量置换 出另一种物质 ,再用标准溶液去滴定该物质 的方法。适用于无明确定量关系的反应。
Na2S2O3+K2Cr2O7 K2Cr2O7 +过量KI S4O6 2-+SO4 2无定量关系 定量生成 I2 淀粉指示剂
Na2S2O3 标液
深蓝色消失
③间接滴定法
适用于不能与滴定剂直接反应的物质。 通过另外的化学反应以间接滴定法定量进行。
§1 滴定分析法概述
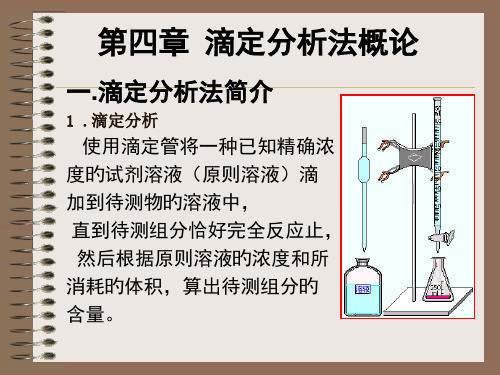
一、滴定分析法原理
def:使用滴定管将一种 已知准确浓度的试剂溶液(标 准溶液)用滴定管滴加到一定 量被测组分的溶液中(或将被 测物质的溶液滴加到已知准确 浓度的溶液中),直到所加标 准溶液与被测组分按化学计量 关系完全反应为止,然后根据 标准溶液的浓度和用量,计算 被测组分含量的一类定量分析 方法。
④ 氧化还原滴定法
是以氧化还原反应为基础 的一种滴定分析法。
如KMnO4法 MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
四、滴定分析法对化学反应的要求
定量计算的基础 按一定化学反应式进行,不发生副反应 反应定量、完全
≥ 99.9%
反应迅速
加热 催化剂
具有合适的确定终点的方法
物质的量: n (mol、 mmol) 必须指明 摩尔质量: M (g· mol-1) 基本单元 -1 物质的量浓度: c (mol· L ) 质量: m (g、mg) 体积: V (L、mL) 质量分数: w (%) 质量浓度: (g· mL-1 、mg· mL-1) 相对分子量: Mr 相对原子量: Ar
适用于反应较慢或难溶于水的固体 试样如EDTA滴定 Al3+、NaOH标准溶液测定
CaCO3
返滴定法 例:Al3+ +一定过量EDTA标液
剩余EDTA
Zn2+标液,EBT
返滴定 n(EDTA)总 - n(EDTA )过量 = n(Al) (c· V) (EDTA)总 - (c· V )(Zn) = (c· V )(Al)
