胶体的稳定性
胶体稳定性名词解释

胶体稳定性名词解释胶体稳定性(胶体稳定性)指胶体不能聚集,形成较大颗粒,呈现为不均一的分散体系。
胶体不仅能在液态和固态之间转变,而且还能从液态转变为气态。
这就是说胶体具有“触变性”和“不稳定性”,即当它与其他物质接触时,如果发生化学作用或物理作用,都会失去稳定性。
只有当改变其外部条件(如温度、 pH值、离子强度、溶剂等)后才恢复其稳定性。
这种因外界条件变化引起的不稳定称为“触变性”,又称“水化作用”;若胶粒间发生碰撞,使其失去稳定性,则称为“动力稳定性”或“凝聚稳定性”。
电镜下可以看到,蛋白质溶液表面存在着空间网状结构,其中许多氢键的线性排列有利于保持胶粒的稳定。
正是由于这些疏水基团在蛋白质溶液表面,以及在蛋白质溶液与周围环境之间,建立了牢固的氢键,所以蛋白质溶液稳定地悬浮在水中。
由此可见,对蛋白质溶液稳定性影响最大的因素是蛋白质溶液中蛋白质的分子量,一般来讲蛋白质分子量越大,其溶液的稳定性也就越差。
大分子蛋白质胶体一般不能单独存在,必须溶解于某种溶剂,才能稳定地存在于溶液中。
由于大多数胶体溶液并不稳定,因此各种蛋白质都应该能够溶解在水中,或者能被水抽提出来,否则不能稳定地保存于溶液中。
如果蛋白质溶液的稳定性受到破坏,那么胶体在形成后很快就会出现不均匀性,导致物质间发生聚沉作用。
相互间反应而产生沉淀,胶体的稳定性也就遭到破坏,所以测定蛋白质的分子量就显得尤为重要。
生物相容性:通常包括无毒、无刺激性和无过敏反应三项内容。
如果不满足这些条件,则蛋白质胶体对人体是有害的。
例如链霉素的热稳定性不好,易受光照破坏,就是因为其含有杂链结构,它对人体有毒害作用。
这是一个专业问题,你应该问问研究生物胶体稳定性的教授,或查阅相关资料。
胶体的稳定性是指溶液中的胶体粒子,在外加的机械力或热、光、电等条件改变时,其在溶液中的存在状态或分布的规律不被破坏的特性。
胶体的稳定性主要决定于它的溶解性和粘度。
在一定条件下,胶粒带同号电荷,它们之间的排斥力远大于吸引力,这样就能保持胶粒稳定。
胶体化学第5章胶体的稳定性

体的移动速度来计算电渗和电动现象,从而判断胶体的稳定性。
02 03
沉降法
沉降法是通过测量胶体在重力场中的沉降速度来判断其稳定性。如果沉 降速度很快,说明胶体的稳定性较差;如果沉降速度很慢,说明胶体的 稳定性较好。
光学法
光学法是通过观察胶体在光学显微镜下的形态来判断其稳定性。如果观 察到明显的聚沉现象,说明胶体的稳定性较差;如果没有观察到明显的 聚沉现象,说明胶体的稳定性较好。
反絮凝
是指通过某些措施使已经 絮凝的胶体重新分散成小 聚集体的过程。
04 胶体的应用
胶体在化学工业中的应用
胶体在化学工业中有着广泛的应用, 如涂料、颜料、粘合剂、印染等。胶 体作为分散相,能够提高产品的性能 和稳定性,改善产品的外观和手感。
胶体在化学工业中还可以用于制备功 能性材料,如光敏材料、电绝缘材料 ห้องสมุดไป่ตู้磁性材料等,以满足不同领域的需 求。
A
B
C
D
电子信息领域
利用胶体化学制备高性能的电子材料和器 件,推动电子信息技术的进步和发展。
能源与催化领域
利用胶体化学制备高效催化剂和燃料添加 剂,提高能源利用效率和减少环境污染。
感谢您的观看
THANKS
分散剂的作用
分散剂可以降低胶体粒子 之间的相互作用力,使胶 体粒子在介质中均匀分散。
分散剂的种类
常用的分散剂包括表面活 性剂、高分子物质等。
胶体的絮凝与反絮凝
胶体的絮凝
是指在某些条件下,胶体 粒子通过相互作用形成较 大聚集体的现象。
絮凝的条件
电解质、高分子物质、温 度变化等都可能引起胶体 的絮凝。
根据分散相粒子的大小,胶体可 分为粗分散体系、溶胶、高分子 溶液和缔合胶体等。
《胶体的稳定性》课件

胶体稳定性的内因
沉淀反应
胶体颗粒由于二次聚集 而失去稳定性。
双电层理论
胶体底物表面附着带电 粒子,被周围的离子包 围形成带电的双电层。
DLVO理论
描述了带电颗粒之间存 在的相互作用,包括吸 引和排斥。
胶体稳定性的外因
温度变化
当温度升高时,胶体稳定性 会下降,而当温度降低时, 胶体稳定性会上升。
电解质浓度变化
3
粘土矿物型
如蒙脱土、天然黏土等。
胶体稳定性的应用
1 工业上的应用涂料、油墨、塑Fra bibliotek、胶水、化妆品等。
2 生物学和医药学上的应用
生物分离、药物输送等。
3 环境保护上的应用
水污染控制、废物处理及回收再利用等。
总结
胶体的稳定性影响因素
温度、pH值、电解质浓度、表面活性剂、聚 合物、粘土矿物等。
应用前景和发展方向
pH值变化
电解质浓度增加时,离子会 在胶体颗粒表面形成紧密的 双层,进而破坏胶体稳定性。
当pH值改变时,胶体颗粒表 面的电荷性质也会发生改变, 这也就改变了胶体的稳定性。
胶体稳定剂
1
离子型与非离子型
离子性表面活性剂及其盐类、黏合气体、亲水胶等。
2
聚合物型
如聚乙烯醇、羟丙基甲基纤维素、聚乙烯醇-醚等。
提高胶体的稳定性,探索新型的胶体稳定剂, 深度挖掘其应用价值。
胶体的稳定性
胶体稳定性是指胶体体系不发生相互作用而维持长期稳定状态的性质。本课 件将为你带来对胶体的深入了解。
胶体的定义
1
定义
介于分子与晶体之间,大小在1~100nm的颗粒体系。
2
胶体分类
溶胶、胶体、凝胶,松散胶、弹性胶等。
胶体的性质

胶体的性质介绍胶体的性质胶体是一种特殊的物质系统,具有非常特殊的物理化学性质。
在化学中,胶体是指一种由微粒(粒径在1-1000纳米之间)悬浮于另一种物质中,形成的混合物。
这种混合物中的微粒被称为胶体粒子,其大小介于分子和颗粒之间。
胶体是许多自然和人工生产的物质的基础。
1. 稳定性胶体能够保持稳定并且不会沉淀下来,这是其最重要的性质之一。
这种稳定性是由胶体粒子和分散介质之间的相互作用所决定的。
这些相互作用包括静电斥力、范德华力和表面张力。
斥力和张力促使胶体粒子分散在介质中,而范德华力则影响粒子之间的相互作用。
2. 视觉透明度大多数胶体是透明的,这意味着它们不会散射光线并且具有高度的视觉透明度。
这是由于胶体粒子的尺寸通常比波长小,因此它们不会散射光线。
这种透明度使胶体作为某些光学应用程序的理想选择。
3. 凝胶形态凝胶是一种特殊的胶体,它具有固体的特性,但可以保持流动性。
凝胶的形成是由于胶体粒子之间的交互作用力将它们紧密地联系在一起。
凝胶通常是具有高度吸水性的生物材料,如明胶和琼脂。
4. 溶胶形态溶胶是一种均匀混合物,其中母体物质和溶解物粒子是完全混合的。
这种混合物是气体、液体或固体中的一种,通常具有均匀的性质,如温度和浓度。
与凝胶不同,溶胶不具有流动性,而且不会形成凝胶。
5. 色散性胶体是色散性的,这意味着它们对光线的波长和色彩非常敏感。
胶体粒子的大小和分散情况直接影响它们对光线的散射和吸收。
由于这种色散性质,胶体在生物组织中被广泛用于光学应用程序。
6. 光学性质胶体是一种光学性质非常优异的物质,它们可以通过光线的穿透、反射和散射来表现。
由于胶体粒子的大小和分散情况的影响,胶体具有光学性质优异的功能。
这些功能包括天然发光、光学稳定性和反射率,因此胶体已经被成功地应用于光学技术和光电子学领域。
7. 磁性、电性和热学性质胶体的磁性、电性和热学性质表现出了其独特的性质。
例如,胶体粒子可以通过磁性相互作用来进行制导和定位;另一方面,由于胶体的非常细小的尺寸,所以它们能够更快地传播热量,因此使得胶体适合于热学应用程序。
胶体稳定性

二、DLVO理论 理论
20世纪 年代,苏联物理化学家 世纪40年代 苏联物理化学家Derjaguin和Landau, 世纪 年代, 和 , 荷兰物理化学家Verwey和Overbeek分别独立提出疏液胶体稳 和 荷兰物理化学家 分别独立提出疏液胶体稳 理论。 定性理论,统称为 理论 定性理论,统称为DLVO理论。 DLVO理论认为,溶胶在一定条件下是稳定存在还是聚 理论认为, 理论认为 沉,取决于粒子间的相互吸引力和静电斥力。若斥力大于吸 取决于粒子间的相互吸引力和静电斥力。 引力则溶胶稳定,反之则不稳定。 引力则溶胶稳定,反之则不稳定。
三、溶胶的聚沉
溶胶的“稳定”是有条件的, 溶胶的“稳定”是有条件的,一旦稳定被破 溶胶中的粒子就会聚集,长大, 坏,溶胶中的粒子就会聚集,长大,最后从介质 中沉淀出来,这种现象就称为聚沉。 中沉淀出来,这种现象就称为聚沉。 影响溶胶稳定性的因素
A、外加电解质的影响 这影响最大,主要影响胶粒的带电情况, 这影响最大,主要影响胶粒的带电情况,使ζ电位下 降,促使胶粒聚结。 促使胶粒聚结。 B、浓度的影响 浓度增加,粒子碰撞机会增多。 浓度增加,粒子碰撞机会增多。 C、温度的影响 温度升高,粒子碰撞机会增多,碰撞强度增加。 温度升高,粒子碰撞机会增多,碰撞强度增加。 胶体体系的相互作用。 D、胶体体系的相互作用。 带不同电荷的胶粒互吸而聚沉。 带不同电荷的胶粒互吸而聚沉。
Hamaker 假设(远程相互作用) 假设(远程相互作用)
Hamaker (1937)假设:一个颗粒所包含 假设: 假设 的分子之间的相互作用具有加和性, 的分子之间的相互作用具有加和性,由此可 得颗粒间的引力位 引力位能 得颗粒间的引力位能EA。
对于大小相同的两个球形粒子 Hamaker常数 常数
胶体稳定性名词解释

胶体稳定性名词解释胶体稳定性名词解释:指的是溶液中的微粒能长期稳定存在于溶液中,而不会聚结成大颗粒。
以及它们在胶体状态下具有稳定性、分散性和增稠性的特点。
如蛋白质溶液在常温下呈胶体状态,因此在通常的溶液状态下,这些胶体微粒是很稳定的,在稀释时也不会聚沉。
但当其浓度较高时,由于胶体微粒吸附水分子,使得微粒的浓度变小,故形成了稳定的胶体状态。
微粒的稳定性有两种类型:非均相性和均相性。
在非均相系统中,物理的或化学的作用可以使分散相或胶体聚集起来形成大的颗粒;在均相系统中,分散相或胶体只在一定条件下才聚集成大颗粒。
前者称为均相性胶体稳定性,后者称为非均相性胶体稳定性。
胶体的稳定性有些来自分散介质本身,有些来自微粒的性质,如尺寸、形状、电荷等。
胶体粒子在不同的条件下可表现出不同的稳定性,如当溶液处于静止状态时,微粒将表现出很强的稳定性;当微粒间的距离增大到某一数值时,所有微粒都将表现出相同的稳定性;随着微粒直径的减小,稳定性逐渐增加。
可见,颗粒粒子的尺寸对其稳定性有重要影响。
一般说来,微粒越小,越容易获得足够的稳定性。
胶体是一种很稳定的微粒群,常用来描述一种无固定形状的、或既有固定形状又有流动性的分散系统。
1、物理稳定性2、化学稳定性3、热稳定性4、生物稳定性5、光学稳定性6、电学稳定性7、磁学稳定性8、放射学稳定性9、相对稳定性10、光化学稳定性11、辐射学稳定性12、空化学稳定性13、动力学稳定性14、能量学稳定性15、静电学稳定性16、溶解学稳定性17、凝聚学稳定性18、界面学稳定性19、老化学稳定性20、输运学稳定性21、毒理学稳定性22、环境学稳定性23、免疫学稳定性24、生态学稳定性25、输血学稳定性26、神经学稳定性27、眼科学稳定性28、麻醉学稳定性29、心脑血管病防治稳定性30、分析化学稳定性31、文献信息传递稳定性32、生物学稳定性33、食品卫生学稳定性34、医学检验稳定性35、其他学科稳定性36、病例组织学鉴定37、临床化学试剂稳定性38、临床放射学稳定性39、医院感染控制稳定性40、肿瘤预防学稳定性41、卫生化学稳定性。
胶体化学第5章 胶体的稳定性

式中,VA为范德华引力势能(为负值);a是球半径;H是两球最短 距离;A是Hamaker常数 。 两平行的等同平板粒子:
VA A 12 D
2
式中,D是两板间距。
上两式表明,VA随距离的增大而下降。 Hamaker常数A是一个重要的参数,它与粒子性质有关,是物质的 特性常数,具有能量的单位,在10-19~10-20J之间。下表是一些物质的 Hamaker常数。
影响絮凝作用的主要因素有: ①絮凝剂的分子结构 絮凝效果好的高分子应有直链结 构,交联和支链结构的效果差。应有水化基团和架桥 功能,电离度越大,荷电越多,分子越伸展,利于架 桥;但若高分子与胶粒荷相同电性时,带电多,产生 静电斥力不利于絮凝。 ②絮凝剂的分子量 分子量越大越好,但过大时,不容 性和远距离则不利絮凝,一般分子量在106左右。 ③絮凝剂的浓度 研究表明存在一个最佳浓度,为胶 粒表面饱和吸附量一般是最好,可见上图示。 ④搅拌 要均匀,不可带激烈。 ⑤酸性和盐 它们对絮凝影响很大。 下面给出了一些代表性的高分子絮凝剂:
4.临界聚沉浓度 电解质是影响V的重要因素之一。见下图示。电解质浓度大(κ亦大), 势垒越低。把势垒值为零时的电解质浓度称为临界聚沉浓度,用Cccc表 示。根据DLVO理论的势能公式,可得到
C ccc 常数
( kT )
3 5
4 0
A z
2
6
这表明,Cccc 与离子价数的六次 方成反比,这与Schulze-Hardy经 验规则相符,也证明了DLVO理 论的合理性。
4.3 高分子的稳定性和絮凝作用
1.空间稳定作用 人们很早就发现高分子物质对溶胶具有稳定作用。稳定机理有如下几 个原因。 ①带电高分子吸附後会增加胶粒间的静电斥力势能。 ②高分子吸附层通常能减小Hamaker常数,从而降低粒子间的范德华 引力势能。 ③带有高分子吸附层的胶粒相互接近时,吸附层的重叠会产生新的斥 力势能阻止粒子聚集。这种稳定作用称为空间稳定作用,产生的斥力势 能称为空间斥力势能,用VS表示。这样粒子间总的相互作用势能为 V = VA + VR + VS
胶体的稳定性
聚沉值
使溶胶发生明显聚沉时外加电解质的最小 浓度称为该电解质对该溶胶的聚沉值 浓度称为该电解质对该溶胶的聚沉值
聚沉能力
聚沉能力=1/聚沉值 聚沉能力=1/聚沉值
解释: 解释:
ci ↑ I ↑
κ↑
VR ↓↓ V ↓↓
斥力不足以克服引力——聚沉 聚沉 斥力不足以克服引力 聚沉值: 聚沉值:
∂V
V = V A + VR = 0
(3)法扬斯(Fajans)规则 法扬斯(Fajans)规则 能与晶体的组成离子形成不溶物或难电离化合物的 异电离子优先被吸附,具有强的聚沉能力。 异电离子优先被吸附,具有强的聚沉能力。
(4)不规则聚沉 有时,少量电解质使溶胶聚沉,电解质浓度高时, 有时,少量电解质使溶胶聚沉,电解质浓度高时, 又重新分散,浓度再高又聚沉,此为不规则聚沉, 又重新分散,浓度再高又聚沉,此为不规则聚沉,多发 不规则聚沉 生在以大离子或高价离子为聚沉剂的情况——大离子或 生在以大离子或高价离子为聚沉剂的情况 大离子或 高价离子引起电动电势反号。 高价离子引起电动电势反号。 (5)有机离子一般具有较强聚沉能力——特殊吸附力 有机离子一般具有较强聚沉能力 特殊吸附力 (6)同号离子的影响 大的同号有机离子因与质点强烈的van 大的同号有机离子因与质点强烈的van der Waals 引力而被吸附,从而改变质点的表面性质。一般说来, 引力而被吸附,从而改变质点的表面性质。一般说来, 大的或高价的负离子对于负溶胶有一定稳定作用, 大的或高价的负离子对于负溶胶有一定稳定作用,大的 或高价正离子对于正溶胶有一定稳定作用。 或高价正离子对于正溶胶有一定稳定作用。
-
- + + ++ + + + ++
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机电解质和高分子都能对溶胶的稳定性产生重大影响,但其机 理不同。为加以区别,通常:
把无机电解质使溶胶沉淀的作用称为聚沉作用 把高分子使溶胶沉淀的作用称为絮凝作用
引力位能皆 规定为负值
三、DLVO理论
(2)两平行的等同平板粒子:
A EA 12πH2
H——两板间最短距离。
从以上两式可以看出,EA随距离增大而下降。
Hamaker常数A是一个重要参数,与粒子性质有 关,是物质的特性参数,具有能量单位,一般在 10-19~10-20J之间。
三、DLVO理论
2.双电层的斥力势能
稳定区
聚沉区
+30mv 0
-30mv
稳定区
不规则聚沉示意图
当ζ电势绝对值低于临界值(一般为30mv)时,溶胶就聚 沉,高于此值,体系稳定。
二、聚沉作用(coagulation)
(4)溶胶相互聚沉
两种电性相反的溶胶混合时可胶发粒生所相带 互聚沉作用,聚沉 的程度与两胶体的比例有关,比例电相荷差为很零 大时,聚沉不完全 或不发生聚沉,在等电点附近沉淀最完全。
第四讲 胶体的稳定性
胶体的稳定性
胶体溶液的稳定性实指其某种性质(如分散相浓度、颗粒 大小、体系黏度和密度等)在一定程度的不变性。
虽然胶体本质上是热力学不稳定体系,但是 实际上它总能稳定一定的时间,有时长达数年, 甚至数十年之久。
稳定性只具有动力学意义,故而是相对的。
一、胶体的三种稳定性
1.热力学稳定性
很早以前,人们就发现高分子物质对溶胶具有稳定作用。如我国 古代制造的墨汁就掺进树胶,以保护炭粉不致聚结。现代工业上制造 的油溶性油漆、涂料、油墨等均利用了高分子的稳定作用。
关于稳定机理,直至近年才有比较深刻的认识,总的来说主要是
高分子在①胶带粒电表高面分的高子分吸子附吸后附会层增而加不胶是粒扩间散双静电电层斥重力叠势的能静E电R。斥力。 主要有②以下高几分方子面吸的附原层因通:常能减小Hamaker常数,因而能降低
三、DLVO理论
1.胶粒间的Vander wadls引力势能
分子间的Vander waals引力包括诱导力(Debye引力), 偶极力(Keesom力)和色散力(London引力),其大小与 分子间距的六次方成反比,也称六次律。
除极性特别大的水分子外,通常对分子间的吸引力的作
用贡献
色散力>偶极力>诱导力
两者可统称为 聚集作用
二、聚沉作用(coagulation)
胶体的离子有很大的比表面,体系的表面能也很高, 所以粒子有自动聚集以降低其表面能的趋势。粒子由小变 大的过程称为聚集过程(aggregation),有胶体粒子聚集 而成的大粒子称为聚集体(aggregate),如聚集的最终结 果导致粒子从溶液中沉淀析出则称为聚沉过程。
距离
10kT 20kT
0=0mv
0=12.8mv
表面电势0 对势能曲线的影响
三、DLVO理论
外界因素(如电解质浓度等)强烈地影响胶粒之间的排斥势能ER。
若降低胶粒的 电势,则其排斥势能减小,势垒降低,聚结稳定性降低。 当 降低到某个程度,势垒被分子热运动所克服,则会导致聚沉(极端 情况下, =0)。
胶体是高度分散的多相体系,有巨大的界面能,因而是热力学 不稳定体系。
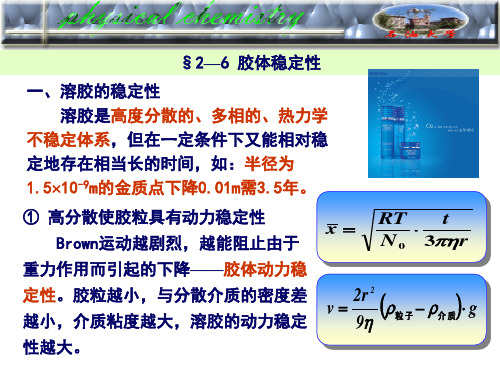
2.动力稳定性
由于胶粒很小,强烈的Brown运动能阻止其在重力场中的沉降, 因而具有动力稳定性。如Farady制备的金溶胶放置了几十年才沉 下来。
一、胶体的三种稳定性
3.聚结稳定性
粒子间有相互聚结而降低其界面能的趋势,称为聚结不稳定性。
二、聚沉作用(coagulation)
(2) 同号离子的影响 一些同号离子,特别是高价离子或有机离子,在
胶粒表面特性吸附后可降低反离子的聚沉作用,而对 溶胶有稳定作用。如对As2S3负溶胶,KCl、KNO3、甲 酸钾、乙酸钾分别是49.5、50、85、110(聚沉值),而 1/3柠檬酸钾是240。
相互聚沉的原因可能有两种:① 两种胶粒电性中和;② 两种 胶粒的稳定剂相互发生破坏(如沉淀)。
此外,溶胶的浓度也影响电解质的聚沉值。通常对一价反离子 来说,溶胶稀释时聚沉值增加,二价反离子不变,三价反离子降低 -Burton-Bishop规则。
三、DLVO理论
前苏联学者Derjajuin和Landan(1941年)与荷兰学者 Verwey和Overbeek(1948年)分别独立提出胶粒之间存 在Vande Wadls吸引势能。据此对溶胶的稳定性进行了定 量处理,形成了能比较完善地解释胶体稳定性和电解质 影响的理论,称之为DLVO理论。
对带电胶体质点的稳定性,DLVO理论是相当成功 的,但对有些现象,DLVO理论是无能为力的,如某些 高分子和表面活性剂稳定胶体的现象。
此外,另一个要考虑的因素是溶剂化层的影响。 如胶粒表面的溶剂化膜是比较定向排列的,表现出一 定的弹性,具有“水化膜斥力”作用。
四、高分子的稳定和絮凝作用
1.高分子的稳定作用
起聚沉作用的主要是反离子,反离子的价数越高,聚沉 效率也越高。对于给定溶胶来说,聚沉值与反离子的价数的 六次方成反比。即1/16∶1/26∶1/36或1∶0.016∶0.0013。
二、聚沉作用(coagulation)
相同价数的反离子聚沉值虽然相近,但也有差距 其顺序为:
Li+>Na+>K+>NH4+>Rb+>Cs+ Mg2+>Ca2+>Sr2+>Ba2+ SCN->I->NO3->Br->Cl->F->1/2SO42- 这种顺序称为感胶离子序(lyotropic series)。 Schulze-Hardy规则只适应于惰性电解质,即不与溶 胶发生任何特殊反应的电解质。因此,溶胶的电势决定 离子、特殊吸附离子不应包括在内。
二、聚沉作用(coagulation)
(3) 不规则聚沉 有时少量的电解质使溶胶聚沉,电解质高时沉淀又重
新分散成溶胶,浓度再高时,又使溶胶聚沉。这种现象称 为不规则聚沉。多发生在高价反离子或有机反离子为聚沉 剂的情况。
不规则聚沉可通过反离子对ζ电势的影响来解释,见 下页图。
二、聚沉作用(coagulation)
5.临界聚沉浓度
电解质是影响E的主要因素之一,电解质浓度越大,值就பைடு நூலகம்大,
ER就越小,势能就越低。我们把势能值为0时的电解质浓度称为临界 聚沉浓度,用Cccc来表示。根据DLVO理论的势能公式,可导出
CCCC 常数 3(A k2T Z)5604
三、DLVO理论
该式表明,临界聚沉浓度与离子价数的六次方成 反比,这与Schulze-Hardy经验规则相符,证明了DLVO 理论的合理性。
胶 用粒的间是距引很力大势(时能at,,tr粒因ac子而ti间Eve呈无负相
势垒
互 值 逐 影。 响作 渐但 当随 又用 大靠 胶着 超, 于近粒距过EE为A总离一相E(零R缩定距,有位。e短距极E时n能重e,离近会r(新g后时E出yR变t,,的)现o为t由E影一aA负l于响的个
粒子极 值 电间距小 ,子值 且云变,的化负相过值互程,作po中为用te出引而n现力产tia一)生l 个,Bo峰因rn
因带电胶粒所带电荷的影响,在其周围形成双电层,使 Stern层和扩散层中的反离子浓度高于体相中的浓度。而在扩 散层以外任何一点不受胶粒电势的影响,因为胶粒所带电荷 对它的作用被双电层中反离子的作用抵消。
由于这种反离子氛的“屏蔽作用”,当两粒子的扩散层不 重叠时,它们之间不产生任何斥力。当两粒子的扩散双电层 发生重叠时,胶粒对重叠区的作用不能被反离子氛完全屏蔽。 重叠后反离子浓度增大,这样既破坏了扩散层中的离子平衡 分布,又破坏了双电层的静电平衡。
胶粒是大量分子的聚集体,Hamaker假设,胶粒间的相互作 用等于组成它们的各分子对之间相互作用的加和。由此推导出 不同形式粒子间的Vander waals引力势能。
(1)两等同球形粒子:
EA
Ar 12H
EA——Vander Waals引力势能(规定为负值); r ——球半径; H——两球间最短距离; A——Hamaker常数。
三、DLVO理论
(2)两平行的等同板状粒子单位面积上的斥力势能
ER64 n0kT 02exp (H)
H——两板间的距离。
三、DLVO理论
3.胶粒间的总相互作用势能
EEAER
排斥能 (repulsive 随离子之间en距er离g的y)增大,
斥
力
ER
E
0 Born斥力
EA 引 力
EA下两降粒速子度靠比近ER吸时缓引,慢首能的先多起,作当
三、DLVO理论
2.双电层的斥力势能
当两粒子的扩散双电层发生重叠时,胶粒对重叠区的作 用不能被反离子氛完全屏蔽。重叠后反离子浓度增大,这样 既破坏了扩散层中的离子平衡分布,又破坏了双电层的静电 平衡。前一种平衡的破坏使离子自浓度大的重叠区向未重叠 区扩散,从而产生渗透性的排斥力;后一种平衡的破坏引起 胶粒间的静电性斥力。它们的大小与粒子的形状有关。
因此平常说的Vander waals主要指色散力。
三、DLVO理论
诱导偶极之间的相互作用。此种模式只在瞬间存在,下一个瞬间 又有新的排列产生,这种作用是非极性气体凝结的原因。
三、DLVO理论
偶极力
具永久偶极的分子倾向于将极性反向 排列,使得固相物质有最大的引力。
两种离子——偶极作用
三、DLVO理论
第二极小值 而 值 斥力,E逐势称渐能为增而势大使垒变。eE为n急e正r剧g值y上。)升,又
形成一个极小值(第一极小
第一极小值
值)。
势能作用曲线
三、DLVO理论
势能的大小是胶体能否稳定的关键,粒子要发生聚沉,必 须越过这一势垒才能进一步靠近。如果势垒很小或不存在,粒 子的热运动完全可以克服它而发生聚沉,从而呈现聚结不稳定 性。如果势垒足够大,粒子的热运动无法克服它,则胶体保持 相对稳定,即表现出聚结稳定性。一般势垒高度超过15RT时就 可阻止粒子由于热运动碰撞而产生的聚沉。第一极小值比第二 极小值低得多,当粒子落入第一极小值时,形成的沉淀紧密而 稳定;而在第二极小值时,体系中形成的结构是疏散的,且不 牢固,不稳定,外界稍有扰动,结构就被破坏,这种体系具有 触变性或剪切稀释性。
