《硅 无机非金属材料》(1) PPT课件
合集下载
5.3.2 无机非金属材料 硅课件 (共17张PPT) 人教版必修二

建筑行业粘合剂 硅酸钠的水溶液俗称“水玻璃” 耐火材料
耐腐蚀材料
知识网络清单
+4
SiO2
H2SiO3
0 Si 单质 氧化物 酸
Na2SiO3 CaSiO3
盐
玻璃 Na2SiO3 、CaSiO3、SiO2
(Na2O·SiO2、CaO·SiO2) 水泥 2CaO·SiO2、3CaO·SiO2、
3CaO·Al2O3
无机非金属材料: 教材描述:
材料是人类赖以生存的物质基础,人类使用材料除了金属材料,还有无机非 金属材料等。从组成上来看,许多无机非金属材料含有硅、氧等元素,具有耐 高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。随着工业生产 和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生……
SiO44-离子
丝光沸石
K2Al2Si10O24 ·7H2O
K2O·Al2O3·10SiO2·7H2O
•
云母
KAl3Si3O11 K2O·3Al2O3·6SiO2
天然水晶 SiO2
教材描述: ……从组成上来看,许多无机非金属材料含有硅、氧等元素,具有耐高温、
抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。随着工业生产和社会 发展对材料性能要求的提高,一批新型无机非金属材料相继诞生……
教材描述: 现代信息技术式建立在半导体材料基础上的。位
于元素周期表第三周期、第ⅣA族的硅元素,正好处 于金属与非金属的过渡位置,其单质的导电性介于 导体与绝缘体之间,是应用最微广泛的半导体材料。
现代信息技术材料
信息的处理与存储
信息的传输
1956---硅集成电路
1970美国康宁公司研制成 低传输损耗的石英光纤
2023年3月日本经济产业省周四宣布正式放宽对氟化 聚酰亚胺、氟化氢和光刻胶的许可要求,并称此举当日 生效。
耐腐蚀材料
知识网络清单
+4
SiO2
H2SiO3
0 Si 单质 氧化物 酸
Na2SiO3 CaSiO3
盐
玻璃 Na2SiO3 、CaSiO3、SiO2
(Na2O·SiO2、CaO·SiO2) 水泥 2CaO·SiO2、3CaO·SiO2、
3CaO·Al2O3
无机非金属材料: 教材描述:
材料是人类赖以生存的物质基础,人类使用材料除了金属材料,还有无机非 金属材料等。从组成上来看,许多无机非金属材料含有硅、氧等元素,具有耐 高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。随着工业生产 和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生……
SiO44-离子
丝光沸石
K2Al2Si10O24 ·7H2O
K2O·Al2O3·10SiO2·7H2O
•
云母
KAl3Si3O11 K2O·3Al2O3·6SiO2
天然水晶 SiO2
教材描述: ……从组成上来看,许多无机非金属材料含有硅、氧等元素,具有耐高温、
抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。随着工业生产和社会 发展对材料性能要求的提高,一批新型无机非金属材料相继诞生……
教材描述: 现代信息技术式建立在半导体材料基础上的。位
于元素周期表第三周期、第ⅣA族的硅元素,正好处 于金属与非金属的过渡位置,其单质的导电性介于 导体与绝缘体之间,是应用最微广泛的半导体材料。
现代信息技术材料
信息的处理与存储
信息的传输
1956---硅集成电路
1970美国康宁公司研制成 低传输损耗的石英光纤
2023年3月日本经济产业省周四宣布正式放宽对氟化 聚酰亚胺、氟化氢和光刻胶的许可要求,并称此举当日 生效。
【高中化学】硅——无机非金属材料ppt

点燃 点燃
预测
常温下硅的性质也 比较稳定
二、C、S、P等在一定条件下可以和O2反应
C+ O2 === CO2
预测
S + O2=== SO2
硅在一定条件下也 可和氧气反应
知识提示:硅原子的最外层有4个 电子,常见的化合价为:0、+4
2、硅的化学性质
与氧气反应:
条件:研碎 的硅、加热
Si + O2=== SiO2
硅的化学性质不活波,但在常温下可以和 氟气(F2)、氢氟酸(HF)和强碱反应
Si + 2F2 === SiF4 Si+ 4HF===SiF4↑+2H2↑
Si+2NaOH+H2O==Na2SiO3+ 2H2↑
工业上单质硅的制取
原料: 焦碳(C)和二氧化硅(SiO2)
设备:
电炉
高温
原理: SiO2 +2C == Si + 2CO↑
第四章
第一节 硅 无机非金属材料
硅材料
材料 世界
特殊新型材料
感光材料
荧光材料
第四章
元素与材料世界
埃迪萨克(EDSAC) 世界上第一台计算机,总 质量达几十吨,占地170多 平方米,耗电150千瓦,每 秒只能完成5000次的加法 运算。 现在的计算机在质量、 体积和耗电上都有很大 的变化,计算速度甚至 达每秒几十万亿次
高温
Si+2NaOH+H2O==Na2SiO3+ 2H2↑
反思小结
① 通过本节课的学习,你 知道了硅的哪些物理化学性 质 ? ② 你对硅及其合金的 用途有怎样的认识?
小结: 物理性质
灰黑色、有金属光泽、硬而脆的固体,是很 好的半导体材料 同素异形体:晶体硅和无定形硅
预测
常温下硅的性质也 比较稳定
二、C、S、P等在一定条件下可以和O2反应
C+ O2 === CO2
预测
S + O2=== SO2
硅在一定条件下也 可和氧气反应
知识提示:硅原子的最外层有4个 电子,常见的化合价为:0、+4
2、硅的化学性质
与氧气反应:
条件:研碎 的硅、加热
Si + O2=== SiO2
硅的化学性质不活波,但在常温下可以和 氟气(F2)、氢氟酸(HF)和强碱反应
Si + 2F2 === SiF4 Si+ 4HF===SiF4↑+2H2↑
Si+2NaOH+H2O==Na2SiO3+ 2H2↑
工业上单质硅的制取
原料: 焦碳(C)和二氧化硅(SiO2)
设备:
电炉
高温
原理: SiO2 +2C == Si + 2CO↑
第四章
第一节 硅 无机非金属材料
硅材料
材料 世界
特殊新型材料
感光材料
荧光材料
第四章
元素与材料世界
埃迪萨克(EDSAC) 世界上第一台计算机,总 质量达几十吨,占地170多 平方米,耗电150千瓦,每 秒只能完成5000次的加法 运算。 现在的计算机在质量、 体积和耗电上都有很大 的变化,计算速度甚至 达每秒几十万亿次
高温
Si+2NaOH+H2O==Na2SiO3+ 2H2↑
反思小结
① 通过本节课的学习,你 知道了硅的哪些物理化学性 质 ? ② 你对硅及其合金的 用途有怎样的认识?
小结: 物理性质
灰黑色、有金属光泽、硬而脆的固体,是很 好的半导体材料 同素异形体:晶体硅和无定形硅
硅 无机非金属材料课件 鲁科版必修1

意不在酒,在乎山水之间也”前后呼应,并与“滁人游”“太守宴”“众宾欢”“太守醉”连成一条抒情的线索,曲折地表达了作者内心复杂的思想感情。目标导学六:赏析文本,感受文本艺术特色1.在把握作者复杂感情的基础上朗读文本。2.反复朗读,请同学说说本文读来有哪些特点,为什么会有这些特点。(1)句法上大量运用骈偶句,并夹有散句,既整齐又富有
第四章
第一节 硅 无机非金属材料
联想·质疑
1、无机非金属材料主要有哪些种类? 它们有何共同特点?
2、什么是半导体材料?现在用途最广的 半导体材料是什么?
3、写出硅的原子结构简图,与所学的哪 种元素的原子结构有相似之处?
4、硅属于哪一类物质,预测它可能具有 怎样的性质?
一、硅的性质与用途
1、自然界中存在形式。
(2)弱氧化性
学 性 质
(2)弱氧化性
高温
CO2+C === 2CO (3)与盐反应(在溶液中)
CO2+Na2CO3+H2O=
高温
SiO2+2C===
Si+2CO ↑
(3)与盐反应(固体)
SiO2+CaCO3
高温
== CaSiO
3
+CO2↑
2NaHCO3
(4)不与酸反应
(4)与氢氟酸反应
SiO2+4HF==SiF4+2H2O (腐蚀玻璃)
三、硅酸盐与无机非金属材料
玻璃
原料
纯碱、石灰石、 石英
反应 原理
反应 条件
CaCO3+SiO2高温 CaSiO3+CO2↑ NaCO3+SiO2高温 Na2SiO3+CO2↑
高温
生产
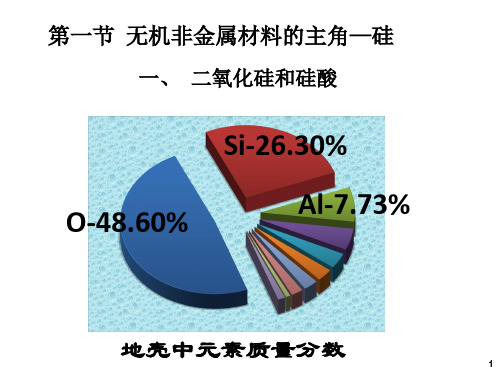
第一节 无机非金属材料的主角-硅(精品课件)

二、 硅酸(H2SiO3)
1、性质
硅酸是一种白色胶状物质,溶解度很小,而且是一种弱 酸,酸性比H2CO3还弱,不能使酸碱指示剂变色。
2、制备:
想一想:能否用SiO2与水反应制取H2SiO3 ?那怎样制备 H2SiO3呢?
制取原理:强酸制弱酸
阅读课本P76并 探究实验4-1
现象 滴入酚酞后溶液变为红色;再滴入稀盐酸,溶 液红色变浅至无色,同时有白色胶状沉淀产生。
漂白液主要成分
有效成分:Ca(ClO)2 2 Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
漂白粉、漂粉精主要成分 漂白原理:次氯酸盐与酸发生复分解反应释放出 HClO而起漂白作用
漂白原理:
日常 Ca(ClO)2+CO2+H2O==CaCO3 +2HClO (反应原理:强酸制弱酸)
只能与强碱发生中和反应
H2SiO3 + 2NaOH == Na2SiO3 + 2H2O ②不稳定(比H2CO3稳定),受热易分解
H2SiO3 ==∆== H2O + SiO2
所生成的硅酸逐渐聚合而形成胶体-硅酸溶胶, 硅酸浓度较大时,则形成软而透明的、胶冻状的硅酸 凝胶。硅酸凝胶经干燥脱水就形成硅酸干胶,称为 “硅胶”。硅胶多孔,吸附水份能力强,常用作实验 室和袋装食品、瓶装药品等的干燥剂,也可以用作催 化剂的载体。
【科学视野】 2、结构
[SiO4]四面体结构
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角. 同时每1个O原子周围结合2个Si原子相结合。
SiO2是由Si和O按1:2的比例组成的立体空间网 状结构,没有SiO2 分子存在,只存在硅、氧原子。
《无机非金属材料硅》课件

2
氧化硅的制备方法
氧化硅可以通过湿法制备、干法制备、化学气相沉积等方法来制备。
3
硅衍生物材料的制备方法
硅衍生物材料可以通过溶胶-凝胶法、水热法、等离子体化学气相沉积法等方法 来制备。
硅的应用
领域 半导体 太阳能 医疗 硅橡胶 其他
Байду номын сангаас
应用 计算机芯片、光电器件、传感器等 太阳能电池板、太阳能热发电等 人工关节、医疗设备、生物传感器等 密封件、电绝缘件、模具等 建筑材料、化妆品、涂层材料等
《无机非金属材料硅》
硅是一种重要的无机非金属材料,具有广泛的应用范围。本课程将向您介绍 硅的基本概念、结构和应用领域,并探讨其未来发展趋势。
硅的历史
半导体
硅是半导体工业的基础材料,计算机芯片等电子设 备都离不开它。
太阳能
硅是太阳能电池的主要材料,有望带动可再生能源 革命。
医疗
硅材料应用于医疗设备制造,提高了医疗质量和疗 效。
硅的未来发展方向
新型材料
近年来,人们不断研发出新型 硅材料,如纳米硅、二氧化硅 纤维等。
产业化发展
随着技术进步和市场需求增加, 硅产业正在朝着更高质量、更 低成本方向发展。
发展趋势
硅材料在多个领域都有广泛应 用,未来发展前景将非常广阔。
总结
硅在半导体、太阳能和医疗等领域都有着广泛应用。未来,随着新材料技术 的涌现,硅的应用领域将会更加广泛。
硅橡胶
硅橡胶具有出色的耐热、耐寒和耐腐蚀性能,应用 广泛。
硅的结构与性质
晶体结构
硅晶体结构紧密有序,有良 好的半导体性能和导电性。
物理性质
硅具有高硬度、高熔点、光 学性能良好等物理性能。
化学性质
无机非金属材料PPT课件
性质
与碱性氧化 物反应
二氧化碳(CO2) CO2+Na2O=Na2CO3
二氧化硅(SiO2)
高温
SiO2+ CaO == CaSiO3
与碱反应 CO2+2NaOH=Na2CO3+H2O SiO2+2NaOH=Na2SiO3+H2O
与水反应 CO2+H2O=H2CO3
——Biblioteka 与氢氟酸反应——SiO2+4HF=SiF4 ↑+2H2O
25
一、二氧化硅和硅酸
26
2.硅酸(H2SiO3)
硅酸是一种白色粉末状的固体,它不溶于水; 是一种弱酸,不能使指示剂变色。
实验探究: 实验4-1:向饱和Na2SiO3溶液 中滴入酚酞,再滴入稀盐酸。
现象
①滴入酚酞溶液呈红色 ②滴入盐酸有凝胶产生
结论
① Na2SiO3溶液呈碱性 ②硅酸难溶于水
方程式 Na2SiO3+2HCl = H2SiO3(胶体) +2NaCl
演讲人:XXXXXX 时 间:XX年XX月XX日
8
一、二氧化硅和硅酸
粘土
9
一、二氧化硅和硅酸
硅元素
画出硅的原子结构示意图
与哪种原子的结构相似? 碳
分析: 既不易失电子,又不易得电子,主要
形成四价的化合物。
10
1、二氧化硅
(1)存在
水晶
硅石
结晶形:石英 无定形
玛瑙
(2)用途:
光导纤维 石英:耐高温化学仪器、石英电子表、石英钟 水晶:电子工业的重要部件、光学仪器、
物理性质:__硬___度__大__、__熔__点__高__、__难__溶__于__水____ 化学稳定性:____通__常__条__件__下__,__很___稳__定____
无机非金属材料的主角——硅PPT课件14 人教课标版(1)
SiO2牢固的立体网状结构
1、赏心悦目的雕花玻璃是用下列物质中的一种 对玻璃进行刻蚀而制成的,这种物质是( B ) A .盐酸 B .氢氟酸 C .烧碱 D .纯碱 2、下列物质中,属于酸性氧化物但不能由氧化 物与水反应得到对应酸的是( B ) A . CO2 B . SiO2 C . SO3 D . Fe2O3
第四章
非金属及其化合物
第一节
无机非金属材料的主角-硅
(第一课时)
主讲:龚彬
无机非金属材料的主角 ----硅
第ⅣA族:碳、硅
碳元素 硅元素
原子 结构
存在 形式 游离态、化合态
化合态(亲氧)
形成了无数种构成人 构成了地壳大部分 自然 类和其它地球生物等 岩石、沙子和土壤, 界中 的有机物,“统治了 “统治了地壳” 分布 有机界”。
石英、水晶、玛瑙、光纤、沙石
如何鉴别真假水晶?
?
硬度:天然水晶硬度大,用碎石在饰品上轻轻划 一下不会留痕迹的是天然水晶;若留有条痕,则 是假水晶…….
SiO2结构 ——立体网状结构 二氧化硅的晶体结构示意图
二氧化硅(SiO2)
(1)物理性质: 坚硬难熔的固体,熔沸点比较高,不溶 于水,硬度比较大。
Na2SiO3+2HCl==== 2NaCl+H2SiO3 (胶体)
小结:
SiO2的性质
高 硬度大 、
(1)物理性质:熔点
(2)化学稳定性: ①化学性质很不活泼(空间我网状结构“稳 定”) ②能与氢氟酸反应但不与其它酸反应(特性)
③高温能与碱性氧化物反应(酸性氧化物通性)
④ 能与强碱反应(酸性氧化物通性) ( 3)使 SiO2具有这些性质的原因是:
Na2SiO3+2HCl===2NaCl+H2SiO3 (胶体)
《无机非金属材料的主角——硅》ppt课件
特别提醒
由于硅酸盐的组成与结构很复杂,为 了简化对硅酸盐组成的表示方法,采用了氧 化物法,实际上硅酸盐不是以简单氧化物形 式存在的,而是以种种结构复杂的盐的形式 存在的。
例4 用氧化物的形式表示硅酸盐的组成,其中 正确的是( )
A.钙沸石[Ca(Al2Si3O10)·3H2O],表示为 Al2O3·CaO·3SiO2·3H2O
3. 硅酸的存在及用途 (1)浓度小时:形成硅酸溶胶; (2)浓度大时:形成 硅酸凝胶。 (3)硅胶
硅酸凝胶经干燥脱水得到的硅酸干凝胶称 为“ 硅胶”,具有强的 吸水性,常用作干燥剂或 催化剂的载体。
三、硅酸盐 1. 概念:硅酸盐是由硅、氧和金属 元素组成的化合物的总称。 2. 硅酸盐的性质
硅酸盐是一类结构复杂的固态物质, 大多不溶于水,化学性质很 。稳定
二、硅酸 1
.硅酸的性质
(1)弱酸性
向Na2SiO3溶液中通入CO2,反应的
化学方程式为Na2SiO3+CO2+
H2O===H2SiO3↓+Na2CO3。
弱
结论:H2SiO3酸性比H2CO3酸性 。
(2)不稳定性
2. 硅酸的制备
可溶的硅酸盐与较强的酸反应可制得硅酸, Na2SiO3与盐酸反应的化学方程式为Na2SiO3+ 2HCl===H2SiO3↓+2NaCl。
C.钾云母(K2Al6Si6H4O24),表示为 K2O·2H2O·3Al2O3·6SiO2 D.石棉[CaMg3Si4O12],表示为 CaO·3MgO·4SiO2
【答案】 D
变式训练
4.钾长石(KAlSi3O8)风化生成高岭土 [Al2Si2O5(OH)4]时反应的离子方程式为:
2KAlSi3O8+2H2CO3+5H2O===2K++ 2HCO3-+4H2SiO3+Al2Si2O5(OH)4
化学课件《硅、无机非金属材料》优秀ppt1 鲁科版
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
无机非金属材料的主角-硅PPT课件
2、硅酸盐组成表示
活泼金属氧化物·较活泼金属氧化物·SiO2·H2O
硅酸钠(Na2SiO3)
Na2O ·SiO2
镁橄榄石(Mg2SiO4) 2MgO ·SiO2
钙沸石Ca(Al2Si3O10) ·3H2O
CaO ·Al2O3 ·3SiO2·3H2O
K(Al3Si3O10)(OH)2 K2O·3Al2O3·6SiO2·2H2O
四、硅酸盐
是由硅、氧和金属组成的化合物的总称。
结构复杂,一般不溶于水,化学性质很 稳定。
硅酸钠(Na2SiO3), 其水溶液俗称水 玻璃,是制备硅胶和木材防火剂等的原 料。
实验4-2
放入蒸馏水
放入Na2SiO3饱和溶液
现象
当水分蒸 发后燃烧
当水分蒸发后 不易燃烧
结论 用水玻璃浸泡过的木材或织物制可备防火木材防 火剂的原料
1、与氟气反应:
Si+2F2==SiF4 2、与氢氟酸反应:
Si+4HF==SiF4↑+2H2 ↑
3、与强碱溶液反应:
Si+2NaOH+H2O==Na2SiO3+2H2 ↑ 4、与氯气反应:
Si+2Cl2=△=SiCl4 5、与氧气反应
Si+O2高=温=SiO2
晶5.体用硅途的导电性介于导体和半导体之间,
生产设备:水泥回转窑 主要成分:3CaO·SiO2
2CaO·SiO2 3CaO·Al2O3
具有特殊功能的含硅物质
1、碳化硅(SiC俗称金刚砂),具有金 刚石的结构。硬度很大,用作砂纸、砂 轮的磨料。
2、硅 钢
(铁合金)
导磁性良 好,用作 变压器铁 芯
3、硅橡胶
4、分子筛
