浮游生物样品采集与分析
7.实验七__浮游动物采集和定量

实验目的
掌握浮游动物采集、浓缩、定量的常用 方法。
实验仪器、用品
广口瓶、浮游生物网、量杯、甲醛、刻 度吸管。
实验内容
1.采样:采样点、采样层次 同浮游植物在野外 采集时,必须遵循先采定量样品,后捞定性标本 的原则。
2.浓缩:用广口采水器采10~30 L(30L)水, 用浮游生物Ⅲ型网(25#,200目, 0.064mm孔径)过滤。用5%甲醛固定。
5.生物量的换算:
测出每升水中浮游动物的数量后,再求得各种 浮游动物的平均重量后,生物量就能换算。
① 体积法:把生物体当做一个近似几何图形,按求 体积公式求得生物体积,并假定比重为1,由此得 到体重。
② 沉淀体积法:把浮游动物样品放在有刻度的滴定 管中,经一段时间沉淀后读出沉淀体积。
③ 直接称重法:就是要把称重的生物体,直接放在 微量天平中称其体重。
3.计数:如果数量少(<1000),可以直接 全部计数。如果数量多,可在相应的计数框内 计数。
4.个体数的计算:
N=(n·V′)/(V·V″)
式中, N为每升的个体数(个/L); n为取样计数的个体数(个); V′为水样浓缩的体积(ml); V″为取样计算的体积(ml); V为采水量或滤水量(L)。
动物
中型浮游动物定 量:取1 ml浓缩 水样于浮游动物 计数框内全片计
数
大型浮游动物 定量:在解剖 镜下体中浮游动物的密度和生物量
图1 浮游动物采样 、定量流程
作业:1.列表表示各种类浮游 动物的数量。
表1 浮游动物数量计数记录表
标本编号
站号
层次(m)
采水量(L)
浓缩体积(ml) 计数体积(ml)
调查时间: 年 月 日
浮游生物调查方法

七、数量计算: 1、定性 2、定量结果 浮游植物定量:
使用的工具有:带有0.1毫升刻度的小吸管,容量 使用的工具有:带有0.1毫升刻度的小吸管,容量 为0.1毫升的计数框(面积20ⅹ20毫米2)和具有移 0.1毫升的计数框(面积20ⅹ20毫米2 动台的显微镜。 经0.1毫升吸管吸水0.1毫升于方框内,盖上盖玻片, 0.1毫升吸管吸水0.1毫升于方框内,盖上盖玻片, 如果框内无气泡亦无水液溢出,即表示容量标准 适合,检查三次均适合,此半数框即可使用。每 次计数时用的盖玻片应用碱水或肥皂水洗净备用。 用前可浸入70%的酒精中,用时取出,用细绢拭 用前可浸入70%的酒精中,用时取出,用细绢拭 净,计数框用前以薄绸布拭净,用毕以水弄湿后 轻拭或用水冲净。
虹吸动作要十分仔细、小心。开始时虹吸管一端 放在沉淀器内约三分之二处,另一端套接在已经 用手挤压出空气的橡皮球上,然后轻轻松手并移 开橡皮球使清液流出,为了避免漂浮水面的一些 微小藻类进入虹吸管而被吸走,管吕应始终低于 水面。虹吸管内清液的活动不宜过快,可用手指 轻捏管壁以控制流量,当吸到原水样的3/5以上时, 轻捏管壁以控制流量,当吸到原水样的3/5以上时, 应使清淮一滴一滴地流下。吸出的清液要用一洁 净的器皿装盛,以便在浓缩过程在出故障时,可 重新倒入沉淀器中浓缩,不必新采水。
数横条,最少不少于5 数横条,最少不少于5条具体可自行掌握。 总之不论数视野还是数横条,每片计数到 的溪流植物总数应达到200个(低浓度时)的溪流植物总数应达到200个(低浓度时)500个(高浓度时)以上。 500个(高浓度时)以上。 同一样品的二片计数结果与其均数之差距 如果不大于其均数的10%,这两个相近的值 如果不大于其均数的10%,这两个相近的值 的均数即可视为计数结果。
浮游动物定量:
浮游植物采集与定性定量分析

第3行
第5行 第8行
总的物种数=
实际看到的物
种数×10/3
3. 水滴法
镜检:根据1毫升的水相当于20滴水,用移液管 取1滴水样,转移至计数框,全部计数。
总数量的计算:假如1升浮游植物水样定容至30 毫升,那么总数量=30÷(1÷20)×计算所得个数
样品采集:首先进行水平面设点和垂直分层,然后 用1升
采水器采集1升水样,加鲁格氏液15毫升,转移 至沉降器沉 淀 24~48小时,通过虹吸法获得浓缩的定 量样品,定容至
50毫升
样品固定:添加3~5毫升甲醛溶液
2. 定性分析 采集:用 25 号浮游生物网在水面以下呈 “∞” 来
回拖行,将所采集水样保存于小方瓶(50毫升)
浮游植物采集与定性定量分析 2019.03.18
蓝藻门 裸藻门 淡 水 种 类 绿藻门 隐藻门 硅藻门 黄藻门
甲藻门 轮藻门
金藻门
采集
分析
确定采样点
记录水体理化 指标
确定采样层次
(福尔马林/碘液)
样品固定
定性样品采集
(25#,64 μm)
定量样品采集
(1L+10L)
(定性、定量)
室内分析
1. 定量分析
固定:添加3-5毫升甲醛溶液保存。
定量计数方法 视野法 行格法 水滴法
0.1ml计数框
移液枪取样0.1毫升 均匀分布于计数框 对部分视野进行镜检 计数该部分框的面积是400 mm2,而显微镜的视野面 积是固定值。 显微镜视野面积的计算:某型号显微镜的视场 数 为 20 , 那 么 在 高 倍 镜 下 的 实 际 视 场 直 径 为 20/40=0.5mm , 高 倍 镜 下 的 视 野 面 积 为 3.14*0.25*0.25≈0.2 mm2。
浮游动物的采样方法

浮游动物生物量的测量方法自赵文《水生生物学》现存量:单位面积或体积中所存在生物体的数量或质量。
现存量若以个体数表示则可称为丰度或(数量)密度,单位为个/L。
若以质量表示则可称为生物量,单位为mg/L。
采集方法:一采水器采水后沉淀分离(适用原生动物、轮虫等小型浮游动物);二用网过滤(适用于枝角类、挠足类等甲壳动物)。
仪器:采水器,(25#)浮游生物网,显微镜,计数框(计数原生动物用0.1ml计数框,计数轮虫和甲壳动物用1ml计数框)解剖镜,毛细管,目测微尺一采集1 设站根据浮游动物的分布设站。
2 采水层次由水体的深度决定。
切不可之采一个表层或一个底层水样。
(据夏季调查,东湖B站(水深4m左右),在2m的水层区,甲壳动物的数量约占31%,而入2m一下的水层占69%左右。
同时还发现,在夏季,一般幼体喜欢在表层,成体在深层。
)分层方法:是每隔0.5m或1m,甚至2m取一个水样加以混合,然后取得一部分作为浮游动物定量之用。
许多水库或深水湖泊,水深20m以上,这种水体在夏季及冬季存在温跃层(或称变温层)。
由于在温跃层一下缺乏光照,浮游植物数量极少,依赖植物生存的浮游动物数量也相应减少。
如果从养殖角度而言,只取温水层以上的水层就足够了。
3 采水量浮游动物不但种类组成复杂,而且个体大小相差也极悬殊。
因此要根据它们在水体中的不同密度二采不同的水量。
(目前计数原生动物、轮虫的水样量以1L为宜,枝角类、桡足类则以10~50L较好。
)4 采集时间采样时间要尽量保持一致。
一般在上午8:00~10:00进行为好。
在长江中下游采集,如果采集四次,则春、夏、秋、冬各一次。
如果只采一次,则应在秋季(9、10月)进行为好。
(这是因为9~10月正是鱼类摄食旺季,为鱼类生长的最佳时期,如果此时有较高的现存量,则可认为该水体中有较大的供铒能力。
)浮游动物样品的固定,原生动物和轮虫可用碘液或福尔马林,加量同浮游植物(一般可与浮游植物合用同一样品)。
浮游生物的测定
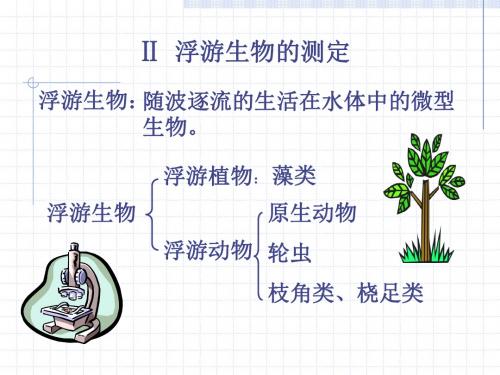
麻醉剂: 1%硫酸镉、水合氯醛、酒精等 1. 浮游植物: (1) 蓝细菌门: 平列藻属 微囊藻属 螺旋藻属 颤藻属 席藻属
具缘微囊藻
不定微囊藻
水花微囊藻
中华平裂藻
微小平裂藻
大平裂藻
小颤藻
为首螺旋藻 大螺旋藻 极大螺旋藻
巨颤藻
(2) 隐藻门
一般浮游植 物及中小型 浮游动物 大型浮游 动物
定性网
定量网
2.采水器
(1) 瓶式采水器
(2) 水生---81型有机玻璃采水器
3.透明度盘
直径 = 20cm
透明度盘
(二)采样层次
江河: 在水面下0.5m 左右采样
水深<2m 湖泊、水库: 深水, 分层采 在0.5 m 处采集
(三)采样方法及采样量
目 哲水蚤 剑水蚤 猛水蚤
前体部远宽于 前体部远宽 前体部略宽 体 形 后体部 于后体部 于后体部 第一触 长达身体的末 适中,6短,5-9节 角 端,23-25节 17节 1个,在身体 2个,在身 1个,在身 卵 囊 中间 体两侧 体中间 生活方 浮游生活 浮游生活 底栖生活 式
汤匙华哲水蚤
毛饰拟剑水蚤
3. 计数方法 (1) 长条计数法
C 1000 浮游生物数/ mL= L W D S
式中C-- 计数的浮游生物数; L-- 一个长条的长度,也就是计数框的长度(mm); W-- 一个长条的宽度,即目尺的长度(mm); D-- 一个长条的深度,即计数框的深度(mm);
S-- 计数的长条数。
肉鞭亚门
植鞭纲
动鞭纲
根足纲 辅足纲
大 变 形 虫 毛板壳虫 放 射 太 阳 虫 球形砂壳虫 有肋楯纤虫 僧帽斜管虫 天蓝喇叭虫
海洋生物讲义-近海海洋生物主要类群及其样品采集整理和分析的注意事项

近海海洋生物主要类群及其样品采集整理和分析的注意事项(国家海洋局第三海洋研究所,林茂)前言海洋生态系统由水层和底层两大子系统组成。
水层生态系统的浮游植物、浮游动物和鱼类浮游生物,底层生态系统的大型底栖生物和潮间带生物是我近海海洋生物监测的主要对象。
本讲义简要说明了上述监测对象的样品采集、处理和信息整实践过程中应注意的主要问题;海洋生物的种类鉴别是海洋生物监测的核心问题,讲义扼要介绍了我们近海水层和底层生物的主要类群和常见物种,目的是促进大家对我国近海水层和底层主要生物类群的种类多样性的了解和认识,为进行监测对象的种类鉴别提供参考。
上篇样品采集整理1 术语和定义1.1 浮游生物缺乏发达的运动器官,运动能力很弱,只能随水流移动,被动地漂浮于水层中的生物群。
1.2 鱼类浮游生物营阶段性浮游生活的鱼卵和仔、稚鱼的总称。
1.3 底栖生物生活于海洋基底表面或沉积物中生物的总称。
根据与底质的关系,底栖生物可划分三种生活类型,即底表生活型、底内生活型和底游生活型。
1.4 大型底栖生物凡被孔宽为0.5mm套筛网目所阻留的生物,称为大型底栖生物。
1.5 小型底栖生物凡能通过孔宽为0.5mm套筛网目,而被孔宽为0.042mm所阻留的生物,称为小型底栖生物。
1.7 潮间带潮区最高高潮线到最低低潮线之间的海岸带。
该地带在涨潮时淹没在海水中,退潮时又暴露在空气中,受到陆、海双重复杂的影响。
1.8 潮间带的划分根据潮汐水位参数或岸滩生物的垂直分布,将潮间带划分为高潮区、中潮区和低潮区。
1.9 潮间带生物在潮间带营附着、固着、底埋和匍匐活动的一类动、植物的总称,这其中不包括鸟类。
2 调查方式2.1 大面观测2.2 断面观测2.3 连续观测3 采样方法3.1 采水适用于叶绿素浓度和初级生产力、微生物、浮游植物等项采样。
3.2 拖网适用于浮游生物、底栖生物和游泳动物等项采样。
3.3 采泥适用于微生物、底栖生物采样。
4 浮游植物、浮游动物和鱼类浮游生物样品采集4.1 网型选用当进行浮游植物、浮游动物和鱼类浮游生物样品拖网采集时,应注意到网型的选用,在30m以浅海域,应采用浅水І型、Ⅱ型浮游生网采集大、中型浮游生物,采用浅水III型浮游生网采集小型浮游生物;在30m以深海域应采用大型、中型游生物网采集大、中型浮游生物,采用小型浮游生物网采集小型浮游生物。
浮游生物及其生态环境的监测技术研究

浮游生物及其生态环境的监测技术研究一、浮游生物的概念及重要性浮游生物是自然界种类最丰富的生物群体之一,它们可以在海洋及淡水中生长繁殖,并居于食物链的基础位置。
浮游生物使海洋或淡水生态系统保持着稳定的结构,是海洋、淡水生态系统中重要的能量传递者和生态效应的产生者。
浮游生物不仅是海洋生态系统中不可或缺的一部分,并且在全球气候变迁与碳循环过程中起着重要的作用。
二、浮游生物监测的意义浮游生物监测指的是及时进行浮游生物的种类、数量、质量以及分布区域等信息的采集、分析与评价,以揭示海洋、淡水生态系统的变迁趋势及其反映对人类活动的响应。
通过浮游生物监测,可以了解生态环境的变化趋势和规律,及时掌握水环境的安全情况,保障和改善水生态环境质量,对环境保护、水资源管理和渔业生产等方面具有很重要的指导意义。
同时,浮游生物监测还可提供关于全球变暖、气候变迁等大量的信息。
三、浮游生物监测技术研究现状1. 浮游生物样品采集技术样品采集是浮游生物监测的重要环节之一,现代浮游生物采样技术可以分为表层采样、垂直采样和连续采样等。
常用的表层采样可以采集水平方向(网口直径一般在0.2-2mm范围内),垂直方向(采样设备一般为Niskin瓶、Rosette等),还可以进行自流采集。
通过表层采集,可以获得海洋浮游生物的种类、数量、密度等基本生态信息;而通过垂直采样,则可以了解生态层、温度、盐度、光照等相关信息。
2.浮游生物显微镜检测技术浮游生物显微镜检测技术是通过显微镜观察浮游生物的形态、结构、大小、颜色、质地及数量等生物学特征,以确定其种类和数量。
与其他浮游生物监测技术相比,浮游生物显微镜检测技术具有高度精确、准确性高等优点。
但它存在着处理样品的时间比较长、技术门槛高、自动化程度低等不足。
因此,目前往往采用将自动化技术与显微技术相结合的方式,以提高浮游生物显微检测的效率、准确性。
3.流式细胞技术流式细胞技术是浮游生物监测中新兴的一个技术,其依靠流式细胞仪对浮游生物进行高通量快速检测。
浮游植物取样测定规范

水体浮游植物分析规范参考淡水生物资源调查技术规范DB43/T 432-2009水层设置水深小于3m时,只在中层采样,混合均匀水体,可以只采表层(0.5m)水样;水深3m~6m时,在表层、底层采样,其中表层水在离水面0.5m处,底层水在离泥面0.5m处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下除特殊需要外一般不采样,对于深水湖泊,取样的水层可以将取样间隔加大,如0m,10m,20m,50m, 100m。
采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
固定浮游植物样品立即用鲁哥氏液固定,用量为水样体积的1%~1.5%。
如样品需较长时间保存,则需加入37%~40%甲醛溶液,用量为水样体积的4%。
现行的一些规律性的方法为:取水样,500ml,加入5ml鲁格,虹吸到30-50ml,加入1ml甲醛。
水样的沉淀和浓缩固定后的浮游植物水样摇匀倒入固定在架子上的1L沉淀器中,2h后将沉淀器轻轻旋转,使沉淀器壁上尽量少附着浮游植物,再静置24h。
充分沉淀后,用虹吸管慢慢吸去上清液。
虹吸时管口要始终低于水面,流速、流量不能太大,沉淀和虹吸过程不可摇动,如搅动了底部应重新沉淀。
吸至澄清液的1/3时,应逐渐减缓流速,至留下含沉淀物的水样20mL~25(或30~40)mL,放入30(或50)mL的定量样品瓶中。
用吸出的少量上清液冲洗沉淀器2次~3次,一并放入样品瓶中,定容到30(或50)mL。
如样品的水量超过30(或50)mL,可静置24 h后,或到计数前再吸去超过定容刻度的余水量。
浓缩后的水量多少要视浮游植物浓度大小而定,正常情况下可用透明度作参考,依透明度确定水样浓缩体积见表3,浓缩标准以每个视野里有十几个藻类为宜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碘液需提前制备:将I2溶于5%的KI溶液,制成饱和碘液
采样过程中做好现场记录,包括站位、水深、绳长、样品瓶号等
!发生以下情况时需要重新采样
网衣或网底管套破损:更换网衣或网底管套,重新采样 翻网:把网整理好,冲洗干净,重新采样 触底:把网冲洗干净,重新采样 采到垃圾或大型水母类:把垃圾或大型水母从网口倒出来,
例:HⅠ0902A1
编号之后,做成外标签(贴到 瓶身上)和内标签(放入瓶 中)。
H:黄海 Ⅰ :浅水Ⅰ型网网底表垂直拖网 0902:2009年2月 A1:站号
浮游动物样品生物量测定
浮游动物生物量以浅水Ι型浮游生物网的样品为准。
所需工具:筛绢、滤纸、布氏漏斗、真空抽滤泵、电子天平、镊子等。
布氏漏斗
真空抽滤泵
个体微小
浮游 动物
浮游 植物
巨型浮游生物:大于1cm,如海蜇; 大型浮游生物:5~10mm,如大型桡足类、磷虾类; 中型浮游生物:1~5mm,如小型水母,桡足类; 小型浮游生物:50μm~1mm,如硅藻、蓝藻; 微型浮游生物:5~50 μm ,如甲藻,金藻; 超微型浮游生物:小于5 μm ,如细菌。
浮游动物隶属的主要门类:
原生动物门 Protozoa 刺胞动物门 Cnidaria 栉水母动物门 Ctenophora 轮虫动物门 Rotatoria 环节动物门 Annelida 软体动物门 Mollusca 节肢动物门 Arthropoda 毛颚动物门 Chaetognaths 尾索动物门 Urochordata
样品沉降一段时间后,将上清液吸走,把样品浓缩到较小的瓶中保存。
所需工具:虹吸管、筛绢。
注意事项:
➢浓缩筛绢的网目一定要比采样筛绢 的网目小。 ➢浓缩后样品保存于干燥避光的场所。
(2)样品编号
样品编号是样品的唯一标识。
样品编号由代表采样海区、采样方式、使用网型、采样年 份和样品序号等内容的代号依次组成。
调查方法
浮游植物:采水、拖网 浮游动物:拖网
详细了解种类组成 底表垂直拖网或分层拖网
昼夜连续观测:每2h或3h采样一次
调查工具
采水:采水器(浮游植物)
拖网
浅水Ⅰ 型网:大中型浮游动物 浅水Ⅱ 型网:中小型浮游动物 浅水Ⅲ 型网:浮游植物
网口
网衣 网底管
调查辅助工具:绞车、钢丝绳、 绳子、铅锤、水桶、冲水设备 等
显微镜
需借助显微镜或解剖镜才能观察到
浮游生物生态地位
海洋食物链中最基本的一环,海洋生态系统的基础
二、浮游生物样品采集
《海洋监测规范 第7部分:近岸污染生态调查和生物监测》 (GB17378.7)
浮游生物调查 调查内容
浮游植物:种类组成、数量分布 浮游动物:种类组成、生物量、数量分布
赤潮生物监测 分层次采水
✓ 网底管用较缓的水流冲洗,反 复多冲几次;
收集样品: ✓ 通过旋转网底管底部的开关旋钮,把网底管内的
样品收入样品瓶内,反复冲洗网底管多次以保证 样品被全部收集; ✓ 洗净网底管,避免把上一站的样品带到下一站中。
加固定剂: ✓ 浮游植物使用碘液(鲁格氏液)固定,每升水加
6-8ml碘液; ✓ 浮游动物使用5%甲醛固定,即加入的甲醛量为样
冲网 收集样品
拖网采样各步骤注意事项:
下网:
✓ 下网前检查网衣是否有破损; ✓ 下网前确保网底管是关闭的; ✓ 下网速度在1m/s左右,保持钢丝绳紧直; ✓ 放到底,记录绳长。
起网:
✓ 起网速度在0.5m/s左右; ✓ 起网过程中不得停顿。
冲网:
✓ 用水在网外自上而下反复冲洗, 不能把水冲进网口内,保证样 品被冲洗到网底管内;
浮游生物样品采集过程
(1)出海前准备
❖ 网具——足量、无破损! ❖ 固定剂——碘液(浮游植物)、甲醛(浮游动物) ❖ 箱子、样品瓶带足够的数量 ❖ 量角器、铅锤 、闭锁器、矢锤 ❖ 检查船上的绞车、钢丝绳、冲水设备等设施 ❖ 其它工具:钳子、剪刀、绳子、桶等 ❖ 流量计
(2)海上采样
下网
起网
加固定液
——浮游生物样品采集与种类鉴定
2014.4 马兆党
国家海洋局北海环境监测中心
主要内容
一、浮游生物定义 二、浮游生物样品采集 三、浮游动物样品分析 四、北海区常见浮游动物简介 五、北海区常见浮游动物的分布特点
一、 浮游生物定义
——分为浮游植物(Phytoplankton)及浮游动物(Zooplankton)
浮游动物样品种类鉴定与个体计数
样品鉴定使用的工具
计 数 框
显微镜 解剖镜
计数板
取样管
计数器 解剖针
样品鉴定的步骤
把样品倒入计数框内
把计数框和样品放到解 剖镜的载物台上
调节镜头高度、粗调和微调旋钮,观察样品,进行种类鉴定并 计数,记录
样品鉴定的技术要求:
✓样品分析要求尽可能鉴定到种(幼体除外),并按种计数; ✓标本数量较少的应全部计数; ✓若标本数量较大,应先将个体大的标本(如水母、虾类、箭虫等) 全部拣出,剩余的稀释取分样计数; ✓计数时残损个体,按头部计数。
生物量测定步骤:
✓将筛绢剪成与布氏漏斗等大,浸湿铺到漏斗中,用真空泵抽去多余 水分后,称量筛绢的重量; ✓将样品转移到布氏漏斗的筛绢上,用真空泵抽去多余水分; ✓将样品连同筛绢转移到滤纸上,进一步吸干水分; ✓放入电子天平称重; ✓样品重量=总重量-筛绢重量
注意事项:
➢称生物量前,将样品中的杂质拣出。 ➢水母等胶体生物数量较多时,在备注中注明。 ➢若要求称量饵料生物量,需将水母、海樽等胶体生物挑出。
把网冲洗干净重新采样
刮船底:调整船的方向,把网冲洗干净,重新采样 倾角超过45 °:把网冲洗干净,适当加重铅锤,重新采样
三、浮游动物样品分析
浮游动物样品分析的工作内容 ➢预处理 ➢生物量的测定 ➢种类鉴定和个体计数 ➢数据整理
浮游动物样品预处理
(1)样品浓缩
将样品浓缩成较小的体积,便于分析。
优势种、常见种应力求鉴定到种
取样管
显微镜和解剖镜的使用方法:
✓目两只镜眼睛看目镜
✓物需要镜观察的样品放在载物台上;
✓目镜倍数固定,物镜倍数可调;
✓调载焦物旋台钮包括粗调旋钮(内侧)和微调旋钮
(外侧),调焦距;
✓观察样品时,先在低倍镜下调节粗调找到样品,
再换调到焦高旋倍钮镜下,调节微调进行观察;
✓节不粗可调直;接在高倍镜下解观剖察镜,不可在高倍镜下调
