C N键的形成
第十四章 羧酸衍生物 酰基碳上的亲核取代反应
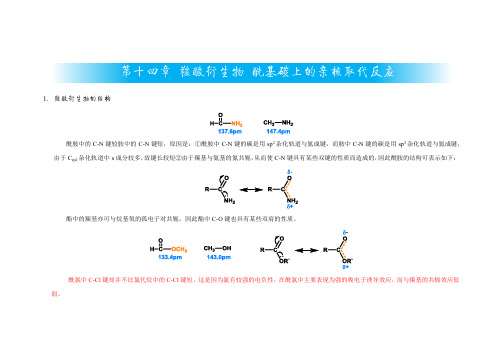
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。
蛋白质的n端和c端名词解释

蛋白质的n端和c端名词解释蛋白质是生命体中至关重要的分子之一,它们在细胞中扮演着各种重要的功能角色。
蛋白质的结构可以分为四个级别:一级结构是由氨基酸链组成的线性序列,二级结构是由氢键和其他作用力导致的局部折叠,三级结构是蛋白质整体的立体结构,而四级结构则是多个蛋白质相互作用形成的复合物。
在探讨蛋白质结构和功能时,我们常常听到两个术语,即N端和C端。
N端是蛋白质的氨基末端,而C端则是蛋白质的羧基末端。
当一个多肽链合成时,它从N端的氨基酸开始,通过肽键将一系列氨基酸连接在一起,最终在C端与一个羧基酸形成肽链。
在这个过程中,氨基酸的侧链可以通过共价键和非共价键的相互作用发生立体构象的变化。
同时,蛋白质也通过互相作用,形成各种复杂的结构。
蛋白质的N端和C端可以影响其结构和功能。
一方面,它们可以通过与其他分子的相互作用来调节蛋白质的功能。
例如,N端和C端可以与其他蛋白质结合,形成信号传导途径,参与细胞信号传导和调节。
另一方面,它们也可以通过调控蛋白质的稳定性和折叠状态来影响其功能。
N端和C端的一些氨基酸残基可能存在特殊的修饰,如磷酸化、甲基化和乙酰化等,这些修饰可以改变蛋白质的稳定性和功能。
此外,N端和C端在蛋白质科学的实验研究中也是非常重要的。
在蛋白质的合成和测序中,我们常常通过化学或酶法来确定蛋白质的N端和C端序列。
这些序列信息对于研究蛋白质的结构、功能和相互作用非常关键。
此外,一些研究还能识别和设计N端和C端部分的特定结构,以提高蛋白质的稳定性和功能。
综上所述,蛋白质的N端和C端在研究和理解蛋白质的结构、功能和相互作用方面发挥着重要的作用。
其作为蛋白质分子的两个末端,不仅仅是化学区域的标识,同时也具有丰富的生物学功能和结构调控的能力。
了解和理解蛋白质的N端和C端对于探讨蛋白质的功能和在生命过程中的作用具有重要意义。
生物氧化的名词解释

生物氧化的名词解释肽键:蛋白质中前一氨基酸的α-羧基与后一氨基酸的α-氨基脱水形成的酰胺键。
肽键平面:肽键中的c-n键具有部分双键的性质,不能旋转,因此,肽键中的c、o、n、h 四个原子处于一个平面上,称为肽键平面。
蛋白质分子的一级结构:蛋白质分子的一级结构是指构成蛋白质分子的氨基酸在多肽链中的排列顺序和连接方式。
亚基:在蛋白质分子的四级结构中,每一个具备三级结构的多肽链单位,称作亚基。
蛋白质的等电点:在某-ph溶液中,蛋白质分子可游离成正电荷和负电荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的ph值称为该蛋白质的等电点。
蛋白质变性:在某些化学因素促进作用下,蛋白质特定的空间构象被毁坏,从而引致其化学性质发生改变和生物学活性的失去的现象。
协同效应:一个亚基与其配体结合后,能影响另一亚基与配体结合的能力。
(正、负)如血红素与氧结合后,铁原子就能进入卟啉环的小孔中,继而引起肽链位置的变动。
变构效应:蛋白质分子因与某种小分子物质(效应剂)相互作用而致构象出现发生改变,从而发生改变其活性的现象。
分子伴侣:分子伴侣是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域和整体蛋白质的正确折叠。
细胞至少有两种分子伴侣家族——热休克蛋白和伴侣素。
dn*的复性促进作用:变性的dn*在适度的条件下,两条彼此分离的多核苷酸链又可以再次通过氢键相连接,构成原来的双螺旋结构,并恢复正常其旧有的化学性质,此即为dn*的复性。
杂交:两条不同来源的单链dn*,或一条单链dn*,一条rn*,只要它们有大部分互补的碱基顺序,也可以复性,形成一个杂合双链,此过程称杂交。
增色效应:dn*变性时,*值随着升高,这种现象叫做增色效应。
解链温度:在dn*热变性时,通常将dn*变性50%时的温度叫解链温度用tm表示。
辅酶:与酶蛋白融合的Nashik,用输血等方法不易与酶分离。
辅基:与酶蛋白融合的比较稳固,难于与酶蛋白瓦解。
酶的活性中心:必需基团在酶分子表面的一定区域形成一定的空间结构,直接参与了将作用物转变为产物的.反应过程,这个区域叫酶的活性中心。
库尔提斯重排反应

库尔提斯重排反应[编辑](重定向自Curtius重排反应)库尔提斯重排反应(Curtius重排反应)是一个重排反应,首先由库尔提斯(Theodor Curtius)发现,反应中酰基叠氮重排生成异氰酸酯。
[1][2]关于此反应的综述参见:[3][4]。
产物可与一系列亲核试剂反应:与水作用水解得到胺;[5]与苯甲醇反应生成带有苄氧羰基保护基(Cbz)的胺类;[6]与叔丁醇作用生成带有叔丁氧羰基保护基(Boc)的胺类,用作有机合成中的重要中间体。
[7][8]羧酸1可通过与叠氮磷酸二苯酯2反应被转化为酰基叠氮3。
[9][10][11][12]目录[隐藏]∙ 1 反应机理∙ 2 延伸∙ 3 参考资料∙ 4 参见反应机理[编辑]反应中,酰基叠氮失去氮气生成酰基乃春(氮烯)2,然后烃基迅速迁移,生成产物异氰酸酯3:延伸[编辑]在Curtius重排反应的基础上,Darapasky递降反应(A. Darapsky, 1936)以α-氰基酯为原料,通过重排反应生成氨基酸。
[13]参考资料[编辑]1. ^ Curtius, T. Ber.1890, 23, 3023.2. ^ Curtius, T. J. Prakt. Chem.1894, 50, 275.3. ^ Smith, P. A. S. Org. React.1946, 3, 337-449. (Review)4. ^ Scriven, E. F.; Turnbull, K.; Chem. Rev.1988, 88, 297-368. Review5. ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51,p.48 (1971).Article6. ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res.Dev.1998, 2, 382-392.7. ^ Lebel, H.; Leogane, O.; Org. Lett.2005, 7(19),4107-4110. doi:10.1021/ol051428b8. ^ Shioiri, T.; Yamada, S. Organic Syntheses, Coll. Vol. 7, p.206 (1990); Vol. 62,p.187 (1984).Article9. ^ Shioiri, T.; Ninomiya, K.; Yamada, S. J. Am. Chem. Soc.1972, 94,6203-6205.doi:10.1021/ja00772a05210. ^ Ninomiya, K.; Shioiri, T.; Yamada, S. Tetrahedron1974, 30, 2151-2157.11. ^ Wolff, O.; Waldvogel, S. R. Synthesis2004, 1303-1305.12. ^ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. Organic Syntheses, Coll.Vol. 6, p.95 (1988); Vol. 59, p.1 (1979). Article13. ^/reactions/RXN051.htm(重定向自贝克曼重排)贝克曼重排反应(Beckmann rearrangement)是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
第四章_形成C-C单键的反应

RBr
OSiMe3
该反应特点: 避免叔卤代烷在强碱下的成烯反应 仲、叔卤代烷活性大于伯卤代烷活性
Br OSiMe3 + Br Br TiCl4 O
第二节 碳原子上的酰基化反应
一、芳环上的酰基化反应
1. Friedel-Crafts 酰化反应 2. Hoesch 反应
3. 甲酰化反应(引入醛基)
HO HO HO H+ C NH R C O R
+
ZnCl2 R-CN HCl
用腈作亲电试剂对芳环的亲电取代,首先产生亚胺,水解后
生成芳基酮。整体结果是一种酰化反应,需要酸(如氯化锌和
盐酸)催化。
只有富电子芳烃如酚或苯胺才能发生反应。反应中的
酮亚胺中间产物可以分离出来。
回首页
信息
结束
3. 芳环上的甲酰化反应 (1) Hoesch 反应
信息
结束
CO2Et
O O
O
+ CH3 C CH2 CH3 EtONa
C CH2 C CH2 CH3
CN O O Cl
+
NaOEt CN O Cl
此类反应多使用对称酮或只含一种α-H 的化合物作原 料,以避免不必要的副产物。
H2C O CH3CH2 C OEt +
CN CN O 1)EtONa 2)H2SO4 Cl CH C CH2CH3
O H C O H + CH3 C CMe3 OH NaOH H C H O CH2 C CMe3
O CHO + H C H
NaOH
CH2OH + HCOO-
回首页
信息
结束
羟甲基化反应和Cannizzaro反应的结合可制备
Buchwald-Hartwig偶联反应及影响因素
Synthesis, 2005, 3229‐3234
非环状2o酰胺类为亲核试剂时,Cu(I)或者Pd/XantPhos 催化体系可以催化芳基碘化物,溴化物的C‐N 偶联。通 过降低Pd上的电子密度来促进转金属过程,即以JackiePhos 为配体,芳基氯化物可以与非环状2o 酰胺类发生偶联。
J. Am. Chem. Soc. 2009, 131, 16720–16734.
配体的电子效应和空间位阻效应对金属催化剂的催化性能调节起到了至关重要的作用。根据配位 原子的种类数目不同可以分为氮配体和膦配体,单齿配体和多齿配体。
氮配体
膦配体
3.2 催化剂
反应中可以直接使用Pd(0),常见的如Pd2(dba)3,三(二亚苄基丙酮)二钯与双烷 烃联苯联合使用适用很多反应,但是,钯与二亚苄基丙酮配位,减弱了钯的催化活性。 因此反应可以使用Pd(II),如Pd(OAc)2、PdCl2,只是在交叉偶联反应前必须将Pd(II) 转 化为 Pd(0) 。
Example 4:酰胺N为亲核试剂 双齿膦配体 Xant‐Phos 是芳基碘化物和溴化物与酰胺偶联的有效催化剂,但在芳基氯化物,芳基‐OTf, ‐OTs 类化合物的反应中却有所欠缺。Buchwald类配体在该类反应中表现出较高活性。 1o 酰胺和内酰胺比非环状的2o 酰胺更容易发生C‐N 偶联。
5. 反应条件优化
美国著名化学家,麻省理工学院化学冠名讲席 教授。因开发了用于改进大型有机分子有机合成过 程 BUCHWALD-HARTWIG 胺化反应,与约翰·哈特维 希教授共获2019年沃尔夫化学奖。
以 他 的 名 字 冠 名 的 钯 催 化 的 Buchwald-Hartwig 偶联反应、以及铜催化的胺化反应–催化的 Goldberg反应等有机化学领域的重大成果。
生物化学名词解释
名词解释肽键:蛋白质中前一氨基酸的α-羧基与后一氨基酸的α-氨基脱水形成的酰胺键。
肽键平面:肽键中的C-N键具有部分双键的性质,不能旋转,因此,肽键中的C、O、N、H 四个原子处于一个平面上,称为肽键平面。
蛋白质分子的一级结构:蛋白质分子的一级结构就是指构成蛋白质分子的氨基酸在多肽链中的排列顺序与连接方式。
亚基:在蛋白质分子的四级结构中,每一个具有三级结构的多肽链单位,称为亚基。
蛋白质的等电点:在某-pH溶液中,蛋白质分子可游离成正电荷与负电荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的pH值称为该蛋白质的等电点。
蛋白质变性:在某些理化因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变与生物学活性的丧失的现象。
协同效应: 一个亚基与其配体结合后,能影响另一亚基与配体结合的能力。
(正、负)如血红素与氧结合后,铁原子就能进入卟啉环的小孔中,继而引起肽链位置的变动。
变构效应: 蛋白质分子因与某种小分子物质 (效应剂)相互作用而致构象发生改变,从而改变其活性的现象。
分子伴侣:分子伴侣就是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域与整体蛋白质的正确折叠。
细胞至少有两种分子伴侣家族——热休克蛋白与伴侣素。
DNA的复性作用:变性的DNA在适当的条件下,两条彼此分开的多核苷酸链又可重新通过氢键连接,形成原来的双螺旋结构,并恢复其原有的理化性质,此即DNA的复性。
杂交:两条不同来源的单链DNA,或一条单链DNA,一条RNA,只要它们有大部分互补的碱基顺序,也可以复性,形成一个杂合双链,此过程称杂交。
增色效应:DNA变性时,A260值随着增高,这种现象叫增色效应。
解链温度:在DNA热变性时,通常将DNA变性50%时的温度叫解链温度用Tm表示。
辅酶:与酶蛋白结合的较松,用透析等方法易于与酶分开。
辅基:与酶蛋白结合的比较牢固,不易与酶蛋白脱离。
酶的活性中心:必需基团在酶分子表面的一定区域形成一定的空间结构,直接参与了将作用物转变为产物的反应过程,这个区域叫酶的活性中心。
13-有机含氮化合物(药学专升本陆涛7版)等待跟新
单一的电性效应使胺的碱性由强至弱顺序为:
R3N > R2NH > R→NH2 > NH3 > > 芳香胺
pKb 3~5 4.75 >9
③空间效应 N原子上连接的基团越多越大,对N上孤对电 子的屏蔽作用越大,N上孤对电子与H+结合就越难, 碱性就越弱。
季 铵 碱 (R4N+OH - ) 为 离 子 化 合 物 , 其 碱 性 与 NaOH相当,是强碱。季铵碱与酸作用生成季铵盐。
NO2 2 硝基丙烷
NO2 2 甲基 2 硝基丙烷
CH3
O 2N
CH3 NO2
NO2
NO2 4 硝基甲苯
NO2 2,4,6 三硝基甲苯
NO2 1,3 二硝基苯
(三)化学反应 1.α-氢的反应 在脂肪硝基化合物中,由于硝基的强吸电诱电 效应和共轭作用,使α—氢的酸性增强和易发生α氢 的反应。 (1) 酸性 (2) 缩合反应
氨分子(NH3)中去掉1个、2个及3个 H 原子后剩下的基团分别叫做氨基(-NH2)、亚氨 基(-NH-)及次氨基(—N—).
类别 结构
伯胺(1 ) 仲胺(2 ) 叔胺(3 ) NH2 氨基
。
。
。
NH 亚氨基
N 次氨基
名称
它们分别是伯胺、仲胺和叔胺的官能团。
伯、仲、叔胺的区别与伯、仲、叔醇或 卤代烃不同。
生物碱
Ar—N=N—Ar’
-N=N-
CH3
一、硝基化合物
(一)结构和命名 烃分子中的氢原子被硝基(一NO2)取代所形成的 化合物叫硝基化合物。一元硝基化合物的通式是 RNO2或ArNO2。
分 类
根据分子中烃基的种类不同,分为脂肪族硝基化 合物、脂环族硝基化合物和芳香族硝基化台物;根据 与硝基直接相连的碳原于种类不同分为伯、仲、叔硝 基化合物。 CH3NO2 硝基甲烷 (CH3)2CHNO2 硝基异丙烷 仲硝基化合物 (CH3)3CNO2 硝基叔丁烷 叔硝基化合物
cc双键顺反异构条件
cc双键顺反异构条件
顺反异构也称几何异构,属于立体异构中的一种。
这种异构一般是由有机化合物结构中,如C=C双键、C≡C叁键、C=N双键、N=N双键或脂环等不能自由旋转的官能团所引起的。
含有这种异构的有机化合物称为顺反异构体,它在物理、化学、生物性质上具有明显的区别,其可根据“顺反式异构命名法和“Z-E命名法”两种命名法来命名。
此外,配位化合物中的配离子亦可能有但不仅限于“顺-反”式的几何异构。
形成顺反异构的条件:
1.有碳碳双键
2.两个取代基连在双键不同的两个碳上。
3.取代基在双键同一侧为顺式,也叫船式;取代基在双键不同侧为反式,也叫椅式。
