哈尔滨工业大学《水分析化学》课件..
合集下载
《水质分析化学》PPT课件

酸碱反应
完整版课件ppt
25
溶剂的质子自递反应
质子溶剂
质子自递常数
平衡常数:
(1)酸碱的离解常数越大酸碱性越强 (2)酸强度>H3O+ (3)碱强度>OH-
Kw = Ka × Kb
完整版课件ppt
26
一元酸分布分数的计算
HAC为例 δHAc+ δAc-= 1
pH值为X轴,δi为Y轴的分布图 对称分布
lgαY(H)≤ lgKMY – 8
完整版课件ppt
50
EDTA酸效应曲线的使用
1. 络合滴定的最小pH值 2. 查出干扰离子
例如对Ca2+的滴定过程中,干扰离子?
完整版课件ppt
1
2). 滴定分析法
容量分析法,将一已知准确浓度的试剂溶液和 被分析物质的组分定量反应完全,根据反应完成时 所消耗的试剂溶液的浓度和用量(体积),计算出 被分析物质的含量的方法。
几个概念:标准溶液(纯度、化学式、稳定) 滴定 化学计量点 滴定终点
完整版课件ppt
2
四大滴定法:
酸碱滴定法:利用质子传递反应进行滴定的方法 沉淀滴定法:利用生成反应进行滴定的方法
pKi 4
滴总量的判断
强度最弱的酸碱进行判断
C sp n K a ( n C s或 p n K b) n 1 1 00
完整版课件ppt
38
以NaOH滴定H3PO4为例
是否满足分级滴定的条件?
(1)第一计量点 (2)第二计量点 (3)第三计量点:CaCl2强化
完整版课件ppt
39
3.7 水中的碱度和酸度
• 真色:除去悬浮杂质后的水,由胶体及溶 解杂质所造成的颜色。
水分析化学 第3章 酸碱滴定法

351强碱滴定强酸或强酸滴定强碱56强酸滴定强碱的情况与强碱滴定强酸的相似只是ph的变化与此相反图35中虚线部分351强碱滴定强酸或强酸滴定强碱57352一元弱酸弱碱的滴定以01000mollnaoh滴定2000ml初始浓度为01000moll的弱酸hac为例滴定反应滴定阶段ph计算依据计算式滴定前按一元弱酸体系计算化学计量点前按缓冲体系计算化学计量点按弱碱公式计算化学计量点后按过量强碱量计算achacpkphnaohoh58352一元弱酸弱碱的滴定开始时ph上升快
1 2
2.pH的计算
例3.8:
2.pH的计算
例:
3.3缓冲溶液
缓冲溶液(Buffer solution):是一种能对溶液的酸 度起稳定作用的溶液。 缓冲溶液通常由浓度较大的弱酸及其共轭碱所组成。 缓冲溶液可抵抗加入的少量酸或碱;抗发生化学反 应所产生的少量酸或碱;抗稀释作用。
3.3.1缓冲溶液pH值计算
cB
3.3.2缓冲溶液的选择和配制
1.缓冲溶液选择的原则 ①缓冲溶液对测量过程没有干扰; ②所需控制的pH应在缓冲溶液的缓冲范围之内。 ③缓冲溶液应有足够的缓冲容量 ④缓冲物质应廉价易得,避免污染。 2.缓冲溶液的配制
3.4酸碱指示剂
3.4.1 酸碱指示剂的作用 原理 酸碱指示剂一般是有机弱 酸或有机弱碱,其共轭酸 碱形式具有明显不同的颜 色。
3.4.2 指示剂的变色范围
[HIn] 10时,呈酸式色,溶液pH≤PKa-1 当 [In ]
当
[HIn] 0.1时,呈碱式色,溶液pH≥PKa+1 [In ]
当溶液PKa-1≤pH≤PKa+1,呈混合色。 人的视觉所能看到的颜色变化范围:(PKa±1)称为酸碱 指示剂的变色范围, PKa是指示剂的理论变色点。
1 2
2.pH的计算
例3.8:
2.pH的计算
例:
3.3缓冲溶液
缓冲溶液(Buffer solution):是一种能对溶液的酸 度起稳定作用的溶液。 缓冲溶液通常由浓度较大的弱酸及其共轭碱所组成。 缓冲溶液可抵抗加入的少量酸或碱;抗发生化学反 应所产生的少量酸或碱;抗稀释作用。
3.3.1缓冲溶液pH值计算
cB
3.3.2缓冲溶液的选择和配制
1.缓冲溶液选择的原则 ①缓冲溶液对测量过程没有干扰; ②所需控制的pH应在缓冲溶液的缓冲范围之内。 ③缓冲溶液应有足够的缓冲容量 ④缓冲物质应廉价易得,避免污染。 2.缓冲溶液的配制
3.4酸碱指示剂
3.4.1 酸碱指示剂的作用 原理 酸碱指示剂一般是有机弱 酸或有机弱碱,其共轭酸 碱形式具有明显不同的颜 色。
3.4.2 指示剂的变色范围
[HIn] 10时,呈酸式色,溶液pH≤PKa-1 当 [In ]
当
[HIn] 0.1时,呈碱式色,溶液pH≥PKa+1 [In ]
当溶液PKa-1≤pH≤PKa+1,呈混合色。 人的视觉所能看到的颜色变化范围:(PKa±1)称为酸碱 指示剂的变色范围, PKa是指示剂的理论变色点。
给排水基础水分析化学PPT课件
=K HAc
V n Ac-
V
pH=4.74-lg 0.1 0.02 =7.74 0 .1 1 9 .9 8
化学计量点: NaAc 〔OH-〕= K C Ac- Ac-
p OH=
1(p 2
K
Ac--lg
n Ac- V
) = 1(1 4 2
4.7 4-lg
0.1 20
2 0) =5.2 8 20
pH=14-pOH=14 - 5.28=8.72
100%
第3页/共89页
2. 精密度:偏差 绝对偏差d=测量值(X)-平均值( )
X Xi
n
相对偏差=d 100% X
平均偏差d= X-X ,相对平均偏差d(%)=d 100%
n
X
标准偏差:
(1)有限次测量s
(Xi X)2
n 1
(2)无限次测定:lim X=(总体平均值) n
= (X-)2
• 滴定曲线:pM(-lg[M])~V(EDTA) 1.滴定前 2.开始~化学计量点前 3.化学计量点 4.计量点之后
例 5 - 2 6 : 0 . 0 1 0 0 0 m o l / L E DTA 滴 定 2 0 m l C a 2+ 滴定突跃:pCa=5.3第~30页7/共.6899页,计量点6.49
由(V1
O
23
)
+
V2
)
算
总
➢算CO总32碱- +度
,H C2OV31-
(V1<V
算
C
O
23
2, pH 8.3~9.5 , (V2-V1)算
, H
由(V1+ CO3- )
V
水分析化学(第一二章)

第二章 水分析测量的质量保证
14:26:54
水质分析程序
1
2
3
4
5
明确分 析目标
采样容 器的选 择和洗 涤、取 样(有 代表性 )
试样的 保存和 预处理
分析方 法的选 择和测 定
分析结 果的计 算和数 据处理 及评价
14:26:54
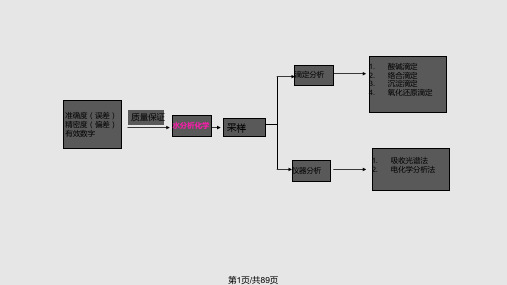
一、水样的采集
水样采集简称取样 1、取样器 见P30图 2、取样量 根据检测内容来确定 3、采样点 布点方法见P29
1.有效数字的意义及位数
实际能测到的数字。在有效数字中, 只有最后一位数是 可疑的,记录测量结果时,只保留一位可疑数据。有效数 字位数由仪器准确度决定,它直接影响测定的相对误差。 分析天平称量质量:0.000x g 滴定管体积: 0.0x mL 容量瓶: 100.0mL, 250.0mL, 50.0mL 吸量管, 移液管: 25.00mL, 10.00mL, 5.00mL,1.00mL pH: 0.0x 单位 吸光度: 0.00x
高的精密度不一定能保证高的准确度。
14:26:54
五、提高分析结果准确度的方法
1.选择合适的分析方法
(1)根据试样的中待测组分的含量选择分析方法。高含量
组分用滴定分析或重量分析法;低含量用仪器分析法。 (2)充分考虑试样中共存组分对测定的干扰,采用适当的 掩蔽或分离方法。 (3)对于痕量组分,分析方法的灵敏度不能满足分析的要
※ 在3600中,一般看成是4位有效数字,但它可能是2
位或3位有效数字,分别写3.6×103,3.60×103或
3.600×103较好。 10008 0.1000 0.0382 54 0.05 3600 43.181 10.98% 1.98 ×10-10 0.0060 2 ×105 100 5位 4位 3位 2位 1位 位数较含糊
14:26:54
水质分析程序
1
2
3
4
5
明确分 析目标
采样容 器的选 择和洗 涤、取 样(有 代表性 )
试样的 保存和 预处理
分析方 法的选 择和测 定
分析结 果的计 算和数 据处理 及评价
14:26:54
一、水样的采集
水样采集简称取样 1、取样器 见P30图 2、取样量 根据检测内容来确定 3、采样点 布点方法见P29
1.有效数字的意义及位数
实际能测到的数字。在有效数字中, 只有最后一位数是 可疑的,记录测量结果时,只保留一位可疑数据。有效数 字位数由仪器准确度决定,它直接影响测定的相对误差。 分析天平称量质量:0.000x g 滴定管体积: 0.0x mL 容量瓶: 100.0mL, 250.0mL, 50.0mL 吸量管, 移液管: 25.00mL, 10.00mL, 5.00mL,1.00mL pH: 0.0x 单位 吸光度: 0.00x
高的精密度不一定能保证高的准确度。
14:26:54
五、提高分析结果准确度的方法
1.选择合适的分析方法
(1)根据试样的中待测组分的含量选择分析方法。高含量
组分用滴定分析或重量分析法;低含量用仪器分析法。 (2)充分考虑试样中共存组分对测定的干扰,采用适当的 掩蔽或分离方法。 (3)对于痕量组分,分析方法的灵敏度不能满足分析的要
※ 在3600中,一般看成是4位有效数字,但它可能是2
位或3位有效数字,分别写3.6×103,3.60×103或
3.600×103较好。 10008 0.1000 0.0382 54 0.05 3600 43.181 10.98% 1.98 ×10-10 0.0060 2 ×105 100 5位 4位 3位 2位 1位 位数较含糊
哈工大环境化学课件水02水体污染废水处理

生物指数法Ⅰ群落特征指数
Shannon-Weaver多样性指数
多样性指数在0 ~ 3.11之间,多年平均值为1.84,大致处于中度污染的状态。其中A断面的多
样性指数最大,多年平均值为2.07,其次是RB断面,平均值为1.86,ET断面最小
年际变化:1998年最大,其次为1997、1999、2000、2001年,呈逐年下降的趋势 季节变化:冬季为最高,其次为春秋两季,最低为夏季 月际变化:1月(2.08)10月(1.96)12月(1.93)9月(1.85)3月(1.84)4月(1.76)6月(1.75)7月(1.53)
生物指数法Ⅰ群落特征指数
s
Shannon-Weaver多样性指数
n n H ' ( i )log2 ( i ) N i 1 N
Margalef 种类丰度指数
Simpson优势度指数 Pielous 种类均匀度指数
d = ( S - 1) / log2N
n D ( i )2 N
J = H′/ log2S
<返回>
我国水中优先控制污染物黑名单
2.2.2 水体污染物的来源和危害
水体污染包括自然污染和人为污染,而后者是主要的
自然污染主要是自然因素所造成,如特殊地质条件使某些地区 有某些或某种化学元素的大量富集,天然植物在腐烂过程中 产生某种毒物,以及降雨淋洗大气和地面后挟带各种物质流 入水体,都会影响该地区的水质。 人为污染是人类生活和生产活动中产生的废、污水对水体的污 染,包括生活污水、工业废水、农田排水和矿山排水等。此 外,废渣和垃圾倾倒在水中或岸边,或堆积在土地上,经降 雨淋洗流入水体,都能造成污染。
原理:
对于未受扰动的群落,绘出的图形是生物量的优势度曲线始终位 于丰度曲线之上,但当群落受到中等程度的污染扰动时,丰度和生物 量曲线接近重合,或出现部分交叉;当环境被严重污染时,丰度曲线位 于生物量曲线之上
Chapter 1 水分析化学英文课件

Example:Two objects were weighed to be 1.6380 g and 0.1637 g, respectively. It is supposed that the true weights for them are 1.6381 g and 0.1636 g. Please give out the corresponding absol ute vales and relative values. E = 1.6380 g – 1.6381 g = -0.0001 g Absolute value: E = 0.1637 g - 0.1636 g = 0.0001 g Er = -0.0001/1.6381×100% = -0.006% Er = 0.0001/0.1638×100% = 0.06%
IV :industrial water, and entrainment water V :agricultrial water, and landscapewater
1.5
Error
Data analysis
Error is the difference between true value and determined value.
During the cycling process, impurities such as heavy metals, toxic organic chemicals, compounds, carbon dioxide, bacterials, humus, protein, sand, algae, and mud can be dissolved and involved in the water.
Uncertainty means the amount by which a measured value deviates from the true value.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[4] EDTA的络合平衡
稳定常数
( 1 :1 ) (逆反应)
稳定常数用途:判断一个络合物的稳定性
EDTA的酸效应 条件稳定常数
[5]金属指示剂
影响金属指示 络合滴定曲线突跃范围 剂的主要因素 金属离子M的初始浓度 金属指示剂(有机络合剂)
金属指示剂的作用原理 解决办法:加掩蔽剂 种类 封闭现象:加入过量的EDTA也不能将MIn中的In置换 出来 的现象 僵化现象:由于生成的显色络合物为胶体或沉淀,使 终点延长或拖后的现象 解决办法 :加 有机溶剂或加热 慢滴,振摇
精确度高,则精密度一定高
准确度低,则精密度一定低
精密度高,而准确度不一定高
[6]标准溶液
基准物质:以直接准确称量,用于配制标准溶 液的一类物质
标准溶液:已知准确浓度的溶液
量浓度 :
滴定度: 1ml标准溶液相当于被测物质的质量( 用Ts/x表示,S-标准溶液,X-待测溶液)
例题与习题:
记住一些常用的摩尔质量 17g/mol 30g/mol 61g/mol
28g/mol
50g/mol
写出碱度计算的正确表达式
例题与习题:
例1:当P>0,M=0时
OH-碱度(mol/L)= ?
OH-碱度(mmol/L)= ?
OH-碱度 例2:已知某酸 =? ,求其共轭碱的PKb
第4章 络合滴定法
[4]碱度的测定
天然水中碱度的种类 :
可构成5种组合形式(假设水中
和
不
共存 ):
碱度和pH的关系:
连续滴定法测水中碱度
测定步骤 概念:酚酞碱度、甲基橙碱度、总碱度 发生的反应: 5种组合的判据 :
[5]碱度计算
首先由P和M的数值判断碱度的组成
确定碱度的表示方法
以mg/L计,以mol/L或mmol/L计,以mgCaO/L或 mgCaCO3/L计
[4]取水样、保存、预处理
取水样
保存
预处理——水样的分离技术
过滤 蒸馏 萃取L-L液萃取:分离水中的有机物 浓缩
富集
[5]分析方法的评价体系
用水和废水水质分析首选GB(国标)方法
准确度:测定值和真空值的接近程度 精密度:测定值之间的接近程度 准确度和精密度之间关系
[3]酸碱指示剂
酸碱指示剂的作用原理 : ,解离平衡常数表达式 讨论
酸碱指示剂的选择 : 可用滴定突跃范围来选择指示剂 酸碱指示剂的分类 :
缓冲溶液
缓冲作用:抵抗少量强酸、强碱或稀释的影响, pH值不变。 pH值决定于缓冲系中共轭酸的Kaθ和缓冲比即[ 共轭碱] [共轭酸]。 同一缓冲系 ,pH值只决定于缓冲比 。[B-] [HB]=1时,则pH = pKaθ。 少量稀释,pH值不变;大量稀释,pH会变化。
EDTA呈现六元酸的特点 ,七种型体存在量的 相对多少取决于溶液的pH值 。 常用乙二胺四乙酸二钠盐(Na2H2Y)来配制 EDTA水溶液,因为H4Y的溶解度小于Na2H2Y
[3]EDTA络合物的特征
络合比1:1 ,为什么
EDTA与无色金属离子生成无色络合物,与有色 金属离子形成络合物颜色会加深
[6]提高络合滴定的选择性
pH值来控制
例1:Ca2+、Mg2+、Fe3+共存,测Fe3+,
掩蔽技术
络合掩蔽
其它应用
例2:测 、 时, 、 干扰,用 掩蔽 沉淀掩敝 其它应 用 例3: 、 共存时,测 , 氧化还原掩蔽 :变更干扰离子的价态 例4:
[7]络合滴定的方式
直接滴定法
要求:络合反应快,生成络合物稳定 应用
返络合滴定
含量分析 ,( ,络合滴定在水质工程学中的应用 Ba2+测定,无合适指示剂
铝盐混凝剂中
)
第5章 沉淀滴定法
知识点 沉淀平衡 影响沉淀平衡的因素 分步沉淀 莫尔法测定水中
[1]沉淀平衡
活度积常数 离子活度系数 溶解积常数
,
条件溶度积常数
,α 为考虑pH,络合剂等外界 因素造成的副反应系数
知识点:
络合反应及特征
金属指示剂
氨羧络合剂
EDTA络合物的特征
提高络合滴定的选 择性
络合滴定的方式
EDTA的络合平衡
[1]络合反应及特征
前提: ①中心离子(金属离子),一定能提供空 的轨道 ②配体:提供孤对电子的化合物 配位键 配位原子 配位数
[2]氨羧络合剂
特征:同时存在氨基和羧基 最常见:EDTA 乙二胺四乙酸(盐),一般定义 EDTA用Y表示
[2]酸碱滴定曲线
强碱滴定强酸与强酸滴定强碱曲线形状相同,位置 相反 滴定剂初始浓度增加(减少)一个数量级,滴定突 跃范围增加(减少)2个pH单位 强碱滴定强酸的突跃范围大于强碱滴定弱酸的突跃 范围 用酸碱指示剂进行强碱滴定弱酸的条件: Csp×Ka≥10-8,(计量点时酸浓度) 通过化学反应改善弱酸或弱碱性,可采用4种强化措 施,络合、金属离子强化、沉淀、氧化还原。
1.测水样某一指标的步骤: 2.如何设计加标回收率实验?
3.如何设计精密度实验?
第3章酸碱滴定法
知识点
酸碱平衡 酸碱滴定曲线 酸碱指示剂 碱度的测定 碱度计算
[1]酸碱平衡
酸、碱 、共轭酸碱对、酸碱反应 酸度和碱度 酸碱强度 酸碱平衡中的组分浓度 共轭酸碱对HB/B-的Ka和Kb关系 拉平效应和区分效应
有机:酚、农药、洗涤剂等
以上污染物都需要水分析方法去定量
分析方法包括
重量分析——称重的办法 化学分析——借助化学反应 仪器分析
用途:残 渣分析
[3]水质指标与水质标准
水质指标
物理指标:不涉及化学反应,参数测定后水
样不发生变化
化学指标 微生物学指标
水质标准:按不同用水目的制定的污染物的量 阈值。除余氯为下界,其他指标均为上界限值, 不可超越
水分析化学
主讲人:崔崇威
第一章 绪论
知识点
水分析化学的地位及作用 水分析化学分析方法的分类 水质指标与水质标准 取水样、保存、预处理
分析方法的评价体系
标准溶液
[2] 水分析化学分析方法的分类
水中污染物包括
无机:金属离子Ca2+、Mg2+ + 重金属离子:
Pb2+、Fe3+、Mn2+、Cd2+、Hg2+等
