紫外光谱详解.ppt
合集下载
紫外光谱教学PPT讲解92页PPT

谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
紫外光谱教学PPT讲解
16、人民应该为法律而战斗,就像为 了城墙 而战斗,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
第二章 紫外吸收光谱(共85张PPT)
max (己烷) =114+5M+nnR环内-10R环外 当苯环上有助色团时,向长波方向移至200 ~ 220nm。
-卤代酮的构象: -卤代环已酮有以下两个构象(A) (竖键)和(B)。 RCOOH及RCOOR的n → *比RCHO 的 小,即紫移*称为 *跃迁 ,实现 *跃迁需要吸收很多能量,约为185 千卡/克分子。
v=频率 用 周/秒(Cps)或赫兹(Hz) E=能量 单位为尔格,电子伏特eV或卡/摩尔
二、紫外光谱的特征
符合朗伯-比尔定律(Lambert-Beer’s Law),这是 吸收光谱的基本定律,用数学公式表示为:
A= ㏒(I0/I)=abc
式中:A:吸光度 I0:入射光强度 I:透射光强度 a:吸光系数 b:吸收池厚度(cm) c:被测物质浓度g/L I0/I:透射比,用T表示
CH3 CH3
N max =227nm( 900)
CH3
CH3Cl CH3OH
max =173nm( 200) max =183nm
3. *跃迁
电子由轨道跃迁到*轨道称→*跃迁,所吸收的能量比n → *小,峰位约在200nm附近,这种跃迁是强吸收, >104
例:CH2 CH2 max =162nm
近紫外区(200~400nm):在此波长范围内,玻璃有吸收,一般用石 英比色器,因此称近紫外区为石英紫外区,近紫外区最为有用,通常
所谓的紫外光谱就是指近紫外区的光谱。
2. 紫外光谱 以波长10~400nm的电磁波照射物质分子,即以紫外光照
射物质分子,由分子的电子能级跃迁而产生的光谱叫紫外光 谱。紫外光谱是电子光谱的一部分,可见光谱也是电子光谱 ,电子光谱是由电子跃迁而产生的吸收光谱的总称。
紫外-可见吸收光谱-ppt

生色团 烯 炔 羧基 酰胺基 羰基 偶氮基 硝基 亚硝基 硝酸酯 溶剂 正庚烷 正庚烷 乙醇 水 正己烷 乙醇 异辛酯 乙醚
二氧杂环己烷
/nm 177 178 204 214 186 339,665 280 300,665 270
max
13000 10000 41 60 1000 150000 22 100 12
(2)空间阻碍使共轭体系破坏,max蓝移, max减小。
表 表4.5 2-4 - 及 ’ - 位有取代基的二苯乙烯化合物的紫外光谱 R H H CH 3 CH 3 C2H5 R’ H CH 3 CH 3 C2H5 C2H5 max 294 272 243.5 240 237.5
max
9
2.2 紫外-可见光谱的产生
通常由最高占有分子轨道中的一个电子在吸收适当波长的 辐射能量后,跃迁到最低未占有分子轨道,产生紫外-可见吸 收光谱。
在电子跃迁过程中吸收光的频率(υ )取决于分子的能级差:
式中:h——普朗克常数,6.626×10-34J· s; c—— 光速,2.9979×10nm· s-1;
2.n→σ *跃迁
实现这类跃迁所需要的能量较高,其吸收光谱在远紫外区和近紫外区, 杂原子如氧、氮、硫及卤素等均含有不成键n电子。含杂原子的化合物可以 产 生 n→σ * 跃 迁 。 如 甲 醇 ( 汽 态 )λ max=183nm , ε =150 ; 三 甲 胺 ( 汽 态)λ max=227nm,ε =900;碘甲烷(己烷中) λ max=258nm,ε =380。
8
(三)吸收池 用于盛放分析试样,一般有石英和玻璃材料两 种。石英池适用于可见光区及紫外光区,玻璃吸收池只能用于 可见光区。为减少光的损失,吸收池的光学面必须完全垂直于 光束方向。 (四)检测器 检测信号、测量单色光透过溶液后光强度变化。 常用的检测器有光电池、光电管和光电倍增管等。硒光电 池对光的敏感范围为300~800nm,能产生可直接推动检流计的 光电流,但由于容易出现疲劳效应而只能用于低档的分光光度 计中;光电管在紫外-可见分光光度计上应用较为广泛;光电倍 增管是检测微弱光最常用的光电元件,它的 灵敏度比一般的光电管要高200倍,对光谱的精细结构有较好的 分辨能力。 (五)信号指示系统 放大信号并以适当方式指示或记录下来。 常用的信号指示装置有直读检流计、电位调节指零装置以 及数字显示或自动记录装置等。
二氧杂环己烷
/nm 177 178 204 214 186 339,665 280 300,665 270
max
13000 10000 41 60 1000 150000 22 100 12
(2)空间阻碍使共轭体系破坏,max蓝移, max减小。
表 表4.5 2-4 - 及 ’ - 位有取代基的二苯乙烯化合物的紫外光谱 R H H CH 3 CH 3 C2H5 R’ H CH 3 CH 3 C2H5 C2H5 max 294 272 243.5 240 237.5
max
9
2.2 紫外-可见光谱的产生
通常由最高占有分子轨道中的一个电子在吸收适当波长的 辐射能量后,跃迁到最低未占有分子轨道,产生紫外-可见吸 收光谱。
在电子跃迁过程中吸收光的频率(υ )取决于分子的能级差:
式中:h——普朗克常数,6.626×10-34J· s; c—— 光速,2.9979×10nm· s-1;
2.n→σ *跃迁
实现这类跃迁所需要的能量较高,其吸收光谱在远紫外区和近紫外区, 杂原子如氧、氮、硫及卤素等均含有不成键n电子。含杂原子的化合物可以 产 生 n→σ * 跃 迁 。 如 甲 醇 ( 汽 态 )λ max=183nm , ε =150 ; 三 甲 胺 ( 汽 态)λ max=227nm,ε =900;碘甲烷(己烷中) λ max=258nm,ε =380。
8
(三)吸收池 用于盛放分析试样,一般有石英和玻璃材料两 种。石英池适用于可见光区及紫外光区,玻璃吸收池只能用于 可见光区。为减少光的损失,吸收池的光学面必须完全垂直于 光束方向。 (四)检测器 检测信号、测量单色光透过溶液后光强度变化。 常用的检测器有光电池、光电管和光电倍增管等。硒光电 池对光的敏感范围为300~800nm,能产生可直接推动检流计的 光电流,但由于容易出现疲劳效应而只能用于低档的分光光度 计中;光电管在紫外-可见分光光度计上应用较为广泛;光电倍 增管是检测微弱光最常用的光电元件,它的 灵敏度比一般的光电管要高200倍,对光谱的精细结构有较好的 分辨能力。 (五)信号指示系统 放大信号并以适当方式指示或记录下来。 常用的信号指示装置有直读检流计、电位调节指零装置以 及数字显示或自动记录装置等。
紫外光谱详解

有机化合物有三种电子:σ电子、p电子 和 n电子
精选版课件ppt
12
电子能级和跃迁示意图
返回
各种跃迁所所需能量(ΔE)的大小次序为:
ss spp p * n * * n *
精选版课件ppt
13
紫外光谱的谱带类型
K带(共轭带):共轭系统pp*跃迁产生,特征是吸 收强度大,log > 4
5个烷基取代
+5×5
3个环外双键
+5×3
延长一个双键
+30×2
计算值
353 nm(355 精nm选版)课件ppt
AcO
42
共轭双烯
共轭双烯基本值
4个环残基取代 1个环外双键 计算值
214
+5×3 +5
234 nm(235 nm)
返回
精选版课件ppt
43
Some examples that illustrate these rules
-NO2, -CO等。 产生p电子的永久性转移,lmax红移。p电子流动性增 加,吸收强度增加。
给电子基与吸电子基同时存在:产生分子内电荷转移
吸收,lmax红移, 增加。 max 精选版课件ppt
返回
26
仪器装置 组成主要包括光源、分光系统、吸收池、 检测系统和记录系统等五个部分
返回
精选版课件ppt
C 2H 5
t C4H 9
CH3 CH3
K带εmax 8900
6070
5300
640
精选版课件ppt
22
跨环效应
λmax εmax
O
300.5nm 292
O
280nm ~150
精选版课件ppt
12
电子能级和跃迁示意图
返回
各种跃迁所所需能量(ΔE)的大小次序为:
ss spp p * n * * n *
精选版课件ppt
13
紫外光谱的谱带类型
K带(共轭带):共轭系统pp*跃迁产生,特征是吸 收强度大,log > 4
5个烷基取代
+5×5
3个环外双键
+5×3
延长一个双键
+30×2
计算值
353 nm(355 精nm选版)课件ppt
AcO
42
共轭双烯
共轭双烯基本值
4个环残基取代 1个环外双键 计算值
214
+5×3 +5
234 nm(235 nm)
返回
精选版课件ppt
43
Some examples that illustrate these rules
-NO2, -CO等。 产生p电子的永久性转移,lmax红移。p电子流动性增 加,吸收强度增加。
给电子基与吸电子基同时存在:产生分子内电荷转移
吸收,lmax红移, 增加。 max 精选版课件ppt
返回
26
仪器装置 组成主要包括光源、分光系统、吸收池、 检测系统和记录系统等五个部分
返回
精选版课件ppt
C 2H 5
t C4H 9
CH3 CH3
K带εmax 8900
6070
5300
640
精选版课件ppt
22
跨环效应
λmax εmax
O
300.5nm 292
O
280nm ~150
紫外吸收光谱分析资料讲解78页PPT

侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
紫外吸收光谱分析资料讲解
16、人民应该为法律而战斗,就像为 了城墙 而战斗 一样。 ——赫 拉克利 特 17、人类对于不公正的行为加以指责 ,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
紫外吸收光谱分析资料讲解
16、人民应该为法律而战斗,就像为 了城墙 而战斗 一样。 ——赫 拉克利 特 17、人类对于不公正的行为加以指责 ,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
第1章 紫外光谱
五、电子跃迁的类型
有机化合物中的价电子根据在分子中成键电子 的种类不同分为3种:①形成单键的ζ电子;②形成 不饱和键的π电子;③氧、氮、硫、卤素等杂原子 上的未成键的n电子。
分子中电子跃迁的方式与化学键的性能有关, 各种电子能级的能量高低顺序:ζ<π<n<π*<ζ*。
当外层电子吸收紫外或可见辐射后,从基态向激发态
(2) 近紫外光区: 200-400nm。芳香族化合物或 具有共轭体系的物质在此区域有吸收(紫外光谱)。 (3) 可见光区: 400-800nm。有色物质在此区域 有吸收。
400nm-紫-蓝-青-绿-黄-橙-红-800nm
波长
200
400
800 3200(nm)
X-射线
紫外 可见
红外
微波
无线电
远/真空紫外
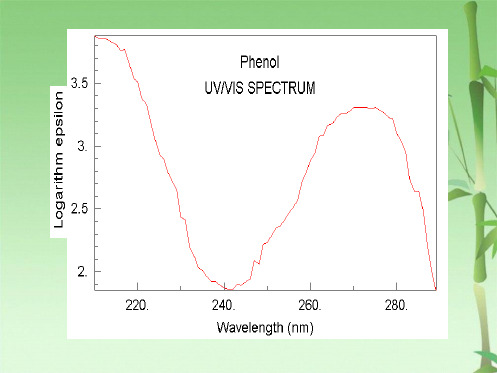
酚酞:
1.2 紫外光谱仪
紫外光谱仪一般又称为紫外分光光度计,其组 成主要包括光源、分光系统、吸收池、检测系统 和记录系统五部分。 1、光源 应能提供光谱区内所有波长的连续辐射光,强度 足够大且稳定。 紫外区:H 灯或 D 灯。160-390nm。 D 灯的辐射强度大于 H 灯,寿命长。 可见光区:钨灯或卤钨灯。350-800nm。
(3)红移:由于取代基或溶剂的影响使最大吸收峰向长波 方向移动的现象称为红移。 (4)蓝移:由于取代基或溶剂的影响使最大吸收峰向短波 方向移动的现象称为蓝移。
(5)增色效应:或称浓色效应。使吸收带的吸收强度增加 的效应,反之称为减色效应或浅色效应。
(6)强带:在紫外光谱中,凡摩尔吸收系数大于104的吸收 带称为强带。产生这种吸收带的电子跃迁往往是允许跃迁。 (7)弱带:凡摩尔吸收系数小于1000的吸收带称为弱带, 禁阻跃迁。
三、 溶剂的选择
第1节紫外光谱基础重要优秀PPT

F< CH3 < Cl < Br < OH < SH < OCH3 < NH2 < NHR < NR2 < O-
4、红移与蓝移
有机化合物的吸收谱带常常因 引入取代基或改变溶剂使最大
吸收波长λmax和吸收强度
发生变化:
λmax向长波方向移动称为红移,
向短波方向移动称为蓝移 。
吸收强度即摩尔吸光系数ε增大
λmax /nm 254 270
125
172
204
258
特征:基团中含有杂原子,且杂原子上有未成键的n电子。
还有:-NH2,-NR2,-OH,-OR,,-Cl,-COOH 等均为助色基团。
问题:为何有这种现象?
因为当助色基团连接到发色基团上时,n电子与π电子相互作 用,相当于增大了共轭体系,降低了电子跃迁所需的能量,使 发色基团的λmax向长波方向位移,且有的吸收强度增大,各助 色基团的助色效应强弱大致如下,效应越强,Δλmax越大。
3、助色基团
某些原子或原子团虽然其本身在200—400nm波长范围内没有吸收, 但是当它与发色基团相连时,可使发色基团产生的λmax 向长波方向 移动,并使吸收强度(ε)增强,这些原子或原子团被称为助色基团。 如:
化合物 C6H6 C6H5-OH CH3-H CH3-Cl CH3-Br CH3-I
σ电子 > π电子 > n电子 (渐松) 如:CH4: λmax =125nm CH3CH3 : λmax =135nm
电子
H
..
CO
H 电子
n电子
2 分子轨道的初步概念
➢ 分子轨道理论认为:当两个氢(H)原子靠近时,H的 两个1S原子轨道可组成两个分子轨道。一个叫做σ1S成 键轨道,其能量比1S原子轨道低,另一个叫做σ1S*反键 轨道,其能量比1S原子轨道高,两个原子轨道形成两个 分子轨道。
4、红移与蓝移
有机化合物的吸收谱带常常因 引入取代基或改变溶剂使最大
吸收波长λmax和吸收强度
发生变化:
λmax向长波方向移动称为红移,
向短波方向移动称为蓝移 。
吸收强度即摩尔吸光系数ε增大
λmax /nm 254 270
125
172
204
258
特征:基团中含有杂原子,且杂原子上有未成键的n电子。
还有:-NH2,-NR2,-OH,-OR,,-Cl,-COOH 等均为助色基团。
问题:为何有这种现象?
因为当助色基团连接到发色基团上时,n电子与π电子相互作 用,相当于增大了共轭体系,降低了电子跃迁所需的能量,使 发色基团的λmax向长波方向位移,且有的吸收强度增大,各助 色基团的助色效应强弱大致如下,效应越强,Δλmax越大。
3、助色基团
某些原子或原子团虽然其本身在200—400nm波长范围内没有吸收, 但是当它与发色基团相连时,可使发色基团产生的λmax 向长波方向 移动,并使吸收强度(ε)增强,这些原子或原子团被称为助色基团。 如:
化合物 C6H6 C6H5-OH CH3-H CH3-Cl CH3-Br CH3-I
σ电子 > π电子 > n电子 (渐松) 如:CH4: λmax =125nm CH3CH3 : λmax =135nm
电子
H
..
CO
H 电子
n电子
2 分子轨道的初步概念
➢ 分子轨道理论认为:当两个氢(H)原子靠近时,H的 两个1S原子轨道可组成两个分子轨道。一个叫做σ1S成 键轨道,其能量比1S原子轨道低,另一个叫做σ1S*反键 轨道,其能量比1S原子轨道高,两个原子轨道形成两个 分子轨道。
课件紫外可见吸收光谱(共83张PPT)

T I I0
I 为透射光的强度
I0 为入射光的强度
A lgI0
lgT
I
1760年朗伯(Lambert)阐明了光的吸收程度和吸收层厚度的 关系,即 A∝b
1852年比耳(Beer)又提出了光的吸收程度和吸收物浓度之间 也具有类似的关系,即 A∝ c
二者的结合称为朗伯-比尔定律,其数学表达式为:
AlgTkbc
Abc
摩尔吸光系数ε的讨论:
(1)吸收物质在一定波长和溶剂条件下的特征常数; (2)不随浓度c和光程长度b的改变而改变。在温度和波长等条件一定时 ,ε仅与吸收物质本身的性质有关,与待测物浓度无关;
(3)同一吸收物质在不同波长下的ε值是不同的。在最大吸收波长λmax 处的摩尔吸光系数,常以εmax表示。εmax表明了该吸收物质最大限度的
➢ 含有杂原子的不饱和化合物可以发生n→p*跃迁, 如含有羰基、硝基、亚硝基等
➢ n→p*跃迁所产生的吸收带称为R带
常用概念
➢ 发色团(或生色团):具有π电子的不饱和基团,即 可在紫外-可见光区产生吸收的官能团。如C=C、 C≡C、 C=O、-NO2等
➢ 助色团:有一些含有n电子的基团(如-OH、-NH2、OR、-SH、-Cl、-Br、-I等),它们本身没有生色功能
第二节
紫外-可见分光 光度计
UV-Vis spectrometer
一、基本组成
二、分光光度计的 类型
一、基本组成
1. 光源
➢ 要求:提供能量,激发被测物质分子使之产生价电子的跃迁, 从而产生电子光谱;在整个紫外光区或可见光谱区可以发射连续光 谱;具有足够的辐射强度、较好的稳定性、较长的使用寿命。
2. 有机化合物的紫外可见吸收光谱
