第一节金属的性质和利用课件1
金属的性质与利用
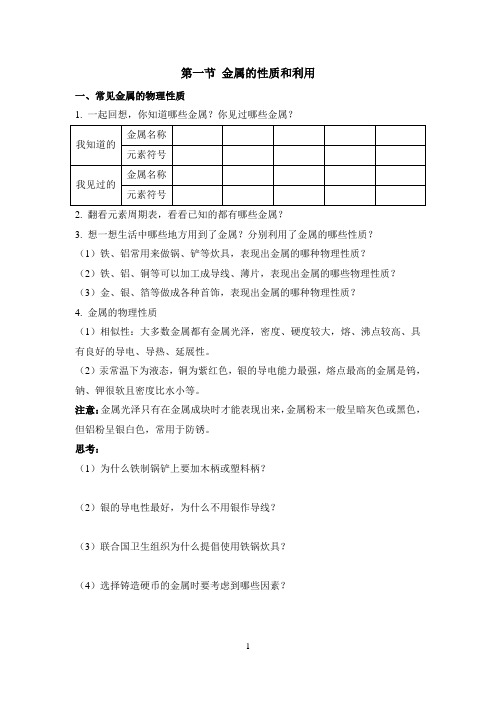
第一节金属的性质和利用一、常见金属的物理性质1. 一起回想,你知道哪些金属?你见过哪些金属?2. 翻看元素周期表,看看已知的都有哪些金属?3. 想一想生活中哪些地方用到了金属?分别利用了金属的哪些性质?(1)铁、铝常用来做锅、铲等炊具,表现出金属的哪种物理性质?(2)铁、铝、铜等可以加工成导线、薄片,表现出金属的哪些物理性质?(3)金、银、箔等做成各种首饰,表现出金属的哪种物理性质?4. 金属的物理性质(1)相似性:大多数金属都有金属光泽,密度、硬度较大,熔、沸点较高、具有良好的导电、导热、延展性。
(2)汞常温下为液态,铜为紫红色,银的导电能力最强,熔点最高的金属是钨,钠、钾很软且密度比水小等。
注意:金属光泽只有在金属成块时才能表现出来,金属粉末一般呈暗灰色或黑色,但铝粉呈银白色,常用于防锈。
思考:(1)为什么铁制锅铲上要加木柄或塑料柄?(2)银的导电性最好,为什么不用银作导线?(3)联合国卫生组织为什么提倡使用铁锅炊具?(4)选择铸造硬币的金属时要考虑到哪些因素?(5)为什么制造菜刀、镰刀、锤子时用铁不用铅?(6)为什么用钨丝做白炽灯的灯丝?二、金属的化学性质根据你已有的知识,推测金属有哪些化学性质1. 金属与氧气反应许多金属都能和氧气反应,但是反应的难易程度和剧烈程度是不同的,如镁、铝等在常温下就能与氧气发生反应;铁、铜在常温下很难与氧气发生反应,但在点燃或加热时能与氧气反应;金在高温下也不和氧气发生反应。
根据上述实验说明铁、铝、镁、铜、金的活泼性。
“真金不怕火炼”说明了金的什么性质?2. 金属与酸的反应许多金属还能和盐酸或稀硫酸反应,生成氢气和金属化合物。
常见的金属与(稀)酸反应的现象及反应的化学方程式如下:(1)铜与稀盐酸、稀硫酸不反应;镁、铝、锌、铁都能与盐酸、稀硫酸反应,生成氢气和相应的化合物。
(2)镁、铝、锌、铁和稀盐酸、稀硫酸反应的剧烈程度不同,说明金属的活动性有差异。
(3)金属的活动性顺序:人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;排在氢之前的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
《第一节金属的性质和利用》设计课件

六. 教学程序
重点: 通过三个探究过程: 1.金属与氧气反应的难易和剧烈程度 2.金属与酸反应的剧烈程度 3.金属与盐溶液的置换。
采用实验——探究的模式,达到突破难点的目的。
六. 教学程序
1 .引入新课 通过课前布置学生收集金属的有关材料,利 用课堂进行交流,从而培养学生收集、整理信 息的能力和合作交流能力,为本节课的教学作 好铺垫,起到“抛砖引玉”的作用。 以课前准备中铁和铜的简单区分直接引入, 同时以此为整节课的主线,展开对金属性质的 研究。
七.交流讨论、归纳小结
【小结反思】与【课堂巩固】:
谈谈这节课你有什么收获?还有什么疑问? (设计意图)学生---成为课堂的主体,发挥 学生的主观能动性,在团结协作中获得成功, 增强学好化学的自信心。通过反思,总结自 身获得的经验和不足,增强学生自我教育的 能力,促进学生把知识转化为自己的内在聪 明,启发学生反思有助于学生的自我反馈、 自我调整、自我完善,使学生有效地提高学 习效率。
三. 教学重难点
教学重点:常见金属的化学
性质和置换反应的基本概念。
教学难点:通过比较学习研
究不同金属化学性质的差异。
四. 教法分析
本节课主要采用实验探究 法为主线,结合使用启发法、 比较法、归纳分析法以及多 媒体辅助教学法。
五. 学情分析和学法指导
学情分析:
1. 学生前面学习了氧气的性质,其中涉及到了 几种金属与氧气反应的有关知识,但是没有形 成知识系统。对金属的性质还不是很清楚。 2.本节课知识比较系统,而且是从实验操作和 实验现象去探索金属化学性质,对于学生来说 还是有一定的难度。 3.学生的总结和归纳能力还是有限,体会金属 的活动性时,这也是给学生提出了较高的要求。
七.交流讨论、归纳小结
金属的化学性质ppt课件

现象: 铝箔熔化,表面失去光泽,熔
化的铝并不滴落,好象有一层膜兜着
为什么
因为铝表面有一层氧化膜保护了铝。构 成薄膜的氧化铝(Al2O3)的熔点很高,没有熔 化,包在外面使熔化的液态铝不会滴落下来
点燃铝箔
结 论:铝很活泼,常温下能与空气中的氧气反应,
生成一层致密的氧化膜,起保护的作用。
2Al2O3
常温或加热
实验装置设计思路:水蒸气 的产生装置→水蒸气与铁粉的反 应装置→气体产物检验装置
实验装置
探究活动3:铝的两2Al + 6HCl == 2AlCl3 + 3H2
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、 碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用 来蒸煮或长时间存放酸性、碱性或咸的食物。
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,
发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
2. 下列关于“焰色反应”的理解正确的是 C (
)
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.只有某些金属或其化合物才有焰色反应
D.只有金属离子才有焰色反应
缓慢氧化:4Na+O2=2Na2O
如果加热,钠又会发生什么变化呢? 常温:4Na+O2=2Na2O
加热:2Na+O2 △ Na2O2
钠受热后,与氧气剧烈反应,钠先融化后燃烧,火焰呈黄 色,生成一种淡黄色的固体——过氧化钠(Na2O2)。
SUCCESS
THANK YOU
人教版九年级下册化学 第八单元 金属和金属材料 金属资源的利用和保护(第1课时) 课件

实验室模拟炼铁步骤
检查装置气密性
向硬质玻璃管中装入氧化铁
通入纯净的一氧化碳
点燃酒精喷灯加热固体
熄灭酒喷灯
继续通CO直至装置冷却
2. 澄清的石灰水变浑浊
1. 红棕色的固体逐渐变成黑色
现 象
如何检验生成的黑色固体中含有铁?
取样,加入稀盐酸中有气泡产生
高炉炼铁
1. 工业炼铁的原料是什么?
x =
2×56× 1000t×80% 160×96%
=583 t
答:理论上可以炼出含铁96%的生铁583吨。
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
160 2×56 1000t×80% x·96%
主要成分 CuFeS2
主要成分 Cu2S
主要成分 Al2O3
含铁量70%
赤铁矿
主要成分 Fe2O3
含铁量72.4%
磁铁矿
主要成分 Fe3O4
含铁量48.3%
菱铁矿
主要成分 FeCO3
含铁量46.7%
黄铁矿
主要成分 FeS2
以下哪种矿物不适宜用来炼铁?
含铁量
产物是否环保
铁的几种矿物:
选择依据:
高温
4
3
4
淳元素原创 盗版必究
装置末端酒精灯的作用是什么?
点燃尾气,防止有毒的CO污染空气
澄清石灰水的作用是什么?
检验并吸收CO2,防止尾气无法被点燃
3.
4.
5.
6.
1.
2.
通入纯净的一氧化碳
点燃酒精喷灯加热固体
熄灭酒喷灯
检查装置气密性
向硬质玻璃管中装入氧化铁
金属的物理性质及合金ppt课件

目前世界年产量最高的金属── 铁
导电、导热性最好的金属── 银 熔点最高的金属── 钨
熔点最低的金属── 汞
延性最好的金属──铂
展性最好的金属──金
精选ppt课件2021
11
金属的用途与金属性质的关系
性质
用途
有金属光泽
作反光体;
比较硬 有延展性
做开矿钻头; 做薄板;
有导电性
做导电线;
有导热性
作加热工具设备 精选ppt课件2021
精选ppt课件2021
17
常见合金的主要成分、性能和用途
合金 主要成分
性能
用途
不锈钢 铁具、容 器、反应釜
黄铜 焊锡
铜、锌 锡、铅
强度高、可塑性好、易加
工、耐腐蚀
机器零件、仪表、日用品
熔点低
焊接金属
硬铝 铝、铜、镁、硅 强度和硬度好
18K黄金 金、银、铜 光泽好、耐磨、易加工
精选ppt课件2021
7
大多数金属为银白色 铜(紫红色)金(黄色) 大多数金属为固体 汞(液态) 大多数金属有光泽 大多数金属能导电导热 大多数金属熔沸点高 大多数金属有延展性
精选ppt课件2021
8
金属与非金属物理性质的比较
物理性质
金属
非金属
状态
在常温下,除 在常温下,有 汞是液体外,其 固、液、气三态 余都是固体
4、为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样?
精选ppt课件2021
16
二、合金
1、什么叫合金:
由一种金属跟其他一种或几种几种金 属(或 金属跟非金属)一起熔合而成的具有金属特 性的物质。
2、合金的性能
(1)合金的性能随组成的改变而发生改变
第一节-金属的化学性质公开课一等奖优质课大赛微课获奖课件

第3页
[探究试验2] :给钠加热
现象
钠先熔化成银白色小球后燃烧,燃烧时火 焰呈黄色,最后身成固体呈淡黄色。 钠在空 气中燃烧产物颜色为淡黄色,阐明不是先前看 到白色(Na2O)
在空气中燃烧 2Na + O2== Na2O2 (淡黄色)
第4页
1、钠物理性质
金属钠含有银白色金属光泽,质软、熔点低。
用铝锅来煮饭呢?” 4Al+3O2 == 2Al2O3
第8页
教授提醒:尽也许不要使用铝制餐具,因为铝在 人体内积累过多会引发智力下降、记忆力衰退和 老年痴呆。
第9页
在生活中有这样一个现象: 苹果、梨子用铁刀切了以后, 表面会变黑。 请同窗们想一想这是为何呢?
这是由于苹果、梨子等各种水果细胞 里,都含有鞣酸,鞣酸能和铁反应,生 成黑色鞣酸铁。
第1页
第2页
第一节 金属化学性质
[探究试验1] :
取一小块钠,用滤纸吸干表面 煤油后,用
刀切去一端外皮,然后切一块绿豆般大小钠。 观测金属钠颜色。
观测现象: 取出金属钠表面有一灰黄色层, 切开后切口处露出银白色光泽;切 口在空气中露置一会儿,会逐步变暗。
保留在石蜡油 或煤油中,以 隔绝空气。
4Na +O2 == 2Na2O
现请你设计试验方案判别真假黄金。
B: “酸菜鲜鱼汤”是某家饭店招牌菜,店老板反应 盛汤铝锅很不耐用,没用多久锅底就漏洞了。请你分 析一下这主要是为何?
第14页
反思小结
①化学性质
②你有哪些收获或疑 惑地方?
第15页
家庭小试验: 搜集几种金属,取少许分别放
入几种小玻璃杯中,然后向各个玻 璃杯中加入一些醋精(主要成份是 醋酸),仔细观测发生现象。试依 据现象判断这几种金属活动性差别。
金属的性质和利用(1)

[投影]展示各种金属材料的应用
[议一议] P115联想与启示
[实验探究]铁丝,铜丝,镁条,铝片的物理性质。
[小结]金属的主要物理性质:具有金属光泽,能导电、导热,有较好的延展性等。
[交流讨论]
1.银的导电性比铜好,为什么电线一般用铜制而不用银制?
A.氧B.铁C.镁D.铝
2.关于铁的物理性质的下列叙述中不正确的是(A)
A.纯铁是黑色的B.铁具有延展性
C.铁能被磁化D.铁导电性比铝弱
3.铝被轧成铂箔是利用了铝的( C )
A.导热性B.导电性C.延展性D.机械强度大
板书:第一节金属与矿物
一、金属的物理性质
1、金属的主要物理性质:具有金属光泽,能导电、导热,有较好的延展性等。
教学课题
金属的性质和利用(1)
教学模式:
第课时共课时
二ቤተ መጻሕፍቲ ባይዱ备课
教学目标
1.认识金属材料在生产、生活和社会发展中的重要作用。
2.了解金属的主要物理性质;学生能通过类比推知多数金属的共性。
3.知道金属矿物在自然界中的存在形态。
重点难点
【教学重点】1.了解金属的主要物理性质。
2.知道金属矿物在自然界的存在形态。
2.为什么菜刀、镰刀、锤子用铁制而不用铅制?
3.为什么有的铁制品如水龙头等要镀铬?
4.联合国为什么推荐使用中国的铁锅作炊具?
[投影]一些金属矿物
[小结]
1.铁矿石:赤铁矿、磁铁矿、菱铁矿、黄铁矿;
2.铜矿物:孔雀石、黄铜矿、赤铜矿、斑铜矿;
3.铝矿物:铝土矿、明矾石
[练习与实践]
1.地壳中含量最多的金属元素是(D)
九年级化学人教版下册《金属的化学性质(第1课时金属与氧气、盐酸、稀硫酸的反应)》课件

水的物质氯化亚铁而被人体吸收,从而起到补血的作用,
Fe + 2HCl ==== FeCl2 + H2↑
其中有关反应的化学方程式为________________________。
13. 某实验小组为了探究影响金属与酸反应快慢的因素,进行了
下列三组实验活动。
实验序号
实验过程
实验现象
1
等质量的镁粉和铁粉分别与5%盐酸反应
_________
2
等质量的铁粉和铁片分别与15%盐酸反应
铁粉产生气体较快
3
等质量的铁片分别与5 %盐酸和15%盐酸
反应
15 %盐酸产生气体较快
(1)实验1的实验现象为___________________。
镁粉产生气体较快
(2)实验2的现象证明___________________________。
接触面积越大,反应越剧烈
(3)实验_________探究的问题是浓度对金属与酸反应速率的
3
影响。
实验序号
实验过程
实验现象
1
等质量的镁粉和铁粉分别与5%盐酸反应
_________
2
等质量的铁粉和铁片分别与15%盐酸反应
铁粉产生气体较快
3
等质量的铁片分别与5 %盐酸和15%盐酸反应
15 %盐酸产生气体较快
行两两反应可写出的化学方程式有5个
5. 下列有关置换反应的说法,不正确的是( C )
A. 有单质参加或单质生成的反应不一定属于置换反应
B. 置换反应与化合反应、分解反应是三种并列的基本反应类型
C. 在置换反应中各元素的化合价都发生变化
D. 在金属与酸进行的置换反应中,作为反应物的金属单质化合
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)装置: (4)收集:
固液不加热型 ①排水法 ②向下排空气法
(5)步骤 ①按照要求连 接装置。
②检查 气密性。
③装 药品:先装固体,后装液体。 ④开始反应,并收集一小试管氢气,进行验 纯(任何 可燃性气体,在做性质实验之前务必进行验纯)。 ⑤用排水法或向下排空气法收 集气体,盖上玻璃片铁制而不用铅制?
铁的硬度大,铝的硬 度小,且有毒。
6、为什么灯泡里的灯丝用钨丝?
钨熔点高,不易熔 断。
探究金属的化学性质
根据你以前所学的知识(如:镁在空气中燃烧、铁
丝在氧气中燃烧的实验)及你的生活经验,请大胆猜测
金属可能有哪些化学性质?
常见金属的化学性质
1、金属与氧气反应—化合反应
合金钢
铜合金
保险丝(武得合金)
铝合金窗
铱铂合金笔
钛合金与人造骨
●
1、取一段保险丝,试试能不能用手 把它弯曲,是不是很容易被折断。 2、某种保险丝是用武得合金制成的,熔点为:69℃。 其组成金属及其熔点分别为:
差异性:汞常温下呈液态,铜为紫红色,银的导电能
力最强,熔点最高的金属是钨等。
金属的物理性质
金属光泽
有些金属粉末细小到一定
Fe 程度时,吸收可 见光后辐射不出去, 所以金属粉末一般 Cu 呈暗灰色或黑色。
防止烫手。因为铁具有良好 的导热性,而木柄或塑料的 导热性较差,这样就可以防 1、为何铁制锅铲需要加上木柄或塑料柄? 止手拿锅铲时被烫伤。 因为银较稀少,价 较多,价格便宜。
早在春秋战国时期,我国就开始生产和使用铁器。
新中国成立以后,我国的钢铁工业得到 了飞跃的发展。 1994年钢产量只有15.8万吨,居世界26位; 1996年,我国的钢铁产量首次特破1亿吨
居世界前列;
2002年,我国的钢产 量为18224.89万吨,连 续多年保持世界第一
为纪念1996年中国钢产量突破1亿吨而发行
点燃
⑵还原性 H2 + CuO ====
△
△
Cu
+
H2O + 3H2O
3H2 + Fe2O3
====
2Fe
3、氢气的用途 ⑴作燃料 优点: 热值高;原料来源广; 无污染;可循环利用。 存在问题: 如何大量、廉价制取; 如何安全运输、贮存。 ⑵冶金
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au 金属活动性由强逐渐减弱 (1)在金属活动性顺序里,金属的位置越靠前,它的活 动性就越强。
2、银的导电性比铜好,为什么不用银制造电线、电缆? 格昂贵,而铜相对 3、联合国卫生组织为什么推荐使用中国的铁锅炊具?
铁锅做炊具,可以补充 人体所需的铁元素,防 止缺铁性贫血。
4、选择铸造硬币的金属材料需要考虑哪些因素?
需要考虑价格、硬度、无毒、耐磨、
耐腐蚀、色泽美观、质轻、易加工、 性质稳定、价廉、资源丰富等因素。
强调:铁跟稀盐酸、稀硫酸反应后显+2价。
观察上述反应的化学方程式,分析这些反应有什么共同特点?
讨论与分析
从反应物和生成物的物质类别的角度分析,有如下特点:
Mg Fe
Fe 单质
+ +
+
2HCl H2SO4
CuSO4 化合物
= =
=
H2 ↑ + H2 ↑ +
Cu 单质 +
MgCl2 FeSO4
FeSO4 化合物
第5 章
金属冶炼与利用
第一节 金属的性质和利用(1)
伦 敦 奥 运 会 的 金 牌 味 道 真 不 错 哦 !
这 些 是 什 么 ?
好炫啊!
好 壮 观 啊!
真 气 魄 !
其实我们知道很多
• 你知道哪些金属?见过哪些金属?说出它们的名称 和元素符号,完成课本P.114的表5-1 。看看谁知道
(2)在金属活动性顺序里,位于氢前面的金属能置换出
盐酸、稀硫酸中的氢元素。 (3)在金属活动性顺序里,位于前面的金属能把位于其 后面的金属从它们盐溶液中置换出来。(不适用于K、 Ca、Na)
知 识 结 构: 金属的化学性质
一. 金属与氧气的反应 4Al+3O2=2Al2O3 2Mg+O2=2MgO 3Fe+2 O2 点燃 Fe3 O4
钢和生铁是由铁、碳等
元素形成的合金
通常所说的“金属材料”,既包 括各种纯金属,也包括各种合金
“多 生 殊 纯 新多 产 要 金 型的 实 求 属 金具 践 。 很 属有 中 为 难 特制此满 合殊 造 , 足 金性 出 人 各 ”能 许 们 种 许在特
—
生铁和钢的比较:都是铁的合金。属混合物,主要成分为铁。
金属在生活、生产中非常广泛的应用。 不同的用途需要不同性能的金属。 如:做飞机机翼的金属,需要坚硬 而质轻; 用于制造切割工具的金属,需要有 很大的硬度 制造化工生产设备的金属要耐腐蚀 等等
制造电灯丝的 金属熔点要高。
制造保险丝的 金属熔点要低
是由一种金属跟其他金属(或非 金属)熔合形成的有金属特性的物质。 如:人类历史上使用最早的青铜是 由铜、锡等元素形成的合金 世界上最常见、应用很广泛的
生铁 碳的质量分数
其他元素 机械性能 机械加工
钢
2%~4.3%
较多硅、锰, 少量硫、磷 硬而脆 可铸,不可锻 制铁锅、暖气片机 床底座等
0.03%~2% 少量硅、锰, 几乎不含硫、磷 硬而韧,延展性好 可铸、可锻、 可压延 制造机械、交通 工具、武器等
用
途
钢铁是非常重要的金属材料。钢铁的生产和使用是人类文明 和社会进步的一个重要标志
二.金属与稀盐酸、稀硫酸反应 ( 置换反应 )
Fe + 2HCl == FeCl2 + H2 ↑ Fe + H2 SO4 == Fe SO4 + H2 ↑ Zn + 2HCl == ZnCl2 + H2 ↑ Zn + H2 SO4 == Zn SO4 + H2 ↑ Mg + 2HCl == MgCl2 + H2 ↑ Mg + H2 SO4 == Mg SO4 + H2 ↑
点燃
再观察: 生成物的角度分析,有何共同特点? 均有氢气生成。 那么这些原理均可用于制氢气吗?
拓展:氢气的制法
氢气的实验室制法 (1)药品:锌和稀硫酸(或稀盐酸) (2)原理: Zn+H2SO4=ZnSO4+H2↑
Zn+2HCl=ZnCl2+H2↑
思考: 为何不用镁或铁等来和酸反应制取氢气? ——镁和酸反应速度太快,而铁的反应速度又太慢, 不便于操作。
的最多!
金属元素的名称和符号
我知道的
金属 名称 元素 符号
金属 名称 元素 符号
钠 Na
镁
Mg
钾
K
锌
Zn
钙 ……
Ca ……
我见过的
铁
铝
铜
银
金 ……
Au ……
Fe
Al
Cu
Ag
金属有很多的用途
你知道我们在什么地方使用了金属吗?想一 想,你会发现我们的生活离不开金属。
金属的物理性质
铁锅 铝锅
思考1:铁、铝常用于制作锅、铲等炊具,表现出金属哪 种物理性质? 导热性
演示:制取氢气的装置.flv
最理想的绿色能源——氢气
1、氢气的物理性质 ⑴通常为无色、无味的气体; ⑵难溶于水; ⑶相同状况下,密度最小的气体; ⑷有三态变化。
2、氢气的化学性质 ⑴可燃但不助燃 —点燃前需要检验纯度
现象:
1、产生淡蓝色火焰 2、放出大量的热 3、干冷的烧杯内壁有水雾 H2 2H2 + O2 ==== 2H2O
镁和稀盐酸
锌和稀盐酸
铁和稀盐酸
铜和稀盐酸
2、金属与(稀)酸溶液反应
反应物 镁 铝 锌 铁 铜 反应现象
剧烈反应,金属逐渐 减少,产生大量气泡 剧烈反应,金属逐渐 减少,产生大量气泡 剧烈较反应,金属逐渐 减少,产生大量气泡 反应缓慢,金属逐渐 减少,有气泡产生, 溶液由无色变为浅绿色 不反应
反应 速度
【演示】 P116《活动与探究1》的实验内容并将实验 现象填入表中。书写正确的化学方程式。
提出问题:
(1)哪些金属能与盐酸、稀硫酸发生反应?反应后生成了
什么气体?(如何检验)哪些金属不能与盐酸稀硫酸发 生反应?
(2)比较三种金属分别与盐酸、稀硫酸反应的难易和剧烈
程度,将三种金属的活动性按由强到弱的顺序进行排列。
2Al + 3 CuSO4 Cu + 2AgNO3 == Al2( SO4 )3+ 3Cu == Cu (NO3 )2 + 2Ag
三.金属与某些化合物溶液反应 ( 置换反应 )
四.置换反应:由单质和化合物反应,生成单质和化合物的反应
五.金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 金属活动性,由强逐渐减弱。
金属的物理性质
铝锭可压 铜线
成很薄的
铝箔用来 包装糖果 等 思考2:铁、铝、铜能加工成导线、能压成薄片,表现出 金属 哪些物理性质?
导电性、 延展性
金属的物理性质
思考3:金、银、铂做成各种首饰等,表现出金属哪种 物理性质? 有金属光泽
金属的物理性质
金 属 铁
金 属 锌
铜 汞 块
金 条
交流与讨论并将结果填入P114表5-2中。总结出金属 的主要物理性质。 一 金属的性质 (一).物理性质: 相似性:大多数金属都有金属光泽,密度、硬度较大, 熔、沸点较高,具有良好的导电、导热性、延展性。
