二氧化氯的制法
二氧化氯制取方法

二氧化氯制取方法
1. 二氧化氯是一种强氧化剂,可以通过电解氯化钠溶液来制取。
将氯化钠溶解在水中,形成氯化钠溶液。
2. 接下来,将制备好的氯化钠溶液倒入电解槽中,并加入电解质,如盐酸或硫酸。
电解质的作用是增加溶液的电导率,促进电解过程的进行。
3. 在电解槽中,有两个电极,分别是阳极和阴极。
阳极通常由钛制成,而阴极可以
是钢制的。
将阳极和阴极连接到电源上,开始电解过程。
4. 在电解过程中,氯化钠分解成氯气和氢气。
氯气从阳极释放出来,而氢气则从阴
极释放出来。
5. 在阳极产生的氯气和水反应,生成次氯酸和氯酸。
这两种反应的平衡可以通过调
整电解槽中的温度和电流密度来控制。
6. 次氯酸和氯酸被瞬间转变为二氧化氯和氯离子。
这是因为二氧化氯比次氯酸和氯
酸更稳定,因此会迅速形成。
7. 在电解槽中生成的二氧化氯溶液被收集和储存。
该溶液通常具有浓度依赖于电解
过程中的参数设置和操作条件。
8. 制备二氧化氯的方法也可以通过混合氯气和二氧化氯气来实现。
这种方法需要控
制混合比例和适当的混合条件。
9. 另一种方法是使用氯酸钠和酸反应,生成二氧化氯。
在此反应中,酸可以是盐酸、硫酸或醋酸等。
10. 在制取二氧化氯的过程中,需要注意安全操作和处理电解槽中产生的气体。
防止
氯气泄漏和与氢气的混合,造成危险。
二氧化硫氯酸钠制取二氧化氯的离子方程式

二氧化硫氯酸钠制取二氧化氯的离子方程式1. 二氧化氯是一种重要的化工原料,广泛应用于水处理、漂白剂、消毒剂等领域。
制取二氧化氯的方法有多种,其中一种常用的方法是利用二氧化硫和氯酸钠反应生成二氧化氯。
这一过程涉及到复杂的离子方程式,下面将详细介绍该反应的离子方程式。
2. 我们先来了解一下相关的化学物质。
二氧化硫的化学式为SO2,氯酸钠的化学式为NaClO3,而生成的二氧化氯的化学式为ClO2。
3. 二氧化硫和氯酸钠在一定条件下进行反应,生成二氧化氯。
在该反应中,二氧化硫氧化为二氧化氯,氯酸钠还原为氯化钠。
4. 反应过程中的离子方程式可以如下表示:- 二氧化硫在水中溶解后会发生以下离子化反应:SO2 + H2O -> H+ + HSO3-HSO3- + H2O -> H2SO3H2SO3 -> 2H+ + SO3^2-- 氯酸钠在水中溶解后会发生以下离子化反应:NaClO3 -> Na+ + ClO3^-- 二氧化硫和氯酸钠反应生成二氧化氯的离子方程式可以表示为: 2ClO3^- + SO2 + 4H+ -> ClO2 + SO3^2- + 2H2O + Cl^- + Na+5. 通过以上离子方程式可以清晰地展现二氧化硫和氯酸钠反应生成二氧化氯的化学反应过程。
这一过程不仅在工业生产上有着重要应用,同时也在科学研究和实验室中有着广泛的应用。
6. 总结起来,二氧化硫氯酸钠制取二氧化氯的离子方程式是个复杂却又极为重要的化学反应过程。
对该反应的深入了解,不仅有助于提高化学实验技能,更有助于理解和应用相关的化学知识。
希望本文所介绍的离子方程式能够对读者有所帮助,引发对化学领域的兴趣和探索欲望。
二氧化氯作为一种重要的化工原料,在水处理、漂白剂、消毒剂等领域有着广泛的应用。
而制备二氧化氯的方法中,利用二氧化硫和氯酸钠反应生成二氧化氯是一种常见且有效的方法。
这一反应涉及到多种化学物质的离子及电子转移,因此需要深入了解和掌握其离子方程式。
二氧化氯(ClO2)是如何制取的

二氧化氯(ClO2)是如何制取的我国自八十年代引进国外二氧化氯产品并开始研究其生产工艺以来,经过十几年的时间,不仅有了国产二氧化氯产品,而且生产工艺有了较大的提高,对二氧化氯作为氧化消毒剂的问题出也有了相当的认识和应用。
随着产品的广泛应用,促进了产品剂型的发展,目前已有二氧化氯发生器、稳定性二氧化氯、以及片剂等固态二氧化氯产品。
现将用于消毒的二氧化氯剂型情况综述如下。
1.二化氯发生器1.1二氧化氯的性质和制备二氧化氯是氯的氧化物,具有与氯气类似的刺激性气味,分子式ClO2,分子量67.457,熔点-59°C,沸点11°C,在室温下以气体形式存在,为一种黄绿色气体。
浓度增加时,颜色变为橙红色,气体二氧化氯极不稳定。
二氧化氯易溶于水,在20°C下溶解度为107.98mg/L,可制成不稳定的液体,其液体和气体对温度、压力和光均较敏感,当空气中的含量高于10%时,火花即可引爆[1],二氧化氯是一种不稳定的化合物,在水中可变成HClO2和HClO3.,在室温下每天约有2-10%的离解率[2],因此不利于大批量制备和运输,一般多在使用场所现用现制备。
二氧化氯发生器制备二氧化氯的方法主要有电解法和化学法,电解法使用广泛的是隔膜电解法,以食盐为原料,在电场的作用下生成含有二氧化氯,次氯酸钠、双氧水、臭氧的混合溶液,二氧化氯的浓度一般仅为10-30%左右,大多为氯气。
化学法主要有以氯酸钠和亚氯酸钠为原料的两类发生二氧化氯的方法。
在氯酸钠法生产二氧化氯过程中,若用氯离子作还原剂,则制得的二氧化氯存在纯度低的缺点,而亚氯酸钠法制得的二氧化氯比例高,一般在90%以上。
1.2设备和杀菌性能国外引进的发生器主要有Tetraralent公司、RioLindo公司、德国的Prominent等,李玲文等[3]报道了Tetraralent公司的二氧化氯协同消毒器的协同杀菌作用,该发生器利用电解食盐溶液,同时产生二氧化氯、氯气、臭氧和双氧水,溶于水中,协同杀菌,其杀菌效果优于上述任何一种消毒剂,实验结果还说明,电解槽的电解电压、电流、电解质浓度及阳极有效面积对消毒器的产气量都有影响。
二氧化氯的制备方法

二氧化氯的制备方法二氧化氯(ClO2)是一种重要的化学品,具有强氧化性和消毒能力,广泛应用于水处理、工业生产和医疗卫生等领域。
下面将介绍几种常见的二氧化氯的制备方法。
1.二氯化钠酸化法:将二次氯化钠固体(NaClO2)溶解在水中,然后加入酸(如盐酸)进行酸化反应。
反应过程中生成的二氯化钠(NaCl)被进一步氧化为二氧化氯。
反应方程式如下:4NaClO2+4HCl→4ClO2+2H2O+2NaCl此方法操作简单,并且生成的二氧化氯浓度较高。
2.氢氧化钠酸化法:将二氯化钠固体溶解在水中,然后加入氢氧化钠进行酸化反应。
反应过程中生成的二氯化钠被氧化为二氧化氯。
反应方程式如下:3NaClO2+2NaOH→2ClO2+NaCl+NaClO3+H2O该方法中,氢氧化钠作为酸化剂,同时产生了多余的氯酸钠(NaClO3)。
3.过硫酸盐法:将过硫酸钠固体溶解在水中,然后加入二氯化钠进行反应。
反应过程中生成的过硫酸钠(Na2S2O8)与二氯化钠反应生成二氧化氯。
反应方程式如下:2NaClO2+Na2S2O8+2H2O→2ClO2+2NaHSO4+NaCl该方法中,过硫酸钠作为氧化剂,在反应中被还原为硫酸钠(NaHSO4)。
4.氯酸钠酸化法:将氯酸钠溶解在水中,然后加入酸进行酸化反应。
反应过程中生成的氯酸钠被氧化为二氧化氯。
NaClO3+2HCl→ClO2+H2O+NaCl该方法操作简单,但由于氯酸钠的价格相对较高,制备成本较高。
总结:以上是几种常见的二氧化氯的制备方法,它们有各自的特点和适用范围。
在实际应用中需根据具体情况选择适合的制备方法,并注意操作安全。
二氧化氯是一种有毒气体,应严格控制其浓度和排放,防止对环境和人体健康造成危害。
二氧化氯配制方法及记录

二氧化氯配制方法及记录二氧化氯是一种强氧化剂,具有强烈的氧化能力和杀菌作用。
它可以用于水处理、空气消毒、固体表面消毒等多个领域。
在使用过程中,正确的配制方法和记录是非常重要的。
下面,我将详细介绍二氧化氯的配制方法及记录。
一、二氧化氯配制方法1.材料准备-氯酸钠(NaClO3)或次氯酸钠(NaClO):作为原料,用来制备二氧化氯。
-氢酸(HCl)或者稀硫酸(H2SO4):用于反应过程中的酸化反应。
-水:作为溶剂,用来配制二氧化氯溶液。
2.配制过程-步骤1:将一定量的氯酸钠或次氯酸钠溶解在一定体积的水中,生成次氯酸钠溶液。
-步骤2:在次氯酸钠溶液中加入适量的氢酸或稀硫酸,使其酸化,生成二氧化氯。
3.反应方程式反应1:2NaClO3+4HCl→2ClO2+Cl2+2H2O+2NaCl反应2:5NaClO+4HCl→4ClO2+Cl2+2H2O+5NaCl二、二氧化氯配制记录配制二氧化氯时,需要进行相应的记录,以确保配制的准确性和追溯性。
以下是配制二氧化氯的记录信息的详细格式:日期:记录配制二氧化氯的日期。
配制人员:记录参与配制工作的人员信息。
配制原料及用量:-氯酸钠(或次氯酸钠):记录使用的氯酸钠或次氯酸钠的批号、使用量等信息。
-氢酸(或稀硫酸):记录使用的氢酸或稀硫酸的批号、使用量等信息。
配制过程:-步骤1:记录溶解氯酸钠或次氯酸钠的过程,包括使用的容器、溶解时间等信息。
-步骤2:记录加入氢酸或稀硫酸酸化的过程,包括使用的容器、酸化时间等信息。
反应情况:-反应方程:记录配制二氧化氯的反应方程式。
-反应时间:记录反应的时间,包括酸化反应和反应生成二氧化氯的时间。
-反应温度:记录反应过程中的温度变化。
配制结果:-生成物:记录配制过程中生成的二氧化氯的质量、浓度等信息。
-配制状态:记录配制成功、失败或有异常情况。
清理及储存:-清理过程:记录清理反应容器的过程,包括使用的清洗剂、清洗时间等信息。
-储存方式:记录储存二氧化氯溶液的方式,包括储存容器、储存条件等信息。
二氧化氯制法与作用

二氧化氯制法与作用小伙伴们!今天咱就来好好唠唠二氧化氯这玩意儿,看看它是咋制备出来的,又有啥神奇的作用。
一、二氧化氯的制法。
咱得知道,二氧化氯的制备方法还挺多样的,下面就给大家介绍几种常见的。
1. 氯酸钠与盐酸反应法。
这种方法呀,就是让氯酸钠和盐酸这俩家伙来一场“化学反应大派对”。
具体反应过程呢,就是氯酸钠和盐酸混合后,在一定条件下就会发生反应,生成二氧化氯。
反应方程式是这样的:2NaClO₃ + 4HCl = 2ClO₂↑ + Cl₂↑ + 2NaCl + 2H₂O。
不过这里要注意哦,这个反应会产生氯气,氯气这东西可是有点小危险的,所以操作的时候可得小心点儿。
2. 亚氯酸钠与氯气反应法。
亚氯酸钠和氯气相遇,也能制造出二氧化氯哦。
这个反应就像是两个小伙伴相互配合,完成了一个神奇的魔法。
反应方程式是2NaClO₂ + Cl₂ = 2ClO₂↑ +2NaCl。
这个方法相对来说,操作起来可能会稍微容易控制一点,不过氯气的使用还是得谨慎呐。
3. 亚氯酸钠与酸反应法。
亚氯酸钠和酸也能玩出二氧化氯来。
比如亚氯酸钠和硫酸反应,5NaClO₂ + 2H₂SO₄ = 4ClO₂↑ + NaCl + 2Na₂SO₄ + 2H₂O 。
这种方法在一些特定的场合可能会比较常用,不过同样要注意反应条件和操作安全哟。
二、二氧化氯的作用。
二氧化氯这小家伙,作用可真是不少,在好多领域都能大显身手呢。
1. 杀菌消毒。
二氧化氯可是杀菌消毒界的“高手”。
它能破坏细菌、病毒这些微生物的细胞结构,让它们没办法再“兴风作浪”。
不管是在饮用水消毒、医院环境消毒,还是食品加工行业的消毒,都能看到它的身影。
比如说在游泳池里,加入适量的二氧化氯,就能把那些可能让我们生病的细菌给消灭掉,让我们可以放心地在水里玩耍。
2. 漂白作用。
它在漂白方面也是一把“好手”。
可以把一些有颜色的物质给“变没”,让东西变得白白净净的。
像在造纸工业中,二氧化氯就经常被用来漂白纸张,让纸张变得更白更亮,而且还不会像一些传统的漂白剂那样,对纸张的质量造成太大的影响。
二氧化氯的制取

二氧化氯的制取一、引言二氧化氯是一种强氧化剂,具有广泛的应用领域,如水处理、消毒、漂白等。
本文将介绍二氧化氯的制取方法及其工艺流程。
二、二氧化氯的制取方法1. 常温常压法常温常压法是制取二氧化氯的一种常用方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
(3)利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
2. 高温高压法高温高压法是另一种常用的制取二氧化氯的方法。
具体步骤如下:(1)将氯气通过液体二氧化硫中,生成氯气溶液。
(2)将氯气溶液通过高温高压反应器,反应生成二氧化氯。
(3)利用冷凝器将二氧化氯冷却成液态。
三、二氧化氯的工艺流程1. 氯气制备氯气是二氧化氯制备的原料之一。
常见的氯气制备方法有电解法和氯化法。
其中,电解法是最常用的方法,通过电解食盐水或氯化铵溶液,产生氯气。
2. 二氧化硫制备二氧化硫是二氧化氯制备的另一个原料。
常见的二氧化硫制备方法有燃烧硫磺和矿石还原法。
其中,燃烧硫磺是最常用的方法,通过将硫磺燃烧产生二氧化硫气体。
3. 氯气溶液制备将氯气通过液体二氧化硫中,生成氯气溶液。
这一步骤可以在常温常压下进行。
4. 二氧化氯制备将氯气溶液通过激光照射或电解的方式,将氯气转化为二氧化氯气体。
这一步骤可以在常温常压下进行,也可以通过高温高压反应器进行。
5. 二氧化氯液体制备利用冷凝器将二氧化氯气体冷却成液态二氧化氯。
这一步骤可以在常温常压下进行。
四、二氧化氯的应用领域1. 水处理二氧化氯可以用于水处理,能有效杀灭水中的细菌、病毒和寄生虫等微生物,净化水质。
2. 消毒由于二氧化氯具有强氧化性,可以用于消毒。
它可以杀灭空气中的细菌、病毒,保持空气清洁。
3. 漂白二氧化氯也可以用于漂白过程。
它可以去除纸浆中的色素和杂质,使纸张更加白净。
五、结论二氧化氯的制取方法主要包括常温常压法和高温高压法。
其工艺流程包括氯气制备、二氧化硫制备、氯气溶液制备、二氧化氯制备和二氧化氯液体制备。
二氧化氯的制备方法
二氧化氯的制备二氧化氯是一种黄绿色具有刺激性气味的气体。
沸点11℃,凝固点-59℃,易溶于水。
液态或气态的二氧化氯都不安定,易挥发,易爆炸。
早在1811年就由英国化学家hu mphre y davey制得,但由于二氧化氯的不稳定性使得大规模的应用受到了限制。
直到近十几年来才引起人们的极大关注,国外正在积极开发和研制各种新产品,扩大应用范围。
目前国际上公认二氧化氯很有开发和应用的价值,市场前景广阔。
但是,二氧化氯在我国的应用尚不够广泛,为此本文将介绍有关二氧化氯的各种制备方法及在各领域中的应用。
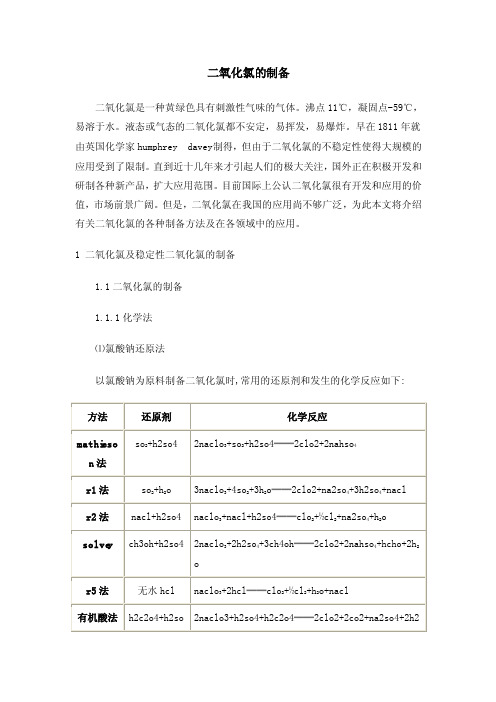
1 二氧化氯及稳定性二氧化氯的制备1.1二氧化氯的制备1.1.1化学法⑴氯酸钠还原法以氯酸钠为原料制备二氧化氯时,常用的还原剂和发生的化学反应如下:⑵亚氯酸钠氧化法a.与氯气反应2naclo2+cl2══2clo2+2naclb.与盐酸反应5naclo2+4hcl══4clo2+5nacl+2h2oc.与硫酸反应10nacl o2+5h2so4══8clo2+5na2so4+2hcl+4h2od.与酸化后的次氯酸钠反应naclo+hcl══nacl+hoclhcl+hocl+2naclo2══2clo2+2nacl+h2o1.1.2电解法目前仍采用亚氯酸盐电解氧化和氯酸盐电解还原法制备二氧化氯.此法较化学法制备的二氧化氯纯度高,但要求的电极材质高,电耗也较大.因此,目前在大规模的生产中,还无法与传统的化学法竞争.在饮用水消毒工艺中,也常用电解饱和浓度的食盐溶液制取二氧化氯,但反应过程中还伴生有氯气、臭氧、氢气等其他气体。
1.2稳定性二氧化氯的制备稳定性二氧化氯是80年代为推广应用二氧化氯而开发的新型产品。
它无色、无味、无毒、无腐蚀性,不易燃,不挥发。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化氯的制法
二氧化氯是一种强氧化剂,可以用于消毒、漂白、污水处理等领域。
它具有高效、快速、无毒、无臭的特点,被广泛应用于饮用水处理、游泳池消毒、食品加工等领域。
下面将介绍二氧化氯的制法。
一、二氧化氯的制法
1. 氯酸钠和硫酸反应制取二氧化氯
二氧化氯可以通过氯酸钠和硫酸的反应制取。
具体步骤如下:
将氯酸钠溶解在水中,生成氯酸钠溶液。
然后,在搅拌的过程中,将硫酸缓慢地加入氯酸钠溶液中。
反应过程中会产生氯气和二氧化氯。
将氯气和二氧化氯的混合气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯纯度较高,适用于工业生产。
2. 氯酸钠和次氯酸钠反应制取二氧化氯
除了与硫酸反应制取二氧化氯外,氯酸钠还可以与次氯酸钠反应制取二氧化氯。
具体步骤如下:
将氯酸钠溶解在水中,生成氯酸钠溶液。
然后,将次氯酸钠溶液加入氯酸钠溶液中,通过搅拌使两者充分混合。
在反应过程中,次氯酸钠会被还原为氯酸钠,同时生成二氧化氯气体。
将二氧化氯气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯适用于小规模的生产和实验室使用。
3. 双氯酸钠反应制取二氧化氯
双氯酸钠是一种常见的二氧化氯制剂,可以通过双氯酸钠的分解反应制取二氧化氯。
具体步骤如下:
将双氯酸钠溶解在水中,生成双氯酸钠溶液。
然后,加热双氯酸钠溶液,使其分解为氯酸钠和二氧化氯。
将生成的二氧化氯气体通过冷凝器冷却,得到液态的二氧化氯。
这种方法制取的二氧化氯操作简单,适用于小规模的制备。
二、二氧化氯的应用
1. 饮用水处理
二氧化氯可以有效杀灭饮用水中的细菌、病毒和其他微生物,保证
水质安全。
它比氯气和次氯酸钠更稳定,不会产生氯味,也不会形成有害的副产物。
2. 游泳池消毒
二氧化氯可以快速杀灭游泳池中的细菌和其他病原体,保持水质清洁卫生。
与传统的氯气和次氯酸钠相比,二氧化氯无臭味,不刺激眼睛和皮肤。
3. 食品加工
二氧化氯可以用于食品加工过程中的消毒和漂白。
它可以有效杀灭食品中的细菌和其他微生物,延长食品的保鲜期。
4. 污水处理
二氧化氯可以用于污水处理中的消毒和去除异味。
它可以有效杀灭污水中的细菌和其他病原体,减少环境污染。
总结:
二氧化氯是一种重要的消毒剂和氧化剂,可以通过氯酸钠和硫酸反应、氯酸钠和次氯酸钠反应或双氯酸钠的分解反应制取。
它具有高效、快速、无毒、无臭的特点,被广泛应用于饮用水处理、游泳池消毒、食品加工等领域。
在使用二氧化氯时,需要注意正确的操作方法和剂量控制,以确保安全和有效的使用。
