分子结构与性质
《分子结构与物质的性质》 知识清单

《分子结构与物质的性质》知识清单一、分子的结构1、共价键共价键是原子间通过共用电子对形成的化学键。
其类型包括σ 键和π 键。
σ 键的电子云沿键轴呈轴对称,头碰头重叠,稳定性较强;π 键的电子云垂直于键轴呈镜面对称,肩并肩重叠,稳定性相对较弱。
共价键具有方向性和饱和性。
方向性指的是原子之间形成共价键时,电子云要沿着特定的方向重叠,才能达到最大重叠程度,形成稳定的共价键。
饱和性则是指每个原子所能形成的共价键总数是一定的,因为一个原子的未成对电子数目是有限的。
2、价层电子对互斥理论该理论可以用来预测分子的空间构型。
中心原子的价层电子对数等于中心原子的孤电子对数与成键电子对数之和。
根据价层电子对数,可以确定分子的空间构型。
3、杂化轨道理论原子在形成分子时,为了增强成键能力,同一原子中能量相近的原子轨道会重新组合形成新的原子轨道,即杂化轨道。
常见的杂化类型有 sp、sp²、sp³等。
sp 杂化轨道是直线形的,如 BeCl₂分子;sp²杂化轨道呈平面三角形,例如 BF₃分子;sp³杂化轨道为正四面体结构,如 CH₄分子。
二、分子的极性1、极性分子和非极性分子分子中正电中心和负电中心不重合的分子为极性分子,重合的则为非极性分子。
例如,HCl 是极性分子,而 Cl₂是非极性分子。
极性分子中存在极性键,非极性分子中可以存在极性键,也可以只存在非极性键。
2、分子极性的判断可以通过分子的空间构型来判断其极性。
若分子结构对称,正负电荷中心重合,则为非极性分子;反之则为极性分子。
还可以根据键的极性和分子的空间构型综合判断。
只含非极性键的分子一般是非极性分子;含极性键的分子,如果空间构型对称,也是非极性分子,否则为极性分子。
三、分子间作用力1、范德华力范德华力是分子间普遍存在的一种作用力,包括色散力、诱导力和取向力。
其作用能一般较小,对物质的熔点、沸点、溶解度等物理性质有影响。
一般来说,组成和结构相似的物质,相对分子质量越大,范德华力越大,物质的熔沸点越高。
分子结构与化学性质的关系

分子结构与化学性质的关系分子结构与化学性质有着密切的关系。
分子结构决定了分子的物理性质和化学性质。
在化学反应中,不同的分子结构会导致不同的反应机制和反应速率。
本文将探讨分子结构与化学性质之间的关系,并分析其在化学领域中的应用。
一、化学键对分子结构的影响化学键是构成分子的基本单位,不同类型的化学键会对分子结构产生不同的影响。
最常见的化学键包括共价键、离子键和金属键。
共价键是由共享电子对来连接原子的化学键。
共价键可以形成有机物和无机物中的大部分分子。
在共价键中,即使原子间电荷的差异很小,它们也会在分子中建立起稳定的结构。
共价键的长度和角度决定了分子中化学键的属性和分子的形状。
例如,双键的存在会导致分子具有刚性,而单键和三键会使分子具有柔性。
离子键是通过电子从一个原子转移到另一个原子而形成的化学键。
离子键通常在金属和非金属之间形成。
由于电荷的差异,离子之间会产生强大的相互吸引力。
离子键的强度直接影响了化合物的熔点和溶解度。
离子键还使离子化合物具有良好的电导性和脆性。
金属键是由金属元素形成的一种特殊化学键。
金属键中的电子可以自由移动,形成电子云。
这使得金属在导电性和热导性方面具有特殊的性质。
金属有很高的熔点和良好的延展性和可塑性,这是由于金属键的存在。
二、分子结构与物理性质的关系分子的物理性质取决于其分子结构。
以下是分子结构与物理性质之间一些常见的关系:1. 极性与溶解性:极性分子之间的相互作用力较强,因此溶解度较高。
相反,非极性分子间的相互作用力较弱,溶解度较低。
极性分子能够溶解在极性溶剂中,而非极性分子能够在非极性溶剂中溶解。
2. 分子量与熔点、沸点:通常情况下,分子量较大的分子具有较高的熔点和沸点,因为需要克服更强的相互作用力。
分子量较小的分子通常具有较低的熔点和沸点。
3. 分子形状与极性:分子形状也会影响分子的极性。
偏离线性形状的分子通常具有极性。
极性分子之间的键长和键角也会发生变化,从而影响分子的性质。
化学-分子结构与性质教案
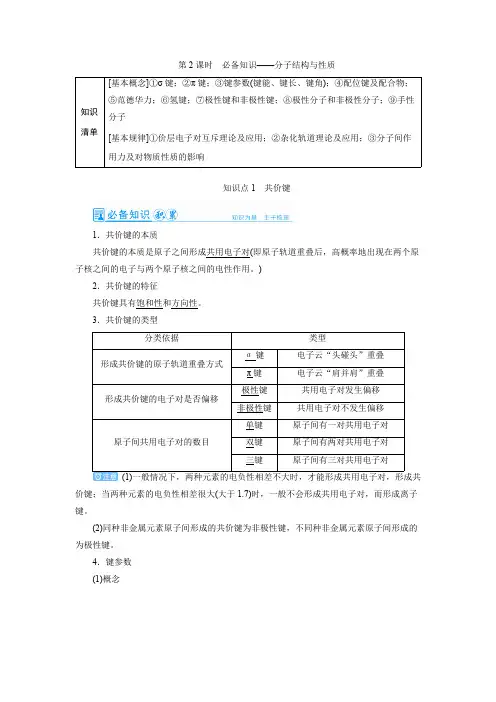
第2课时 必备知识——分子结构与性质知识清单[基本概念]①σ键;②π键;③键参数(键能、键长、键角);④配位键及配合物;⑤范德华力;⑥氢键;⑦极性键和非极性键;⑧极性分子和非极性分子;⑨手性分子[基本规律]①价层电子对互斥理论及应用;②杂化轨道理论及应用;③分子间作用力及对物质性质的影响知识点1 共价键1.共价键的本质共价键的本质是原子之间形成共用电子对(即原子轨道重叠后,高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。
)2.共价键的特征共价键具有饱和性和方向性。
3.共价键的类型分类依据类型σ键电子云“头碰头”重叠形成共价键的原子轨道重叠方式π键电子云“肩并肩”重叠极性键共用电子对发生偏移形成共价键的电子对是否偏移非极性键共用电子对不发生偏移单键原子间有一对共用电子对双键原子间有两对共用电子对原子间共用电子对的数目三键原子间有三对共用电子对(1)一般情况下,两种元素的电负性相差不大时,才能形成共用电子对,形成共价键;当两种元素的电负性相差很大(大于1.7)时,一般不会形成共用电子对,而形成离子键。
(2)同种非金属元素原子间形成的共价键为非极性键,不同种非金属元素原子间形成的为极性键。
4.键参数(1)概念(2)键参数对分子性质的影响一般情况下,共价键的键能越大,键长越短,分子越稳定。
5.等电子原理(1)等电子体原子总数相同,价电子总数相同的粒子互称为等电子体。
例如,N 2和CO 、O 3与SO 2是等电子体。
(2)等电子原理等电子体具有相似的化学键特征,它们的许多性质相近,此原理称为等电子原理。
例如,CO 和N 2都存在三键,性质较稳定。
常见的等电子体及其空间构型微粒通式价电子总数空间构型CO 2、SCN -、NO、N + 2- 3AX 216e -直线形CO 、NO 、SO 32-3- 3AX 324e -平面三角形SO 2、O 3、NO -2AX 218e -V 形SO 、PO 2- 43-4AX 432e -正四面体形PO 、SO 、ClO 3- 32-3- 3AX 326e -三角锥形CO 、N 2AX 10e -直线形CH 4、NH + 4AX 48e -正四面体形[通关1] (易错排查)判断正误(1)在任何情况下,都是σ键比π键强度大( )(2)ss σ键与sp σ键的电子云形状对称性相同( )(3)σ键能单独形成,而π键一定不能单独形成( )(4)σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )(5)碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )答案 (1)× (2)√ (3)√ (4)√ (5)×[通关2] (2020·江苏卷,21A 节选)(1)与NH 互为等电子体的一种分子为________(填+4化学式)。
化学物质的分子结构与性质

化学物质的分子结构与性质化学物质是由各种不同元素的原子组成的,它们通过化学键相互连接而形成分子。
化学物质的分子结构对其性质起着至关重要的作用。
本文将讨论化学物质的分子结构对其性质的影响,并以几个具体的例子来加深理解。
一、分子结构对极性的影响分子结构决定了化学物质的极性,而极性是衡量分子间相互作用力的重要因素之一。
分子如果具有极性,会产生各种重要的性质,如溶解性、熔点和沸点等。
以水分子为例,水分子由一个氧原子和两个氢原子组成,呈现出角度接近104.5度的V形结构。
氧原子的电负性高于氢原子,因此水分子呈现出极性。
这种极性使得水分子能够形成氢键,增加了其溶解其他极性物质的能力,也使得水具有高沸点和高比热容的性质。
二、分子结构对分子间力的影响分子间力是由分子之间的弱吸引力引起的,包括范德华力、氢键和离子作用力等。
分子结构的形状和键的类型可以影响分子间力的强度。
以氯化钠为例,它由一种钠离子和一种氯离子组成,形成离子晶体的结构。
离子晶体的分子间力较强,使得氯化钠在常温下为固体。
而乙醇分子由碳、氧和氢原子组成,呈现出一个带有氧原子的极性结构。
乙醇分子之间形成氢键,这使得乙醇的分子间力比氯化钠的范德华力更强,因此乙醇在常温下为液体。
三、分子结构对化学反应的影响分子结构还会影响化学反应的速率和产物的选择性。
以酶为例,酶是一种生物催化剂,能够加速化学反应的进行。
酶的活性和选择性取决于其分子结构。
酶的活性位点有特定的构象,只有拥有与其配对的底物分子才能与酶发生反应。
这种特异性的分子结构使酶能够选择性地催化特定底物的反应。
酶的分子结构还决定了其反应的速率,更高级别的结构可以提供更多的反应位点,从而加快反应速率。
总结起来,化学物质的分子结构对其性质具有重要影响。
分子的极性和分子间力直接影响物质的物理性质,如溶解性和沸点。
此外,分子结构还能够决定化学反应的速率和选择性。
进一步研究分子结构与性质的关系,有助于我们更好地理解化学反应和物质的行为。
【人教版】分子结构与物质的性质优秀课件PPT

(4)知道氢键是常见的分子间作用力;能说明氢键对物质熔 点、沸点等性质的影响,能举例说明其对于生命的重大意义。
(5)初步认识分子的手性,了解其在药物研究中的应用。
基团 Cl原子数目越多, 吸引电子能力越大
使羧基中的羟基极性越大
羧酸的酸性越强
酸性:三氯乙酸>二氯乙酸>氯乙酸
一、共价键的极性
表2−6 不同羧酸的pKa
羧酸
pKa
丙酸(C2H5COOH)
4.88
乙酸(CH3COOH)
4.76
甲酸(HCOOH)
3.75
氯乙酸(CH2ClCOOH)
2.86
二氯乙酸(CHCl2COOH) 1.29
2、分子的极性: (1)极性分子:分子的正电中心与负电中心不重合,使分子的 某一部分呈正电性(δ+),另一部分呈负电性(δ-)。 (2)非极性分子:分子的正电中心与负电中心重合
一、共价键的极性 思考:含极性键的分子一定是极性分子吗?
分子
V形H,2空O间
正四C面C体l4形,
思考:三氟乙酸的酸性为什么强于三氯乙酸?
甲酸(HCOOH)
3.75
氯乙酸(CH2ClCOOH)
2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH)
0.65
三氟乙酸(CF3COOH)
0.三氯乙酸?
氟的电负性大于氯的电负性,F−C 的极性>Cl−C的极性;使F3C−的 极性>Cl3C−的极性,导致三氟乙 酸在羧基中的羟基极性增强,易电 离出H+。
物质分子的结构和性质

物质分子的结构和性质物质是组成世界的基本元素,而物质由分子构成。
分子是化学反应的基本单位,也是物质性质的决定因素。
因此,研究物质分子的结构和性质对于深化对物质性质本质的认识具有重要意义。
一、分子结构分子结构是指分子中原子的排列方式、原子间的键合情况以及原子的空间取向。
物质的性质与其分子结构密切相关。
1. 原子排列方式分子中的原子排列方式不同,其性质也随之不同。
如乙醇和甲醇的分子式都是CH3OH,但其分子结构却不相同。
甲醇的分子中氧原子连接碳原子,而乙醇的分子中氧原子连接碳链上的一个碳原子。
这样的区别会引起乙醇与甲醇性质的不同。
如在同样的条件下,乙醇的沸点比甲醇高。
2. 原子间的键合情况原子间的键合强度与化学键类型有关,如离子键、共价键、酸碱键、氢键等。
键合类型不同,其性质也发生变化。
以共价键为例,它的种类有单键、双键、三键,每种化学键的键长、键强度和反应活性也有所不同。
另外,在共价键之间,还会发生极性与非极性的区别,不同的化学键特性对应了不同的物质性质。
3. 原子的空间取向原子的空间取向对于分子的物理性质有着非常重要的影响。
不同的原子空间取向,其分子的形状也不同,如甲烷和乙烷的分子式都是C2H6,但前者是正四面体,而后者是扁平的扇形。
这种区别导致了二者化学性质、物理性质的差异性。
例如,相同温度下,甲烷凝固为固体,而乙烷仍然是液体状态。
二、分子性质分子性质主要有物理性质和化学性质两种。
1. 物理性质物理性质是指与物质的广义状态参数或固有特性有关的性质。
如密度、熔点、沸点、导电性、折射率、溶解度等。
密度是物质 unit 体积的质量,反映了物质分子间的相对位置和排列方式。
分子间的距离越小,密度也就越大。
熔点和沸点是指物质在相应的温度下液体到固体、液体到气体的相变温度。
大多数情况下,熔点和沸点都与物质的分子结构有着密切的关系。
不同的化合物分子结构的相对排列不同,因而会影响它们的沸点和熔点。
2. 化学性质化学性质是指在化学反应中,分子内部以及分子与其他物质之间发生的转化。
化学分子结构与物质性质
分子结构与物质性质【德智助学】1.分子的立体结构2.分子的性质3.化学键(离子键、共价键),配位键,金属键4.8电子稳定结构【知识梳理】考试要点一、分子的立体结构1.价层电子对互斥模型(1)当A的价电子全部参与成键时,价层电子对间的相互排斥使得键角最大,据此可以直接推测分子的空间构型。
(2)当A上有孤电子对时,孤电子对要占据一定的空间,并参与电子对间的排斥,使得各电子对间的夹角最大,据此可推测出分子的VSEPR模型,去除孤电子对后即得分子的立体结构。
(3)中心原子的杂化及价层电子对互斥模型。
2.杂化轨道理论杂化轨道理论是鲍林为了解释分子的立体结构提出的。
杂化前后轨道总数不变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在的平面垂直,可用来形成π键。
3.中心原子杂化轨道数、孤电子对数及与之相连的原子数间的关系(1)杂化轨道数=中心原子的孤对电子数+中心原子键合原子数。
(2)杂化轨道的形状:2个sp杂化轨道呈直线形,3个sp2杂化轨道呈平面三角形,4个sp3杂化轨道呈正四面体型。
二、分子的性质1.分子的极性(1)分子极性是分子中化学键极性的向量和。
只含非极性键的分子一定是非极性分子(O3除外),只含极性键的分子不一定是极性分子,极性分子中必然含有极性键(O3除外)。
(2)分子中正、负电荷中心重合的是非极性分子,正、负电荷中心不重合的是极性分子。
在极性分子中,某一个部分呈正电性(δ+),另一部分呈负电性(δ-)。
(3)对于AB n型分子,根据VSEPR模型,若中心原子核外最外层没有孤对电子(即化合价的绝对值等于主族序数),该分子一般是非极性分子,否则是极性分子。
2.分子间作用力对物质性质的影响(1)范德华(Van der Waals)力:范德华力是普遍存在于分子间的作用力,其强度比化学键弱,对物质的熔点、沸点和硬度有影响,范德华力越大,熔、沸点越高,硬度越大。
一般来讲,具有相似空间构型的分子,相对分子质量越大,范德华力越大;分子的极性越大,范德华力越大。
分子的结构与性质的关系
分子的结构与性质的关系分子的结构与性质的关系是化学学科的重要研究内容之一。
分子的结构指的是分子中各个原子之间的相互排列方式以及原子与原子之间的化学键的连接方式。
而分子的性质则是指分子在化学反应和物理过程中所表现出来的特性和行为。
分子的结构直接影响着分子的性质。
一方面,分子的结构可以决定分子之间的相互作用力,进而影响物质的物理性质,如沸点、熔点、溶解度等。
另一方面,分子的结构还可以决定分子在化学反应中的反应性质,如反应的速率、选择性等。
首先,分子的结构与物质的物理性质密切相关。
例如,取代基的种类和位置可以影响有机化合物的沸点和溶解度。
在有机化学中,当取代基的体积增大时,分子间的范德华力也会增加,导致沸点升高。
同时,相同的取代基在不同位置的影响也不同,如苯环上的取代基会改变苯环的电子密度分布,进而影响苯环与其他分子间的相互作用。
其次,分子的结构对于化学反应的速率和选择性也有重要影响。
以有机合成为例,分子中官能团的位置和取代基的选择往往能够决定反应路径和产物选择。
例如,当氢原子被氟取代时,反应中可以选择引入氟原子的位置,从而得到不同的产物。
此外,分子的手性结构对于光学异构体的形成和对映选择性反应也具有重要作用。
另外,分子的结构还决定了分子之间的相互作用力。
分子间的相互作用力对于物质的凝聚态性质至关重要。
例如,氢键是分子间最常见的相互作用力之一,在生物分子的结构稳定性和具体功能中起着重要的作用。
此外,分子间力的大小还可以影响到分子的溶解度、热稳定性等性质。
综上所述,分子的结构与分子的性质之间存在着密切的关系。
分子的结构决定了分子的物理性质、化学反应性质以及相互作用力。
在化学研究和应用中,理解和研究分子的结构与性质的关系对于探索新材料、药物研发和化学工艺等领域具有重要的意义。
(以上内容仅供参考,具体内容和篇幅可以根据需要进行调整。
)。
化学分子结构与性质的关联与解释
化学分子结构与性质的关联与解释 化学是一门研究物质组成、结构和性质以及物质之间的变化的科学。在化学中,分子是构成物质的基本单位,而分子的结构直接关联着物质的性质。本文将探讨化学分子结构与性质之间的关联,并试图解释这种关联的原因。
1. 分子结构对化学性质的影响 分子结构的不同排列方式会导致分子具备不同的性质。举例来说,若是考虑有机化合物,碳原子的化合价为4,它能够形成与其他碳原子或其他元素的共价键。在有机化学中,分子的结构可以通过键长、键角和空间取向等参数来描述。
(正文继续...) 2. 共价键的影响 共价键的类型和数量对分子性质具有重要的影响。一种特定的共价键可以导致分子更容易发生化学反应,而另一种类型的共价键可能使得分子稳定而难以发生反应。例如,双键和三键相对于单键来说更为活泼,因为双键和三键中存在的电子云的共享更多,使得分子更易于发生反应。
(正文继续...) 3. 分子极性的关系 分子的极性指的是分子中正、负电荷分布的不均匀性。分子的极性对它的溶解性、沸点和熔点等性质产生重要影响。极性分子之间的相互作用力较强,因此其沸点和熔点往往较高。相反,非极性分子之间的相互作用力较弱,其沸点和熔点往往较低。
(正文继续...) 4. 电子排布和分子性质 分子中原子的电子排布也对分子性质产生重要影响。原子的电子排布可能导致分子的稳定性和活性的变化。举例来说,根据分子轨道理论,当原子中的电子填充到不同的分子轨道时,分子的能级和反应活性也将发生改变。
(正文继续...) 5. 形状与分子性质 分子的形状对其化学性质也有显著的影响。分子的形状可以决定分子之间的空间排列以及它们发生反应的可能性。举例来说,线性分子通常比弯曲分子更容易发生反应,因为线性分子之间的相互作用力更大。
(正文继续...) 总结起来,化学分子结构与性质之间存在密切的关联。分子结构的不同排列方式、共价键的类型和数量、分子的极性、电子排布以及分子的形状都在一定程度上决定了分子的化学性质。深入理解分子结构与性质之间的关联有助于我们更好地理解和解释化学现象,并为材料设计和药物研发等领域提供指导。
第6章 分子的结构与性质
键长和键角是描述分子几何结构的两个要素。
分子或晶体中相邻原子(或离子)间强烈的相互 吸引作用称为化学键。
共价键—Ch6 离子键—Ch7 金属键—Ch7 配位键—Ch8
6.2 价键理论
6.2.1 共价键
2. 化学键:分子或晶体内部,原子(或离子)之间存 在着较强烈的相互作用力。化学上把分子或晶体中相 邻原子(或离子)间强烈的相互吸引作用称为化学键。
§6.1 化学键参数 §6.2 价键理论 §6.3 分子的几何构型 杂化轨道理论 *价层电子对互斥理论 §6.4 分子轨道理论 §6.5 分子间力和氢键
6.1键参数 凡能表征化学键性质的物理量统称为键参数。
化学键的强度: 键级 (B.O.) 键能 (E)
分子的空间构型: 键长 键角
化学键的极性: 键距 (键的偶极距 u = q l )
6.1.1 键能 E°
在标准条件下将1摩尔的气态AB分子中的化学键断 开,使每个AB分子离解成两个中性气态原子A + B时 所需的能量或者所释放的能量。
当两个自旋方向相反的电子相互靠近时,两个1s原 子轨道发生重叠(波函数相加),核间形成一个电子概 率密度较大的区域, 两个H原于核都被电子概率密 度大的电子云吸引,系统能量降低,当核间距达到 平衡距离R0(74pm)时,系统能量达到最低点----基态。 如果两个H原子核再接近,原子核间斥力增大.使 系统的能量迅速升高,排斥作用又将H原子推回平 衡位置。
ns-np杂化,ns-np-nd杂化,(n-1)d-ns-np杂化 ② 杂化轨道成键能力大于未杂化轨道。
+
+–
