碳同位素2
同位素标记法碳的同位素
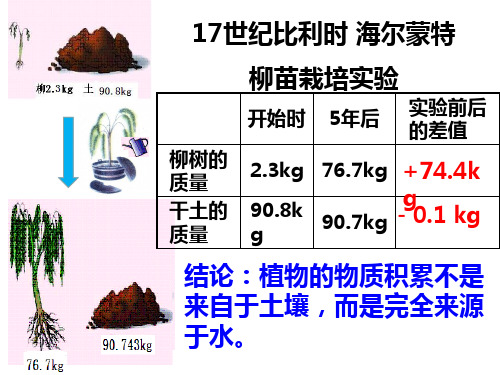
提出问题:
光能哪里去了?
1845年,德国科学家梅耶根据 能量转化与守恒定律明确指出:植 物进行光合作用时,把光能转换成 化学能储存起来。 提出问题: 光能转换成化学能,贮存于什么物质中呢? 即植物在吸收水分和二氧化碳、释放氧气的过 程中,还产生了什么物质呢?
atp中活跃的化学能转变为糖类等有机物中稳定的化学能2catp2c3ch2oc5多种酶固定还原co2adppiatp暗反应糖类ch光反应阶段暗反应阶段进行部位条件物质变化能量变化联系叶绿体内基粒类囊体薄膜上叶绿体基质中光酶色素多种酶hatp水的光解atp的合成二氧化碳的固定三碳化合物c的还原atp中活跃化学能atp中活跃化学能有机物中稳定化学光反应为暗反应提供还原剂h和供能物质atp暗反应产生的adp和pi为光反应合成atp提供原料光合作用
(2)H218O―→18O2 。
6.光合作用的能量转变为:光能 ―→ATP中活跃的化学能―→有机物中稳定的化学 能。
光 合 速 率 温度 叶龄
光 合 速 率
归纳拓展
光合速率的测定方法
(1)NaHCO3溶液作用:玻璃瓶中的NaHCO3溶液保
证了容器内CO2浓度的恒定,满足了绿色植物光合作用 的需求。 (2)植物光合速率指标:植物光合作用释放氧气, 使容器内气体压强增大,毛细管内的水滴右移。单位
时间内水滴右移的体积即是光合速率。
普利斯特利(英)实验 1771
普利斯特利没有发现光在 植物更新空气中的作用。
结论:绿色植物可以更新空气
2、英格豪斯实验(1779年)
1785年,由于发现了 空气的组成,人们才明 确绿叶在光下放出的气 ①普利斯特利的实验只有在阳光照射 体是氧气,吸收的是二 氧化碳 下才能成功。
稳定碳同位素

稳定碳同位素自然界有六种碳同位素:10C、11C、12C、13C、14C*和15C*。
主要有三种,它们的丰度是:12C-98.9%;13C-1.08%;14C-1.2×10-10%。
其中12C、13C是稳定同位素,14C是放射性同位素。
碳有两种稳定同位素:12C和13C,由于它们的质量不同,在自然界中的物理、化学和生物作用下产生分馏。
一般来说,在碳的有机循环中,轻同位素容易摄入有机质(例如烃、石油中富含12C,-30~-20‰)中;而在无机循环中,重同位素倾向于富集在无机盐(例如碳酸盐富含13C,海相灰岩约0‰)中。
碳同位素分馏包括动力学分馏(如光合作用、有机物的生物降解等)和平衡分馏(如大气CO2-溶解的HCO3--固体CaCO3系统)。
(1) 光合作用中的碳同位素动力分馏(6CO2+6H2O→C6H12O6+O2):由于轻同位素分子的化学键比重同位素分子的化学键易于破坏,因而光合作用的结果使有机体相对富集轻同位素(12C),而残留CO2中则相对富集重同位素(13C)。
叶子表面对两种二氧化碳(12CO2、13CO2)同位素分子吸收速度上的差异是造成这一分馏的主要原因。
光合作用中碳同位素分馏程度与光合碳循环途径密切相关。
根据CO2被固定的最初产物的不同,光合碳循环可分为C3、C4和CAM三种方式。
C3循环长,分馏大,δ13C=-23‰~-38‰;C4循环为短循环,分馏小,δ13C=- 12‰~-14‰;CAM循环介于C3与C4间,其13C的亏损程度也介于C3与C4植物间。
(2)生物氧化-还原作用过程中的碳同位素分馏:一方面,微生物通过氧化还原反应获取能量,加速氧化还原反应的进行。
另一方面,微生物在参与反应的过程中,对于同位素的利用具有选择性,优先选择利用化学能较弱的轻同位素化学键,使得轻同位素较重同位素更易被微生物所利用,进而产生显著的同位素分馏。
大气CO2-溶解的HCO3--固体CaCO3系统中的化学交换平衡反应:同位素平衡分馏只与温度有关,碳同位素分馏的结果是使固体碳酸盐中富集重同位素13C 从大气中的CO2到生物圈中有机碳化合物再到生物燃料和生物成因的甲烷,其碳同位素呈现出递减趋势,总体变化规律是氧化态的碳富集13C,还原态的碳富集12C。
碳的放射性同位素

碳的放射性同位素
碳的放射性同位素是指通过各种方式射出的具有放射性特性的碳同位素。
它是一种有用的放射性物质,可用于开展许多科学研究。
它也可以用来检测环境中污染物的浓度。
碳的放射性同位素可以从环境中发现,它们主要来源于太阳能射出的自然γ射线和核反应。
有时,它们也来源于可能发生的核反应,以及人为制造的核爆炸。
碳的放射性同位素由化学元素的变体组成,也就是其他常见元素的氘核或氙核组成,其同位素的半衰期范围可达千分之一秒至数百万年。
碳的放射性同位素可以帮助研究人员检测和测定污染物的量,更重要的是它可以应用于地下水、土壤和肥料中污染物的检测。
碳的放射性同位素可以测量准确的污染物的质量,可有效识别和定位污染物的源头,从而更好地控制污染物的活动。
在铀等危险有毒矿物的检测中,碳的放射性同位素也可以发挥作用。
可以测量核辐射是否泄漏至环境中,用于识别危险物质的分布情况,确定核辐射污染物的轨迹。
对于生物研究,碳的放射性同位素也很重要。
它可以用于追踪各种体外生物材料的运动特征,以及内部机体的结构和活动机制的研究,提供生物药物的研发和检测,以及有关基因和遗传调控机制的研究。
从以上可以看出,碳的放射性同位素是一种有用的放射物质,可以被广泛应用于工业生产和科学研究中,为人类提供了重要的作用。
c2化学名称

c2化学名称摘要:1.引言2.C2 化学名称的含义3.C2 的化学性质4.C2 的实际应用5.结论正文:【引言】C2,即碳的第二个同位素,是一种碳原子核中含有两个中子的同位素。
在化学领域,C2 有着广泛的应用,特别是在核物理和放射性研究中。
本文将从C2 的化学名称、化学性质和实际应用等方面进行介绍。
【C2 化学名称的含义】C2 化学名称中的“C”代表碳元素,而“2”则表示该同位素的原子核中含有两个中子。
在元素周期表中,C2 的原子序数为6,质量数为12。
因此,C2 的化学名称为碳-12(^12C)。
【C2 的化学性质】C2,即碳-12,具有稳定的化学性质。
由于其原子核中的中子数量为2,与质子数量相等,这使得C2 具有稳定的原子结构。
在常温常压下,C2 以气态存在,呈无色、无味、无毒的性质。
C2 的化学性质与普通碳(C)相似,但在核物理和放射性研究中,C2 具有特殊的应用价值。
【C2 的实际应用】C2,即碳-12,在许多领域都有实际应用,尤其是在核物理和放射性研究中。
以下是C2 的一些主要应用领域:1.核物理研究:C2 被广泛用于核物理实验中,作为示踪原子。
由于C2 具有稳定的化学性质和较长的半衰期,它成为研究核反应和放射性衰变机制的理想示踪剂。
2.放射性药物:C2 在医学领域也有广泛应用,特别是在放射性药物治疗中。
例如,C2 可用于生产放射性药物如碳-12 标记的氨基酸、核苷酸等,这些药物在诊断和治疗癌症等疾病方面具有重要价值。
3.考古学和环境科学:C2 在考古学和环境科学领域也有应用。
通过检测文物中的C2 含量,可以推测文物的年代和来源;在环境科学中,C2 可用于研究碳循环过程和温室气体排放等。
4.工业领域:C2 在工业生产中也有一定的应用,如在石油化工、化学制品生产等方面的质量控制和分析。
【结论】C2,即碳-12,是一种具有稳定化学性质的重要同位素。
在核物理、放射性研究、医学、考古学、环境科学和工业等领域都有广泛的应用。
同位素例子

同位素例子同位素是一种原子中具有相同数量的质子和中子,但质子数量和中子数量不同的类型。
它们是原子的一个基本特性,被用来标识具有不同特性的原子。
本文尝试在不同的同位素例子中探讨原子的结构和特性。
每一种元素有不同的同位素,具有不同的质子数和中子数。
碳的4种同位素是碳-12、碳-13、碳-14和碳-15。
碳-12是碳的原子核的基本结构,它的原子核由6个质子和6个中子组成。
它的原子量为12,可以被认为是最常见和最稳定的同位素。
它是自然界中最常见的元素,占据整个大气中99.98%的量。
碳-13是碳-12的稳定同位素,原子核中有7个质子和6个中子,它的原子量为13。
尽管碳-13的质子数量比碳-12多一个,但由于它们的原子质量是不同的,它们仍可被称为稳定同位素。
碳-13的含量比碳-12低,但仍占大气中碳的0.01%,大多数情况下,它是碳的放射性同位素。
碳-14和碳-15也是碳的稳定同位素,都有6个质子和8个中子,但碳-14的原子量为14,碳-15的原子量为15。
由于高质子数,碳-14和碳-15是自然界中最不稳定的同位素,但其含量又比碳-13要高。
尽管它们是放射性同位素,但其辐射后存活时间较长,这就导致了它们在自然界中的存在。
此外,研究人员发现了许多其他的同位素,他们的结构和特性也有所不同。
在氟,氯,氧和氮这四种元素中,都可以发现多种同位素,这些同位素的原子核结构都不同,由此可以推断出它们对应的特性也是不同的。
例如,氟-18和氟-17是两种稳定同位素,它们的原子核由9个质子和10个中子组成,但前者质量比后者大2倍,它们的物质性质也不尽相同。
另外,氯-35也是稳定同位素,其原子核由17个质子和18个中子组成,其中氯-35与氯-37是放射性同位素,它们的原子核由17个质子和20个中子组成。
由于质子数量不同,氯-35和氯-37的特性也不尽相同,例如,氯-37的辐射更加强烈。
以上就是不同的同位素的例子,它们都有着不同的原子核结构,这就决定了它们的原子量,以及它们的物质性质,甚至放射性质质不同。
碳同位素地球化学

理论分馏系数: 1. CO2-CH4间13C 富集于CO2相内, 随温度降低分馏系 数快速增大。 方解石-石墨和金刚 石-石墨分馏系数依 次减小,温度效应 减弱。 CO2-方解石和CO2金刚石在低温区分 馏出现反向富集 方解石- CO
(溶液)
13
13
(气)
CO 2 +( CO3 )
(溶液)
12
2
12
( 气)
CO 2 +( CO3 )
(溶液)
13
2
反应(1) α=1.014 反应(2) α=1.012
(25℃)
海水CO3-2和HCO3-比大气CO2富集13C
海相碳酸盐岩石δ13C为 -6.39~5.2‰ 平均为 -1.16‰ 陆地土壤中有机物产生的CO2富含12C贫13C. 淡水碳酸盐富集δ13C和δ18O, δ13C为 -18.5~8.5‰
(2)地幔碳同位素组成变化的原因:
东西伯利亚雅库梯矿床中彩色金刚石的δ13C值为 -5.0-32.3‰ 。平均 δ13C 值为 -11.8‰ ,比无色金刚 石的平均δ13C(-7.2)小,它与生物成因的碳同位 素组成重叠。
金刚石 δ13C 值的较大可变性与米切尔和克罗克 特( 1971 )的假说相一致,他们认为自然界金刚 石可能在比它的稳定域更浅的深度与更低的温度 下亚稳地形成(为什么)。
煤平均δ13C值约为-25‰ 海相石油δ13C值为-22~-29.4‰ 陆相石油δ13C值为-29.7~-32.8‰ 甲烷更富集12C 天然气δ13C值更负 变化范围更大
2. CO2与HCO-3和CO3-2 的 碳同位素分馏
碳同位素组成特征及其在地质中的应用

同位素地球化学目录一、碳的同位素组成及其特征 (1)1.碳同位素组成 (1)Ⅰ、碳的同位素丰度 (1)Ⅱ、碳的同位素比值(R) (1)Ⅲ、δ值 (2)2.碳同位素组成的特征 (2)Ⅰ.交换平衡分馏 (2)Ⅱ.动力分馏 (3)Ⅲ.地质体中碳同位素组成特征 (4)二、碳同位素在地质科学研究中的应用 (8)1. 碳同位素地温计 (8)2.有机矿产的分类对比及其性质的确定 (9)Ⅰ.煤 (9)Ⅱ.石油 (9)Ⅲ. 天然气 (11)碳同位素组成特征及其在地质科研中的应用一、碳的同位素组成及其特征1.碳同位素组成碳在地球上是作为一种微量元素出现的,但分布广泛,在地质历史中有着重要作用。
碳的原子序数为6 ,原子量为12.011,属元素周期表第二周期ⅣA族。
碳在地壳中的丰度为2000×10-6,是一个比较次要的微量元素。
在地球表面的大气圈、生物圈和水圈中,碳是最常见的元素之一,是地球上各种生命物质的基本成分馏。
碳既可以呈固态形式存在,又能以液态和气态形式出现。
它既广泛分馏布于地球表面的各层圈中,也能在地壳甚至地幔中存在。
总之,碳可呈多种形式存在于自然界中。
在有机物质和煤、石油中,以还原碳的形式存在,在二氧化碳气体和水溶液中,以氧化碳形式出现。
碳还可呈自然元素形式出现在某些岩石中(如金刚石和石墨)。
一般用同位素丰度、同位素比值和δ值来表示同位素的组成。
Ⅰ、碳的同位素丰度同位素丰度指同位素原子在元素总原子数中所占的百分比,自然界中的碳有2个稳定同位素:12C和13C。
习惯采用的平均丰度值分别为98.90%和1.10%。
由此可见,在自然界中碳原子主要主要是以12C的形式存在。
另外碳还有一个放射性同位素14C,半衰期为5730a。
放射性14C的研究,目前已发展成为一种独立的同位素地质年代学测定方法,主要应用于考古学和近代沉积物的年龄测定。
适合用于作碳稳定同位素分馏析的样品包括:石墨、金刚石等自然碳矿物,方解石、文石、白云石、菱铁矿、菱锰矿等碳酸盐矿物;石灰岩、白云岩、大理岩等全岩样品;各种矿物包裹体中的C O2和CH4气体以及石油、天然气及有机物质中的含碳组分馏等。
04 第四章(碳同位素)

碳是一种变价元素,在不同的条件下 可形成不同价态的化合物,它们之间存 在着明显的同位素分馏。
图1 生物圈与其它圈层间的相互 关系——有机碳循环与碳酸盐循
环(据S.Golubic等,1978)
• Carbon 14 is formed when cosmic radiation in the upper atmosphere excites a neutron, causing the neutron to impact a Nitrogen 14 atom and dislodges a proton forming carbon 14.
该系统中的碳同位素分馏可分为三个阶段。
第一阶段:大气CO2溶解阶段。研究表明,在20℃时,大气CO2的溶 解作用是在无明显分馏的情况下进行的,与大气CO2相比,溶解的 CO2大约贫乏1‰的13C。即:
7 (-8)=1‰ 13CCO2(大气)
13CCO2 ( 水中)
第二阶段:溶解的CO2和重碳酸 盐分馏阶段。在这一阶段,重碳
碳同位素及其丰度
自然界有六种碳同位素:10C、11C、12C、13C、14C*和15C*。主要 有三种,它们的丰度是:12C-98.89%;13C-1.108%;14C- 1.2×10-10%。其中12C、13C是稳定同位素,14C是放射性同位素。
13C是稳定同位素,用δ值表示,按δ值的定义:
13C
(
R样-R标 R标
)
1000=(
R样 R标
-1)1000
稳定碳同位素的国际标准为PDB。
The isotopes of H, O, C and S are ubiquitous in natural ground water and are useful in studying biogeochemical processes.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、 热液中碳同位素组成的 、 变化
碳是变价元素,电价的改变对于 13C是富集 还是贫化影响极大。因此在热液矿床中,碳酸 盐矿物的碳同位素组成不仅取决于热液的总碳 同位素组成,而且也强烈依赖于热液的物理化学参数,如氧逸度、酸碱度、温度、碳总浓 度的变化。由于这些参数的变化,即使热液体 系中碳的来源均一,从热液中沉淀的碳酸盐矿 物的碳同位素组成也会发生明显的变化。
(1)温度降低 温度降低使热液中CO2 的溶解度升高。含碳组分之间的同位素 交换,使CO2富集 13C,导致晚期形成的 碳酸盐矿物碳同位素组成的δ13C值升高。 但研究表明,温度下降100℃仅能使碳酸 盐矿物的δ13C值增加2‰。因此在该矿床 中,热液与渐冷的围岩中的碳酸盐矿物 之间同位素分馏的增强可能是晚期碳酸 盐矿物δ13C值增加的一个重要原因。
三、碳同位素地质测温
与硫、氧同位素相比,碳同位素地质测温 的适应性和效果都较差。 据 G. C. Ferrara 等 (1963) 研 究 , 在 意 大 利 Tuscany的Larderello喷气孔中,19个样品的碳 同 位 素 测 定 结 果 为 : δ13CCO2= -3.74‰ , δ13CCH4= -26.74‰,∆CO2-CH4=23.00‰。 根据图6-8Craig曲线查得平衡温度为258℃,该 值与H. Craig(1953)报道的黄石公园喷泉与温 泉 的 温 度 值 以 及 J. R. Hulston 和 W. J. McCabe(1962)报道的新西兰北岛地热区的温度 值相似,因而上述计算结果是比较合理的。
H. Ohmoto(1972)在这方面作了详细的研 究,他的结论是:热液碳酸盐矿物的碳 同位素组成取决于热液的总碳同位素组 成以及矿物沉淀时热液的温度、氧逸度、 酸碱度和阳离子浓度的变化特征。
氧逸度主要影响热液中合碳组分的氧化-还 原状态。 在高氧逸度情况下,热液中大多数碳以氧化 碳形式出现,CH4(水溶)可以忽略不计。在这 种高氧逸度条件下形成的碳酸盐矿物的δ13C 值与热液的总碳同位素组成相似。 当热液氧逸度降低时,CH4 (水溶)的数量迅 速增加。由于CH4 强烈富集 12C,因而所形成 的碳酸盐矿物便明显富集 13C,δ13C值可高达 29‰。
第三节 碳同位素在矿床学中的应用
ห้องสมุดไป่ตู้
一、碳同位素组成
碳有两种稳定同位素,其习惯用的丰度 值为: 12C 98.893% 13C 1.107% 表示碳同位素成分的方法有三种: 12C/13C的比值;或13C/12C比值、或δ13 C(‰)
碳同位素分布
1、 地壳中气体的碳同位素成分 、
根据对天然气、火山喷气、煤田气以及沉 积物所含气体的研究,可将地壳气体划分 如下: (1) 生物化学带:这个带CO2=CH4 反应 是有机的,δ13C= -50—-80‰,是生物分馏 作用引起的。 ·
在排除了脱碳酸盐化和地下水循环引起 的可能性之后,根据同位素资料与地质 资料的综合研究,他们认为在铁矿层中, 13C富集的原因是铁矿层的沉积环境,即 铁矿层形成于一个离海洋很近但又是封 闭的、不受海洋碳同位素组成影响的盆 地中。
铁矿层中轻碳主要来自由风化作用而被带入 沉积盆地的有机物。因为在与铁矿层伴生的 燧石中,已发现有微生物(藻类)存在的证据; 铁矿层中已发现有同位素组成与有机物相似 的还原碳,整个铁矿层都含有少量黄铁矿, 一般认为它是在有机物存在的情况下形成的。 由于火山气体的δ13C值一般为-8一-12‰,因 而在铁矿层形成过程中,火山作用也可能提 供一部分轻碳。
由于这些矿床都不含石墨,因而这些矿 床中方解石的平均δ13C值可近似作为矿 床的δ13C值。由此可知,矿床的δ13CΣC值 既不同于岩浆碳的值的δ13C值(-5一-8‰), 也不同于海相碳酸盐碳的δ13C值(近于 零),它们很可能是岩浆碳和碳酸盐碳 按不同比例混合的产物。
3、沉积矿床的碳同位素组成 、
可以看出,这些矿床的总碳同位素组成都落在 岩浆碳的范围内。这和氢、氧同位素研究得出 的这些矿床的成矿溶液以岩浆水为主的结论是 一致的。 此外,据穆治国等 (1981)研究,漂塘钨矿床中 层解石的δ13C值都低于-5.5‰,方解石的δ13C 值都高于-5.5‰。两者的成分都是碳酸钙,但 由于层解石的形成温度高,因而在温度较低条 件下形成的方解石便相对富集13C。
(2) 催化带:在这个带中,有机碳变为 甲烷。 (3) 热化学带:这个带中,CO2 =CH4 反应是无机的。 (4) 深部带:地幔石墨是呈气体形式存 在的碳的来源。 表层生物化学带富含轻碳(12C),愈向深 部愈富13C,深部带δ13C= -l0—-30‰。
2、岩石圈中的碳同位素 、
地壳中碳按同位素成分大体可分四类: (1) 沉积的碳酸盐类矿物和岩石,如方解石、 石灰岩、白云岩,其δ13C=0; (2) 岩浆成因的碳酸盐岩、金伯利岩中的碳 酸盐、金刚石、内生成因石墨等,其δ13C = 5.3— -7.0‰; (3) 火成岩及其中的碳,金伯利岩中SiC和黑 金刚石,其δ13C=-17.9一-28‰,与陨石碳相近 似; (4) 有机沉积物、沉积岩中的有机质、石油、 油页岩、煤和天然气等,其δ13C= -24—-29‰。
三 、 碳同位素在矿床成因研究 中的应用
(一)热液矿床的碳同位素组成 1、热液中碳的来源 、 归纳起来,成矿溶液中的碳有3个来源: 岩浆源或深部源,它们的δ13C值为-7‰ 左右; 沉积碳酸盐来源,其δ13C值为0左右; 沉积岩、变质岩与火成岩中的有机碳(还 原碳),它们的δ13C值为-25‰左右。
( 四 ) 石油和天然气的碳同位 素组成
在石油和天然气研究方面,碳同位素应 用占有十分重要的地位。 碳同位素在石油和天然气方面的应用可 概括为以下几个方面。
1、石油δ13C值的 "年龄效应 、石油 年龄效应" 值的 年龄效应
目前对世界各地不同时代 (从前寒武 纪至更新世)地层中油、气碳同位素组成 所作的统计分析表明,石油的碳同位素 组成与其形成时代之间有着明显的关系。
穆治国等 (1981)和张大椿等 (1984)对 我国某些钨矿床的碳同位素组成进行了 研究。由于这些矿床不含石墨,因而方 解石的平均δ13C值可近似等于成矿溶液 的δ13C值。
矿床 西华山 漂塘 行洛坑 阳储岭 δ13C -6.45(6) -3.70(14) -5.70(3) -8.0(4) 资料来源 穆治国 穆治国 张大椿 张大椿
澳大利亚Hamersley Range铁矿是一个 十分有名的沉积矿床。尽管对该矿床已 作过十分详细的研究,但关于矿床的成 因,特别是铁矿层的沉积环境仍然在争 论之中,有些研究人者认为是浅海相, 有的认为是咸湖相,还有些认为是内陆 淡水湖相。
为了解决这一问题,R.H.Becker和R. N. Clayton(1979)对该矿来进行了详细的碳 同位素研究。铁矿层 (Dales Gorge段)中 绝 大 多 数 碳 酸 盐 矿 物 的 δ13C 值 为 -9— 11‰; 位于铁矿层上、下的Duck Creek白云岩 和Wittenoom白云岩中,大部分碳酸盐矿 物的δ13C值为-2—+2‰,与现代海相碳 酸盐的δ13C值相似。
这些源区中的氧化碳是通过溶解反应, 即 CaCO3+2H+→ H2CO3+Ca2+ 和脱碳反应,即 3 白 云 石 +4 石 英 → 滑 石 +3 方 解 石 +3CO2进入热液体系
上述源区中的还原碳是通过氧化反应, 即 C+O2→CO2 和水解反应,即 2C+2H2O→CO2+CH4 进 入 热 液 体系。
对热液总碳的估计
( 二 ) 某些热液矿床的碳同位 素组成
R. O. Rye等(1979)对某些热液矿床中碳酸盐 矿物及气液包裹体中二氧化碳的碳同位素组成 进行了研究,其结果显示:图6-11。 早期形成的高温碳酸盐矿物一般以六面体晶体 为主,它们的δ13C值 (Panasqueira矿床除外)大 都在-6一-9‰之间,反映出这些碳具有深部来 源的特点。 晚期碳酸盐矿物(Upper Mississippi alley矿床除 外)一般均富13C。但在不同的矿床中,13C富集 的原因可能是不同的,归纳起来主要有:
热液的酸碱度变化主要影响热液中含 碳原子团的存在形式。 当热液的pH值小于6时,热液中H2CO3的 浓度大于HCO3- 的浓度,CO32- 的浓度可 以忽略不计。 随着热液pH值逐渐增加至12, HCO3-逐 渐居主要地位。 当热液的pH值大于12时,含碳组分则以 CO32-为主。
Ohmoto(1972)指出,除非成矿热液 的温度、氧逸度和酸碱度已知,否则不 能认为δ13C值为-5—-8‰的碳酸盐是从 δ13C∑C为-5—-8‰的热液中沉淀的。 生物成因碳的δ13C值的变化是很大的, 但是,热液氧逸度和酸碱度的变化也能 使热液中沉淀的碳酸盐矿物的δ13C值发 生很明显的变化。
2、斑岩型矿床的碳同位素组成 、
下表列出了我国某些不同种类斑岩型矿床 的碳同位素组成。
矿床 多宝山Cu 团结沟金矿 冷水铅锌矿 样品数 δ13C‰ 10 5 4 -2.48 -1.11 -3.82 δ18O‰ 2.8—2.1 10.2—-9.36 11.29—5.21 来源 马德有 吴尚全 黄耀生
H. Ohmoto和R. O. Rye(1979)指出,热液矿 床中一个潜在的地温计是方解石-二氧化碳。 通过测定不含碳的寄主矿物(host mineral)如石 英、硫化物的原生气液包裹体中二氧化碳以及 同时沉淀的方解石的碳同位素组成,就可利用 相应的分馏系数计算其形成温度。即使在温度 高达300℃的情况下所获得的成矿温度也是比 较可靠的,误差在士20℃范围内,因此,碳同 位素地温计也是有效的。
2、确定原油的形成环境 、
一般认为,石油是由海相或陆相盆地沉积物 中的动植物残体逐渐演化形成的;而海相和陆 相有机质的碳同位素组成是不同的。 E. T. Degens(1969)对现代沉积物中有机碳的研 究表明,海相沉积有机碳的δ13C值为-20‰左 右,淡水沉积有机碳的平均δ13C值为-25‰左 右,有的甚至低到-30%。。
