花生球蛋白和伴球蛋白的功能特性及构象研究
花生蛋白质改性方法与应用策略

花生蛋白质改性方法与应用策略李玉珍;肖怀秋;赵谋明【摘要】花生蛋白质是重要的植物蛋白质资源,具有消化利用率高、富含人体必需氨基酸和抗营养因子少等优点,由于传统加工方法蛋白质变性严重,限制了其在食品工业中的应用,而且不同食品加工体系对蛋白质功能特性要求不同,因此,对花生蛋白质进行改性来制备或满足食品加工需要是花生蛋白质资源精深加工的重要内容.文章从花生蛋白质改性机理、改性蛋白应用以及存在问题等方面进行系统论述,并对花生蛋白改性的研究方向进行了分析,以期为花生蛋白质的综合利用提供帮助.【期刊名称】《廊坊师范学院学报(自然科学版)》【年(卷),期】2016(016)004【总页数】6页(P48-53)【关键词】花生蛋白质;蛋白质改性机理;物理改性;化学改性;酶法改性【作者】李玉珍;肖怀秋;赵谋明【作者单位】湖南化工职业技术学院,湖南株洲412004;湖南化工职业技术学院,湖南株洲412004;华南理工大学,广东广州510640;华南理工大学,广东广州510640【正文语种】中文【中图分类】Q51蛋白质是细胞组成结构和细胞生物学功能发挥的重要物质基础,具有重要的营养功能,是食物最重要组分之一,对食品加工品质有重要的影响。
通过改变氨基酸顺序、种类和比例以及肽链长短可合成功能多样的蛋白质产物,蛋白质组成复杂性和结构多元化是蛋白质生物功能多样性的重要结构基础。
在食品加工过程中,不同食品加工体系对蛋白质功能特性有不同要求,如液态乳饮料要求蛋白质有良好的乳化分散性,而肉制品要求蛋白质具备良好的凝胶性和持水力,而任何一种蛋白质都不可能兼具所有加工特性,因此,在加工过程中,需平衡不同来源蛋白质的加工属性。
如何将蛋白质资源,特别是植物源蛋白质应用到不同加工类型的食品体系中,其核心技术就是对蛋白质进行改性处理[1]。
蛋白质改性就是人为地对蛋白质结构进行修饰。
从分子层面看,蛋白质改性实质是蛋白质分子主链或侧链基团的重构,通过氨基酸残基和多肽链的改变引起蛋白空间结构和理化性质的变化,从而改善其生物学功能和营养价值[2]。
球蛋白分类

球蛋白分类球蛋白(globularproteins)作为最为重要的生物大分子,可以被分为几大类,每一类具有不同的构象和生物学功能。
首先,可将球蛋白分为氨基酸蛋白质(amino acid proteins)和糖蛋白质(glycoproteins)。
前者是由氨基酸组成的蛋白质,它们的结构主要由折叠的α-螺旋和β-螺旋,以及胶状结构构成,例如表皮蛋白(keratin);后者是由糖苷键和氨基酸构成的蛋白质,具有免疫功能和结构稳定性,例如血凝素(fibrinogen)。
其次,金属蛋白质(metalloproteins)也属于球蛋白,它们通常含有某种金属离子,有助于其生物学功能。
例如,运载氧的血红蛋白(hemoglobin)含有四个铁原子,促进它的能量转移;另一个例子是细胞内的细胞钙调节蛋白(calmodulin),其含有钙离子,有助于其调节细胞代谢。
此外,膜蛋白(membrane proteins)也是典型的球蛋白,其主要功能是调节跨膜惯性运动和信号转导,常见的有离子跨膜转运蛋白和受体蛋白。
离子跨膜转运蛋白具有结构可折叠调节活性,它们可以调节多种离子的运载,有助于呼吸和肌肉收缩等;受体蛋白拥有通过交联折叠的结构,可以检测外界的刺激,有助于细胞的信号转导。
最后,凝血因子也属于球蛋白,由具有折叠结构的碳氢键构成,具有促进凝血的功能。
凝血因子是由12种不同类型的蛋白构成,它们主要参与血液凝固,可以促进血小板累积,阻止出血,限制伤口愈合,使血液循环正常。
综上所述,球蛋白可以被分为氨基酸蛋白质、糖蛋白质、金属蛋白质、膜蛋白和凝血因子等几大类,它们的形状、结构以及生物学功能都有一定的差异。
球蛋白的研究在生物学和医学上都有很重要的意义,它们可以帮助我们更好地了解生物体的结构和功能,为治疗疾病提供有效的药物研发等提供重要的借鉴。
蛋白质功能性
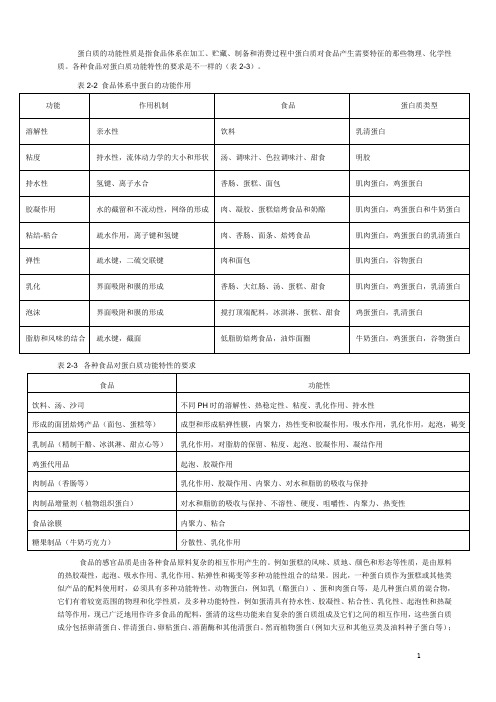
食品的感官品质是由各种食品原料复杂的相互作用产生的。
例如蛋糕的风味、质地、颜色和形态等性质,是由原料的热胶凝性,起泡、吸水作用、乳化作用、粘弹性和褐变等多种功能性组合的结果。
因此,一种蛋白质作为蛋糕或其他类似产品的配料使用时,必须具有多种功能特性。
动物蛋白,例如乳(酪蛋白)、蛋和肉蛋白等,是几种蛋白质的混合物,它们有着较宽范围的物理和化学性质,及多种功能特性,例如蛋清具有持水性、胶凝性、粘合性、乳化性、起泡性和热凝结等作用,现已广泛地用作许多食品的配料,蛋清的这些功能来自复杂的蛋白质组成及它们之间的相互作用,这些蛋白质成分包括卵清蛋白、伴清蛋白、卵粘蛋白、溶菌酶和其他清蛋白。
然而植物蛋白(例如大豆和其他豆类及油料种子蛋白等);a. 蛋白质分散在0.5%的磷酸盐缓冲液中,pH6.5,离子强度0.1,琥珀酰化(%)表示酵母蛋白中琥珀酰化的赖氨酸基数2.起泡性(foaming properties)食品泡沫通常是气泡在连续的液相或含可溶性表面活性剂的半固相中形成的分散体系。
种类繁多的泡沫其质地大小不同,例如蛋白质酥皮、蛋糕、棉花糖和某些其他糖果产品、点心顶端配料、冰淇淋、蛋奶酥、啤酒泡沫、奶油冻和面包等。
大多数情况下,气体是空气或CO2,连续相是含蛋白质的水溶液或悬浊液。
某些食品泡沫是很复杂的胶态体系,例如冰淇淋中存在分散的和群集的脂肪球(多数是固体)、乳胶体(或悬浊液)、分散的冰晶悬浮体,多糖凝胶、糖和蛋白质的浓缩溶液以及空气气泡。
通常用表面活性剂以保持界面,使之防止气泡聚集,因为表面活性剂能够降低界面张力,并积定义为100×E/A;膨胀量为100×B/A=100×(C-A)/A,起泡能力为100×B/D,泡沫相体积为第二种起泡方法是在有大量气相存在时搅打(或搅拌)或振摇蛋白质水溶液产生泡沫,搅打是大多数食品充气最常用一种方法,与鼓泡法相调制中常用到奶沫,而奶沫的制作就是用了搅打法。
4种花生粕蛋白的理化性质及功能特性研究

4种花生粕蛋白的理化性质及功能特性研究李婷;任虹;王丹丹;兰社益【期刊名称】《中国粮油学报》【年(卷),期】2016(031)011【摘要】以花生粕为原料,采用分级提取工艺提取花生清蛋白、球蛋白、醇溶蛋白和谷蛋白,研究4种花生粕蛋白的理化性质和功能特性.扫描电镜观察,4种花生粕蛋白的形态结构各不相同.SDS-PAGE法测定分子质量表明,清蛋白含有4种亚基,分子质量为70、40、30、25和15 ku;醇溶蛋白含有2种亚基,分子质量分别为25和15 ku;球蛋白含有5种亚基,相对分子质量分别为40、38、30、25和15 ku;谷蛋白含有4种亚基,相对分子质量分别为40、30、25和15 ku.花生清蛋白、醇溶蛋白、球蛋白、谷蛋白的等电点分别为pH 3.6、pH 5.2、pH 4.6、pH 5.0.功能性质研究表明,球蛋白的持水性最好,为1.52 mL/g,其次为谷蛋白1.10 mL/g,清蛋白和醇溶蛋白的持水性较低分别为0.49、0.14 mL/g;清蛋白的持油量相对较高为8.21mL/g,其次为球蛋白为7.16 mL/g,谷蛋白和醇溶蛋白的持油量相对较低,分别为3.82 mL/g和5.49 mL/g;清蛋白的乳化性和乳化稳定性相对较高,乳化能力(EC)值和乳化稳定性(ES)值分别为71.4%和83.33%,谷蛋白次之,EC和ES值分别为66.7%和82.86%,醇溶蛋白和球蛋白相对较低,EC值分别为64.0%和62.2%,ES值分别为82.35%和76.67%.综上,花生粕清蛋白的持油性、乳化性和乳化稳定性相对较好.【总页数】6页(P37-42)【作者】李婷;任虹;王丹丹;兰社益【作者单位】北京工商大学食品学院;北京市食品风味化学重点实验室;食品添加剂与配料北京高校工程研究中心,北京100048;北京工商大学食品学院;北京市食品风味化学重点实验室;食品添加剂与配料北京高校工程研究中心,北京100048;北京工商大学食品学院;北京市食品风味化学重点实验室;食品添加剂与配料北京高校工程研究中心,北京100048;北京工商大学食品学院;北京市食品风味化学重点实验室;食品添加剂与配料北京高校工程研究中心,北京100048【正文语种】中文【中图分类】TS209【相关文献】1.小麦分离蛋白质理化性质及功能特性研究 [J], 温青玉;张康逸;杨帆;盛威;康志敏;高玲玲2.TGase酶法交联改善低温花生粕分离蛋白功能特性的研究 [J], 任娇艳;胡晓;崔春;赵谋明;何鹏臣3.青麦仁分离蛋白理化性质及功能特性的研究 [J], 温青玉; 张康逸; 屈凌波; 李天义; 金先东; 宋江峰; 王康君4.杏鲍菇谷蛋白理化性质及功能特性研究 [J], 耿正玮;樊林娟;张咏梅;程艳芬;冯翠萍5.超声辅助碱性蛋白酶提取鸡爪胶原蛋白肽理化性质及功能特性 [J], 周婷;吴瑀婕;卢方云;杨彪;马晶晶;杨静;邹烨;王道营;徐为民因版权原因,仅展示原文概要,查看原文内容请购买。
受体蛋白的结构及功能研究

受体蛋白的结构及功能研究受体蛋白是一类具有重要生物学功能的蛋白质。
它们被广泛存在于各种生物系统中,从细胞表面的受体分子到细胞内部的信号转导分子都在这一类蛋白中发挥重要作用。
研究受体蛋白的结构与功能,有助于我们更深入地了解生物学基础研究和治疗一系列疾病的分子机制。
一、受体蛋白的定义与分类受体蛋白,指的是一类能够与化学物质、生物分子或外来物质结合,从而产生信号转导的蛋白质。
根据其结构特点不同,受体蛋白可分为多种类型。
其中,G蛋白耦联受体(GPCR)是最广泛研究的一类受体蛋白,它们通过活性的G蛋白在细胞内部产生信号响应。
细胞膜离子通道(Ligand-gated ion channel)也是一类常见的受体蛋白,它们可以响应离子或某些化学物质的结合而发生构象变化,从而控制离子的通道开闭;酪氨酸激酶受体(tyrosine kinase receptor)则是能够激活细胞内的酪氨酸激酶信号转导系统的一类蛋白质。
二、受体蛋白的结构特点受体蛋白的结构可以通俗地理解成由不同区域组成的类似于“锁”—“钥匙”的板块。
这些区域包括配体结合区域、跨膜域和细胞内膜区域。
当外界配体结合到配体结合区域时,受体蛋白的状态会发生变化,导致受体蛋白从细胞膜表面移到细胞内膜区域,并与跨膜域相连。
跨膜域主要是由α-螺旋和β-折叠构成的,它们负责传导信号。
在细胞内部,受体蛋白与多种细胞内信号转导分子相互作用,最终将信号传送至细胞内特定靶点,实现生物学效应。
三、受体蛋白的功能分析受体蛋白在生物学过程中具有极为重要的功能。
通过研究它们的结构和作用机制,科学家们可以对其进行更深入的探究,并为疾病筛查和药物开发提供有益的参考。
以GPCR为例,研究人员探索这类受体蛋白晶体结构的变化方式,以及在不同配体结合下的响应,从而深入了解它们的信号转导机制。
GPCR在临床上的应用广泛。
例如,β2肾上腺素能受体激动剂可用于治疗支气管痉挛,甲状腺素受体激动剂可用来治疗甲状腺癌并改善心功能。
免疫球蛋白的结构和类型

免疫球蛋白的结构和类型免疫球蛋白(Immunoglobulin,简称Ig)是一类在体内产生并参与免疫应答的蛋白质。
它具有类似球状的结构,由两个相同的重链和两个相同的轻链组成。
免疫球蛋白的结构和类型是在免疫系统领域中的重要研究内容之一免疫球蛋白的结构由其重链和轻链的序列和构象决定。
重链有五种类型,分别是IgM、IgD、IgG、IgA和IgE,轻链有两种类型,分别是κ和λ。
重链和轻链通过非共价键连接在一起,形成一个四链结构。
每个免疫球蛋白分子的两个重链和两个轻链分别形成一个可折叠和结实的Y形结构。
在免疫系统中存在多种类型的免疫球蛋白,它们在免疫应答中发挥不同的功能。
下面将分别介绍各种免疫球蛋白的结构和功能。
1.IgM(免疫球蛋白M):IgM是体内生成的第一个抗体,也是肿瘤细胞表面的B细胞受体。
它由五个抗体单体组成,每个单体由两个重链(μ链)和两个轻链(κ或λ链)组成。
在免疫应答初期,IgM起到快速清除病原体的作用;在长期免疫应答中,IgM向IgG转化,提供持久和特异性的保护。
2.IgD(免疫球蛋白D):IgD是另一种存在于B细胞表面的抗体,它是免疫球蛋白家族中结构最简单的一种。
IgD与IgM共同存在于B细胞表面,参与B细胞活化和免疫应答的调控。
3.IgG(免疫球蛋白G):IgG是循环免疫球蛋白中最常见的类型。
它在血液和组织中起着重要的保护功能。
IgG有四个亚型(IgG1、IgG2、IgG3和IgG4),每个亚型具有不同的生物学功能。
IgG能够中和病原体、调节免疫应答、激活吞噬细胞和凝集病原体等,是最重要的抗体类别之一4.IgA(免疫球蛋白A):IgA主要存在于黏膜表面和体液中,是防止病原体侵入黏膜组织的重要抗体。
IgA通过与黏膜上皮细胞表面的浆膜泡蛋白结合形成分泌型IgA,进而在黏膜表面形成第一道免疫屏障。
5.IgE(免疫球蛋白E):IgE对抗寄生虫和引起过敏反应的抗原具有特异性。
IgE参与过敏反应的发生,通过与嗜碱性粒细胞和肥大细胞结合而引发组织过敏反应。
粮食工程技术《大豆蛋白的结构特征与功能性质》
一大豆蛋白的结构与特征由于研究蛋白质的出发点不同,其分类方法也不同。
关于大豆蛋白的分类,一般有4种分类方法,分别按溶解度、构成蛋白质的最根本单位、结构和生理功能分类。
大豆球蛋白是由奥斯本〔Osborn〕和丹皮鲍尔〔Dampball〕首先用食盐溶液萃取,经反复透析沉淀而得到的一种蛋白质。
由于该蛋白质的长轴和短轴之比小于10:1,因而命名为大豆球蛋白。
球蛋白外形接近球形或椭圆形,溶解性较好,能形成结晶。
这种蛋白质也溶于水或碱溶液,加酸调pH至等电点4.5或加硫酸铵〔55%〕至饱和,那么沉淀析出,故又称为酸沉蛋白。
而清蛋白因无此特性,故又称为非酸沉蛋白。
根据构成蛋白质的最根本单位来分类,大豆蛋白根本上都属于结合蛋白,此种蛋白质由简单蛋白与其他非蛋白成分结合而成,即水解后所得产物不只是氨基酸,还含有一些配体,如糖等。
可以说大豆蛋白绝大局部都是糖蛋白,只是含糖多少不同。
大豆蛋白是具有四级结构的蛋白质。
植物蛋白按其在一系列溶剂里的溶解性分类〔此方法至今仍被沿用〕:溶于水的清蛋白〔albumin〕;不溶于水但溶于盐的球蛋白〔globulin〕;不溶于水但溶于70%-80%乙醇的溶蛋白〔prolamine〕;不溶于水、醇,但溶于稀酸或稀碱的谷蛋白〔glutelin〕。
因此,根据蛋白质组分在不同溶剂中的溶解性,可按顺序用蒸馏水、稀盐、乙醇、稀碱分别提取清蛋白、球蛋白、醇溶蛋白和谷蛋白,分别收集提取液来测定蛋白质组分含量。
根据生理功能分类法可分为贮藏蛋白和生物活性蛋白两类。
贮藏蛋白是主体,占总蛋白的70%左右,其中7S球蛋白约占37%,11S 球蛋白约占31%。
这种蛋白质没有生物活性,但它与大豆的加工性关系密切。
生物活性蛋白包括得较多,如胰蛋白酶抑制剂、β-淀粉酶、血细胞凝集素、脂肪氧化酶等,它们在总蛋白中所占比例不多,但对大豆制品的质量却有非常大的影响。
〔一〕蛋白体蛋白体外表有一层膜,使之接近球形。
大豆蛋白直径为5-2021,但大多数在5-8um这个狭小范围内。
球蛋白的功能和作用机理
球蛋白的功能和作用机理
球蛋白是一类水溶性蛋白质,其主要功能包括:
1. 抗体功能:球蛋白可以作为抗体,参与人体免疫反应,识别和结合各种抗原,进而启动免疫应答。
2. 酶功能:某些球蛋白具有酶作用,参与生理代谢过程,例如能够水解食物中的蛋白质,帮助人体吸收营养物质。
3. 运载功能:球蛋白可以与一些离子、分子、荷尔蒙和药物等结合,运输和分配到人体需要的部位。
其作用机理主要与其分子结构有关,球蛋白的分子结构通常为球状,具有较强的水溶性和稳定性,这些特性使其能够承担多种生理功能。
例如,球蛋白的特定结构可以识别和结合各种抗原,进而触发免疫反应;其结构还可以与离子和分子形成静电作用、氢键、亲水力等多种相互作用方式,实现药物运输、代谢调节等多种功能。
植物蛋白质简介
第五章植物蛋白质目前,人类在对蛋白质代谢的研究和认识过程中,逐步得出了以下四个方面的结论:(1)任何生物细胞并不会合成全部自身遗传信息中所具有的蛋白质。
但那些维持细胞生命活动基本代谢过程所需要的酶和蛋白质是必须合成的。
(2)由于细胞分化作用导致了各种专业化细胞的生成,使得不同的生物细胞所拥有的蛋白质各不相同,而且细胞的专业化可导致某些基本酶和蛋白质的合成终止。
例如,在种子中,专门贮存蛋白质的细胞所含有的蛋白质,在叶片细胞中就没有;反之,在叶片细胞中专门进行光合作用的蛋白质在种子中也不存在。
(3)在一个细胞内,其合成和拥有的蛋白质种类,将随着生物的生长发育过程而发生一定的变化。
例如,同工酶谱的变化。
(4)由人类DNA测序结果可知,真核生物基因不是一个基因决定一种蛋白质多肽链。
由于DNA转录产物RNA可剪接和编辑,因而一个基因可以编码两条以上蛋白质多肽链。
第一节种子贮存蛋白质人们通常将植物在某发育阶段合成、需保存到另一发育阶段才能发挥作用的蛋白质称为贮存蛋白质(storage proteins)。
典型的贮存蛋白质一般都具有水溶性低、细胞中存在量大和脱水状态下几乎无生物活性的特征。
在粮食作物中最重要的种子贮存蛋白主要有两种,即谷类作物种子蛋白和豆类作物种子蛋白。
一、谷类作物种子蛋白禾谷类种子的胚乳除含有大量淀粉外,还含有许多蛋白质。
虽然胚中的蛋白质含量很高,但由于胚比胚乳小得多,所以从种子蛋白的总量上看,大部分蛋白质存在于胚乳中。
禾谷类种子蛋白质的分离提取通常按溶解性不同分为四个组分,即清蛋白、球蛋白、醇溶蛋白和谷蛋白。
其中清蛋白可溶于水;球蛋白则溶于稀盐溶液中。
由于这两种蛋白在胚乳中含量较少,所以,有人认为它们可能是种子形成过程中酶蛋白的剩余物,并不是典型的种子贮存蛋白。
禾谷类种子中的蛋白质含量因品种、气候和栽培条件而异,其主要谷类蛋白质含量变化幅度见表1。
由表1可见,燕麦与其它谷物不同,其主要贮存蛋白是一种球蛋白。
珠蛋白_精品文档
珠蛋白珠蛋白是一种重要的蛋白质分子,广泛存在于生物体内,包括动物和植物。
它是由氨基酸序列组成的链状结构,在细胞内发挥着多种重要的生物学功能。
在这篇文章中,我们将探讨珠蛋白的结构、功能以及在生物体中的作用。
首先,让我们来了解珠蛋白的结构。
珠蛋白的分子结构包括多个氨基酸残基连接而成的氨基酸序列。
这些氨基酸残基按照一定的顺序排列,可以形成不同的结构域和功能区域。
珠蛋白的结构域包括α-螺旋、β-折叠和无规则卷曲结构。
这些结构域的不同组合可以赋予珠蛋白不同的功能和特性。
珠蛋白在生物体内发挥着重要的功能。
首先,珠蛋白可以作为酶的辅助蛋白质,帮助催化酶的活性。
它可以通过与酶结合来提供必要的辅助因子,促进酶的催化反应。
其次,珠蛋白也可以作为结构蛋白质,参与细胞内的结构组装。
它可以通过与其他蛋白质相互作用,形成复合物,从而维持细胞的结构稳定性和形态。
此外,珠蛋白还可以作为信号分子,参与细胞的信号传导和调控。
它可以与其他蛋白质、DNA或RNA相互作用,调控基因的表达和细胞的功能。
珠蛋白在生物体中的作用极其广泛。
在动物体内,珠蛋白参与免疫应答和炎症反应。
它可以识别并结合病原体,激活免疫细胞,参与清除病原体和维持机体的免疫平衡。
此外,珠蛋白还参与血液凝块的形成和溶解,维持血管的正常功能。
在植物体内,珠蛋白参与植物的抗逆性和生长发育。
它可以调控植物的抗氧化能力、耐盐性和抗病能力,从而提高植物的生长和产量。
珠蛋白的功能和作用机制还有很多待研究的领域。
科学家们正在努力研究珠蛋白的结构和功能,以及其在疾病发生和治疗中的作用。
他们希望通过深入了解珠蛋白的生物学特性,为人类健康和农业生产提供新的突破。
总结起来,珠蛋白是一种重要的蛋白质分子,具有多种结构和功能。
它在生物体内发挥着重要的作用,包括酶的辅助、结构组装和信号传导等。
珠蛋白在动物体内参与免疫应答和炎症反应,在植物体内参与抗逆性和生长发育。
我们对珠蛋白的研究还有很多不足,但随着科技的进步,相信我们将会对珠蛋白有更深入的了解,为人类健康和农业生产做出更大的贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
模量值( G’ ) 约为花生球蛋 白的 5倍。花生球蛋 白的变性温度 T d ( 1 0 4 . 8 4℃ ) 及焓变值 A H( 1 3 . 7 8 J / g ) 显著 高于伴球蛋 白的变性温度 ( 8 9 . 4 7 ℃ )与焓变值 ( 8 . 1 1 J / g ) ( P < 0 . 0 5 ) ;花生球蛋 白分子表 面的巯基 ( S H) 较少,欠部分巯基包裹于球蛋 白分子 内部 ,而伴球蛋 白中大部分巯基暴露于分子的表 面。荧光光谱分析表 明,伴球蛋 白比花生球蛋 白具有更疏松的三级结构和更高的界面活性。 关键词:花生球蛋白;伴球蛋白;结构特性;功能特性
现代食品科技
Mo d e r n F o o d S c i e n c e a n d T e c h n o l o g y
2 0 1 3 , V o 1 . 2 9 , No . 9
花生 球 蛋 白和 伴球 蛋 白 的功 能特 性及构 象研 究
刘岩 ’ ,赵冠里 ,苏新 国 ’
Ab s t r a c t : A c o mp a r a t i v e s t u d y wa s ma d e o n f u n c i t o n a l a n d c o n or f ma t i o n a l p r o p e r t i e s o f a r a c h i n a n d c o n a r a c h i n i s o l a t e d b y a mmo n i u m
LI U Ya h , ZHAO Gu a n- i ̄ f , S U Xi n- g uo
( 1 . C o l l e g e o f F o o d , G u a n g d o n g F o o d a n d D r u g V o c a t i o n a l C o l l e g e , G u a n g z h o u 5 1 0 5 2 0 , C h i n a )
s u l f a t e . C o n a r a c h i n h d a t h e h i g h r e s o l u b i l i t y ha t n a r a c h i n e x c e p t a t n e a r p I( p H 4 . 5 - 6 . 0 ) . A n d c o n a r a c h i n h a d b e t t e r e m u l i s i o n a b i l i t y i n d e x ( 7 0  ̄ 1 8 0 m a nd f o a m c a p a c i t y( 3 6 - - 5 7 %) t h a n a r a c h i n( 6 0  ̄ 1 3 0 m Z / g nd a 1 9  ̄ 3 3 %) . T h e G’ o f c o n a r a c h i n wa s 5 t i me s h i g h e r t h a n t h a t o f a r a c h i n . A r a c h i n h a d h i g h e r d e n a t u m t i o n t e mp e r a t u r e( 1 o 4 . 8 4 ̄ C nd a A l l v a l u e 1 3 . 7 8 J / 曲t ha n c o n a r a c h i n( 8 9 . 4 7℃ a n d 8 . 1 1 J / 曲( P < 0 . 0 5 ) .
( 1 . 广东食品药品职业学院,广东广州 5 1 0 5 2 0 ) ( 2 . 中国农业科学院农产品加工研究所,北京 1 0 0 1 9 3 )
摘要 :本丈对花生球蛋白与伴球蛋白的结构和功能特性进行了分析和比较。结果表明,花生球蛋白在等 电点附近 ( p H4 . 5  ̄ 6 . 0 )
( 2 . I n s t i t u t e o f A g r o — f o o d S c i e n c e nd a T e c h n o l o g y , C h i n e s e Ac a d e m y o f Ag r i c u l t u r a l S c i e n c e s , B e i j ng i 1 0 0 1 9 3 , C h i n a )
比伴球蛋 白具有 更高的溶解性 ,而在偏 离等电点时其溶解性低 于伴球蛋 白,伴球蛋 白的乳化活性指数 ( 7 0 - - 1 8 0 m 2 /球蛋 白的乳化活性指数 ( 6 0 ~ 1 3 0 m2 / g )和起泡能力 ( 1 9 ~ 3 3 %) ( P < 0 . 0 5 ) ,伴球蛋 白所形成热凝胶 的弹性
Mo s t o ff r e e S H o fa r a c h i n Wa s b u r i e d i n t h e nt i e r i o r , b u t l o c a t e d t a he t s u r f a c e o fc o n a r a c h i n —C o mp a r e d wi m c o n a r a c h i n . a r a c h i n h a d mo r e
文 章篇 号 :1 6 7 3 — 9 0 7 8 ( 2 0 1 3 ) 9 - 2 0 9 5 — 2 1 0 1
Fu n c t i o n a l a n d C0 n f 0 r ma t i o n a l Pr o p e r i t e s 0 f Ar a c h i n a n d Co n a r a c h i n
