奥美拉唑的合成进展
奥美拉唑的药代动力学研究进展

奥美拉唑的药代动力学研究进展奥美拉唑是一种常用的质子泵抑制剂,被广泛用于治疗胃酸相关疾病,如胃溃疡、食管反流病和幽门螺杆菌感染等。
药代动力学研究是了解药物在体内的吸收、分布、代谢和排泄过程的重要手段,对于优化药物治疗方案、预测药物的疗效和安全性具有重要意义。
本文将介绍奥美拉唑的药代动力学研究进展。
1. 药物吸收奥美拉唑是一种口服给药的质子泵抑制剂,其口服后会在胃酸的作用下迅速转变为活性物质,从而发挥药物疗效。
研究表明,奥美拉唑的吸收受到食物的影响,食物可延缓奥美拉唑的吸收速度,但对总吸收量没有显著影响。
此外,奥美拉唑的吸收也受到胃酸的影响,胃酸抑制剂的使用可减慢奥美拉唑的吸收速度。
2. 药物分布奥美拉唑在体内主要分布在胃黏膜和肝脏组织中,其中胃黏膜是奥美拉唑发挥作用的主要靶点。
研究表明,奥美拉唑在胃黏膜中的浓度较高,可抑制胃酸的分泌,从而有效治疗胃酸相关疾病。
此外,奥美拉唑还可通过血液进入肝脏组织,参与药物的代谢过程。
3. 药物代谢奥美拉唑在体内主要经过肝脏的代谢作用,其中CYP2C19是奥美拉唑代谢的主要酶。
研究表明,奥美拉唑的代谢能力存在个体差异,部分人群中CYP2C19酶活性较低,导致奥美拉唑的代谢速度较慢,药物在体内的半衰期延长。
因此,在临床上应根据患者的基因型和酶活性来调整奥美拉唑的剂量,以达到更好的治疗效果。
4. 药物排泄奥美拉唑在体内主要通过尿液排泄,尿液中的奥美拉唑主要以代谢产物的形式存在。
研究表明,奥美拉唑的排泄速度较快,约占总剂量的80%左右。
此外,奥美拉唑还可通过胆汁排泄,但对总剂量的贡献较小。
总结起来,奥美拉唑的药代动力学研究揭示了该药物在体内的吸收、分布、代谢和排泄过程。
了解奥美拉唑的药代动力学特性有助于优化该药物的治疗方案,提高治疗效果和减少不良反应的发生。
此外,奥美拉唑的药代动力学研究还为个体化用药提供了理论依据,通过调整剂量和给药方案,能够更好地满足患者的治疗需求。
制药工艺-奥美拉唑的生产工艺原理PPT课件

二、5-甲氧基-1H-苯并咪唑-2-硫醇的制备
O
O
NO2
SnCl2/HCl
NH2
NH2 NH2
O
CS2/KOH/C2H5OH
N SH N H
(一) 4-甲氧基邻苯二胺的制备
1、工艺原理
Ar-NO2
Ar-NH2
金属Zn、Sn和Fe (酸性条件下) 催化氢化 水合肼 硫化钠
机理
+O Ar N
O-
具有迅速缓解疼痛、疗程短、病变愈合率高的优点
该药无严重的副作用, 耐受性良好,适用于治疗胃 及十二指肠溃疡、返流性食管炎等等,是目前已发 现的胃酸抑制剂中疗效最强者之一
奥美拉唑是由瑞典Astra 公司研究开发的, 于 1988 年上市
到1992 年已有65个国家批准使用。1998-2000 年, 按单一药品销售额计连续三年列全球畅销药 物的第一名
㈡ 5-甲氧基-1H-苯并咪唑-2-硫醇的 制备
1、工艺原理
CS2 + KOH + C2H5OH
O
NH2
NH2
回流
S
H3C
O
S-K+
+
乙氧基黄原酸钾
O
N SH
N H
2、反应条件与影响因素
原料摩尔比 乙醇原料又为溶剂
生成5-甲氧基-1H-苯并咪唑-2-硫醇钠盐,加酸游离析出
产生硫化氢,需要碱性水溶液吸收尾气
3、工艺过程
① 配料比:重量配料比为4-甲氧基-2-硝基 乙酰苯胺:碱液:水=1:1.86:1.56.
② 操作方法:将7-10加到已经配制好的碱 液中,回流15min后,加水,再回流15min, 冷却至0-5℃,抽滤,冰水洗涤三次,得砖红 色固体的4-甲氧基-2-硝基苯胺(7-11), mp122-123℃ ,收率88%。
奥美拉唑合成、药理ppt(1)

(2)2,3,5-三甲基- 硝基吡啶- 氧化物(3) (2)2,3,5-三甲基-4-硝基吡啶-N-氧化物(3) 将化合物(2) mol)加到 加到500 mL三口瓶 将化合物(2) (54.8 g, 0.4 mol)加到500 mL三口瓶 缓慢倒入48 mL浓硫酸 搅拌加热至90℃,滴加70 浓硫酸, 90℃,滴加 中,缓慢倒入48 mL浓硫酸,搅拌加热至90℃,滴加70 mL 浓硫酸与82.6 65%浓硝酸的混合液 浓硝酸的混合液,1.5 h滴加完毕 浓硫酸与82.6 mL 65%浓硝酸的混合液,1.5 h滴加完毕 保温反应5 h,反应完毕 冷却至0℃, 反应完毕, 0℃,分出下层混酸层 ,保温反应5 h,反应完毕,冷却至0℃,分出下层混酸层 回用,上层物倒入冰水中, 5%碳酸钠水溶液中和 碳酸钠水溶液中和, 回用,上层物倒入冰水中,用5%碳酸钠水溶液中和,并用 乙酸乙酯萃取,分出有机相,无水硫酸镁干燥, 乙酸乙酯萃取,分出有机相,无水硫酸镁干燥,溶剂浓缩 至干, g淡黄色固体(3),收率 淡黄色固体(3),收率94.1%,mp: 69~ 至干,得68.5 g淡黄色固体(3),收率94.1%,mp: 69~ 71℃ 、4-甲氧基- 2,3,5-三甲基吡啶-N-氧化物(4) 3)、 甲氧基- 2,3,5-三甲基吡啶- 氧化物( (3) 将化合物(3) mol)和 28%的工 将化合物(3) (49.2 g, 0.27 mol)和105 mL 28%的工 业甲醇钠溶液加到500 mL无水甲醇中 搅拌加热至回流, 无水甲醇中, 业甲醇钠溶液加到500 mL无水甲醇中,搅拌加热至回流, 反应3h 减压蒸馏回收溶剂至干,冷却至室温,加入5% 3h, 反应3h,减压蒸馏回收溶剂至干,冷却至室温,加入5% 碳酸钠水溶液,调节PH PH至 100ml× 的二氯甲烷萃取, 碳酸钠水溶液,调节PH至8,用100ml×2的二氯甲烷萃取, 合并有机层,无水硫酸镁干燥,浓缩回收溶剂至干, 合并有机层,无水硫酸镁干燥,浓缩回收溶剂至干,得 43g黄色油状物(4),无需精制可直接用于下一步反应。 43g黄色油状物( ),无需精制可直接用于下一步反应。 黄色油状物 无需精制可直接用于下一步反应
奥美拉唑的合成进展

奥美拉唑的合成进展
饶国武;胡惟孝;杨忠愚
【期刊名称】《合成化学》
【年(卷),期】2002(010)004
【摘要】介绍了抗胃溃疡新药奥美拉唑的各种合成方法,并评价了其优缺点.参考文献29篇.
【总页数】6页(P297-301,313)
【作者】饶国武;胡惟孝;杨忠愚
【作者单位】浙江工业大学制药工程研究所,浙江,杭州,310014;浙江工业大学制药工程研究所,浙江,杭州,310014;浙江工业大学制药工程研究所,浙江,杭州,310014【正文语种】中文
【中图分类】R975+.5;TQ463+.53
【相关文献】
1.奥美拉唑杂质的合成 [J], 王易;伏世建;刘文杰;张伟
2.奥美拉唑的合成工艺进展 [J], 肖国民;吴平东
3.有机合成新理念及前沿方法在化学制药工艺学教学中的体现r——以奥美拉唑的合成为例 [J], 高鹏;白梓静
4.抗胃溃疡新药奥美拉唑的合成研究进展 [J], 梁亮;崔英德
5.奥美拉唑合成研究 [J], 马金焕;臧营
因版权原因,仅展示原文概要,查看原文内容请购买。
奥美拉唑的生产工艺流程框图
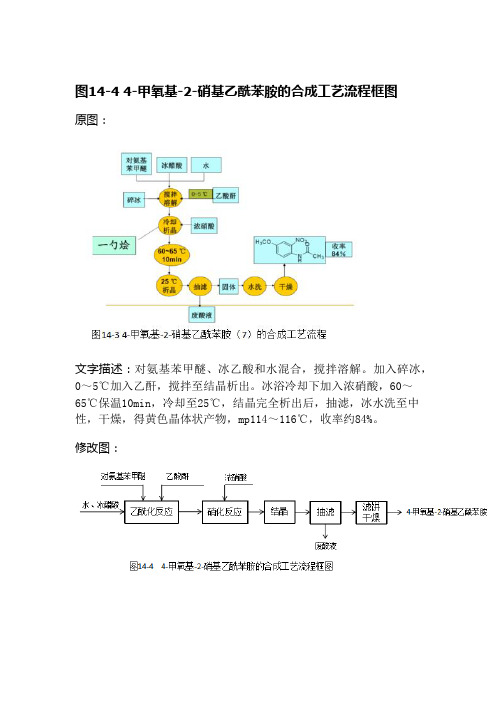
图14-4 4-甲氧基-2-硝基乙酰苯胺的合成工艺流程框图原图:文字描述:对氨基苯甲醚、冰乙酸和水混合,搅拌溶解。
加入碎冰,0~5℃加入乙酐,搅拌至结晶析出。
冰浴冷却下加入浓硝酸,60~65℃保温10min,冷却至25℃,结晶完全析出后,抽滤,冰水洗至中性,干燥,得黄色晶体状产物,mp114~116℃,收率约84%。
修改图:图14-5 4-甲氧基-2-硝基苯胺的合成工艺流程框图原图:文字描述:将4-甲氧基-2-硝基乙酰苯胺原料加入Claisen碱液中,加热回流15min,加水,再回流15min,冷却至0~5℃结晶,抽滤,冰水洗3次,得砖红色固体产物,mp122~123℃,收率约88%。
修改图:图14-6 4-甲氧基邻苯二胺的合成工艺流程框图原图:文字描述:SnCl2与浓盐酸混合溶解,20℃下加入4-甲氧基-2-硝基苯胺,搅拌反应3h。
滴加40%NaOH液至pH=14,控温不超过40℃。
用乙酸乙酯萃取2次,水洗有机相,无水Na2SO4干燥。
减压脱出溶剂,黄色油状物冷冻结晶,得产物4-甲氧基邻苯二胺,收率约72%。
修改图:图14-7 5-甲氧基-1H-苯并咪唑-2-硫醇制备工艺流程框图原图:文字描述:搅拌下将4-甲氧基邻苯二胺和CS2加到95%EtOH和KOH的混合液中,加热回流3h。
加入活性炭回流,趁热过滤。
滤液搅拌下滴加乙酸至pH=4~5析出结晶,冷却至4~5℃使析出完全。
抽滤,水洗至中性,干燥,得土黄色产物结晶,mp254~256℃,收率约78%。
修改图:图14-8 2,3,5-三甲基吡啶-N-氧化物的制备工艺流程框图原图:文字描述:将2,3,5-三甲基吡啶与H2O2、HAc混合,搅拌下缓缓升温至80~90℃,反应24h。
减压蒸除溶剂,冷却,用40%的NaOH调节pH =14,用CHCl3萃取3次,无水Na2SO4干燥。
减压浓缩,50~60℃真空干燥,得黄色固体产物,收率80.3%。
修改图:图14-9 4-硝基-2,3,5-三甲基吡啶-N-氧化物制备的工艺流程框图原图:文字描述:搅拌、控温<90℃,将硫酸滴加到三甲基吡啶氧化物中,缓慢滴加混酸(硫硝比=1∶1.10),90℃保温反应20h。
第七章 奥美拉唑的生产工艺原理

(二)、奥美拉唑的制备 1 工艺原理
常用的氧化剂有:30%H2O2、NaIO4或叔丁基氯酸酯(t-BuOCl)
2 反应条件与影响因素
① MCPBA与7-8的摩尔比为1:1.
② 反应溶剂为氯仿或者乙酸乙酯
③ 产物容易氧化分解,应避光于干燥阴凉处。
3 工艺过程
7-8溶于氯仿,将反应液冷却至-10℃以下,滴加MCPBA的氯仿溶液 (MCPBA:氯仿=1:15.11),室温搅拌15min。用饱和碳酸氢钠水溶液 和水依次洗涤反应液,无水硫酸镁干燥。减压浓缩至干,得棕黑 色产物。用已腈处理粗品,得白色或几乎白色粉末奥美拉唑7-1, mp:>154,收率67.4%。
2. 4-甲氧基-2-硝基苯胺的制备 (1)工艺原理
(2)反应条件与影响因素
① 反应碱液配制的比例: 氢氧化钾:水:乙醇= 176g:126mL:374mL ② 反应中加水稀释的目的是什么?
(3)工艺过程
① 配料比: 重量配料比为4-甲氧基-2-硝基乙酰苯胺:碱液:水=1:1.86:1.56. ② 操作方法: 将7-10加到已经配制好的碱液中,回流15min后,加水,再回流15min, 冷却至0-5℃,抽滤,冰水洗涤三次,得砖红色固体的 4-甲氧基-2-硝基 苯胺(7-11),mp122-123℃ ,收率88%。
两种原料来源困难,合成难度大,文献 资料少,实用价值不大。
断开C处
三、4-甲氧基邻苯二胺和2-[(3,5-二甲基-4-甲氧基-2吡啶基)甲硫基]甲酸反应
7-23合成路线长,制备困难,使整个路线较长, 后处理麻烦,总收率低于路线1
断开d处
四、5-甲氧基-2-甲基亚磺酰基-1H-苯并咪唑碱金属盐与 1,4-二甲氧基-3,5-二甲基吡啶鎓盐反应
刘兰兰 学号:1045252109 奥美拉唑的生产工艺设计 1

《制药工艺学》课程见习总结报告奥美拉唑的生产工艺设计药学院制药工程系2013年4月8日目录1 绪论 (3)1.1 奥美拉唑的性质 (3)1.2 奥美拉唑的药理作用及不良反应 (3)1.3 奥美拉唑的常见剂型 (4)2 工艺路线及主要反应原理 (4)2.1 工艺路线 (4)2.1.1 5-甲氧基-1H-苯并咪唑-2-硫醇(6)与2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(7)反应 (5)2.1.1奥美拉唑的合成路线 (6)2.2 主要反应原理 (7)2.2.1 5-甲氧基-1H-苯并咪唑-2-硫醇的生产工艺原理 (7)2.2.2 2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐的生产工艺原理 (9)2.3 奥美拉唑的成产工艺流程 (10)2.4 反应设备 (11)2.5“三废”处理及综合利用 (11)3 总结 (12)参考资料 (12)1 绪论瑞典 AstraZenaca 公司研制奥美拉唑(omeprazole)是世界上第一个应用于临床的质子泵抑制剂,为治疗胃溃疡的特效药。
奥美拉唑分子由苯并咪唑通过亚砜基连接吡啶环组成,内含手性硫原子,故存在 S-(-)型和 R-(+)型对映异构体。
相对于外消旋体和 R-构型奥美拉唑,S-构型奥美拉唑的疗效好,毒副作用低。
光学活性 S-2 构型奥美拉唑镁盐(商品名 Nexium)已于2000 年在瑞典首次上市。
通过对外消旋体进行拆分是获得 S-奥美拉唑对映体的方法之一。
目前,拆分奥美拉唑的方法有:高效液相色谱、结晶法(WO9702261)、模拟移动床色谱和化学拆分等。
1.1 奥美拉唑的性质奥美拉唑(omeprazole简称OPZ)是1988年由瑞典Astra Zenaca公司开发成功,并在瑞士首先上市,1998年通过FDA批准在美国上市,商品名为”洛塞克”。
奥美拉唑的化学名为5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)甲基亚磺酰基}-1H-苯并咪唑,分子式C17H19N3O3S ,分子质量为345.41,化学结构式如图(1)所示。
奥美拉唑的结构性质鉴别与合成

H3CO
N
CH3
N
S
H
O
N
埃索美拉唑
OCH3 CH 3
鉴别反应
? 在0.1mol/L氢氧化钠溶液中溶解后,加硅钨酸试液摇匀,再滴加数 滴稀盐酸,即产生白色絮状沉淀。
? 取本品,加无水乙醇制成每 1m1中含15μg的溶液,照分光光度法测 定,在 302nm 的波长处有最大吸收。
合成原理
甲基化
氧化
硝化
甲氧基化
水解
氯代
2-巯基-5环合-甲氧基苯并咪唑
酰胺化 保护氨基
还硝 原基
硝化 水解还原氨基
Байду номын сангаас
酰化
2-氯甲基-3,5-二 甲基-4-甲氧基吡 啶
5-甲氧基-2[(4-甲氧基-3,5二甲基吡啶)2-甲硫基]-1H苯并咪唑
间氯过氧苯甲酸 氧化
体内代谢
前药
? 奥美拉唑在体外无活性,口服进入胃壁细胞后,在 H+催化下转化为 次磺酰胺等形式。
? 本品在体内代谢较为复杂。次磺酰胺是奥美拉唑的活性代谢物,与 H+/K+ -ATP酶结合而使之失活,从而抑制胃酸的生成。
? 但次磺酰胺极性太大,不易吸收入血,不能直接作为药物使用。 ? 本品在肝脏代谢后,迅速通过肾脏排出。
临床用途
? 本品主要适用于十二指肠溃疡和卓 -艾综合征,也可用于胃溃疡和 反流性食管炎。
? 临床用于治疗消化道溃疡,比传统的 H2受体拮抗剂作用更好,能迅 速缓解疼痛,疗程短,治愈率高,不良反应少。
鉴别反应合成原理甲基化氧化硝化甲氧基化酰化水解氯代间氯过氧苯甲酸氧化酰胺化保护氨基硝化水解还原氨基硝基硝基还原还原环合环合2巯基5甲氧基苯并咪唑2氯甲基35二甲基4甲氧基吡啶5甲氧基24甲氧基35二甲基吡啶2甲硫基1h苯并咪唑?奥美拉唑在体外无活性口服进入胃壁细胞后在hh催化下转化为次磺酰胺等形式
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
奥美拉唑的合成进展
20082350XXXX 药081-1 XXX
摘要: 介绍了抗胃溃疡新药奥美拉唑的各种合成方法,包括缩合直接制备和硫醚
氧化制备,其中国内生产主要为第二种方法。对这些方法进行评价了其优缺点。
关键词: 奥美拉唑; 抗胃溃疡; 苯并咪唑; 烷基吡啶; 合成;
奥美拉唑(Omeprazole, 1),化学名 5-甲氧基2- [ ( 4-甲氧基-3, 5-二甲
基吡啶基)甲亚硫酰基] 1H苯并咪唑,属苯并咪唑类,为近年国内外临床应用的
新型、高效安全的抗消化道溃疡药物。纯净的奥美拉唑为白色结晶或结晶性粉末 ,
溶于二氯甲烷、三氯甲烷 ,几乎不溶于乙腈和乙酸乙酯,熔点为147~150℃[1]。
奥美拉唑呈弱碱性 ,在 pH值 =7~9的条件下化学稳定性好。奥美拉唑的抗消化
道溃疡作用及其作用机理与其理化性质密切相关.奥美拉唑为脂溶性弱碱性药
物,易浓集于酸性环境中特异地分布于胃粘膜壁细胞的分泌膜中。在酸性的条件
下奥美拉唑转化为亚磺酰胺(sulphenamide)的活性形式,然后通过二硫键与壁细
胞分泌膜中的H 一K 一 ATP酶(又称质子泵)呈不可逆性结合而抑制该酶的活
性,使壁细胞分泌胃酸功能明显减弱,故奥美拉唑又称为质子泵阻断药[2]。
奥美拉唑是瑞典 ASTRA公司研制开发的第一代苯并咪唑类质子泵拮抗
剂 ,于 1988年上市,到 1992年已65个国家和地区批准和使用 , 1998~2000
年连续三年列全球畅销药物的第一名[3],2002年其销售额为 52亿美元。奥美
拉唑用于治疗消化性胃溃疡和返流性食管炎等疾病[4],对胃酸分泌的抑制作用
强 ,作用时间长达48h[5]。
结构式1
1合成方法
奥美拉唑最早的合成专利报道于1979 年。奥美拉唑结构分为苯并咪唑和吡
啶两部分, 虽然其合成包括了许多步骤, 但合成方法大致可分为两大类。
1. 1 缩合直接制备
该类合成方法是由甲基亚磺酰基甲氧基苯并咪唑碱金属盐和烷氧基吡啶金
翁盐缩合直接制备。反应温度一般在 0℃~ 120℃, 取决于所用碱金属离子M
和组分X溶剂的沸点是最佳操作温度, 收率72%[6] 。
1. 2 硫醚氧化制备
1.2.1路线一:
5-甲氧基-1H-苯并咪唑-2-硫醇(6)与2氯甲基-3,5-二甲基-4-甲氧基吡啶
盐酸盐(7)在碱性条件下,发生Williams反应,生成硫醚(8)。间氯过氧苯甲
酸(MCPBA)和高碘酸钠是将硫醚氧化成亚砜的常用试剂,该步反应收率在70%以
上。反应温度一般在 0℃~150℃, 温度取决于所用溶剂的沸点, 反应时间在
5 ~ 12h,收率85% ,再氧化得[8]|。
此路线具有合成路线短,收率高的特点,是国内厂家生产奥美拉唑(1)采
用的路线。
H3CON
N
H
SH
+
NHCH3OCH3H3CCH2Cl
Cl
H3CO
N
N
H
S
N
CH
3
OCH3H3C
H3CO
N
N
H
S
ONCH3OCH3H3C
6
7
8
1
NaOH/C2H5OH
MCPBA
1.2.2路线二
2氯-5-甲氧基-1H-苯并咪唑与3,5-二甲基-4-甲氧基-2-吡啶甲硫醇反应[9]
与路线一相似,但是两种原料来源困难,合成难度大,文献资料少,实用价
值不大。
1.2.3路线三
4-甲氧基邻苯二胺和2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]甲酸反应
[10]
缺点:(23)合成路线长,制备困难,使整个路线较长,后处理麻烦,总收
率低于路线一
2.结语:
奥美拉唑是上世纪八十年代首个上市的质子泵抑制剂,至今药物已经具有二
十多年临床治疗史,验证了其卓着的疗效和可靠的安全性。它为第一代质子泵拮
H3CON
N
H
Cl
+
NHCH3OCH3H3CCH2SH
Cl
H3CO
N
N
H
S
N
CH
3
OCH3H3C
H3CO
N
N
H
S
ONCH3OCH3H3C
21
22
8
1
NaOH/C2H5OH
MCPBA
H3CONH
2
NH
2
+
N
H3COCH3CH
3
SOH
O
HCl
H3CO
N
N
H
S
N
CH
3
OCH3H3C
8
H3CO
N
N
H
S
N
CH
3
OCH3H3C1O
NalO
4
1223
抗剂。随着奥美拉唑的成功,近年来对质子泵拮抗剂的基础和临床研究又取得了
巨大进展并出现了第二代第三代药品,如替那拉唑和雷贝拉唑、埃索美拉唑[11]。
在奥美拉唑的带动下,相信随着研究的深入质子泵拮抗剂的应用方式还会发生变
化,新的质子泵拮抗剂也会很快的进入市场并得到广泛应用。
参考文献
[1]陈芬儿. 有机药物合成法M. 北京: 中国医药科技出版社1999.
[2]刘宇宏, 王世鑫. 近年来质子泵抑制剂的研究进展[ J].中国新药杂志, 2001
[3]刘宇宏,王世鑫.近年来质子泵抑制剂的研究进展 [J]. 中国新药杂志,
2001,
[4]江新春.奥美拉唑的临床应用进展 [J].安徽医药, 1998, 2 1 :28 - 30.
[5]王成永,时 军.奥美拉唑肠溶微丸制备及其质量影响因素探讨 [J].安徽医
药,2005, 9 7 :493.
[6]饶国武, 胡惟孝, 杨忠愚.奥美拉唑的合成进展[J].浙江工业大学制药工程
研究所, 浙江 杭州
[7]颜国和, 王飞武. 奥美拉唑合成路线图解[ J]. 中国医药工业杂志, 1991
[8] Leong K.W.D’ Amore P. Langer R. J .Biomed Matter.Res[J],1986
[9] Brem H. Langer. R. SciMed [J]1996, 3: 52.
[10] Domb J A Langer R J Polym Sci Part A Polym Chem [ J], 1987, 25: 3373.
[11]刘宇宏, 王世鑫. 近年来质子泵抑制剂的研究进展[ J].中国新药杂志,
2001
