同系物、同分异构体
烷烃(同系物和同分异构体)
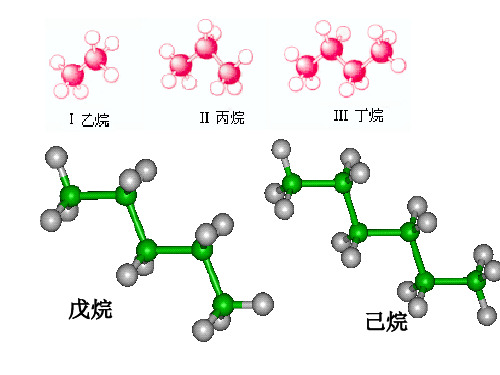
烷烃复 习一: 什么叫烷烃? 链状、单键、饱和
烷烃的通式是?其完全燃烧生成的水和二氧化碳 之比为多少? C2H2n+2 (n≥1) 已知10ml的某气态烷烃在50mlO2中充分燃烧,得到 液态水和体积为35ml的混合气体(所有气体都在同温同 压下测定),则该烃可能是什么?
烷烃的表示方法
有机物的几种表示方法
烷烃的化学性质
(1)烷烃的氧化反应 烷烃完全燃烧的通式: CnH2n+2+(3n+1)/2O2 → nCO2+(n+1)H2O
通常情况下,烷烃与高锰酸钾等强氧化剂不发 生反应,不能与强酸和强碱溶液反应。
(2)烷烃的取代反应
其它烷烃与甲烷一样,一定条件下能发生取
代反应。因为可以被取代的氢原子多,所以
H
C
H
C H
H
对称氢原子的概念
我们先看看最简单的甲烷分子… 我们知道甲烷的四个氢原 子是对称的。 如果将甲烷的四个氢原子 用甲基取代,结果会…?
由此可以得到两个规律…
对称氢原子确定的规律
同一碳原子上的氢原子完全对称 。 与同一碳原子相连的甲基上的氢原
子完全对称。
与同一碳原子相连的相同基团对应位置上的
烷烃组成和结构的表示方法
结构简式怎么写?------p23(有机化学)
1.将结构式中的C—H省略,其他的共价键一律不省略.C—C 可省也可不省.但其它如双键,叁键一律不能省. 实际上写结构简式的最简单处理方法就是省略C—H,
其它一概不变!
2.连在同一个C上的相同基团有时也可以合并,并带上括号. 3.同一条链上连续的相同的基团也可以合并,并带上括号
4、主链少三个碳原子
C C ∣ ∣ C -C - C - C ∣ ∣ C C
高考化学同系物及同分异构体复习

高考化学同系物及同分异构体复习一、同系物的判断规律1.一差(分子组成差一个或若干个CH2)2.二同(同通式,同结构)3.三注意(1)必为同一类物质(2)结构相似(有相似的原子连接方式或相同的官能团种类和数目)(3)同系物间物理性质不同化学性质相同因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。
二、同分异构体的种类1.碳链异构2.位置异构3.官能团异构(类别异构)(详见下表)组成通式可能的类别典型实例C n H2n烯烃环烷烃CH2=CHCH H2C CH2CH2C n H2n-2炔烃二烯烃环烯烃CH= CCH2CH3CH2=CHCH=CH2 C n H2n+2O 醇醚C2H5OH CH3OCH3C n H2n O 醛酮烯醇环醇环醚CH3CH2CHO CH3COCH3CH=CHCH2OH CH3CH CH2CH2 CH OHO CH2C n H2n O2羧酸酯羟基醛羟基酮CH3COOH HCOOCH3HOCH2CHO C n H2n-6O 酚芳香醇芳香醚H3CC6H4OH C6H5CH2OH C6H5OCH3 C n H2n+1NO2硝基烷烃氨基酸CH3CH2NO2H2NCH2COOHC n(H2O)m单糖或二糖葡萄糖与果糖(C6H12O6)蔗糖与麦芽糖(C12H22O11)三、同分异构体的书写规律1.主链由长到短,支链由大到小,位置由心到边,排列由对到邻到间2.按照碳链异构位置异构官能团异构的顺序书写,也可按照官能团异构碳链异构位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写四、分异构体数目的判断方法1.记忆法记住已掌握的常见的异构体数。
例如:(1)凡只含一个碳原子的分子均无异构,甲烷、乙烷、新戊烷(看作CH4的四甲基取代物)、2,2,3,3—四甲基丁烷(看作乙烷的六甲基取代物)、苯、环己烷、乙炔、乙烯等分子一卤代物只有一种;(2)丁烷、丁炔、丙基、丙醇有2种;(3)戊烷、丁烯、戊炔有3种;(4)丁基C8H10有4种;(5)己烷、C7H8O(含苯环)有5种;(6)戊基、C9H12有8种;2.基元法例如:丁基有4种,丁醇、丁醛都有4种;3.替元法例如:C6H4Cl2有3种,C6H2Cl4有3种(将H替代Cl);4.对称法(又称等效氢法)判断方法如下:(1)同一C 原子上的氢原子是等效(2)同一C 原子所连甲基上的氢原子是等效氯(3)处于镜面对称位置上的氢原子是等效题型一:确定异构体的数目例1 某烃的一种同分异构只能生成1种一氯代物,该烃的分子式可以是()A.C3H8B.C4H10C.C5H12D.C6H14解析:分析C3H8、C4H10、、C6H14各种结构,生成的一氯代物不只1种。
同系物与同分异构体及其强化练习

同系物与同分异构体一、同系物1、概念:结构相似,分子组成相差一个或若干个CH2基团的化合物之间的互称。
①结构相似指的是官能团相同、官能团个数相同、连接方式类似。
例如,烷烃同系列中,结构相似,指的是除甲烷外,碳碳之间以单键相连,形成链状,剩余价键与氢原子结合。
烯烃同系列中,结构相似,指的是分子中含有一个碳碳双键,形成链状,剩余价键与氢原子结合。
CH3②相差若干个CH2基团,是组成上相差而不是结构上相差。
例如,CH3CH2CH3与CH33之间,结构上并没有相差一个CH2,组成上相差一个CH2,所以互为同系物。
2、目前,所学有机物,就是按官能团分类的。
基本上是按同系列一个一个类别罗列的,形成了烷烃、烯烃、炔烃、苯及其同系物、饱和一元卤代烃、饱和一元醇、饱和一元醛、饱和一元羧酸、饱和一元酯等有机系列。
二、同分异构体1、概念:分子式相同,结构不同的化合物之间的互称。
化合物分子,分子式相同,结构不同的现象叫同分异构现象。
有机物同分异构现象普遍,是造成有机物种类繁多的一个重要原因。
值得注意的是,不仅有机物有同分异构现象,无机化合物也有同分异构现象。
例如,H—S—C N与H—N=C=S之间,互为同分异构体。
2、类型:①碳链异构:由碳原子连接顺序不同引起的同分异构体。
例如,丁烷与2—甲基丙烷。
②位置异构:由官能团的位置不同引起的同分异构体。
例如,2—丁烯与1—丁烯。
③类别异构:由官能团类型不同引起的同分异构体。
例如,乙醇与甲醚。
④顺反异构:由原子或原子团在空间位置不同引起的同分异构体。
H3C CH3H3C例如, C C 与 C CH H H CH3⑤对映异构:有中心碳原子连接四个不同的原子或原子团构成彼此不能重合但又互为镜像的同分异构体。
OH例如,乳酸CH3— CH—COOH就有对映异构。
3、方法:①碳链异构:写直链,一线牵;取一碳,放中间;往外排,不到边;先整体,后拆分;重位置,同邻间。
②一般顺序:先考虑碳链异构,再考虑位置异构,再考虑类别异构。
同系物同位素同素异形体同分异构体的举例

同系物同位素同素异形体同分异构体的举例同系物、同位素、同素异形体、同分异构体是化学中常用的概念,用来描述化学物质在分子结构上的差异。
下面将以具体实例为例,细致解释这四个概念的含义和应用。
同系物是指具有相同或相近分子式的化合物。
它们在分子构造上有着相似但不完全相同的特点。
例如,酚类化合物对苯酚、间酚和邻酚,它们的分子式都是C6H6O,但它们的分子结构和性质有所不同。
另一个例子是醇类化合物,如乙醇、异丙醇等都是同系物。
同位素是指原子核中质子数相同、中子数不同的同位素体系。
例如,氢气的同位素有氘(氢的同位素,质子数为1,中子数为1)和氚(质子数为1,中子数为2)。
同一元素的不同同位素有时会导致其物理和化学性质的差异。
同素异形体是指由同一组原子组成,但分子结构不同的同素体。
常见的例子是热带硬脂酸的两种异构体。
正硬脂酸和癸二酸,化学式都是C17H34O2,但它们的分子结构和物理性质有所不同。
另一个例子是异构烯烃,如顺式-丁烯和反式-丁烯都是C4H8的同素异形体。
同分异构体是指分子式相同,但结构略有不同的化合物。
例如,异丁烷和2-甲基丁烷,它们的分子式都是C4H10,但它们的分子结构不同。
另一个例子是异构酮,如丙酮和乙酸酯,它们的分子式都是C3H6O,但它们在分子结构上有所不同。
这四个概念在化学中有着广泛的应用。
首先,通过研究同系物,可以了解不同化合物之间的相似性和差异性,为合成新的化合物提供参考。
其次,同位素的使用在放射性同位素示踪、核能利用和碳定年等方面具有重要意义。
同素异形体和同分异构体的研究可以深入了解化学反应机制,对有机合成和药物设计有着重要的指导作用。
总结起来,同系物、同位素、同素异形体和同分异构体是用来描述化学物质在分子构造上的差异的重要概念。
通过研究和区分这些概念,我们能够更好地理解化学物质的性质和行为,从而为新化合物的合成和应用提供指导。
同位素,同素异形体,同分异构体,同系物的概念[资料]
![同位素,同素异形体,同分异构体,同系物的概念[资料]](https://img.taocdn.com/s3/m/9b341b253868011ca300a6c30c2259010202f34d.png)
同位素的表示符号同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。
人教版高中化学选修5-1.2知识总结:同系物、同分异构体、同位素、通俗异形体、同种物质的比较

分子式相同,结构不同的化合物互称为同分异构体
化合物
相同
不同
物理性质不同,化学性质不一定相同
同种物质
分子式和结构式都相同的物质
-
相同
相同
相同
同系物
结构相似,分子组成上相差若干个CH2原子团的有机物
化合物
不相同
相似
物理性质不同,化学性质相似
同系物、同分异构体、同位素、同素异形体、同种物质的比较
定义
比较对象
分子式
结构
性质
同位素
质子数相同、中子数不同的核素(原子)互称为同位素
核素(原子)
符号表示不同,如:H、H、H
电子排布相同,原子核结构不同
物理性质不相同,化学性质相同
同素异形体
同一元素组成的不同单质
单质
元素符号表示相同,分子式可不同,如:金刚石和石墨、O2和O3
同系物和同分异构体同素异形体 同位素题目
同系物和同分异构体同素异形体同位素题目同系物和同分异构体、同素异形体、同位素是化学中常见的概念,它们描述了不同的情况。
以下是一些关于这些概念的练习题:1. 下列关于同系物的说法中不正确的是()A. 烷烃中最简单的同系物是甲烷、乙烷和丙烷B. 每个碳原子的化合价都相同C. 分子组成上相差一个或若干个$CH_{2}$原子团且符合同一通式的有机物之间互为同系物D. 互为同系物的有机物不一定有相同的通式2. 下列说法正确的是 ( )A. 分子组成相差一个或若干个$CH_{2}$原子团的物质互称为同系物B. 苯与苯酚互为同系物C. 分子式为$C_{3}H_{7}Cl$的有机物可能存在同分异构体D. 分子式为$C_{2}H_{6}O$的有机物一定存在同分异构体3. 下列各组物质中,属于同系物的是( )A.$CH_{3} - CH_{3}$和$CH_{3} - CH = CH_{2}$B.$CH_{3} - CH =CH_{2}$和$CH_{2} = CH - CH_{3}$C.$CH_{3} - CH_{2} - CH_{3}$和$CH_{3} - CH = CH_{2}$D.$CH_{3} - CH = CH_{2}$和$CH_{2} = CH - CH_{3}$4. 同分异构体具有:① 同一化学式;② 不同结构。
下列各组物质中互为同分异构体的是 ( )A. 甲烷和乙烷B. 乙醇和二甲醚C. 乙烯和聚乙烯D. 丙稀和环丙烷5. 下列关于同位素的说法中,正确的是()A.质子数相同,中子数不同的原子互称为同位素B.同一元素的不同核素互称为同位素C.凡是核素都是同位素D.钠的一种核素$\mspace{2mu}^{23}Na$ 的质子数为11,中子数为12,则钠元素的相对原子质量为116. 下列关于有机物的说法中,正确的一组是()① "乙醇汽油"是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成 CO₂和 H₂O③煤中含有苯、甲苯、二甲苯等化合物,这些物质可通过煤的干馏,从煤焦油中蒸馏而得④高纯硅广泛应用于太阳能电池、计算机芯片,是一种重要的半导体材料⑤将 ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag。
5同系物和同分异构体doc 4
专题三第一单元常见的烃第二节同系物和同分异构体学习目标:1、认识同系物的概念,并能进行正确的判断2、掌握同分异构体的书写方法学习重点:同分异构体的书写方法学习难点:同分异构体的书写方法【基础知识】知识点一、同系物(认真阅读资料P29的内容,回答下面问题)1、什么是同系物?化合物互为同系物的必备条件有哪些?2、同系物之间存在哪些规律?对应训练:下列各对物质中,互为同系物的是()知识点二、同分异构体和同分异构现象(认真阅读课本P24-25内容,回答下面问题)1、同分异构现象:2、同分异构体:3、产生同分异构现象的本质原因是什么?互为同分异构体的物质性质是否相同?【能力提升】知识点三、同分异构体的书写基本方法:主链由长到短,支链由整到散,位置由心到边(烃基不能到端),排布由邻位到间位,再到对位(或同一个碳原子上)。
位置:指的是支链或官能团的位置。
排布:指的是支链或官能团的排布。
1、根据提示,写出己烷(C6H14)的几种同分异构体(用结构简式表示)⑴写出没有支链的主链⑵写出少一个碳原子的主链,将这个碳原子(即-CH3)作为支链,该支链在主链上的位置由心到边,但不能到端(-CH3不能连接在末端的碳上)。
⑶写出少两个碳原子的主链,将这两个碳原子作为支链连接在主链上碳原子的邻位、间位或同一个碳原子上。
2、判断己烷(C6H14)的每种同分异构体中有几种等效氢?【知识应用】1、写出庚烷(C7H16)的几种同分异构体2、代表有机物中几种同系物的相对分子质量的一组数字是()A .16、32、48、64 B.2、16、30、44、58C .16、17、18、19 D.46、60、74、88、102。
专题三同系物和同分异构体
专题三同系物和同分异构体考纲要求:1、了解同分异构现象普遍存在的本质原因。
2、掌握同分异构和同系物的概念,会识别同系物和列举同分异构体。
知识点:一、同系物:1、定义:2、同系物的判断规律(1)一差(分子组成差一个或假设干个CH2);(2)二同(同通式,同构造);(3)三注意:①必为同一类物质②构造相似(有相似的原子连接方式或一样的官能团种类和数目)③同系物间物理性质不同,化学性质相似,因此,具有一样通式的有机物除烷烃外都不能确定是不是同系物。
二、同分异构体1 概念辩析(同分异构、同一种物质、同系物)同分异构:化合物具有一样的分子式,但构造不同的现象称为同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
在中学阶段,引起同分异构的原因主要有三种:碳架异构、位置异构和官能团异构。
识别两者是否是同分异构体,首先要查碳原子数,判别分子式是否一样,然后再看构造式。
在分子式一样的情况下,假设构造不同,那么两者必为同分异构体。
同一种物质:两者不仅分子式一样,而且构造也完全一样,那么为同一种物质。
同一种物质应具有一样的物理参数,如有一样的熔沸点。
判断两构造是否一样方法有二:(1)将分子整体翻转或沿对称要素(面、线)旋转后能“重合〞者;(2)用系统命名法命名,所得名称一样者。
同系物:构造相似,在分子组成上相差一个或几个CH2原子团的物质互称同系物。
构造相似是指分子中含有官能团的种类和数目都要一样。
如乙醇与丙醇为同系物,但乙二醇与丙三醇就不属同系物了。
假设两构造式要判断它们是否具有一样的分子式,数不饱和度要比数氢原子数目快捷得多。
在C、O、N、Cl等原子数对应一样的前提下,不饱和度一样的,分子式一定一样。
如:ClHOCl O两者C、O、Cl原子数一样,不饱度都是4,所以两构造式具有一样的分子式。
而构造显然不同,因此两者应为同分异构体。
对于稠环芳香烃利用公用边数目来确定两个构造式的关系那么很方便。
在苯环数一样的前提下,假设公用边数一样,且各苯环排列顺序又一样,那么两者表示的是同一种物质;假设公用边数一样,且各苯环排列顺序不一样,那么两者表示的是同分异构体;假设公用边数不同,那么两者即不是同分异构体,也不是同一物物质。
同系物同位素同素异形体同分异构体的举例
同系物同位素同素异形体同分异构体的举例一、引言在化学领域中,同系物、同位素、同素异形体以及同分异构体都是常见的概念。
它们代表了不同的化学性质和结构特征。
本文将对这些概念进行详细解释,并给出相关的例子,以便更好地理解它们之间的区别和联系。
二、同系物同系物是指具有相似化学性质和结构特征的一组化合物。
它们通常具有相似的分子式和相近的分子量,但其结构可能存在差异。
下面是几个例子:1.甲醛(HCHO)和乙醛(CH3CHO):它们都是醛类化合物,具有类似的化学性质,但其分子结构不同。
2.硫酸(H2SO4)和亚硫酸(H2SO3):它们都是含硫酸基团的无机化合物,但亚硫酸比硫酸少一个氧原子。
三、同位素同位素是指具有相同原子序数(即相同的元素)但质量数不同的原子。
同位素具有相似的化学性质,但其物理性质可能存在差异。
以下是一些例子:1.氢的同位素:氢有三种主要的同位素,分别是氢-1(1H)、氘(2H)和氚(3H)。
它们在化学反应中表现出类似的性质,但在物理性质上有所不同。
2.碳的同位素:碳有两种稳定的同位素,分别是碳-12(12C)和碳-13(13C)。
它们在化学反应中表现出类似的性质,但由于质量数不同,在物理性质上也存在差异。
四、同素异形体同素异形体是指具有相同元素组成但结构或空间构型不同的化合物。
它们通常具有不同的物理和化学性质。
以下是几个例子:1.顺式和反式异戊二烯酸二甲酯–顺式异戊二烯酸二甲酯(CH3OC(O)C(CH3)=CHC(O)OCH3):两个甲基基团位于双键相对位置。
–反式异戊二烯酸二甲酯(CH3OC(O)C(CH3)=CHC(O)OCH3):两个甲基基团位于双键同侧位置。
2.光学异构体–D-葡萄糖和L-葡萄糖:它们是以不对称碳原子为中心的异构体,可以通过手性合成得到。
两者具有相同的分子式和结构,但旋光性质不同。
五、同分异构体同分异构体是指具有相同分子式但结构不同的化合物。
它们具有不同的物理和化学性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
全力以赴对待高中生活,三年后你会发现你的付出是值得的!
同系物、同分异构体
制作人: 制作时间:2015年10月16日 备课组长签字:
课题 同系物、同分异构体 课时 2课时
学习目标 1、了解同系物的定义 2、了解有机物中碳的成键特征
3、了解有机物的同分异构现象
重点
同分异构现象
难点 同分异构现象
一、同系物
名称 结构简式
甲烷
CH4
乙烷
CH3CH3
丙烷
CH3CH2CH3
丁烷
CH3(CH2)2CH3
戊烷
CH3(CH2)3CH3
十七烷
CH3(CH2)15CH3
1、定义:结构相似,在分子组成上相差一个或若干个 原子团的有机物互称为同系物
2、特征:(1)结构相似
(2)分子组成相差一个或若干个
(3)物理性质递变
(4)化学性质相似
(5)符合同一个通式
【练习1】下列物质是否为同系物?
①CH4和 CH3CH3 ② CH3CH2CH3 和 CH3-CH2-CH-CH3
CH
3
③CH2=CH2 和
【小结】判断同系物方法:
(1)结构相似,即属于同一类物质
(2)分子式不能相同,分子组成上必须相差n个CH2
二、同分异构体
1、定义: 相同, 不同的化合物互称为同分异构体
2、同分异构现象:化合物具有相同的分子式,但具有不同结构的现象。
2
全力以赴对待高中生活,三年后你会发现你的付出是值得的!
3、同分异构体的书写方法:(1)成直线一线串
(2)摘头碳挂中间
(3)往边排不到端
(4)等效碳不重排
(5)还可摘从(2)来
注:①支链是甲基则不能放1号碳原子上
②若支链是乙基则不能放1和2号碳原子上,依次类推
【练习2】写出下列物质的同分异构体的结构简式
C4H10:
C5H12:
C6H14:
【思考】一氯乙烷有几种?
4、卤代烃同分异构体种类的规律
(1)一卤代烃:烷烃分子中有几种不同的氢原子,它就有几种一取代物
【练习3】分别写出C4H9Cl、C5H11Cl、C6H13Cl的同分异构体的结构简式
3
全力以赴对待高中生活,三年后你会发现你的付出是值得的!
【小结】等效氢:a.同一碳原子上的氢原子是等效的
b.同一碳原子所连甲基上的氢是等效的
c.处于镜面对称位置上的氢原子是等效的
【思考】已知C2H5Cl有一种,那么C2HCl5有 种;已知C2H4Cl2有2种,那么C2H2Cl4有 种;
(2)多卤代物符合互补规律:若某有机物分子中总共含a个氢原子,当m+n=a时,则m元取代物和n元取代物
的种类相等。
【练习4】写出C7H16的同分异构体的结构简式
【练习5】进行一氯取代后,只能生成三种沸点不同产物的烷烃的是( )
A.(CH3)2CHCH2CH2CH3 B.(CH3)3CCH2CH3 C.(CH3)2CHCH(CH3)2 D.(CH3)2CHCH3
【练习6】二氯丙烷(C3H6Cl2)有四种同分异构体,六氯丙烷(C3H2Cl6)的同分异构体数为( )
A.2种 B.3种 C.4种 D.6种
【小结】
同系物 同位素 同分异构体 同素异形体
研究对象 有机化合物 原子 化合物 单质
相似点 结构相似通式相同 质子数相同 分子式相同 同种元素
不同点 相差n个原子团(n》1) 中子数不同 原子排列不同 组成或结构不同
【练习7】下列物质互为同位素的是 互为同素异形体的是 属于同系物的是
属于同分异构体的是
①O2和O3 ②CH3CH3 和 CH3CH2CH2CH3 ③金刚石和石墨 ④CH3CH2CH2CH3 和 CH3CH(CH3)CH3 ⑤氕、氘和氚
【练习8】下列物质中互为同分异构体的是
A.CH3CH2CH2CH3 B.CH3CH2CHCH3 C.CH3CHCH2Cl D.CH3CH2CH2CH2Cl
CH3 CH
3
