河南省中考化学复习中考考点过关物质构成的奥秘课件
合集下载
中考化学复习专题物质构成的奥秘PPT下载

中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
(5)元素与原子的区别和联系
元素
原子
区别
只表示一类原子的总称;只讲 原子是微观概念,既表示 种类,不论个数,是宏观概念 个数,又表示种类
化学变化中元素的种类不变
化学变化中,原子的种类 和数目不变
联系
元素是同类原子的总称,元素是组成物质的基本成分; 原子是构成元素的基本单元
(3)离子:带电的原子(或原子团),如Mg2+、NH4+、Cl等。由离子构成的物质:氯化钠、硫酸铜等。
2. 用分子、原子观点解释物质的变化
(1)在物理变化中:构成物质的分子没有发生变化,水蒸 气液化只是水分子的____间__隔__发生变化(如图1)。
(2)在化学变化中:构成物质的分子可以分为_原__子_____, ___原__子___又组合成新的分子(如图2)。
微粒
离子
区别 与联系
原子
电性
不显电性
粒子符号 用元素符号表 表示法 示,如Na
相互转化 关系
阳离子
阴离子
显正电性
用离子符号表 示,如Na+
显负电性
用离子符号 表示,如S2-
中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
【易错易混点】 ①元素的化学性质主要取决于最外层电子数; ②根据粒子的结构示意图判断原子、离子的种类
D. 阴离子
3.某原子的结构示意图如图所示,该
原子的核电荷数为__1_7___,核外有__3__个电子层。
中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
(5)元素与原子的区别和联系
元素
原子
区别
只表示一类原子的总称;只讲 原子是微观概念,既表示 种类,不论个数,是宏观概念 个数,又表示种类
化学变化中元素的种类不变
化学变化中,原子的种类 和数目不变
联系
元素是同类原子的总称,元素是组成物质的基本成分; 原子是构成元素的基本单元
(3)离子:带电的原子(或原子团),如Mg2+、NH4+、Cl等。由离子构成的物质:氯化钠、硫酸铜等。
2. 用分子、原子观点解释物质的变化
(1)在物理变化中:构成物质的分子没有发生变化,水蒸 气液化只是水分子的____间__隔__发生变化(如图1)。
(2)在化学变化中:构成物质的分子可以分为_原__子_____, ___原__子___又组合成新的分子(如图2)。
微粒
离子
区别 与联系
原子
电性
不显电性
粒子符号 用元素符号表 表示法 示,如Na
相互转化 关系
阳离子
阴离子
显正电性
用离子符号表 示,如Na+
显负电性
用离子符号 表示,如S2-
中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
【易错易混点】 ①元素的化学性质主要取决于最外层电子数; ②根据粒子的结构示意图判断原子、离子的种类
D. 阴离子
3.某原子的结构示意图如图所示,该
原子的核电荷数为__1_7___,核外有__3__个电子层。
中考化学复习专题物质构成的奥秘PPT 下载
中考化学复习专题物质构成的奥秘PPT 下载
2023年中考化学一轮复习第三单元物质构成的奥秘课件
也就不同;一般情况下,失电子时电子层数减少一层,得电子时电子层数不变。
1.辨一辨
(1)原子核内的质子数一定等于中子数。( × )
(2)不同种类的原子,核内质子数不同。( √ )
(3)稀有气体原子的最外层电子数都是8。( × )
(4)钠原子与钠离子的核内质子数不同。( × )
(5)原子失去电子形成阳离子后,电子层数不变。( × )
②依据给出的具体原子或离子结构示意图,考查原子的构成及结构与性质的关系。
③以粒子的结构和变化为内容,考查离子的形成、分类及同种元素的原子与离子之间的相互转化
关系。
④依据粒子结构示意图考查原子得失电子情况。
[例2](2022怀化)根据如图回答问题。
(1)汞原子的核电荷数为
,汞元素属于
误的是(
)
A.自然界中水的天然循环——水分子不断运动的结果
B.氧气经压缩储存在钢瓶中——氧气分子体积变小了
C.一滴水中大约含有1.67×1021个水分子——水分子很小
D.氧气和液氧都能支持燃烧——物质的分子相同,其化学性质相同
解析:A.自然界中水的天然循环,是水分子不断运动的结果;B.氧气经压缩储存在钢瓶中,是因为
10,属于氖元素,属于稀有气体原子。(3)由图2中的阴、阳离子分别是氧离子和镁离子可知,构
成的化合物是氧化镁,化学式是MgO。
答案:(2)4
E
(3)MgO
三、物质的组成与构成
元素是宏观概念,只有种类之分,没有数量之别;而分子、原子均是微观概念,既有种类之分,又有
数量之别;元素是从宏观上对物质组成的描述,而分子、原子是从微观上对物质构成的描述;一般用
1个氧原子
构成。
(4)用分子的观点解释现象
1.辨一辨
(1)原子核内的质子数一定等于中子数。( × )
(2)不同种类的原子,核内质子数不同。( √ )
(3)稀有气体原子的最外层电子数都是8。( × )
(4)钠原子与钠离子的核内质子数不同。( × )
(5)原子失去电子形成阳离子后,电子层数不变。( × )
②依据给出的具体原子或离子结构示意图,考查原子的构成及结构与性质的关系。
③以粒子的结构和变化为内容,考查离子的形成、分类及同种元素的原子与离子之间的相互转化
关系。
④依据粒子结构示意图考查原子得失电子情况。
[例2](2022怀化)根据如图回答问题。
(1)汞原子的核电荷数为
,汞元素属于
误的是(
)
A.自然界中水的天然循环——水分子不断运动的结果
B.氧气经压缩储存在钢瓶中——氧气分子体积变小了
C.一滴水中大约含有1.67×1021个水分子——水分子很小
D.氧气和液氧都能支持燃烧——物质的分子相同,其化学性质相同
解析:A.自然界中水的天然循环,是水分子不断运动的结果;B.氧气经压缩储存在钢瓶中,是因为
10,属于氖元素,属于稀有气体原子。(3)由图2中的阴、阳离子分别是氧离子和镁离子可知,构
成的化合物是氧化镁,化学式是MgO。
答案:(2)4
E
(3)MgO
三、物质的组成与构成
元素是宏观概念,只有种类之分,没有数量之别;而分子、原子均是微观概念,既有种类之分,又有
数量之别;元素是从宏观上对物质组成的描述,而分子、原子是从微观上对物质构成的描述;一般用
1个氧原子
构成。
(4)用分子的观点解释现象
新人教版中考化学复习课件 中考冲刺:第1部分 物质构成的奥秘

15
第2讲 元素及元素周期表
二、元素周期表
1.元素周期表中,同一横行,__电__子__层__数_____相等,称为同一周期;同一 纵列,最__外_层__电__子_ 数 相等,称为同一族。
2.1—20号元素名称和符号默写:
第一周 期
第二周 期
第三周 期
第四周 期
Ⅰ
Ⅱ
Ⅲ
Ⅳ ⅤⅥ Ⅶ 0
1 氢H
2He
碳C 氮N 氧O 氟F 氖Ne 3L钠i Na 4Be镁Mg 5B 铝Al 6 硅Si 7 磷P 8 硫S 9 氯Cl 10氩Ar
4.元素符号表示的意义 (宏观):表示 ( 一种元素
)
(微观):表示该元素的( 一个原子 )。
5.元素分类:__金__属____元素、___非__金__属____元素、__稀__有__气__体________元素,中
文部首分别是________和_________________和_________
粒子 电性 符号
原子
离子
阳离子
阴离子
核内质子 数_等__于__核 外电子数
核内质子数_大__于__ 核外电子数
核内质子数 ___小__于__核外电 子数
不显电性 显正电性
显负电性
用Hale Waihona Puke 素符 用阳离子符号表 用阴离子符号表
号表示 示,如: n+
示,如:n-
联系
7
第1讲 构成物质的微粒——分子、 原子、离子
化学
第一部分 物质构成的奥秘
1
第一部分 物质构成的奥秘
第1讲 构成物质的微粒——分子、原子、离子
第2讲 元素及元素周期表 第3讲 化合价与化学式
2
第2讲 元素及元素周期表
二、元素周期表
1.元素周期表中,同一横行,__电__子__层__数_____相等,称为同一周期;同一 纵列,最__外_层__电__子_ 数 相等,称为同一族。
2.1—20号元素名称和符号默写:
第一周 期
第二周 期
第三周 期
第四周 期
Ⅰ
Ⅱ
Ⅲ
Ⅳ ⅤⅥ Ⅶ 0
1 氢H
2He
碳C 氮N 氧O 氟F 氖Ne 3L钠i Na 4Be镁Mg 5B 铝Al 6 硅Si 7 磷P 8 硫S 9 氯Cl 10氩Ar
4.元素符号表示的意义 (宏观):表示 ( 一种元素
)
(微观):表示该元素的( 一个原子 )。
5.元素分类:__金__属____元素、___非__金__属____元素、__稀__有__气__体________元素,中
文部首分别是________和_________________和_________
粒子 电性 符号
原子
离子
阳离子
阴离子
核内质子 数_等__于__核 外电子数
核内质子数_大__于__ 核外电子数
核内质子数 ___小__于__核外电 子数
不显电性 显正电性
显负电性
用Hale Waihona Puke 素符 用阳离子符号表 用阴离子符号表
号表示 示,如: n+
示,如:n-
联系
7
第1讲 构成物质的微粒——分子、 原子、离子
化学
第一部分 物质构成的奥秘
1
第一部分 物质构成的奥秘
第1讲 构成物质的微粒——分子、原子、离子
第2讲 元素及元素周期表 第3讲 化合价与化学式
2
初中中考化学复习讲义课件 中考模块复习 模块二 物质构成的奥秘 第10讲 化学式与化合价

选项
物质
主要成分的化 学式
用途
A 活性炭
可作防毒面具滤毒
C
灌中的吸附剂
B 石灰石
CaO
可作建筑材料
C
沼气
CH4
75%的乙醇
可作燃料
2.(2016·益阳)中国科学家屠呦呦女士在2015年获得诺 贝尔医学或生理学奖。她成功提取出的青蒿素(化学式 C15H22O5),被誉为“拯救2亿人口”的发现。下列有 关青蒿C素的说法正确的是(有关相对原子质量:H-1、 C-12、O-16) ()
易错点2:分子构成 点拨:描述分子中原子的个数时,注意前提一定是“1 个分子中”;分子由原子构成,因此某某分子中肯定不 会含有其他分子。 2.相对分子质量的计算 易错点:误认为相对分子质量的单位是“g” 点拨:相对分子质量单位是“1”,通常不写
3.原子个数比和元素质量比的计算 易错点:混淆原子个数比与元素质量比 点拨:原子个数比是1个分子中各原子的个数之比,即 化学式中各元素角码的最简整数比,元素质量比是相 对原子质量与原子个数的乘积之比
第10讲化学式与化合价
1 知识梳理素养形成 2 重点难点素养拓展 3 真题自测明确考向
知识梳理素养形成
知识点1 化学式 1.概念:用元素符号和数字的组合表示物质组成的式 子。 2.化学式的书写 (1)金属、稀有气体和部分固体非金属:直接用元素符号 表示,如铁Fe、氦气He、硫S等。 (2)非金属气体:用“Xn”表示,如氧气O2、氢气H2等。 (3)化合物:正左负右,标价交叉,化简复查,如氧化铁,
A.NO2
B.N2
C.NH4Cl
D.HNO3
命题点3化学式与化合价的综合 7.(2018·益阳)写出符合下列要求的化学符号: (1)实验室中最常用的H溶2剂O _______; (2)能使酚酞溶液变红色的NH气3体_______; (3)天然气主要成C分H_4______; (4)熟石灰中的阴离O子H-_______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点帮
考点1 考点2 考点3 考点4
原子和离子
4.离子 (1)定义:带电的原子或原子团。
(2)离子的形成:原子
失去电子
阳离子, 原子
得到电子
阴离子;
根据原子核外最外层电子数可知,金属元素的原子易失去电子形成阳离子,非金属元素的原子易 得到电子形成阴离子。 阳离子:带正电荷的原子或原子团,如Na+、Al3+、NH4+等 阴离子:带负电荷的原子或原子团,如F-、S2-、SO42-等 (4)离子的表示方法: 在元素符号的右上角用“+”或“-”表示离子的电性,数字表示每个离子所带的电荷数,先写数字后 写正负号,当数字为1 时,省略不写,如Na+、Cl-、Al3+、SO42-。 (5)离子符号表示的意义:表示离子(或一个离子) 铝离子(或一个铝离子) 例如:Al3+表示_________ 每个铝离子带3个单位的正电荷 两个铝离子
易失分点 分子只能保持物质的化学性质,不能保持物质的物理性质。在化学变化中,分子可以再分,原子 不可以再分。若离开了化学变化这一范围,分子、原子都是可以再分的,分子可以分成原子,原 子又可以分成质子、中子和电子。
考点帮
考点1 考点2 考点3 考点4
分子的性质
1.分子的性质
分子的性质 小——分子的质量和体积都很小 动——分子总是在不断运动;温度越 高,分子运动速率越快 间——分子之间有间隔 同——同种分子化学性质相同;不同 种分子化学性质不同 子 闻到花香、湿衣服晾干 热胀冷缩、6 000 L氧气在加压条件 举例 一滴水中大约有1.67×1021个水分
(2)相对原子质量≈质子数+中子数。
失分警示 物质受热膨胀使粒子间的间隔变大,不是粒子的体积变大。例如:水烧开后易把壶盖顶起,是 因为受热后水分子间间隔变大;水银温度计受热液柱上升,是因为受热后汞原子间间隔变大。
考点帮
考点1 考点2 考点3 考点4
原子和离子
3.原子结构示意图 原子核 (1)原子结构示意图的识别(以铝原子为例) 电子层 该层容纳的电子数
考点帮
考点1 考点2
构成物质的微粒
2.分子和原子
分子 概念 分子是保持物质⑦__________ 最 化学性质 小粒子 原子 原子是⑧__________ 中的最小粒子 化学变化
考点3
考点4
相 同 点
联系 区别
质量和体积都很小;总是在不断运动着;彼此之间有间隔;同种分子( 或原子)化学性质相同,不同种分子(或原子)性质不同 分子由⑨_______ 原子 构成 在化学变化中,分子可以分成⑩_______, 原子 而原子不能再分
元素名称
(或核电荷数) 决定。 __质子数 _______________
(2)横行(周期):元素周期表的每一横行叫做一个周期,共有7个周期。每一横行元素的 电子层数 _______ __相同,最外层电子数从左到右依次增加。
(3)纵行(族):元素周期表的每一个纵行叫做一族。每一纵行元素的
同,电子层数依次增加。 得分速记 (1)原子序数=核电荷数=质子数=原子核外电子数; (2)从元素的名称可推知元素的种类; (3)电子层数等于周期数,最外层电子数等于族序数; (4)原子最外层电子数相同,元素的化学性质相似;
(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2~3滴酚酞试液,再向其中滴加浓氨水,由实验Ⅰ 氨水能使酚酞试液变红 。 得出的结论有______________________
(2)实验Ⅱ(如图甲所示):烧杯B中的现象是_______________________, 产生这一现象的原因是 B烧杯中液面会下降 氨水易挥发 。 ____________
化学性质
质子核
(2)元素化学性质与原子最外层电子数的关系
元素种类 最外层电子数 得失电子
金属元素
除稀有气体元素 外的非金属元素 稀有气体元素
一般少于4个
一般多于4个 8个(氦为2个),为相对稳 定结构
易失去电子
易得到电子 既不易得电子也不易 失电子
不稳定
不稳定
非金属 元素
稳定
得分巧记 决定元素种类的是质子数(即核电荷数);元素的化学性质主要由原子的最外层电子数 决定。
钴Co、镍Ni、硒Se、氪Kr、汞Hg、铂Pt、金Au、砷As等。
(3)元素符号的意义
考点帮
考点1 考点2 考点3 考点4
元素及元素周期表
3.元素周期表 (1)每一格:在元素周期表中,每一 种元素均占据一格,元素的编号叫 原子序数 _______________, 其由原子的 原子序数 相对原子质量 (单位为1) 元素符号
可装入容积为40 L的钢瓶中
水受热变为水蒸气,水的化学性质不 变;CO和CO2的组成元素相同,但化 学性质不同
失分警示
物质受热膨胀使粒子间的间隔变大,不是粒子的体积变大。例如:水烧开后易把壶盖 顶起,是因为受热后水分子间间隔变大;水银温度计受热液柱上升,是因点3 考点4
(3)为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如图乙所示)作为对比实验。你认为有无必 蒸馏水不能使酚酞变红,实验Ⅰ已经证明了 无 (填“有”或“无”),理由是________________________________________________ 要?___ 。
实验帮
实验突破 3
例
分子运动现象的探究
最外层电子数 相 ________________
(5)阿伏加德罗提出分子学说、道尔顿提出原子论、门捷列夫发现了元素周期律并 编制出元素周期表。
PART 02
实验帮
实验突破 3 分子运动现象的探究
实验帮
实验突破 3
分子运动现象的探究
1.实验目的:认识分子的运动
2.实验装置:
特别提醒 大烧杯的作用:防止氨分子扩散到空气中对空气造成污染(或使氨分子局限在一定的空间内运动,浓度
(3)元素含量 氧、硅、铝、铁 其中含量最多的金属元素为 地壳中含量前四位的元素是 __________________, 铝 钙 空气中含量最多的元素为 ________; 人体中含量最多的金属元素为 _______; 氮 形成化合物种类最多的元素为 _________ 碳 。 ______;
考点帮
同种 分子。 ___________
同种 原子构成,化合物的分子由 (4)单质、化合物:由分子构成的物质,单质的分子由 _______ 不同种 原子构成。 ___________
考点帮
考点1 考点2 考点3 考点4
原子和离子
1.原子的构成 正 核外电子 得分巧记 (1) 原子中,核电荷数=质子数=核外电子数,所以原子不显电性; (2) 原子核中不一定有中子; (3) 同一原子中质子数和中子数不一定相等。 2.相对原子质量 (1) , ,其单位为1,常省略不写。 质子 中子
(3)离子的分类:
考点帮
考点1 考点2 考点3 考点4
原子和离子
(6)原子和离子的区别和联系
粒子种类 原子 离子 阳离子 阴离子
结构示意图
构成微粒间 区 的关系 别 电性 粒子符号的 表示 相互转化关系
质子数 =核外电子数 不显电性 用元素符号表示, 如Na 阳离子 得电子 失电子
质子数 >核外电 质子数 <核 子数 外电子数 带正电 带负电
答:氨水呈碱性,能使酚酞变红色;浓氨水中挥发出的氨分子从右侧运动到左侧,使左侧滤纸条上 的酚酞变色;温度越高,分子运动越剧烈(或温度升高,分子运动速率加快)。(任意两条即可)
实验帮
实验突破 3
例
分子运动现象的探究
实验帮
实验突破 3
分子运动现象的探究
1. 虽然这个实验的现象明显,但也存在一些不足,请列举两个不足之处? 答:氨水的用量大、有很多氨气逸出大烧杯等。 2. 针对上述不足之处,该实验可以进行哪些改进? 答:改进后的实验装置如下:
实验帮
实验突破 3
例
分子运动现象的探究
变式训练1
[2019原创]某兴趣小组做如下实验探究微粒的运动,请回答实验中的有关问题。
增大,实验现象明显)。
3. 实验过程: 红色 (1)在无色酚酞溶液中滴加几滴浓氨水,溶液由无色变为①_____; (2)将盛有无色酚酞溶液和浓氨水的小烧杯放在倒扣的大烧杯底下,如上图所示,过一段时间,观察实验现象。 红 色,A、C烧杯中的溶液③_______ 不变色 。 4.实验现象: B烧杯中的溶液变②____ 5.原因分析:浓氨水有挥发性,A中氨气分子运动到B中与水反应生成氨水,氨水显碱性,可使酚酞溶液变红,C在 实验中的作用是对照实验。 6.实验结论:分子在不断地运动。
变式训练
[2019原创]如图所示为教材上探究分子运动现象的实验,据此实验,不能得到的结论是 ( C )
A.酚酞遇蒸馏水呈无色 C.氨分子之间有间隔
B.酚酞遇氨水变红色 D.氨分子在不断运动
思路分析
浓氨水能挥发出氨气,氨气溶于水形成氨水,氨水呈碱性,能使酚酞变红,可
证明氨分子在不断运动,但不能得出氨分子之间有间隔的结论;蒸馏水呈中性,酚酞遇蒸 馏水不变色。
中 考 化 学
2019
第一部分
河南中考考点过关
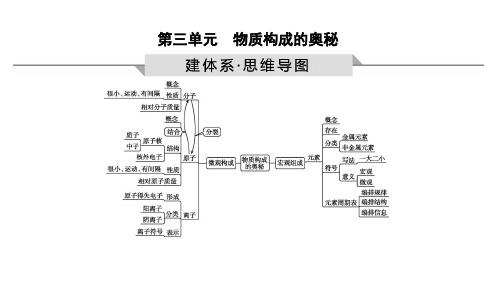
第三单元 物质构成的奥秘
目录
CONTENTS
PART 01
PART 02
PART 03
考点帮
实验帮
方法帮
PART 01
考点帮
考点1 构成物质的微粒
考点2 分子的性质
考点3 原子和离子 考点4 元素及元素周期表
考点帮
考点1
构成物质的微粒
1.构成物质的基本离子 构成物质的基本粒子有① 分子 、② 原子 、③ 离子;
实验帮
实验突破 3
例
分子运动现象的探究
