水的电离和溶液的酸碱性
水的电离和溶液的酸碱性典型例题及习题
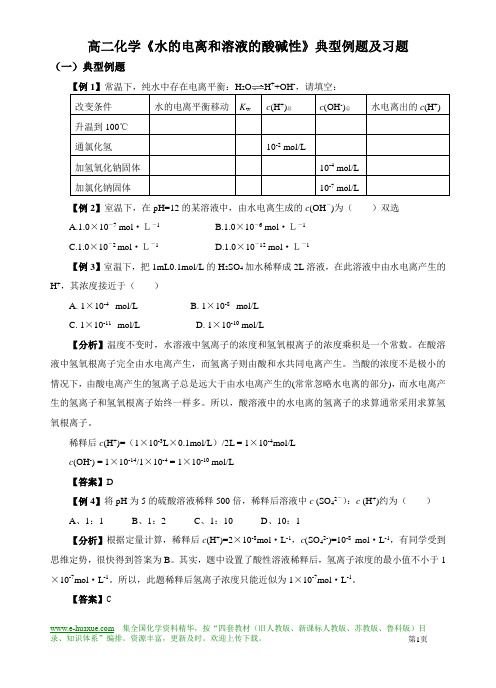
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H+-,请填空:改变条件水的电离平衡移动K w c(H+)总c(OH-)总水电离出的c(H+) 升温到100℃通氯化氢10-2 mol/L加氢氧化钠固体10-4 mol/L加氯化钠固体10-7 mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为()双选A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1【例3】室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L【分析】温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后c(H+)=(1×10-3L×0.1mol/L)/2L = 1×10-4mol/Lc(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L【答案】D【例4】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:1【分析】根据定量计算,稀释后c(H+)=2×10-8mol·L-1,c(SO42-)=10-8mol·L-1,有同学受到思维定势,很快得到答案为B。
高中化学 水的电离和溶液的酸碱性

课时38水的电离和溶液的酸碱性知识点一水的电离(一)水的电离平衡【考必备·清单】1.水的电离(1)水是极弱的电解质,其电离方程式为H2O+H2O⇌H3O++OH-,可简写为H2O⇌H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1。
[名师点拨]任何情况下,水电离产生的c(H+)、c(OH-)总是相等的。
2.水的离子积常数[名师点拨]K W=c(H+)·c(OH-)中的H+和OH-不一定都是由水电离出来的,而是指溶液中的c(H+)和c(OH-)。
3.水电离平衡的影响因素(1)温度:温度升高,促进水的电离;温度降低,抑制水的电离。
(2)酸、碱:抑制水的电离。
(3)能水解的盐:促进水的电离。
(4)实例(填写下表):体系变化条件移动方向K W电离程度c(OH-)c(H+)加酸逆不变减小减小增大加碱逆不变减小增大减小[名师点拨] ①给水加热,水的电离程度增大,c (H +)>10-7 mol ·L -1,pH<7,但水仍显中性。
②酸、碱能抑制水的电离,故室温下,酸、碱溶液中水电离产生c (H +)<1×10-7 mol ·L -1而能水解的盐溶液中,水电离产生的c (H +)[或c (OH -)]>1×10-7 mol ·L -1。
(二)水电离出的c 水(H +)或c 水(OH -)的计算 【考必备·清单】1.当抑制水的电离时(如酸或碱溶液)在溶液中c (H +)、c (OH -)较小的数值是水电离出来的。
如下表:2.当促进水的电离时(如盐的水解)在溶液中c (H +)、c (OH -)较大的数值是水电离出来的。
如下表:【探题源·规律】[示例] 25 ℃时,在等体积的①pH =0的H 2SO 4溶液、②0.05 mol ·L-1的Ba(OH)2溶液、③pH =10的Na 2S 溶液、④pH =5的NH 4NO 3溶液中,发生电离的水的物质的量之比是( ) A .1∶10∶1010∶109 B .1∶5∶(5×109)∶(5×108) C .1∶20∶1010∶109 D .1∶10∶104∶109[解析] H 2SO 4与Ba(OH)2抑制水的电离,Na 2S 与NH 4NO 3促进水的电离。
高中化学新人教版教案-水的电离和溶液的酸碱性(区一等奖)

2.通过练习,是学生会使用水的离子积和PH的计算解决实际问题,提高学生分析问题、解决问题的能力。
过程与方法:通过练习,提高学生分析、综合、分类、对比、抽象、概括能力。
情感态度与价值观:
1.充分发挥学生的主动性,调动不同层次的学生的积极性,让学生手、脑、口并用;
1.了解水的电离、离子积常数。
2.了解溶液 pH 的定义和测定溶液 pH 的方法;能进行 pH 的简单计算。
触摸高考:
高考选项正误判断
1.『2012·江苏卷』水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应( )
2.『2012·广东卷』常温下pH为2的盐酸由水电离出的c(H+)=×10-12mol/L( )
3.『2013·天津卷』25℃时,NH4Cl溶液的Kw大于100 ℃ NaCl溶液的Kw ( )
4.『2013·江苏卷』由水电离出的c(H+)=×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-可以大量共存( )
二、回归教材,夯实基础
一、水的电离
水是一种______的电解质,H2O+H2O⇌H3O++OH-,简写为:__________________。
3、(1)常温下,某溶液中由水电离产生的C(H+)=10-6mol·L-1,则此溶液有可能是()
(2)常温下,某溶液中由水电离产生的C(H+)=10-9mol·L-1,则此溶液有可能是()
A、HCl B、NaCl C、NaHSO4D、NH4Cl
4、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是()
高三一轮复习——
水的电离和溶液的酸碱性_反思(高敏)

教学反思水的电离和溶液的酸碱性(第二课时)高敏我授课的内容是普通高中课程标准实验教科书(人教版)化学•选修4第三章第二节水的电离和溶液的酸碱性(第二课时),下面,我将课堂教学情况加以分析和说明。
一、教学的整体设计1、教学过程反思本节内容包括水的电离、水的离子积。
只有认识水的电离平衡及其移动,才能从本质上认识溶液的酸碱性和pH。
本节的学习也为盐类的水解及电解等知识的教学奠定基础。
教材从实验事实入手,说明水是一种极弱的电解质,存在着电离平衡。
由此引出水的电离平衡常数,进而引出水的离子积,并使学生了解水的离子积是个很重要的常数。
本节课的内容实际上是应用了本册书上一章化学平衡原理,探讨了水溶液中离子间的相互作用,内容丰富,理论与实际,知识与技能兼有之;水的电离是对本章第一节课的延续,它的电离过程的分析体现了化学理论的指导意义。
本节课的教学重点是水的离子积,c(H+)、PH与溶液酸碱性的关系。
难点是水的离子积,有关PH的简单计算。
由于本节课的特点,所以采用“引导-探究”教学模式,并借助多媒体教学。
教师指导学生从已有的知识开展学习活动,结合实验,层层深入。
这种使学生动口动手动脑动眼的多层次教学,让学生成为真正的主体,感受到学习化学的乐趣,化难为易,并使知识系统化。
水的电离方程式的书写→ 水的电离平衡常数→ 水的离子积常数讲清水的离子积的涵义是完成本节教学任务的关键。
让学生借助对化学平衡状态以及化学平衡常数的了解,去理解水的电离平衡;然后强调在酸或碱的稀溶液中,水的浓度基本不变,进而引出:水的离子积在一定温度下是个常数,并为认识溶液pH和后面学习盐类水解打下基础。
要使学生从本质上认识稀溶液的酸碱性与c(H+)、c(OH-)的关系,关键还是要学生在思路上紧扣平衡移动原理,通过对水的电离平衡及其影响因素的分析,明确一个变化趋势:外界对溶液中c(H+)或c(OH-)所作的任何改变,结果总是c(H+)·c(OH-)= K w,而与此相反的是,K w值并不随溶液中c(H+)、c(OH-)的改变而改变,这就是水的电离平衡的特点。
高中化学《水的电离和溶液酸碱性》的教案设计

高中化学《水的电离和溶液酸碱性》的教案设计•相关推荐高中化学《水的电离和溶液酸碱性》的教案设计【考试说明要求】1. 了解水的电离和水的离子积常数;2. 了解溶液PH的定义,能进行PH的简单计算。
【基础知识梳理】一、水的电离1、水是一种电解质,其电离方程式为,水的离子积Kw=Kw只随温度变化而不随浓度变化,水的电离是热过程,25℃时,Kw=2、影响水的电离平衡的因素⑴温度⑵酸、碱⑶易水解的盐【思考】分析下列条件的改变对水的电离平衡的影响:项目条件平衡移动方向 C(H+)变化 C(OH-)变化 C(H+)与C(OH-)大小比较 Kw 溶液酸碱性升温加入少量H2SO4加入少量NaOH加入少量Na2CO3加入少量FeCl3【例1】纯水在25℃和80℃时的H+浓度,前后两个量的大小关系为( )A. 大于B. 等于C. 小于D. 不能确定二、溶液的酸碱性和pH1、溶液的酸碱性取决于溶液中_________和__________的相对大小。
酸性溶液:C(H+)_____C(OH-),中性溶液:C(H+)__ _C(OH-),碱性溶液:C(H+)_ _C(OH-)2.(1)pH=_______________,pH大小反映了溶液中__________浓度大小,即反映溶液的_______性强弱。
(2)25℃时,酸性溶液:pH_____,中性溶液:pH_____,碱性溶液:pH_____。
(3)同种溶质的稀溶液:c(酸)越大,酸性越_____,pH越_____;c(碱)越大,碱性越_____,pH越_____。
(4)相同pH的酸(或碱),若酸(或碱)越弱,其物质的量浓度越____。
【思考】判断下列说法是否正确?(对的打√,错误打×)⑴pH=0的溶液中C(H+)=0 ( )⑵pH相同盐酸和硫酸分别中和一定量氢氧化钠溶液,消耗两种酸体积比为2∶1 ()⑶pH相同的氨水和NaOH溶液中和等量的盐酸时,消耗两种碱体积比为1∶1 ( )⑷pH=5的盐酸10mL加水稀释至1000mL后pH=7 ( )⑸100℃时纯水的pH=6,则100℃时纯水显酸性 ( )⑹pH=4.3的硫酸和pH=9.7的氢氧化钠溶液中水的电离程度近似相等 ( )3.pH的计算①已知酸碱浓度求pH ②稀释计算③混合计算【例2】⑴求pH=4的盐酸与水等体积混合后溶液的pH⑵求pH=12的.Ba(OH)2溶液与水以体积比2∶3混合后溶液的pH⑶常温下,重水离子积常数为 1.6×10-15,则0.001mol/LNaOD重水溶液1mL加重水稀释至10L后溶液的pD⑷求pH=4、pH=6的两种强酸溶液混合后溶液的pH=5时的体积比⑸求pH=8的强碱溶液100mL和pH=9的强碱溶液300mL混合后溶液的pH⑹求0.1mol/LHCl 800mL和0.1mol/LNaOH200mL混合后溶液的pH⑺等体积的pH=4的盐酸与醋酸加水稀释到pH=5,加水体积:前者_______后者。
水的电离和溶液酸碱性计算、酸碱滴定

一、水的电离水是极弱的电解质,发生微弱的电离,水分子电离示意图:1、水的电离H2O + H2O H3O+ + OH-简写:H2O H++ OH-实验测定:25℃c(H+)= c(OH-)=1×10-7mol/L2、水的离子积:25℃K W = c(H+)·c(OH-)= 1.0×10-14。
说明:(1) Kw只与温度有关,温度越高Kw越大。
因水的电离是吸热过程,升高温度Kw 将增大,100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)·c(OH-)=1×10-12。
(2) Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
3、影响水的电离平衡的因素(1) 温度:温度升高,水的电离程度增大,水的电离平衡向电离方向移动,离子浓度增大。
(2) 酸、碱:在纯水中加入酸或碱,抑制H2O的电离,均使水的电离平衡向分子化过程移动,此时若温度不变,Kw不变,水的电离程度变小;c(H+)发生改变,pH也随之改变;若向水中加入酸,则c(H+)增大,c(OH—)变小,pH变小(3) 其他因素:如向水中加入活泼的金属,由于与水电离出的H+直接作用,因而促进了水的电离平衡向电离的方向移动。
二、溶液的酸碱性与pH1、溶液的酸碱性以0.1mol/L HCl为例,由于酸电离出H+能使H2O H++OH-平衡向左移动,即抑制了水的电离,溶液中H+由两部分组成,一部分为酸提供,另一部分为H2O提供,水电离提供的c(H+)远小于酸提供的c(H+),故可忽略,溶液中H+全部看作酸提供,故c(H+)溶液=0.1mol/L,但溶液中OH-全部为H2O电离产生,c(OH—)溶液= c(OH—),水电离产生 c(H+)和c(OH—)始终相等,因此有c(OH—)溶液 = c(OH—) = c(H+)==1×10-13。
2、pH⑴定义:pH=-lgc(H+)溶液的酸性越强,其pH越小;溶液的碱性越强,其pH越大。
水的电离和溶液的酸碱性

c(H+)×c(OH-) 平衡常数:K 电离= c(H2O)
结论(1)水是极弱的电解质,它能微弱 “自身”电离生成H+与OH-
(2)水的电离是可逆的,存在电离平衡, 它的逆反应为中和反应
[定性讨论] 纯水的组成微粒有哪些? 作为弱电解质,水的电离平衡受哪些外 界因素影响? 温度、离子浓度(H+、OH-)等影响 在水中投入金属钠,对水的电离平衡 有无影响?
(3)易水解的盐:
在纯水中加入能水解的盐,不管水解后 显什么性,均促进水的电离,但只要温度 不变, Kw不变。 (4)其他因素: 如:向水中加入活泼金属
知识延伸: 1、c(H+)=1×10-7mol/L,溶液一定呈 中性吗? 说明:溶液或纯水呈中性,是因为溶液中 c(H+)=c(OH-) 2、纯水中溶液c(H +)、c(OH-)浓度的计 算方法: c(H +)=c(OH-)= Kw
思考:PH=0是何含义?
注意:pH=0 并非无H+,而是c(H+)=1mol/L,
pH=14 并非无OH -,而是c(OH -)=1mol/L
3、溶液的酸、碱性跟pH的关系 溶液的 酸碱性 中性溶 液 酸性溶液 c(H+)和 常温 c(OH-)的关 常温下:c(H+) 下: pH 系 [H+]=[OH-] 1×10-7mol/L
KW只与温度有关(与浓度无关):
温度升高,KW增大
如: 25℃ KW=10-14 100℃ KW=10-12
3、影响水电离平衡的因素 (1)加入酸或碱,抑制水的电离,Kw 不变;
(2)升高温度,电离过程是一个吸热 过程,促进 水的电离,水的离子积增 大,在常温时, KW=1×10-14;在100℃ 时,KW=1×10-12。
水的电离及溶液的酸碱性第1课时

《选修四第三章第二节 水的电离及溶液的酸碱性》导学案(第1课时)高二 班 第 组 姓名 组内评价 教师评价【课标要求】1、了解水是一种弱电解质以及水的离子积常数所表示的意义。
2、掌握水的离子积的应用。
3、了解溶液酸碱性和PH 值的关系。
【难点重点】1、水的电离和溶液的酸碱性;2、影响水的电离平衡的因素以及pH 的计算 【新课导学】[思考]如何用实验证明水是一种极弱的电解质? 1.现象:G :指针摆动 ○×:不亮 2.结论:3.原因: 或 实验测定(25℃时):c(H +)= c(OH -)=10-7mol/L 一、水的电离1、水是一种极弱电解质,能微弱电离:,因为c(H 2O )=常数,所以K 电离=c(H +)×c(OH -).2、水的离子积常数1)表达式:Kw= Kw 叫做水的离子积常数,简称 。
2)影响Kw 的因素:如:Kw (25℃)=10-14Kw (100℃)=10-12Kw 只与温度有关(与浓度无关):温度升高,Kw 注:常数无单位 【练习】1.水的电离过程为H 2OH + + OH -,在不同温度下其离子积分别为Kw (25℃)=1×10-14,Kw (35℃)=2.1 ×10-14。
则下列叙述正确的是( )A 、c(H +)随着温度的升高而降低 B 、在35℃时,纯水中c(H +)>c(OH -) C 、水的电离常数Kw (25℃)>Kw (35℃)D 、水的电离是一个吸热过程 2.判断正误:1)任何水溶液中都存在水的电离平衡。
2)任何水溶液中(不论酸、碱或中性)都存在Kw=10-14。
3)某温度下,某液体c(H +)=10-7mol/L ,则该溶液一定是纯水。
【讨论】对常温下的纯水进行下列操作,完成下表:【小结】加入酸或碱都 水的电离 3、影响水电离平衡的因素(1)加入酸或碱,抑制水的电离,Kw 不变;(2)升高温度,电离过程是一个吸热过程,促进水的电离,水的离子积增大, 【知识延伸】c(H +)=1×10-7mol/L ,溶液一定呈中性吗?说明:溶液或纯水呈中性,是因为溶液中c(H +)= c(OH -)4、利用Kw 的定量计算①任何水溶液中H +和OH -总是同时存在的,只是相对含量不同.②根据Kw= c(H +)×c(OH -)在特定温度下为定值, c(H +)和c(OH -)可以互求; ③任何水溶液中由水电离出来的c(H +)H 2O与c(OH -)H 2O 相等;④纯水中溶液c(H +)、c(OH -)浓度的计算方法:c(H +)= c(OH -)=【例题】⑴﹑0.1mol/L 的盐酸中由水电离出的c(H +)和c(OH -)是多少?⑵﹑0.1mol/L 的NaOH 溶液中水电离出的c(H +)和c(OH -)是多少?【练习】1. 0.1mol/L 的NaOH 溶液中,c(OH -)=?c(H +)=?由水电离出的c(OH -)水=?c(H +)水=?2. 0.1mol/L 的H 2SO 4溶液中,c(H +)=?c(OH -)=?由水电离出的c(OH -)水=?c(H +)水=?3. 0.1mol/L 的NaCl 溶液中,c(OH -)=?c(H +)=?4、25℃时,向纯水中加入少量氯化氢气体,仍能保持不变的是 ( )A. c(H +)B. c(OH -)C. KwD. c(H +)/c(OH -)5、水中加入氢氧化钠固体,c(OH -)__ _ __ ;则水的电离平衡向__ _ ___移动,水的电离被___ ,Kw__________,c(H +) ___ _____。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水的电离和溶液的酸碱性学习目标1. 从水的电离平衡去理解水的离子积和溶液pH值的含义,掌握溶液pH值跟氢离子浓度和溶液酸碱性的关系。
2.了解指示剂的变色范围,学会用pH试纸测定溶液的pH值。
3.掌握酸碱的pH值计算以及氢离子浓度和pH值的互算。
一、知识讲解1、水的电离:水是电解质,发生电离,电离过程思考:实验测得,在室温下1L H2O(即 mol)中只有1×10-7mol H2O电离,则室温下C(H+)和C(OH-)分别为多少? 纯水中水的电离度α(H2O)= 。
2.水的离子积水的离子积:K W= 。
注:(1)一定温度时,K W是个常数,K W只与有关,越高K W越。
25℃时,K W= ,100℃时,K W=10-12。
(2)K W不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
任何水溶液中,由水所电离而生成的C(H+) C(OH-)。
2、溶液的酸碱性和pH1.影响水的电离平衡的因素(1)温度:温度升高,水的电离平衡向方向移动,C(H+)和C(OH-) ,K W。
(2)溶液的酸、碱性:改变溶液的酸、碱度均可使水的电离平衡发生移动。
改变下列条件水的电离平衡是否移动?向哪个方向移动?水的离子积常数是否改变?是增大还是减小?①升高温度②加入NaCl ③加入NaOH ④加入HCl①在0.01mol/LHCl溶液中, C(OH-)= , C(H+)= ,由水电离出的H+浓度= ,由水电离出的OH-浓度= 。
,②在0.01mol/LNaOH溶液中,C(OH-)= ,C(H+)= ,由水电离出的H+浓度= ,由水电离出的OH-浓度= 。
③在0.01mol/LNaCl溶液中, C(OH-)= ,C(H+)= ,由水电离出的H+浓度= ,由水电离出的OH-浓度= 。
归纳小结(1)升高温度,促进水的电离K W增大(2)酸、碱抑制水的电离2.溶液的酸碱性常温(25℃)中性溶液:C(H+) C(OH-) C(H+) 1×10- 7mol/L 酸性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L 碱性溶液:C(H+) C(OH-) C(H+) 1×10- 7mol/L3.溶液的pH: pH=-lgc(H+)(1)C(H+)=1×10-6mol/L pH=______;C(H+)=1×10-3mol/L pH=____C(H+)=1×10-m mol/L pH=______ ;C(OH-)=1×10-6mol/L pH=_____C(OH-)=1×10-10mol/L pH=______ ;C(OH-)=1×10- n mol/L pH=_____(2)pH=2 C(H+)=________ ;pH=8 c(H+)=________(3)c(H+)=1mol/L pH= ______ ;c(H+)=10mol/L pH= ______pH与溶液酸碱性的关系(25℃时)3(1)酸碱指示剂法说明:常用的酸碱指示剂有石蕊、甲基橙、酚酞试液。
(2使用方法:(3)PH 计法热身练习1已知0.1 mol/L 的醋酸溶液中存在电离平衡:CH 3COOH CH 3COO -+H +,要使溶液中c (H+)/c (CH 3COOH)值增大,可以采取的措施是( )A.加少量烧碱溶液B.升高温度C.加少量冰醋酸D.加水热身练习2 在体积均为1L ,pH 均等于2的盐酸和醋酸溶液,分别投入0.23g Na ,则下图中比较符合反应事实的曲线是 ( )二、例题辨析题型一、水的电离和离子积例题1 水的电离平衡曲线如图所示。
(1) 若以A 点表示25℃时水的电离平衡的离子 浓度,当温度升高到100℃时,水的电离平衡状 态移动到B点,则此时水的离子积 从________变化到_________。
(2) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液 的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
(3) 已知A n B m 的离子积为[c(A m+)]n [c(B n-)]m ,若某温度下Ca(OH)2的溶解度为0.74g ,设饱和溶液的密度为1g/mL ,其离子积约为______________。
变式练习1某温度下纯水中C(H +) = 2×10-7 mol/L ,则此时溶液中的C(OH -) = ___________。
若温度不变,滴入稀盐酸使C(H +) = 5×10-6 mol/L ,则此时溶液中的C(OH -) = ___________。
变式练习2 (1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH 3NH 4++NH 2-据此判断以下 101010 10 c(H )mol/L c(OH -叙述中错误的是 ( )A .液氨中含有NH 3、NH 4+、NH 2-等微粒B .一定温度下液氨中C(NH 4+)·C(NH 2-)是一个常数C .液氨的电离达到平衡时C(NH 3) = C(NH 4+) = C(NH 2-)D .只要不加入其他物质,液氨中C(NH 4+) = C(NH 2-)(2)完成下列反应方程式①在液氨中投入一小块金属钠,放出气体————————————————————————————②NaNH 2溶于水的反应——————————————————————————————————题型二、溶液的酸碱性例题1 某温度下的溶液中c (H +)=1.0×10x mol/L ,c (OH -)=1.0×10y mol/L 。
x 与y 的关系如右图所示;(1)求该温度下,中性溶液的pH 。
(2)求该温度下0.01mol/LnaOH 溶液的PH(3)该温度下,pH=a 的醋酸溶液与pH=b 的NaOH 溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。
变式练习1 测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。
测定温度______室温(填高于、低于或等于),其理由是 。
将此温度下pH=11的NaOH 溶液aL 与pH=1的H 2SO 4溶液bL 混合。
(1)若所得混合液为中性,则a ︰b 。
(2)若所得混合液的pH=2,则a ︰b 。
变式练习2 已知一种c (H +)=1×10-3 mol / L 的酸和一种c (OH -)=1×10-11 mol / L 的碱溶液等体积混合后溶液呈酸性。
其原因可能是 ( )A. 浓的强酸和稀的强碱溶液反应B. 浓的弱酸和稀的强碱溶液反应C. 等浓度的强酸和弱碱溶液反应D. 生成了一种强酸弱碱盐题型三、有关pH 的计算例题3 1、分别求0.05mol/LH 2SO 4溶液和0.05mol/L Ba(OH)2溶液的PH 。
2、将PH=2的H 2SO 4溶液与PH=4的H 2SO 4溶液等体积混合后,求溶液的PH 。
3、将PH=8的NaOH 溶液与PH=10的NaOH 溶液等体积混合后,求溶液的PH 。
4、常温下PH=4的HCl 和PH=10的NaOH 分别按体积比为1:1,11:9,9:11混合,分别求三种情况下溶液的PH 。
5、常温下,将PH=1的H 2SO 4溶液和PH=13的NaOH 溶液分别稀释1000倍,求所得溶液的PH 。
若在常温下,将PH=1的CH 3COOH 溶液和PH=13的NH 3·H 2O 溶液分别稀释1000倍,则所得溶液的PH 在什么范围之内。
0 Y -5 -10 -15变式练习1 25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________变式练习2 往相同浓度、相同体积的NaOH溶液中分别加入pH为3和4的醋酸,使其刚好完全反应,若消耗两种醋酸溶液的体积分别为V1和V2,则V1、V2的关系是()A.V2=10V1B.V2<10V1C.V2>10V1D.V1=10V2三、归纳总结pH计算方法:(一)单一溶液pH的计算①强酸溶液 pH=-lg c(H+)②强碱溶液 pH=-lg c(H+) pH+pOH=-lg(Kw)(二)单一溶质加水稀释起始PH=a,稀释10n倍强酸 PH=a+n ;弱酸 a< PH<a+n;强碱 PH=a-n;弱碱 a-n. < PH<a;无限稀释, PH一律接近于7(三)、混合型(多种溶液混合)“酸按酸,碱按碱,酸碱混合求过量”(1)强酸混合,先求c(H+)混c(H+)混=[c(H+)1V1+c(H+)2V2]÷(V1+V2)(2)强碱混合先求c(OH-)混c(OH-)混=[c(OH-)1V1+c(OH-)2V2]÷(V1+V2)(3)强酸和强碱混合①若恰好中和,pH=7②若酸有余,求c(H+)余②若碱有余,求c(OH-)余四、拓展延伸例题25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;⑴a值可否等于3(填“可”或“否”)_________,其理由是___________________⑵a值可否等于5(填“可”或“否”)________,其理由是____________________⑶a的取值范围是_______________________________________。
变式练习现有浓度为0.1 mol·L-1的五种电解质溶液:① Na2CO3② NaHCO3 ③ NaAlO2④ CH3COONa ⑤ NaOH(1)这五种溶液的pH由小到大的顺序是___ ___(填编号);(2)将五种溶液稀释相同的倍数时,其pH变化最大的是____ __(填编号);(3酸;乙组实验所得混合溶液中由水电离出的c (OH-)= mol/L。
求出该混合溶液中下列算式的值,要求写出推理、计算过程。
I.c (Na+)-c (A-):;II.c (OH-)-c (HA):。
五、课后作业1.下列说法正确的是 ( )A. 温度升高水的电离程度增大,pH增大B. 纯水中c(H+)与c(OH-)的乘积一定等于1×10-14C. 某水溶液中只要c(H+)=c(OH-),则一定是中性的D. 电离程度大的酸一定比电离程度小的酸pH小2.将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近于 ( )A. 2×10-10 mol/LB. 12(10-8+10-10) mol/LC. (10-8+10-10) mol/LD. (1×10-14-5×10-5) mol/L3.将一块去掉氧化膜的锌片放入100 mL pH为1的盐酸中,2 min后溶液的pH变为2,则产生H2的速率可表示为(设溶液体积不变) ( )A. 0.0225 mol / (L·min)B. 0.05 mol / (L·min)C. 0.045 mol / (L·min)D. 0.01 mol / (L·min)4.下列四种溶液中,酸性最强的是 ( )A. pH=14的溶液B. c(OH-) =10×10-13 mol / L的溶液C. 0.1 mol / L的醋酸溶液(ρ=1 g/cm3 )D. pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合5.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是 ( )A. pH=3的硝酸跟pH=11的氢氧化钾溶液B. pH=3的盐酸跟pH=11的氨水溶液C. pH=3的硫酸跟pH=11的氢氧化钠溶液D. pH=3的醋酸跟pH=11的氢氧化钡溶液6.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是 ( )A. pH=3的硝酸跟pH=11的氢氧化钾溶液B. pH=3的盐酸跟pH=11的氨水溶液C. pH=3的硫酸跟pH=11的氢氧化钠溶液D. pH=3的醋酸跟pH=11的氢氧化钡溶液7.用0.1 mol/L的NaOH溶液去滴定0.1 mol/L的盐酸20 mL,若滴定误差为±0.1%,(指消耗NaOH的物质的量相当于HCl,不足和过量了0.1%),反应完毕后,溶液的pH最接近的范围是()A. 6.3─8.8B. 4.3─9.7C. 1.3─12.7D. 3.3─10.78.将体积为10 mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5。
