常见无机物在有机溶剂中的溶解度
有机化学相关知识点

有机化学相关知识点有机化学相关知识点(1) 难溶于水:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的醇、醛、羧酸等。
(2) 易溶于水:低级[n(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(都能与水形成氢键)。
(3) 具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是 9.3g (属可溶),易溶于乙醇等有机溶剂,当温度高于65℃ 时,能与水混溶冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④ 有的淀粉、蛋白质可溶于水形成胶体。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
有机物的密度(1) 小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2) 大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3. 有机物的状态[常温常压(1个大气压、20℃ 左右)](1) 气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态② 衍生物类:一氯甲烷(CH3Cl,沸点为 -24.2℃ ) 氟里昂(CCl 2F 2,沸点为 -29.8℃ )氯乙烯(CH2=CHCl,沸点为 -13.9℃ ) 甲醛(HCHO,沸点为 -21℃ )氯乙烷(CH3CH2Cl,沸点为12.3℃ ) 一溴甲烷(CH3Br,沸点为 3.6℃ )四氟乙烯(CF2=CF2,沸点为 -76.3℃ ) 甲醚(CH3OCH3,沸点为 -23℃ )甲乙醚(CH3OC2H5,沸点为10.8℃ ) 环氧乙烷( ,沸点为13.5℃ )(2) 液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
初中级常见无机盐的溶解度

9.9×10-3 8.055× 10-7 1.462× 10-4 1.722× 10-6 32 114 20°C 4.692× 10-5 395 100°C
碳酸锌 氯化锌 硝酸锌
ZnCO3 ZnCl2 Zn(NO3)2
614
硫酸锌
物质--银
ZnSO4
化学式
53.8
60.5
溴化银 碳酸银 氯化银 硫酸银
化学式
AlCl3 Al(NO3)3 Al(OH)3
化学式
MgCO3 MgCl2 Mg(OH)2 MnCl2
氢氧化镁 氯化锰
20°C 100°C -2 3.9×10 54.6 73.3 9.628× 10-4 73.9 115
氢氧化锰 硝酸锰 硫酸锰
物质--钠 碳酸钠 氯化钠 氢氧化钠 硝酸钠 硫酸钠 物质--铅
CaCl2 Ca(HCO3)2 Ca(OH)2 Ca(NO3)2 ·4H2O CaSO4·2H2O
化学式
100°C 159 18.4 363 0.205 100°C 156 56.3 56.3 178 245 24.1 100°C 49 160
K2CO3 KClO3 KCl KOH KNO3 KMnO4 K2SO4
100°C 354 77.3 871 103 153 100°C
溶解度表以化学品中特征元素的拼音
பைடு நூலகம்
碳酸钡 氯化钡 氢氧化钡 硫酸钡
物质--钙 氯化钙 碳酸氢钙 氢氧化钙
BaCO3 BaCl2 Ba(OH)2·8H2O BaSO4
化学式
59.4
硝酸钙 硫酸钙
物质--钾 碳酸钾 氯酸钾 氯化钾 氢氧化钾 硝酸钾 高锰酸钾 硫酸钾 物质--铝 氯化铝 硝酸铝 氢氧化铝 物质--镁 碳酸镁 氯化镁
氯化铈溶解度

氯化铈溶解度
氯化铈是一种溶解度很高的碱性金属氯化物,它的溶解度在普通氢氧化铈的溶解度的十倍以上。
因此,氯化铈通常被用作溶液中的氯化剂,能够有效地溶解各种有机物和无机物,并能抑制有机物的酯化反应。
在各种工业应用中,氯化铈的溶解度也受到了许多因素的影响。
首先,温度是影响氯化铈溶解度的主要因素。
随着温度的升高,氯化铈的溶解度也会升高。
根据热力学原理,溶解过程与温度有关:当温度升高时,物质的表面的动能增加,分子间的键的结合能力减弱,溶质和溶剂之间的作用力减弱,从而溶质分子更易于溶解。
其次,pH值也是影响氯化铈溶解度的重要因素。
随着pH值的变化,氯化铈在溶液中的溶解度也会发生变化。
碱性环境中,pH值较高,氯化铈溶解度也较高;而在酸性环境中,溶解度则会降低,但不至于完全沉淀。
此外,氯化铈的溶解度还受制多种因素的影响,例如质量浓度、添加剂、固定离子强度等等。
质量浓度是指在溶液中氯化铈的质量与总质量的比例,它也是影响氯化铈溶解度的重要因素。
随着氯化铈浓度的升高,其溶解度也随之增加。
此外,添加剂也是影响氯化铈溶解度的重要因素,正离子添加剂可以抑制氯化铈的溶解度,而负离子添加剂可以促进氯化铈的溶解度。
此外,固定离子强度也会影响氯化铈的溶解度,如果离子强度比较高,溶液中的氯化铈分子很难溶解,从而使氯化铈溶解度降低。
总之,氯化铈的溶解度受到许多因素的影响,因此在使用氯化铈
进行工业应用时应该根据实际情况选择合适的溶液条件,以期获得较高的溶解度。
高考化学物质溶解性规律总结

高考化学物质溶解性规律总结物质溶解性规律:(1)气体的溶解性①常温极易溶解的NH3[1(水)∶700(气)] HCl(1∶500)还有HF,HBr,HI,甲醛(40%水溶液—福尔马林)。
②常温溶于水的CO2(1∶1)Cl2(1∶2)H2S(1∶2.6)SO2(1∶40)③微溶于水的O2,O3,C2H2等④难溶于水的H2,N2,CH4,C2H2,NO,CO等。
(2)液体的溶解性①易溶于水或与水互溶的如:酒精、丙酮、醋酸、硝酸、硫酸。
②微溶于水的如:乙酸乙酯等用为香精的低级酯。
③难溶于水的如:液态烃、醚和卤代烃。
(3)固体的水溶性(无机物略)有机物中羟基和羧基具有亲水性,烃基具有憎水性,烃基越大,则水溶性越差,反而易I溶于有机溶剂中。
如:甲酸、乙酸与水互溶,但硬脂酸、油酸分子中因—COOH比例过少反而不溶于水而溶于CCl4,汽油等有机溶剂。
苯酚、三溴苯酚、苯甲酸均溶于苯。
(4)从碘、溴、氯的水溶液中萃取卤素的有机溶剂如:苯、汽油、乙醚、乙酸乙酯、CCl4、CS2等。
(5)白磷、硫易溶于CS2(6)常见水溶性很大的无机物如:KOH,NaOH,AgNO3溶解度在常温超过100g(AgNO3超过200g)。
KNO3在20℃溶解度为31.6g,在100℃溶解度为246g。
溶解度随温度变化甚少的物质常见的只有NaCl。
(7)难溶于水和一般溶剂的物质①原子晶体(与溶剂不相似)。
如:C,Si,SiO2,SiC等。
其中,少量碳溶于熔化的铁。
②有机高分子:纤维素仅溶于冷浓H2SO4、铜氨溶液和CS2跟NaOH 作用后的溶液中,已热固化的酚醛树脂不溶于水或一般溶剂。
醋酸钾醋酸钠在不同溶剂中的溶解度解析

实验方案醋酸钠化学式CH3COONa,无色透明晶体。
密度1.45克/厘米3。
熔点58℃。
123℃时失去结晶水。
无水物的密度1.528克/厘米3,熔点324℃。
溶于水,呈弱碱性。
稍溶于乙醇。
用作照相、印染、化学试剂及肉类防腐等。
醋酸钾化学式CH3COOK ,分子量98.14,白色结晶性粉末,多呈细颗粒或粉沫状。
有咸味,易潮解。
相对密度 1.570;熔点292℃.极易溶于水、乙醇和甲醇,不溶于乙醚。
溶液对石蕊呈碱性,对酚酞不呈碱性。
主要用于青霉素钾盐生产,也可用作化学试剂、制备无水乙醇及聚氨酯、保温材料、玻璃钢作工业催剂、助剂、填加剂等。
乙醇是无色、透明,具有特殊香味的液体(易挥发),密度比水小,能跟水以任意比互溶,是一种重要的溶剂,能溶解多种有机物和无机物。
丙酮,也称作二甲基酮,饱和脂肪酮系列中最简单的酮。
熔点-95度,沸点56度,无色液体,有特殊气味。
溶解度是指在一定压力和温度下,物质在一定量溶剂中溶解的最高量.一般以100克溶剂中能溶解的物质的克数来表示。
一般来说固体溶解度的测定方法有两种,即:平衡法和动态法。
试验测定溶解度的方法有平衡法和动态法。
平衡法是将被测物系在某一温度下恒温搅拌一定时间,静置后分析上层溶液的组成作为该温度下的溶解度。
动态法是通过观察物系中固相的消失来测定溶解度。
前者对溶解达到平衡的速度没有限制,而且代表着物质达到真实溶解平衡的数据,因而得到了广泛的应用。
本研究采用静态平衡法进行测定,同时采用溶解和结晶过程相结合的方法来测定其溶解度。
本实验为测定CH3COOK和CH3COONa分别在乙醇和丙酮中的溶解度,温度分别控制在20,25,30,35,40,45,50,55度,采用静态平衡法进行测定。
一、测定CH3COOK和CH3COONa在丙酮中的溶解度1、制取过饱和溶液用量筒量取50ml丙酮,将量取好的丙酮倒入洁净干燥的锥形瓶中,放入某一温度的恒温水浴中,加入固体醋酸钠,直至有固体不溶,静置片刻,用1ml 的移液管快速移取上层清液进行分析。
常用有机溶剂性质(极性、沸点、溶解性等)
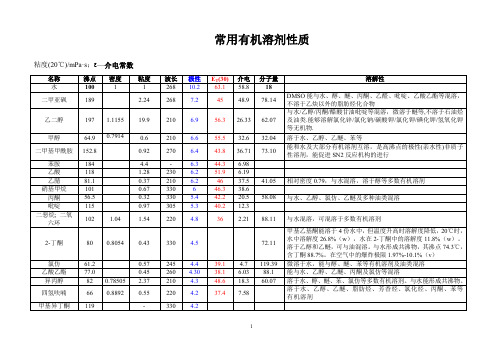
常用有机溶剂性质粘度(20℃)/mPa·s; —介电常数名称沸点密度粘度波长极性E T(30) 介电分子量溶解性水100 1 1 268 10.2 63.1 58.8 18二甲亚砜189 2.24 268 7.2 45 48.9 78.14 DMSO能与水、醇、醚、丙酮、乙醛、吡啶、乙酸乙酯等混溶,不溶于乙炔以外的脂肪烃化合物乙二醇197 1.1155 19.9 210 6.9 56.3 26.33 62.07 与水/乙醇/丙酮/醋酸甘油吡啶等混溶,微溶于醚等,不溶于石油烃及油类.能够溶解氯化锌/氯化钠/碳酸钾/氯化钾/碘化钾/氢氧化钾等无机物.甲醇64.9 0.7914 0.6 210 6.6 55.5 32.6 32.04 溶于水、乙醇、乙醚、苯等二甲基甲酰胺152.8 0.92 270 6.4 43.8 36.71 73.10 能和水及大部分有机溶剂互溶,是高沸点的极性(亲水性)非质子性溶剂,能促进SN2反应机构的进行苯胺184 4.4 - 6.3 44.3 6.98乙酸118 1.28 230 6.2 51.9 6.19乙腈81.1 0.37 210 6.2 46 37.5 41.05 相对密度0.79,与水混溶,溶于醇等多数有机溶剂硝基甲烷101 0.67 330 6 46.3 38.6丙酮56.5 0.32 330 5.4 42.2 20.5 58.08 与水、乙醇、氯仿、乙醚及多种油类混溶吡啶115 0.97 305 5.3 40.2 12.3二恶烷; 二氧六环102 1.04 1.54 220 4.8 36 2.21 88.11 与水混溶,可混溶于多数有机溶剂2-丁酮80 0.8054 0.43 330 4.5 72.11 甲基乙基酮能溶于4份水中,但温度升高时溶解度降低,20℃时,水中溶解度26.8%(w),水在2-丁酮中的溶解度11.8%(w)。
溶于乙醇和乙醚,可与油混溶。
知识点高二化学有机物的溶解性和密度

知识点高二化学有机物的溶解性和密度下面查字典化学网为大家整理了高二化学有机物的溶解性和密度,希望大家在空余时间进行复习练习和学习,供参考。
1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
② 苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③ 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④ 有的淀粉、蛋白质可溶于水形成胶体。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤ 线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、氟代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯以上就是高二化学有机物的溶解性和密度,希望能帮助到大家。
乙醇降低溶解度原理

乙醇降低溶解度原理一、什么是溶解度在化学中,溶解度是指单位体积溶剂中最多可溶解的物质的量,通常用摩尔的形式表示。
溶解度决定了物质在溶液中的存在形式和浓度。
二、溶解度的影响因素溶解度受到多种因素的影响,包括温度、压力和溶剂等。
其中,溶剂是影响溶解度的重要因素之一。
三、乙醇的溶解度表现乙醇是一种常见的有机溶剂,在很多化学和生物过程中都起到重要作用。
乙醇具有较高的溶解度,可以溶解许多无机和有机物质。
3.1 乙醇的无机物溶解度乙醇可以溶解许多不同种类的无机盐,例如氯化钠、硫酸铜等。
这些无机盐在乙醇中形成离子和非离子化合物,溶解度与离子间相互作用力有关。
3.2 乙醇的有机物溶解度乙醇对许多有机物也有良好的溶解度。
这是因为乙醇能够与许多有机物发生氢键和范德华力等相互作用。
乙醇可以溶解许多有机化合物,如糖类、氨基酸、脂肪酸等。
四、乙醇降低溶解度原理乙醇在水中的溶解度随温度的升高而降低。
这是由于乙醇和水的分子结构不同,导致它们之间存在特殊的相互作用力。
4.1 氢键的作用乙醇和水分子之间可以通过氢键相互作用。
氢键是一种特殊的化学键,是由氢原子与高电负性的原子(如氧、氮)形成的。
乙醇和水分子之间的氢键相互作用较强,导致它们之间的吸引力增大,从而降低了乙醇在水中的溶解度。
4.2 对溶剂结构的影响乙醇的存在会改变水分子的排列方式。
在乙醇溶液中,乙醇分子会插入到水的结构中,破坏水分子之间的氢键网络。
这种结构改变导致溶液中溶质(如无机盐、有机物)的溶解度降低。
4.3 温度的影响温度对溶解度有显著的影响。
乙醇在水中的溶解度随温度的升高而降低。
这是由于温度升高会增加溶质和溶剂分子的热运动能量,使得它们之间相互作用力减弱,从而降低了溶解度。
五、应用和意义乙醇降低溶解度的原理在多个领域具有重要应用和意义。
5.1 化学分离技术乙醇降低溶解度的原理被广泛应用于化学分离技术中,如结晶、沉淀、萃取等。
通过调节溶剂的组成和温度,可以实现对目标物质的高效分离和纯化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
某些无机化合物在部分有机溶剂中的溶
解度 (一)
Solubilities of Some Inorganic Compounds in Organic Solvents
序号
(No.)
化学式
(Chemical
formula)
溶解度(Solubility)/(g/100g)
甲醇 (Methanol) 乙醇 (Ethanol) 丙酮 (Acetone) 甘油 (Glycerol) 吡啶
(Pyridine)
1 AgBr 7.0×10-7 1.6×10-8 - - -
2 AgCl 6.0×10-6 1.5×10-6 1.3×10-6 - 1.9
3 AgI 2.0×10-7 6.0×10-9 - - -
4 AgNO3 3.8 2.1 0.44 - 34.0
5 BaBr2 4.1 3.6 0.026 - -
6 BaCl2 2.2 - - 9.8 -
7 BaI2 - 77.0 - - 8.2
8 Ba(NO3)2 0.06 1.8×10-3 5.0×10-3 - -
9 BiCl3 - - 18.0 - -
10 BiI3 - 3.5 - - -
11 Bi(NO3)3·5H2O - - 14.7 - -
12 CaBr2 56.2 53.8 2.73 - -
13 CaCl2 29.2 25.8 0.01 - 1.69
14 CaI2 127.0 - 89.0 - -
15 Ca(NO3)2 138.0 51.0 16.9 - -
16 CaSO4 - - - 5.2 -
17 CdBr2 16.1 30.0 18.1 - -
18 CdCl2 2.7 1.5 - - 0.70
19 CdI2 223.0 113.0 42.8 - 0.45
20 CdSO4 0.035 0.03 - - -
21 CoBr2 43.0 77.0 64.0 - -
22 CoCl2 40.0 54.0 3.0 - 0.6
23 CoSO4 1.040 0.02 - - -
24 CoSO4·7H2O 5.5 - - - -
25 CuCl2 57.5 55.5 2.96 - 0.34
26 CuI2 - - - - 0.5
27 CuSO4 1.5 1.1 - - -
28 CuSO4·5H2O 15.6 - - - -
29 FeCl3 150.0 145.0 62.9 - -
30 Fe2(SO4)3·9H2O - 12.7 - - -
31 H3BO3 - 11.0 0.5 22.0 7.1
32 HCl(气体) 88.7 69.5 - - -
33 HgBr2 60.0 30.0 51.0 - 39.6
34 Hg(CN)2 44.1 9.5 10.3 27.0(15.0℃) 65.0
35 HgCl2 67.0 47.0 141.0 34.4 25.0
36 HgI2 3.8 2.2 3.4 - 31.0
37 KBr 2.1 0.46 0.03 15.0 -
38 KCN 4.91 0.88 - 32.0 -
39 KCl 0.5 0.03 9.0×10-5 3.7 -
40 KF 0.19 0.11 2.2 - -
41 KI 16.4 1.75 2.35 40.0 0.3
42 KOH 55.0 39.0 - - -
43 KSCN - - 20.8 - 6.15
44 LiBr - 70.0 18.1 - -
45 LiCl 43.4 25.0 1.2 11.0 12.0
46 LiI 343.0 250.0 43.0 - -
47 LiNO3 - - 31.0 - 33.0
48 MgBr2 27.9 15.1 2.0 - 0.5
49 MgCl2 16.0 5.6 - - -
50 MgSO4 0.3 0.025 - 26.0 -
51 MgSO4·7H2O 43.0 - - - -
52 MnCl2 - - - - 1.3
53 MnSO4 0.13 0.01 - - -
54 NH3(气体) 24.0 12.8 - - -
55 NH4Br 12.5 3.4 - - -
56 (NH4)2CO3 - - - 20.0 -
57 NH4Cl 3.3 0.6 - 9.0 -
58 NH4ClO4 6.8 1.9 2.2 - -
59 NH4I - 26.3 - - -
60 NH4NO3 17.1 2.5 - - 0.3
61 NH4SCN 59.0 23.5 - - -
62 NaBr 16.7 2.4 0.008 - -
63 Na2CO3 - - - 98.0 -
64 NaCl 1.5 0.1 3.0×10-5 - -
65 Na2CrO4 0.36 - - - -
66 NaF 0.42 0.1 1.0×10-4 - -
67 NaI 72.7 46.0 26.0 - -
68 NaNO2 4.4 0.31 - - -
69 NaNO3 0.43 0.04 - - -
70 NaOH 31.0 17.3 - - -
71 NaSCN 35.0 20.0 7.0 - -
72 NiBr2 35.0 - 0.80 - -
73 NiCl2 - 10.0 - - -
74 NiCl2·6H2O - 53.7 - - -
75 NiSO4 4.0 0.02 - - -
76 NiSO4·7H2O 20.0 2.2 - - -
77 PbBr2 - - - - 0.6
78 PbCl2 - - - 2.0 0.5
79 PbI2 - - 0.02 - 0.2
80 Pb(NO3)2 1.4 0.04 - - 7.0
81 SbF3 160.0 - 70.0 - -
82 SbCl3 - - 538.0 - -
83 SnCl2 - - 56.0 - -
84 SrBr2 117.0 64.0 0.6 - -
85 SrCl2·6H2O 63.3 - - - -
86 SrI2 - 4.0 - - -
87 Sr(NO3)2 - 0.009 - - 0.7
88 UO2(NO3)2 - 3.3 1.5 - -
89 ZnBr2 - - 365.0 - 4.4
90 ZnCl2 - - 43.3 50.0 2.6
91 ZnI2 - - - 40.0 12.6
92 ZnSO4 0.6 0.03 - 35.0 -
93 ZnSO4·7H2O 5.9 - - - -
