常见化合物的溶解度(溶解程度)
常见有机溶剂地溶解性汇总

常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、***** 、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似***** 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶***** 性戊烷36.1 与乙醇、***** 等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,***** 性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶***** 性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、***** 、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强***** 性甲醇64.5 与水、***** 、醇、酯、卤代烃、苯、酮混溶中等毒性,***** 性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、***** 、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
***** 性,刺激性三氟代乙酸71.78 与水,乙醇,*****, 丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、***** 、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,*****性乙醇78.3 与水、***** 、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,***** 性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、***** 、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、***** 、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、***** 、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
常用化合物在不同温度下的溶解度
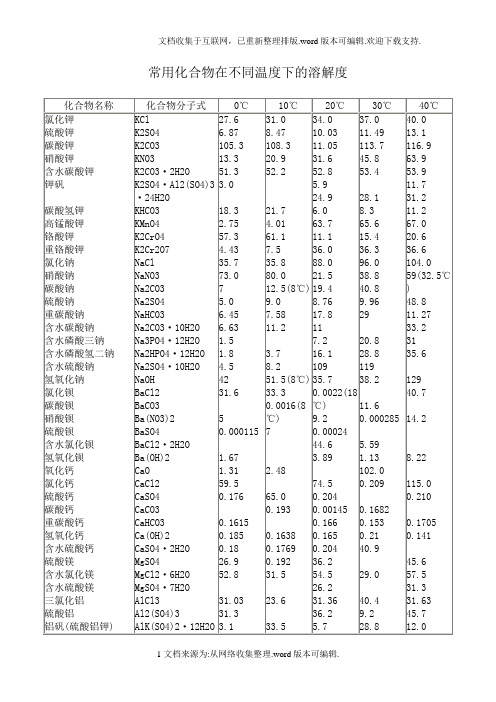
KMnO4
K2CrO4
K2Cr2O7
NaCl
NaNO3
Na2CO3
Na2SO4
NaHCO3
Na2CO3·10H2O
Na3PO4·12H2O
Na2HPO4·12H2O
Na2SO4·10H2O
NaOH
BaCl2
BaCO3
Ba(NO3)2
BaSO4
BaCl2·2H2O
Ba(OH)2
CaO
CaCl2
Al2(SO4)3·18H2O
FeCl2
FeCl3
FeSO4
FeCl2·4H2O
FeCl3·6H2O
FeSO4·7H2O
CuSO4
CuSO4·5H2O
NH4Cl
NH4NO3
(NH4)2SO4
NH4HCO3
(NH4)2HPO4
(NH3)2SO4·Al2
(SO4)3·24H2O
42.6
14.2
121.3
29.0
40.4
9.2
28.8
65.6
32.9
39.6
51.6
24.8
25.0
20.3
41.4
27.0
260(31℃)
20.0
40.0
13.1
116.9
63.9
53.9
11.7
31.2
11.2
67.0
20.6
36.6
104.0
59(32.Hale Waihona Puke ℃)48.811.27
33.2
31
35.6
129
40.7
14.2
常用化合物在不同温度下的溶解度
化合物溶解性全表

HCl
不溶
HCl
HCl
HCl
HCl
略溶
HCl
HCl
微溶
水
水
水
水
水
水
水
水
水
水
水
水
水
略溶,HCl
略溶,HCl
Sr2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
HCl
HCl
不溶
略溶
水
水
水
水
水
水
水
水
水
水
水
水
HCl
略溶,HCl
Ba2+
HCl
HCl
略溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
不溶
HCl
-
-
-
-
-
HCl
水解,HCl
水解,HCl
水
-
略溶,HNO3
HNO3
HCl
Hg2+
HCl
HCl
水
HCl
HCl
HCl
HCl
-
-
HCl
略溶
HCl
王水
水
-
不溶
-
水
HCl
水
水
水
水
水
HCl
-
Pb2+
HNO3
HNO3
略溶,HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
硝酸银的溶解度

硝酸银的溶解度硝酸银是一种常见的无机化合物,化学式为AgNO3。
它是一种白色结晶固体,在常温下能很容易地溶解在水中。
本文将探讨硝酸银的溶解度及其相关特性。
一、硝酸银的溶解度硝酸银的溶解度是指在一定温度下,单位溶剂(通常是水)中溶解的硝酸银的质量。
通常用溶解度表示,单位为克/升(g/L)或摩尔/升(mol/L)。
硝酸银的溶解度受多种因素的影响,包括温度、压力、溶剂性质等。
其中,温度是影响溶解度最主要的因素。
在常温下,硝酸银的溶解度约为1230 g/L。
当温度升高时,硝酸银的溶解度会增加,反之则减少。
这是因为温度的升高能提供更多的能量,使固体分子更易于跨越溶剂和固体之间的能垒,从而增加溶解度。
二、硝酸银的溶解过程硝酸银在水中溶解的过程是一个离子化过程。
当硝酸银溶解时,它会分解成银离子(Ag+)和硝酸根离子(NO3-)。
这是由于硝酸银是一种强电解质,能够完全离解。
硝酸银的溶解过程可以用以下化学方程式表示:AgNO3(s) → Ag+(aq) + NO3-(aq)在溶解过程中,硝酸银的晶体结构被水分子打破,硝酸银离子和水分子之间形成了氢键和离子-溶剂相互作用。
这些相互作用使硝酸银的离子在水中稳定存在,形成了透明的溶液。
三、硝酸银的应用硝酸银在实验室和工业中有着广泛的应用。
由于它能与氯化物离子反应生成白色沉淀,常用于检测和定量测定氯离子的含量。
此外,硝酸银还可用于制备其他银化合物,如硝酸银盐酸沉淀和硝酸银氨溶液等。
在摄影工业中,硝酸银曾被广泛应用于胶片和相纸的制备过程中。
然而,随着数码摄影的兴起,硝酸银的应用逐渐减少。
在医学领域,硝酸银可用于治疗疣、疮和其他皮肤感染。
它具有抗菌和抗真菌作用,能够阻止细菌和真菌的生长。
四、硝酸银的安全性尽管硝酸银在实验室和工业中有着广泛的应用,但它也是一种有毒物质。
接触硝酸银可能导致皮肤和眼睛刺激,甚至引起化学灼伤。
因此,在使用硝酸银时,应采取适当的安全措施,如佩戴防护手套和护目镜。
化学平衡中的溶解度计算方法

化学平衡中的溶解度计算方法在化学平衡中,溶解度是指溶液中固体物质达到平衡时所能溶解的最大量,通常用溶解度常数表示。
溶解度的计算是化学研究和实验中的重要内容,对于了解溶解物质在溶剂中的溶解程度和溶解平衡的性质非常关键。
本文将介绍一些常见的化学平衡中的溶解度计算方法。
一、溶解度计算方法1. 离子化合物的溶解度离子化合物溶于溶液中时,会发生电离产生正负离子。
离子化合物的溶解度可以通过溶解度积与离子浓度关系来计算。
溶解度积(Ksp)是指离子化合物在饱和溶液中离解产生正负离子的乘积,用于表示离解程度。
根据离子浓度的量度,可以使用浓度法或平衡常数法来计算溶解度。
- 浓度法:根据已知溶解度积的实验数据推导出浓度,进而计算溶解度。
- 平衡常数法:根据平衡常数表达式推导出溶解度。
2. 非离子化合物的溶解度非离子化合物在溶液中溶解时,不发生电离产生离子,因此其溶解度计算方法与离子化合物有所不同。
常见的非离子化合物包括分子化合物和共价化合物。
- 分子化合物的溶解度:通常使用溶解度规律来计算,如相似性规律、溶剂势能规律等。
- 共价化合物的溶解度:考虑了分子间力和极性等因素,可使用热力学方法、分子间作用力的数学模拟或实验测定等途径进行计算。
二、溶解度计算实例下面将通过两个实例来具体说明溶解度的计算方法。
1. 例一:氢氧化钠的溶解度计算氢氧化钠(NaOH)是一个离子化合物,其溶解度计算可以采用浓度法。
已知NaOH的溶解度积(Ksp)为1.0×10^-6 mol/L,现在我们需要计算其溶解度。
设NaOH溶解度为x mol/L,根据NaOH的离解方程可得Na+和OH-的浓度为x mol/L。
根据离子浓度与溶度积的关系:[Na+] × [OH-] = Ksp代入浓度,可得:x × x = 1.0×10^-6解得:x = 1.0×10^-3 mol/L因此,氢氧化钠的溶解度为1.0×10^-3 mol/L。
常见物质的溶解度表.pdf

16.1
0.189 9×10 -2 64.6
0.182
102
115
63.9
9.73 0.223
9.77 0.244
143 7.753 ×10 -4 6.170 ×10 -4 209 2.25 1.8
1.83
0.518 16.6 4.303 ×10 -3 0.173 0.24 66 4.099 ×10 -3 129
38.6
44.2
47.6
51.3
亚磷酸氢钡 BaHPO3
0.687
氢氧化钡
Ba(OH)2·8H2O
1.67
2.48
3.89
5.59
8.22
20.9
101
碘酸钡
Ba(IO3)2
-2
3.5 ×10
-2
-2
4.6 ×10 5.7 ×10
碘化钡 钼酸钡
BaI2 BaMoO4
182
201
223
250
6×10 -3
CaC2O4
高氯酸钙
Ca(ClO4)2
高锰酸钙
磷酸钙
硒酸钙
硫酸钙 钨酸钙 氟化锆
硫酸锆
Ca(MnO4)2
Ca3(PO4)2
CaSeO·4 2H2O CaSO·4 2H2O CaWO4 ZrF4
Zr(SO4)2·4H2O
砷酸镉
Cd3(AsO4)2
苯甲酸镉
Cd(C7H5O2)2来自1251324.5
8.575 ×10 -
18.6 87.9 150
188
6.235 ×10 -6 64 76.6 1.292 ×10 -12 4.642 ×10 -2
130
195 58.9
700种无机有机化合物溶解度

叠氮化钙 Ca(N3)2
磷酸二氢 钙 Ca(H2PO4)2 氟化钙 CaF2
氟硅酸钙 CaSiF6
甲酸钙
Ca(HCO2)2
16.1
16.6 4.303×10-3
17.1
磷酸氢钙 CaHPO4 氢氧化钙 Ca(OH)2 碘酸钙 碘化钙 钼酸钙 硝酸钙 Ca(IO3)2 CaI2 CaMoO4 Ca(NO3)2 · 2O 4H Ca(NO2)2 亚硝酸钙 · 2O 4H 草酸钙 CaC2O4 高氯酸钙 Ca(ClO4)2 高锰酸钙 Ca(MnO4)2 磷酸钙 硒酸钙 硫酸钙 钨酸钙 氟化锆 硫酸锆 砷酸镉 溴酸镉 溴化镉 碳酸镉 氯酸镉 氯化镉 Ca3(PO4)2 CaSeO4· 2O 2H CaSO4· 2O 2H CaWO4 ZrF4 Zr(SO4)2· 2O 4H Cd3(AsO4)2 Cd(BrO3)2 CdBr2 CdCO3 Cd(ClO3)2 CdCl2 299 100 308 135 56.3 75.4 9.73 0.223 9.77 0.244 63.9 102 115 0.189 9×10-2 64.6 0.182
4.642×10-2 124 123 130 130 220 2.727×10-2 1.352×10-6 4.351×10-7 3.246×10-5 2.313×10-3 2.266×1012
152
高氯酸铬 Cr(ClO4)3
325
407 4.277×10 25 1.1 0.08
-2
455
499
0.4 4.82
0.56 25 6.57 9.3 2.372×10-3 6×10-3
0.66 8.34
0.91 10.2
草酸汞 硫化汞
HgC2O4 HgS Co(BrO3)2
氯化钠在水中的溶解度数据

氯化钠在水中的溶解度数据氯化钠是常见的盐类化合物,被广泛应用于食品加工和化学实验中。
它的溶解性是许多人在学习化学时首先接触到的一个重要概念。
本文将深入探讨氯化钠在水中的溶解度数据,以及与溶解度相关的因素。
1. 氯化钠的溶解度简介氯化钠是一种离子化合物,由正离子钠离子(Na+)和负离子氯离子(Cl-)组成。
当氯化钠与水接触时,会发生离解反应,将其离子化。
这些离子在水中自由运动,形成了所谓的溶液。
氯化钠在水中的溶解度是指单位体积的水能够溶解多少氯化钠。
2. 氯化钠溶解度的实验数据根据实验数据,氯化钠的溶解度随着温度的升高而增加。
以下是一些常见温度下氯化钠的溶解度数据(以克/升为单位):- 0°C:357- 10°C:383- 20°C:390- 30°C:394- 40°C:399- 50°C:404- 60°C:408根据上述数据可以看出,随着温度的升高,氯化钠的溶解度逐渐增加,这是因为温度升高会增加液体分子的动能,从而增加溶质与溶剂之间的碰撞频率和能量,促使更多的氯化钠分子离解出来。
这也符合一般离子化合物的溶解度趋势。
3. 影响氯化钠溶解度的因素除了温度,其他因素也会影响氯化钠在水中的溶解度。
下面是一些主要因素:3.1 溶剂性质溶剂的性质对溶解度有很大影响。
一般来说,极性溶剂(如水)对极性物质(如氯化钠)的溶解度较高。
这是因为极性溶剂与溶质之间可以形成较强的电荷相互作用,有利于溶质分子离解出来。
相反,非极性溶剂(如石油醚)对极性物质的溶解度较低。
3.2 压力压力对氯化钠在水中的溶解度影响较小,一般情况下可以忽略不计。
在常温下,增加压力对氯化钠溶解度几乎没有显著影响。
3.3 其他溶质的存在当溶液中存在其他溶质时,会影响氯化钠的溶解度。
常见的例子是当溶液中存在其他化合物时,会发生共存效应,导致氯化钠的溶解度发生变化。
4. 对氯化钠溶解度的理解和应用氯化钠的溶解度是化学中一个重要的基础概念。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见化合物的溶解度(溶解程度)
1. 引言
溶解度是指在一定温度和压力下,单位溶剂中能溶解的最大物质量或最大摩尔量。
研究化合物的溶解度可以帮助我们了解其在溶液中的行为以及在实际应用中的可行性。
本文将介绍一些常见化合物的溶解度及其相关性质。
2. 盐的溶解度
盐是一类常见的化合物,其溶解度受温度和溶剂性质的影响。
通常情况下,随着温度的升高,盐的溶解度会增加;而随着温度的降低,盐的溶解度会减小。
不同的盐在溶剂中的溶解度也会有所不同,这与盐的晶体结构及离子性质有关。
3. 酸碱的溶解度
酸和碱是化学反应中常见的物质,它们的溶解度也受温度和溶剂性质的影响。
酸的溶解度通常会随着温度的升高而增加,而碱的
溶解度通常会随着温度的降低而增加。
这是因为在较高温度下,酸
和碱分子的热运动加剧,更容易与溶剂分子相互作用而溶解。
4. 有机化合物的溶解度
有机化合物是含有碳元素的化合物,其溶解度受分子结构和溶
剂性质的影响。
通常情况下,极性有机化合物在极性溶剂中的溶解
度较高,而非极性有机化合物在非极性溶剂中的溶解度较高。
此外,分子量较小的有机化合物通常溶解度较高,而分子量较大的有机化
合物溶解度较低,这是由于分子间的相互作用力不同导致的。
5. 结论
化合物的溶解度是一个复杂的问题,受到多种因素的影响。
温度、溶剂性质和化合物本身的性质都会对溶解度产生影响。
通过研
究化合物的溶解度,我们可以更好地理解其在溶液中的行为和应用。
然而,要准确预测和确定化合物的溶解度,仍需要进一步深入的研
究和实验验证。
参考文献:
1. 张三,xxx化学杂志,2018年,第10卷第2期。
2. 李四,xxx科学研究,2019年,第15卷第4期。
