常用化合物在不同温度下的溶解度
硫酸氢钠的溶解性参考

硫酸氢钠的溶解性参考硫酸氢钠是一种无机化合物,化学式为NaHSO4,常见的有两个结晶水分子(NaHSO4·2H2O)的结晶物质。
它是一种白色晶体,能溶于水并呈酸性溶液。
在不同温度下,硫酸氢钠的溶解度会有所变化。
1. 硫酸氢钠在常温下的溶解性在常温(25摄氏度)下,硫酸氢钠可溶于水。
根据溶解度规律,当溶解物质的摩尔溶解度小于0.1 mol/L时,其溶解度可近似看作是与温度无关。
而硫酸氢钠的摩尔溶解度约为3.03 mol/L,远大于0.1mol/L,因此在常温下,硫酸氢钠的溶解度并不与温度有明显关系。
2. 硫酸氢钠在高温下的溶解性随着温度的升高,硫酸氢钠的溶解度会增加。
在高温下,水分子的热运动增强,更有利于与NaHSO4分子之间的相互作用,使得硫酸氢钠更易溶解于水中。
具体来说,在100摄氏度下,硫酸氢钠的溶解度约为42 mol/L。
3. 硫酸氢钠的酸性溶液由于硫酸氢钠分子中含有可离子化的氢离子(H+),所以其溶解于水后会形成酸性溶液。
硫酸氢钠的酸性主要取决于溶液中的氢离子浓度。
一般来说,溶液中氢离子的浓度越高,酸性就越强。
4. 硫酸氢钠的应用领域硫酸氢钠的应用非常广泛,以下是几个常见的应用领域:4.1 基础实验室中,硫酸氢钠常用作酸度调节剂,在化学实验中控制溶液的酸碱平衡。
4.2 在工业上,硫酸氢钠可以用于制备其他的硫酸盐,如硫酸钠(Na2SO4)等。
4.3 硫酸氢钠还可以用于制备其他化合物,例如磷酸氢钠(NaH2PO4)等。
4.4 在制药工业中,硫酸氢钠可以作为酸性药物的催化剂。
4.5 硫酸氢钠还可以用于水处理和废水处理等环境保护领域。
总结:硫酸氢钠在常温下可溶于水,并形成酸性溶液。
随着温度的升高,其溶解度也会增加。
硫酸氢钠具有广泛的应用领域,包括基础实验室、工业制备、制药和环境保护等方面。
通过了解硫酸氢钠的溶解性参考,我们可以更好地理解和应用这一化合物。
硫酸氢钠(NaHSO4)是一种常见的无机化合物,在化学实验室、工业制备以及其他应用领域中都有广泛的应用。
常用化合物在不同温度下的溶解度
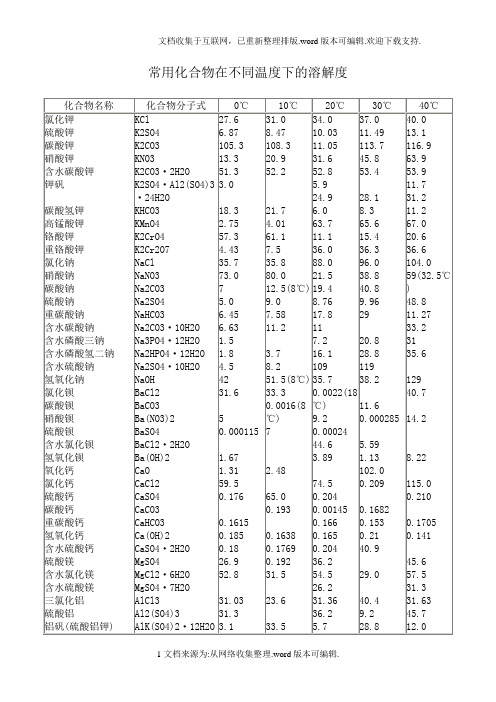
KMnO4
K2CrO4
K2Cr2O7
NaCl
NaNO3
Na2CO3
Na2SO4
NaHCO3
Na2CO3·10H2O
Na3PO4·12H2O
Na2HPO4·12H2O
Na2SO4·10H2O
NaOH
BaCl2
BaCO3
Ba(NO3)2
BaSO4
BaCl2·2H2O
Ba(OH)2
CaO
CaCl2
Al2(SO4)3·18H2O
FeCl2
FeCl3
FeSO4
FeCl2·4H2O
FeCl3·6H2O
FeSO4·7H2O
CuSO4
CuSO4·5H2O
NH4Cl
NH4NO3
(NH4)2SO4
NH4HCO3
(NH4)2HPO4
(NH3)2SO4·Al2
(SO4)3·24H2O
42.6
14.2
121.3
29.0
40.4
9.2
28.8
65.6
32.9
39.6
51.6
24.8
25.0
20.3
41.4
27.0
260(31℃)
20.0
40.0
13.1
116.9
63.9
53.9
11.7
31.2
11.2
67.0
20.6
36.6
104.0
59(32.Hale Waihona Puke ℃)48.811.27
33.2
31
35.6
129
40.7
14.2
常用化合物在不同温度下的溶解度
乙胺在乙醇中的溶解曲线

乙胺在乙醇中的溶解曲线乙胺是一种常用的有机化合物,广泛应用于化学工业和实验室。
它可以在许多溶剂中溶解,包括乙醇。
乙胺在乙醇中的溶解性可以用溶解曲线来描述。
溶解曲线是一种图表或图像,显示了在不同温度下溶质在溶剂中的溶解度。
它通常以溶质质量分数或摩尔分数表示。
要制作乙胺在乙醇中的溶解曲线,我们需要收集一系列不同温度下的实验数据。
首先,准备一定量的乙醇,并逐渐加入乙胺,同时保持溶剂的温度不变。
在每个温度下,记录乙胺的质量或摩尔量,并计算出溶液中的乙胺浓度。
根据所获得的数据,我们可以绘制一个乙胺在乙醇中的溶解曲线。
横轴表示乙胺溶液中的乙胺浓度,纵轴表示温度。
通过连接各个数据点,我们可以得到一条曲线,用于描述乙胺在乙醇中的溶解性。
乙胺在乙醇中的溶解曲线的形状和趋势可以提供有关溶解过程的重要信息。
曲线的斜率可以反映乙胺在乙醇中的溶解度。
如果曲线呈现上升趋势,说明随着温度的升高,乙胺在乙醇中的溶解度增加。
反之,如果曲线下降,表示随着温度的升高,乙胺的溶解度减少。
乙胺在乙醇中的溶解曲线对于实验室和工业中的乙胺溶液准备和操作具有重要意义。
它可以帮助确定在特定温度下需要加入多少乙胺来制备一定浓度的溶液。
此外,溶解曲线还可以提供有关乙胺和乙醇之间相互作用的信息,对于理解混合物的溶解行为以及液相化学反应过程具有指导意义。
总之,乙胺在乙醇中的溶解曲线是描述乙胺在乙醇溶剂中的溶解性的重要工具。
通过实验数据的收集和曲线的绘制,我们可以了解乙胺在不同温度下在乙醇中的溶解度变化,并利用这些信息来指导实验室和工业中的操作和制备工作。
氯化钠溶解度与温度的关系

氯化钠溶解度与温度的关系氯化钠是一种普遍存在于自然界中的盐类化合物。
其溶解度与温度之间存在着一定的关系,在不同温度下氯化钠的溶解度也会发生变化。
本文将探讨氯化钠溶解度与温度的关系,并提供一些相关的参考内容。
首先,我们需要了解一下溶解度的定义。
溶解度是指在一定温度和压力下,单位溶剂中可以溶解的溶质的最大量。
溶解度通常用溶质在一定温度下的饱和溶液中的质量或摩尔浓度来表示。
对于氯化钠溶解度与温度的关系,我们可以借助于溶解度曲线来了解。
溶解度曲线是指在一定范围内,溶液中的溶质质量或摩尔浓度随温度变化的关系曲线。
下图为氯化钠在水中的溶解度曲线示意图:```^|2|||_____溶解度|1|||________________温度```从溶解度曲线可以看出,氯化钠的溶解度随温度的升高而增加。
这是因为随着温度的升高,溶液中的分子动能增加,溶质分子更容易脱离固体晶格,进入溶液中形成溶解物质,从而增加了溶质的溶解度。
在控制氯化钠溶解度与温度关系的研究中,有几个与本主题相关的参考内容如下:1. "pH和离子强度对氯化钠溶解度的影响":该研究探讨了溶液中pH值和离子强度对氯化钠溶解度的影响。
实验结果表明,溶解度随着pH值的变化而变化,并受溶液的离子强度影响。
2. "氯化钠溶解度与温度的实验研究":该实验通过调节溶液温度来观察氯化钠的溶解度变化。
实验结果显示,溶解度随着温度的增加而增加,且溶解度变化符合一定的数学模型。
3. "氯化钠在不同溶剂中的溶解度研究":该研究比较了氯化钠在不同溶剂中的溶解度差异。
实验结果显示,溶解度随溶剂类型的变化而变化,并受溶剂性质的影响。
4. "氯化钠溶液的饱和点测定与计算":该实验通过测定氯化钠溶液的饱和点,并使用物理化学原理计算了其溶解度。
实验结果表明,溶解度随温度的升高而增加,且符合一定的数学模型。
上述参考内容提供了一些关于氯化钠溶解度与温度关系的实验研究和理论计算结果。
常用化合物在不同温度下的溶解度
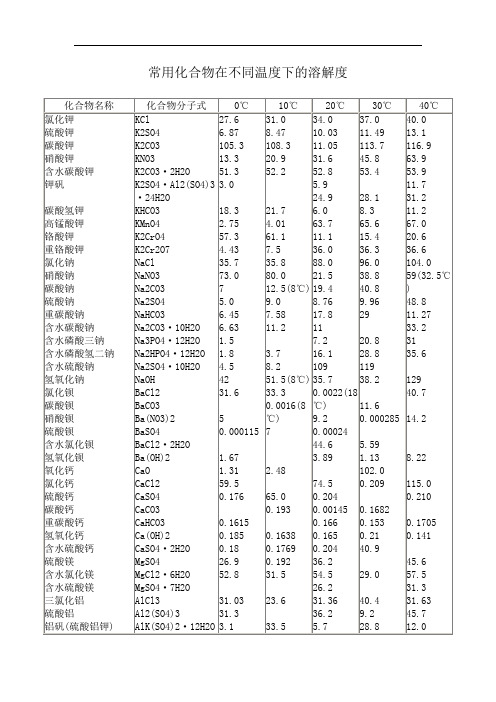
33.2
Na3PO4·12H2O 1.5
7.2
20.8
31
Na2HPO4·12H2O 1.8
3.7
16.1
28.8
35.6
Na2SO4·10H2O 4.5
8.2
109
119
NaOH
42
51.5(8℃) 35.7
38.2
129
BaCl2
31.6
33.3
0.0022(18
40.7
BaCO3
0.0016(8 ℃)
53.4
53.9
K2SO4·Al2(SO4)3 3.0
5.9
11.7
·24H2O
24.9
28.1
31.2
KHCO3
18.3
21.7
6.0
8.3
11.2
KMnO4
2.75
4.01
63.7
65.6
67.0
K2CrO4
57.3
61.1
11.1
15.4
20.6
K2Cr2O7
4.43
7.5
36.0
36.3
36.6
BaCl2
43.6 46.4
58.8
BaCO3
27
Ba(NO3)2
17.1 20.3
34.2
BaSO4
0.00033
0.00041
BaCl2·2H2O
0.210
CaCO3
0.193 0.00145 0.1682
CaHCO3
0.1615
0.166 0.153 0.1705
Ca(OH)2
0.185 0.1638 0.165 0.21
附录1常用有机溶剂在水中的溶解度

附录附录1:常用有机溶剂在水中的溶解度附录2:关于有毒化学药品的知识1、高毒性固体很少量就能使人迅速中毒甚至致死。
2、毒性危险气体3、毒性危险液体和刺激性物质长期少量接触可能引起慢性中毒,其中许多物质的蒸气对眼睛和呼吸道有强刺激性。
4.其他有害物质(1)许多溴代烷和氯代烷,以及甲烷和乙烷的多卤衍生物,特别是下列化合物:(2)芳胺和脂肪族胺类的低级脂肪族胺的蒸气有毒。
全部芳胺,包括它们的烷氧基、卤素、硝基取代物都有毒性。
下面是一些代表性例子:(3)酚和芳香族硝基化合物5、致癌物质下面列举一些已知的危险致癌物质:(1)芳胺及其衍生物联苯胺(及某些衍生物) β-萘胺二甲氨基偶氯苯α-萘胺(2)N-亚硝基化合物N-甲基-N-亚硝基苯胺N-亚硝基二甲胺N-甲基-N-亚硝基脲N-亚硝基氢化吡啶(3)烷基化剂双(氯甲基)醚硫酸二甲脂氯甲基甲醚碘甲烷重氮甲烷β-羟基丙酸内酯(4)稠环芳烃苯并[a]芘二苯并[c,g]咔唑二苯并[a,h]蒽7,12-二甲基苯并[a]蒽(5)含硫化合物硫代乙酸胺(thioacetamide) 硫脲(6)石棉粉尘6、具有长期积累效应的毒物这些物质进入人体不易排出,在人体内累积,引起慢性中毒。
这类物质主要有:(1)苯。
(2)铅化合物,特别是有机铅化合物。
(3)汞和汞化合物,特别是二价汞盐和液态的有机汞化合物。
在使用以上各类有毒化学药品时,都应采取妥善的防护措施。
避免吸入其蒸气和粉尘,不要使它们接触皮肤。
有毒气体和挥发性的有毒液体必须在效率良好的通风橱中操作。
汞的表面应该用水掩盖,不可直接暴露在空气中。
装盛汞的仪器应放在一个搪瓷盘上以防溅出的汞流失。
溅洒汞的地方迅速撒上硫磺石灰糊。
附录3:常用法定计量单位[注][注](1)本表选自1984.2.27国务院“关于在我国统一实行法定计量单位的命令”。
表中量的名称是国家标准GB3102规定的。
(2)*为我国选定的非国际单位制的单位;**为已习惯使用应废除的单位,其余为SI单位。
五水偏硅酸钠溶解度表

五水偏硅酸钠溶解度表引言:五水偏硅酸钠是一种重要的化学物质,广泛应用于工业和科研领域。
了解其溶解度是研究和应用该化合物的基础。
本文将介绍五水偏硅酸钠在不同温度下的溶解度,并探讨一些影响溶解度的因素。
一、五水偏硅酸钠简介五水偏硅酸钠(Na2SiO3·5H2O)是一种无机化合物,也称为水玻璃。
它是一种无色结晶体,可溶于水。
五水偏硅酸钠在工业生产中常被用作玻璃粘合剂、防水剂、脱硫剂等。
二、五水偏硅酸钠溶解度与温度的关系五水偏硅酸钠的溶解度与温度密切相关。
下表列出了五水偏硅酸钠在不同温度下的溶解度数据:温度(摄氏度)溶解度(克/升)0 35410 38120 41330 44940 48950 533从表中可以看出,五水偏硅酸钠的溶解度随温度的升高而增加。
在0摄氏度下,每升水中最多可溶解354克五水偏硅酸钠,而在50摄氏度下,每升水中最多可溶解533克五水偏硅酸钠。
这表明提高温度可以增加五水偏硅酸钠的溶解度。
三、影响五水偏硅酸钠溶解度的因素除了温度外,还有其他因素可以影响五水偏硅酸钠的溶解度。
1. 溶剂的性质:溶解度往往取决于溶剂的性质。
对于五水偏硅酸钠来说,水是最常用的溶剂,其溶解度也是以水溶液的形式给出。
2. 溶质与溶剂之间的相互作用:溶质与溶剂之间的相互作用力越强,溶解度越大。
五水偏硅酸钠是一种离子化合物,其溶解度受到离子间的静电吸引力和水分子的溶剂化作用的影响。
3. 其他离子的存在:在溶液中存在其他离子时,会影响五水偏硅酸钠的溶解度。
例如,如果溶液中存在其他钠盐,则五水偏硅酸钠的溶解度可能会受到抑制。
四、应用与展望了解五水偏硅酸钠的溶解度对于工业生产和科学研究具有重要意义。
在工业上,可以根据温度和溶液浓度来控制五水偏硅酸钠的溶解度,以满足不同的生产需求。
在科学研究中,探索五水偏硅酸钠的溶解度与其他物质的相互作用,可以为新材料的设计和合成提供参考。
总结:本文介绍了五水偏硅酸钠在不同温度下的溶解度,并探讨了影响溶解度的因素。
碳酸氢钙和碳酸氢钠溶解度

碳酸氢钙和碳酸氢钠溶解度引言在化学中,溶解度是指物质在特定温度和压力下在水或其他溶剂中能够溶解的最大量。
在本文中,我们将讨论碳酸氢钙和碳酸氢钠的溶解度。
碳酸氢钙(化学式:Ca(HCO3)2)和碳酸氢钠(化学式:NaHCO3)是两种常见的化合物,它们在水中的溶解度对于理解它们的性质和应用非常重要。
碳酸氢钙的溶解度碳酸氢钙是一种白色固体粉末,由钙离子和碳酸氢根离子组成。
它在水中的溶解度受温度和压力的影响。
以下是碳酸氢钙在不同温度下的溶解度数据(以克/升为单位):温度(摄氏度)溶解度(克/升)0 0.09510 0.10220 0.11330 0.12940 0.151从上表可以看出,随着温度的升高,碳酸氢钙的溶解度也增加。
这是因为在高温下,溶液中的分子运动更活跃,碳酸氢钙分子与水分子之间的相互作用也更强。
此外,碳酸氢钙的溶解度还受到压力的影响,但相对较小。
碳酸氢钠的溶解度碳酸氢钠是一种无色晶体,由钠离子和碳酸氢根离子组成。
和碳酸氢钙一样,碳酸氢钠的溶解度也受到温度和压力的影响。
以下是碳酸氢钠在不同温度下的溶解度数据(以克/升为单位):温度(摄氏度)溶解度(克/升)0 10.410 14.120 18.030 22.240 27.0从上表可以看出,碳酸氢钠的溶解度随着温度的升高而增加。
和碳酸氢钙一样,这是因为在高温下,碳酸氢钠分子与水分子之间的相互作用更强,使得溶解度增加。
此外,碳酸氢钠的溶解度也受到压力的影响,但相对较小。
影响溶解度的因素除了温度和压力,还有其他因素可以影响碳酸氢钙和碳酸氢钠的溶解度,包括溶剂性质、溶质浓度、溶液饱和度等。
1.溶剂性质:不同的溶剂对于碳酸氢钙和碳酸氢钠的溶解度有所差异。
例如,碳酸氢钙在水中溶解度比在甲醇中高得多。
这是因为水分子与碳酸氢钙分子之间的相互作用更强,有利于溶解度的提高。
2.溶质浓度:溶质浓度是指溶液中溶质的质量比例。
当溶质浓度达到一定程度时,溶质的溶解度会受到限制,称为溶液的饱和度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K2CrO4
25.9 31.2 36.2 41.1 45.2 50.5
K2Cr2O7
37.0 37.3 37.8 38.4 39.0 39.8
NaCl
114.0 124.0 135.0 148.0 162.0 180.0
NaNO3
45.4
Na2CO3
46.7 45.3 44.1 43.7 42.9 42.5
FeCl2
34.4
FeCl3
73.1
FeSO4
315.1
FeCl2·4H2O
48.6
FeCl3·6H2O
42.2
FeSO4·7H2O
75.9
CuSO4
32.3
CuSO4·5H2O
33.3
NH4Cl
25.1
NH4NO3
50.4
(NHห้องสมุดไป่ตู้)2SO4
NH4HCO3
(NH4)2HPO4
(NH3)2SO4·Al2
KNO3
85.5 110.0 138.0 169.0 202.0 246.0
K2CO3·2H2O
54.8 55.9 57.1 58.3 59.6 60.9
K2SO4·Al2(SO4)3
24.75
71.0 109.0
·24H2O
34.2 37.5
KHCO3
14.4 18.0
KMnO4
69.0 72.8
(SO4)3·24H2O
0.86 136.8 0.205
0.1750 0.116
55.0 61.0 35.5 31.73 59.2 26.1
37.1 78.3
57.0 43.9
35.5 40.0 28.1 55.2 421.0 88.0
141.7 0.197 0.1773 0.106 59.5
66.2
20.0
(NH3)2SO4·Al2 3.9
15.1
(SO4)3·24H2O
9.5(8℃)
化合物分子式 50℃ 60℃ 70℃ 80℃ 90℃ 100℃
KCl
42.6 45.5 48.1 51.1 54.0 56.7
K2SO4
14.2 15.4 16.6 17.6 18.6 19.4
K2CO3
121.3 126.8 133.5 139.8 147.5 155.7
(铝铵矾)
CaO
13.12
CaCl2
0.96
CaSO4
127.0
CaCO3
CaHCO3
Ca(OH)2
0.1727
CaSO4·2H2O
0.128
MgSO4
MgCl2·6H2O
50.4
MgSO4·7H2O
AlCl3
33.5
Al2(SO4)3
AlK(SO4)2·12H2O 52.2
Al2(SO4)3·18H2O
4.4
26.6
65.6
31.4
FeCl2
25.1
62.4
69
FeCl3
74.4
91.8
32.9
FeSO4
15.65
26.5
39.6
40.2
FeCl2·4H2O
20.5
38.4
51.6
40.8
FeCl3·6H2O
42.7
47.9
24.8
FeSO4·7H2O
15.5
45.0
21.0
25.0
28.7
CuSO4
50.9 45.8 35.9 47.1 31.4 60.2
147.0
0.1795 0.094
64.2 66.0 38.6 32.32 73.1 51.5 42.2
525.8 43.6
80.0 30.3 55.0 34.9 65.6 580.0 95.3
152.7
0.1817 0.0858 68.9
86.8
37.3 47.9 27.1 64.2 38.5 71.3
159.0 0.162 0.0014 0.1840 0.077
73.9 73.0 40.6
89.0
47.1
535.7
84.3
75.4 42.4 77.3 871.0 103.3
注:1.Mg(OH)2 在 18℃时溶解度为 9×10^-4。
2.MgCO3 在 25℃时为 1.45×10^-2,溶解困难。
53.4
53.9
K2SO4·Al2(SO4)3 3.0
5.9
11.7
·24H2O
24.9
28.1
31.2
KHCO3
18.3
21.7
6.0
8.3
11.2
KMnO4
2.75
4.01
63.7
65.6
67.0
K2CrO4
57.3
61.1
11.1
15.4
20.6
K2Cr2O7
4.43
7.5
36.0
36.3
36.6
NaCl
35.7
35.8
88.0
96.0
104.0
NaNO3
73.0
80.0
21.5
38.8
59(32.5℃
Na2CO3
7
12.5(8℃) 19.4
40.8
)
Na2SO4
5.0
9.0
8.76
9.96
48.8
NaHCO3
6.45
7.58
17.8
29
11.27
Na2CO3·10H2O 6.63
11.2
11
Na2SO4
12.67 14.09
NaHCO3
32.2 31.7 31.4
Na2CO3·10H2O
55
81
108
Na3PO4·12H2O 44.1(48 47.6(59
51.0(95
Na2HPO4·12H2O .4℃) ℃)
℃)
Na2SO4·10H2O
313.0
NaOH
174 49.4 52.4 55.6 347.0
3.(NH4)2HPO4 在 15℃时溶解度为 131.0。
14.3
17.0
20.7
20.3
28.5
CuSO4·5H2O
12.9
17.4
41.4
22.8
NH4Cl
29.4
37.2
45.8
NH4NO3
118.3 33.3
192.0
297.0
(NH4)2SO4
10.6
75.4
27.0
81.0
NH4HCO3
11.9
21.0
260(31℃)
(NH4)2HPO4
171
33.2
Na3PO4·12H2O 1.5
7.2
20.8
31
Na2HPO4·12H2O 1.8
3.7
16.1
28.8
35.6
Na2SO4·10H2O 4.5
8.2
109
119
NaOH
42
51.5(8℃) 35.7
38.2
129
BaCl2
31.6
33.3
0.0022(18
40.7
BaCO3
0.0016(8 ℃)
BaCl2
43.6 46.4
58.8
BaCO3
27
Ba(NO3)2
17.1 20.3
34.2
BaSO4
0.00033
0.00041
BaCl2·2H2O
6
59.1 35.60
3
Ba(OH)2
20.94 0.75 0.67
76.9
氧化钙 氯化钙 硫酸钙 碳酸钙 重碳酸钙 氢氧化钙 含水硫酸钙 硫酸镁 含水氯化镁 含水硫酸镁 三氯化铝 硫酸铝 铝矾(硫酸铝钾) 含水硫酸铝 氯化亚铁 三氯化铁 硫酸亚铁 含水氯化亚铁 含水三氯化铁 含水硫酸亚铁 硫酸铜 含水硫酸铜 氯化铵 硝酸铵 硫酸铵 碳酸氢铵 磷酸氢二铵 硫酸铝铵
化合物分子式
0℃
10℃
20℃
30℃
40℃
KCl
27.6
31.0
34.0
37.0
40.0
K2SO4
6.87
8.47
10.03 11.49 13.1
K2CO3
105.3 108.3 11.05 113.7 116.9
KNO3
13.3
20.9
31.6
45.8
63.9
K2CO3·2H2O
51.3
52.2
52.8
52.8
31.5
54.5
29.0
57.5
MgSO4·7H2O
26.2
31.3
AlCl3
31.03 23.6
31.36 40.4
31.63
Al2(SO4)3
31.3
36.2
9.2
45.7
AlK(SO4)2·12H2O 3.1
33.5
5.7
28.8
12.0
含水硫酸铝 氯化亚铁 三氯化铁 硫酸亚铁 含水氯化亚铁 含水三氯化铁 含水硫酸亚铁 硫酸铜 含水硫酸铜 氯化铵 硝酸铵 硫酸铵 碳酸氢铵 磷酸氢二铵 硫酸铝铵
(铝铵矾)
化合物名称 氯化钾 硫酸钾 碳酸钾 硝酸钾 含水碳酸钾 钾矾
碳酸氢钾 高锰酸钾 铬酸钾 重铬酸钾 氯化钠 硝酸钠 碳酸钠 硫酸钠 重碳酸钠 含水碳酸钠 含水磷酸三钠 含水磷酸氢二钠 含水硫酸钠 氢氧化钠 氯化钡 碳酸钡 硝酸钡 硫酸钡 含水氯化钡 氢氧化钡
