四川省成都市新津县高三理综(化学部分)下学期开学考试试题
四川省新津中学高一化学下学期开学考试试题
四川省新津中学2020—2021学年高一化学下学期开学考试试题可能用到的相对原子质量:H —1 O- 16 S —32 Na — 23 Mg —24 Al —27 Ca —40 Fe- 56I —127 Ba- 137第Ⅰ卷选择题一、选择题(每小题只有一个选项符合题意) 1.生活是化学的源泉。
下列叙述错误的是( )A .75%浓度的酒精、含氯消毒剂均可以有效灭活新型冠状病毒B .许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质C .生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料D .可溶性铜盐有毒,故人体内不存在铜元素2。
在给定条件下,下列选项所示物质间的转化不能一步实现的是A. 22O O222VNa Na O Na O −−→−−→B. −−−−−→−−−−→22O H O324点燃S SO H SO C 。
−−−−−→−−−−−→22Cl H 4高温高温Si SiCl SiD 。
−−−−−−→−−−−→22OO32催化剂/△NH NO NO 3。
下列有关物质的俗称、分类和用途的说法都正确的是( )物质俗称 分类 用 途A NaHCO 3 纯碱盐常用于中和发酵面团产生的酸B CaO生石灰 碱性氧化物 加入煤中可减少温室气体的排放C KAl(SO 4)2·12H 2O 明矾 电解质作净水剂使水中的悬浮物沉降 D Na 2SiO 3水溶液水玻璃 非电解质是制备硅胶和木材防火剂的原料4。
A N 是阿伏加德罗常数的值。
下列说法正确的是( ) A. 11L 0.1mol L -⋅的3CH COOH 溶液能电离出H +数目为A 0.1N B 。
227.8g Na O 晶体中阴阳离子总数为A 0.3NC. 150mL 12mol L -⋅浓盐酸与足量二氧化锰共热反应,生成2Cl 分子的数目为A 0.15N D 。
标准状况下,322.4L SO 含氧原子数为A 3N 5.下列说法中正确的是( ) A .用湿润的pH 试纸测定2Cl 的pH 值B .常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸不与铁、铝反应C .候德榜是我国近代化学工业的奠基人之一,候氏制碱法得到的“碱"是碳酸钠D .节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽的色彩,所以焰色试验是化学变化6。
四川省成都市高三下学期三诊模拟考试理综-化学试题Word版含答案

浊又变为蓝色溶液,这个反应可以反复多次。
下列关于上述过程的说法不正确的是种合成原料由C、H、O三种元素组成,其球棍模型如图所示(图中的连线表示化学键),下列说法正确的液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。
下列说法正确的是回答下列问题:。
再次将装置A称重,记为mg。
按下图连接好装置进行实验。
2,充分加热。
实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
件已略去):下几种有机物的生成热:,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
的1.75倍。
________________________。
_________________________________。
还存在氢键作用,画出该氢键的表示式_______。
(例如,水中氢键的表示式为: )。
可)。
____种。
_______________________________。
的水蒸气带走;同时防止FeC2O4被空气氧化(2分)3FeC2O4△Fe3O4+4CO+ 2CO2↑(2 分)O-+2Fe2++ H2O+4OH-=2 Fe(OH)3↓+Cl-1.0×10-5.2(2分)(4)①0.15 (1分) ②4.5mol/L(2分) (5)C4H10+13CO32--26e-=17CO2+5H2O (2 分)①3s23p63d7(1分) 配位键(1分) N 原子有孤电子对,Co2+有空轨道(2分)。
四川省新津中学高三化学12月月考试题(含解析)

四川省新津中学2016届高三化学12月月考试题(含解析)可能用到的相对原子质量:K—39 Na—23 H—1, O—16 S—32 C—12一、选择题(本题共7小题,每小题6分,共42分)1、化学与生产、生活息息相关,下列说法不正确的是( )。
A.误食重金属盐可立即喝鲜牛奶或鸡蛋清解毒B.硅是人类将太阳能转换为电能的常用材料C.Al(OH)3可用来治疗胃酸过多,其原因是发生了氧化还原反应D.高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水【答案】C【解析】试题分析:A、重金属盐可以是蛋白质变性,所以误食后会中毒,服用大量的蛋清和牛奶后,可以和重金属反应,变为不被吸收的物质,减弱对肠胃的影响,故A正确;B、硅单质是太阳能电池的材料,故B正确;C、氢氧化铝与盐酸反应生成氯化铝和水,没有元素的化合价变化,不发生氧化还原反应,故C错误;D、K2FeO4中Fe元素化合价高,具有强氧化性,可以杀菌消毒,被还原为铁离子,铁离子水解生成氢氧化铁胶体,表面积很大,可以吸附悬浮物起净水作用,故D正确;故选C。
考点:考查了化学与生产、生活的相关知识。
2、下列说法中正确的是( )。
A.中子数为18的氯原子可表示为18ClB.盐酸和食醋既是化合物又是酸C、可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去D.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同【答案】D【解析】试题分析:A、元素符号左下角数字表示质子数、左上角数字表示质量数,所以中子数为18的氯原子可表示为1735Cl,故A错误;B、盐酸和食醋都是水溶液,属于混合物,不是化合物,故B错误;C、胶体和溶液都能透过滤纸,所以不能通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去,故C错误;D、6.8g固体KHSO4的物质的量为0.05mol、3.9g固体Na2O2的物质的量为0.05molO,每个化学式中阴离子个数都是1,所以二者所含阴离子个数相等,故D正确;故选D。
四川省成都市新津县高二化学下学期入学考试试题
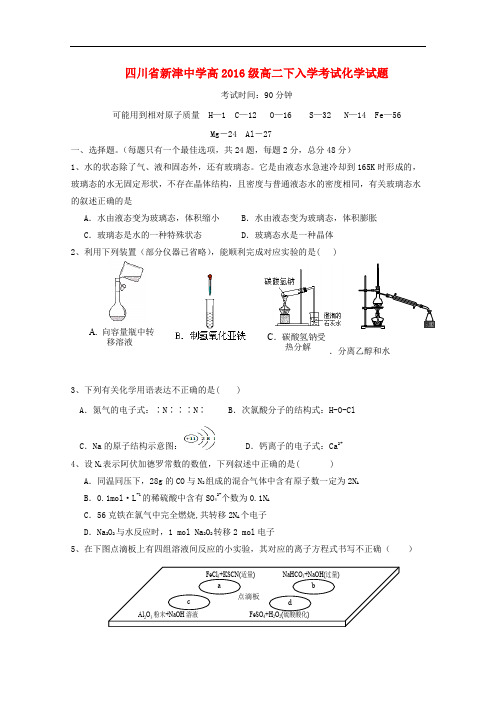
四川省新津中学高2016级高二下入学考试化学试题考试时间:90分钟可能用到相对原子质量 H —1 C —12 O —16 S —32 N —14 Fe —56Mg -24 Al -27一、选择题。
(每题只有一个最佳选项,共24题,每题2分,总分48分)1、水的状态除了气、液和固态外,还有玻璃态。
它是由液态水急速冷却到165K 时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是A .水由液态变为玻璃态,体积缩小B .水由液态变为玻璃态,体积膨胀C .玻璃态是水的一种特殊状态D .玻璃态水是一种晶体2、利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )D .分离乙醇和水3、下列有关化学用语表达不正确的是()A .氮气的电子式:∶N∶∶∶N∶B .次氯酸分子的结构式:H-O-ClC .Na 的原子结构示意图:D .钙离子的电子式:Ca 2+4、设N A 表示阿伏加德罗常数的数值,下列叙述中正确的是( )A .同温同压下,28g 的CO 与N 2组成的混合气体中含有原子数一定为2N AB .0.1mol·L -1的稀硫酸中含有SO 42-个数为0.1N AC .56克铁在氯气中完全燃烧,共转移2N A 个电子D .Na 2O 2与水反应时,1 mol Na 2O 2转移2 mol 电子5、在下图点滴板上有四组溶液间反应的小实验,其对应的离子方程式书写不正确( )A. 向容量瓶中转 移溶液 C .碳酸氢钠受 热分解a 点滴板 cb d FeCl 3+KSCN(适量) NaHCO 3+NaOH(过量) Al 2O 3粉末+NaOH 溶液 FeSO 4+H 2O 2(硫酸酸化)A.a反应:Fe3++ 3SCN-=Fe(SCN)3 B.b反应:HCO3-+ OH-=CO32-+ H2OC.c反应:Al2O3+2OH-=2AlO2-+H2O D.d反应:Fe2++ 2H++ H2O2=Fe3++ 2H2O6、常温下,下列各组离子在指定条件下一定能大量共存的是A由水电离的c(H+)=10-12mol/L的澄清溶液中:K+、Na+、MnO4-、SO42-B.c(NH4+) =0.1 mol/L的溶液中:Na+、Cl-、OH-、SO42-C. c(H+)/ c(OH-)=1010的溶液中:NH4+. Ba2+、ClO-、Cl-D.加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42-7、向m克Mg和Al的混合物中加入足量的盐酸,充分反应后再向溶液中加入过量的NaOH溶液,过滤,将沉淀充分灼烧,得到的固体仍为m克,则原混合物中Al的质量百分数为()A、50%B、40%C、47%D、70%8、用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是()A、漂白粉被氧化B、有色布条被空气中的氧气氧化C、漂白粉跟空气中的CO2反应,生成较多 HClOD、漂白粉溶液蒸发掉部分水,其浓度增大9、下列有关物质分类的说法中正确的是( )A.石英玻璃、普通玻璃主要成分都属于硅酸盐 B.CH2Cl2、C2H6都是纯净物C.煤、石油都属于可再生能源 D.纯碱、烧碱都属于碱类物质10、硫与硒位于元素周期表中第ⅥA族,下列对硫与硒元素的有关叙述中,正确的是()A.硒化氢比硫化氢稳定B. 氯气能与水反应而硫不能与水反应,说明氯元素非金属性强于硫C. H2SeO4的酸性比H2SO4强D.硒的原子半径比硫的大11、一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3△ 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为()A.5∶3 B.5∶4 C.1∶1 D.3∶512、40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。
四川省成都市新津县五津中学高三化学模拟试卷含解析

四川省成都市新津县五津中学高三化学模拟试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是操作现象结论A 滴加BaC12溶液生成白色沉淀原溶液中有SO42-B 滴加氯水和CC14,振荡、静置下层溶液液显紫色原溶液中有I-C 用洁净铂丝蘸取溶液进行焰色反应火焰呈黄色原溶液中有Na+无K+D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝原溶液中无NH4+B略2. 设N A表示阿伏加德罗常数的值,下列叙述正确的是()A. 标准状况下,4.48 L CH3Cl中所含原子数目为N AB. 所含共价键数均为0.4N A的白磷(P4)和甲烷的物质的量相等C. 将2 g H2与足量的N2混合,充分反应后转移的电子数为2N AD. 电解精炼铜,当电路中通过的电子数为0.1N A时,阳极质量减少3.2 g参考答案:AA.标况下,4.48 L CH3Cl的物质的量为0.2mol,所含原子为0.2mol×5=1mol,故A正确;B.白磷分子中含有6个P-P键,甲烷分子中含有4个C-H键,0.1mol甲烷中所含的共价键数均为0.4N A,而0.1mol的白磷(P4)共价键数0.6N A,故B错误;C. H2和N2反应是可逆反应,反应后转移的电子数小于2N A,故C错误;D、电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属,如铁等,故当电路中通过0.1N A个电子时,阳极上减轻的质量不等于3.2g,故D错误;故选A。
点睛:本题考查了阿伏伽德罗常数的计算和判断。
本题的易错点为BD,B中要注意白磷分子是正四面体结构,和她6个P-P键,D中电解精炼铜时,阳极上放电的金属有铜和比铜活泼的金属。
3. 下列各图像中,不正确的是参考答案:A4. 下列反应的离子方程式错误的是A.硫酸镁溶液和氢氧化钡溶液反应: SO42-+Ba2+ == BaSO4↓B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2+ + 2OH– + NH4+ + HCO3– == BaCO3↓+ NH3·H2O + H2OC.氢氧化铝与足量的氢氧化钠溶液反应:Al( OH )3 + OH– == AlO2– + 2H2OD.向苯酚钠溶液中能入CO2:C6H5-O―+CO2+H2O →C6H5-OH+HCO3―参考答案:A略5. 有一不饱和的NaOH溶液,加入a molNa2O、b molNa2O2或c mol NaOH恰好得到NaOH饱和溶液(同一温度下),则a、b、c的关系为A.a=b=c/2 B.a=b>c/2 C.a=b<c/2 D.a>b>c参考答案:C6. 有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:第一组He -268.8 (a) -249.5 Ar -185.8 Kr -151.7第二组F2 -187.0 Cl2 -33.6 (b) 58.7 I2 184.0第三组(c) 19.4 HCl -84.0 HBr -67.0 HI -35.3第四组H2O 100.0 H2S -60.2 (d) -42.0 H2Te -1.8 下列各项中正确的是()A.a、b、c的化学式分别为Ne2、Br2、HFB.第二组物质只表现氧化性,不表现还原性C.第三组物质中C的沸点最高,是因为C分子内存在氢键D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te参考答案:D略0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为()A.0.16mol B.0.22mol C.0.30mol D.0.48mol参考答案:A略8.参考答案:答案:A 9. (08山东历城质检)根据组成特点和所具有的性质,通常把无机物分为单质、氧化物、酸、碱、盐。
四川省新津中学高二化学下学期入学考试试题(无答案)

四川省新津中学2015级高二入学考试化学试题可能用到的相对原子质量:H 1 O 16 S 32 Na 23 Mg 24 Cu 64第Ⅰ卷(选择题 共42分)每小题只有一个选项符合题意。
每小题2分。
一、选择题(本题共21个小题,每小题只有一个选项符合题意,每小题2分,共42分) 1.物质应用与其性质密切相关。
下列说法错误的是( ) A .硅胶可防止食物受潮是由于其具有吸水性 B .葡萄糖用于医疗输液是因为它属于强电解质 C .Na 2CO 3可用作食用碱,因为Na 2CO 3的水溶显碱性 D .酸性重铬酸钾用于检查酒驾是利用其强氧化性 2.下列事实中,不能用勒夏特列原理解释的是( ) A .新制氯水中加CaCO 3后,溶液漂白性增强 B .反应:H 2(g)+I 2(g)2HI(g) 达平衡后,增大压强,气体颜色变深C .盛有NO 2、N 2O 4混合气体的烧瓶置于冰水中,气体颜色变浅D .纯碱溶液在加热时,去除油污的效果更好3. 常温下,将0.1L0.1mol/LNa 2S 2O 3溶液与一定量的pH=2的硫酸溶液混合,放出VL 气体。
N A 代表阿伏加德罗常数的值,下列说法正确的是( ) A .pH=2的硫酸溶液含有H +数目为0.01N A B .该反应释放SO 2分子数目为22.4VN A C .反应中每摩尔Na 2S 2O 3转移的电子数目为4 N AD .若98gH 2SO 4溶于水完全电离,其断裂的共价键数目为2 N A4.为探究锌与稀硫酸的反应速率(以v (H 2)表示),向反应混合液中加入某些物质,下列判断正确的是( )A .加入NH 4HSO 4固体,v (H 2)不变B .加入少量水,v (H 2)减小C .加入CH 3COONa 固体,v (H 2)增大D .滴加少量CuSO 4溶液,v (H 2)减小5.反应NH 4HS(S ) NH 3(g)+H 2S(g)在某一温度下达到平衡,下列各种情况中,能使平衡发生移动的是( )A. 减少部分NH 4HS 固体B. 压强温度不变充入少量ArC. 容积、温度一定、充入HeD. 增加部分NH4HS固体6.在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图像的说法正确的是A.依据图a可判断正反应为吸热反应B.在图b中,虚线可表示压强增大C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>07.下列说法正确的是()A.pH=6.8的溶液一定显酸性B.相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③C.电离平衡常数(K)只与弱电解质本身有关,与其它外部因素无关D. 0.1mol·L-1的硫化钠溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-)8. 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是A.pH=4的醋酸中:c(H+)= 4.0mol·L-1B.饱和小苏打溶液中:c(Na+)= c(HCO3-)C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-2 mol·L-19. 对Ca(OH)2(K sp=5.5×10-6)、Mg(OH)2(K sp=1.2×10-11)、AgCl(K sp=1.56×10-10)三种物质,下列说法正确的是()A.Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小C.AgCl的溶解度最小D.同一温度下K sp越大的溶解度也越大10.下列说法正确的是()A.热化学方程式中,化学式前面的化学计量数只能表示反应的物质的量B.1 moL H2生成1 mol H2O时放出的热量就是氢气的燃烧热的值C.用1 mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值D.条件相同,用16 g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同11.下列说法不正确的是()A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3C .稀氨水中部分粒子的浓度大小关系:c(NH 3·H 2O)>c(OH -)>c(NH 4+)>c(H +) D .1mol/LNaX 和1mol/LNaY 两种盐溶液中c(X -)=c(Y -)+c(HY),则HX 为强酸12.常温下,下列各组离子在相应的条件下可能大量共存的是( )A .能使pH 试纸变红的溶液中:CO 32-、K +、Cl -、Na +B .L mol H c Kw /10)(10-+=的溶液中:Na +、HCO 3-、Cl -、K +C .在c(OH -)/c(H+)=1×1012的溶液中:NH 4+、Fe 2+、Cl -、NO 3-D .由水电离产生的c(OH -)=1×10-12mol/L 的溶液中:NO 3-、Mg 2+、Na +、SO 42-13.室温条件下,现有四种溶液:①pH=2的CH 3COOH 溶液;②pH=2的HCl 溶液;③pH=12的氨水;④pH=12的NaOH 溶液。
2023-2024学年四川省成都市树德中学高三下学期开学考试理科综合试题-高中化学
2023-2024学年四川省成都市树德中学高三下学期开学考试理科综合试题-高中化学1.化学推动着社会的进步和科技的创新。
下列说法错误的是A.《吕氏春秋别类》中“金(即铜)柔锡柔,合两柔则钢”,体现合金硬度的特性B.汽车排气管上装有“催化转化器”,使有毒的和反应生成和,但不利于酸雨的防治C.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料D.北京冬奥会手持火炬“飞扬”在出口处喷涂含碱金属的焰色剂,实现了火焰的可视性2.下列指定反应的离子方程式书写正确的是A.过量与“84”消毒液反应:B.用惰性电极电解溶液:C.溶液中加足量溶液:D.与反应:3.点击化学是一种快速合成大量化合物的新方法,给传统有机合成化学带来重大革新。
下图是科学家研究点击化学的一种代表反应:下列说法正确的是A.化合物a苯环上的二取氯代物有6种B.上述反应属于取代反应C.化合物b分子中共线的原子最多有4个D.化合物c分子式为C 15 H 12 N 34.根据下列实验事实能得出相应结论的是常温下,分别向等体积的盐酸和硫酸中加入大小相同的铝片,前者反应速率更快常温下,分别向浓度均为的和溶液中通入气体至饱和,仅后者生成沉淀溶度积常数:在和时,测得溶液的分别是9.66和9.37 水解常数:B C.C D.D5. X、Y、Z、M、Q为原子序数依次增大的短周期主族元素,其最外层电子数之和为19.Z的原子序数是X与Y的原子序数之和,M与X同主族,X与Q可形成原子个数比为2:1的18e-分子。
下列说法正确的是A.X与Z形成的10电子微粒只有2种B.简单离子半径:Q> M>Z>YC.由X、Y、Z三种元素形成的化合物的水溶液均显酸性D.含Z、M、Q三种元素的化合物超过3种6.浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池。
理论上当电解质溶液的浓度相等时停止放电。
图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。
四川省新津中学高三文综下学期入学考试试题
新津中学高2014级高三下期文综入学测试题第I卷(选择题共140分)本卷共35小题。
每小题4分,共140分。
在每个小题给出的四个选项中,只有一项是符合题目要求的。
2016年11月20日,中央气象台发布暴雪蓝色预警,预计20日20时至21日20时,北京等地部分地区有大雪,局部地区有暴雪。
21日凌晨,初雪如期而至,但暴雪失约。
为此,气象台官方微博道歉,因半路上气温过于热情,把“白茫茫”变成了“湿漉漉”,并发布温馨提醒,称雪是好雪但“风不正经”。
表1是北京2016年11月空气质量指数(AQI)趋势(其数值越大说明空气污染状况越严重)。
据此完成下列问题。
1.此次影响北京地区初雪如期而至的天气系统是A、气旋B、反气旋C、暖锋D、冷锋2.影响暴雪失约的主要因素是A、冷高压的强度B、锋移动的速度C、暖气团的湿度D、冷气团的温度3.这次降雪对北京空气质量的影响及原因是A、改善盛行偏北风,利于污染物扩散B、改善大气垂直上升,利于污染物扩散C、恶化取暖燃煤增多,大气污染物增多D、恶化大气垂直下沉,污染物沉降低空“光伏农业”就是将太阳能广泛应用到现代农业种植、养殖、灌溉、病虫害防治以及农业机械动力提供等领域的一种新型农业。
新疆地区利用生态光伏农业的现代化设施(如图1所示)取得了“南果北种”显著成效,使热带植物在西北边陲产生更多的经济效益。
据此完成下列问题。
4.“光伏农业”成功实施,主要依赖于全球气候变暖A、全球气候变暖B、现代农业科技的进步C、国家政策的支持D、市场需求的不断扩大5.新疆光伏农业能够规模发展的有利条件①热量丰富②光照充足③昼夜温差大④地广人稀A、①②B、①③C、②④D、③④6.我国西北地区“光伏农业”投入规模化生产后将对农业带来的影响有①增加生产成本②改变生产方式③促进农业转型④农产品过剩A、①③B、②③C、②④D、①④当今世界,一场新的制造业竞争已经拉开序幕:美国力促高端制造业回归、德国倾力打造“工业4.0”(指以智能制造为主导的第四次工业革命,或革命性的生产方法,它将制造业向智能化转型)。
四川省成都市新津中学高二(下)入学化学试卷
四川省成都市新津中学高二(下)入学化学试卷一、单选题(本大题共20小题,共40.0分)1.物质应用与其性质密切相关,下列说法错误的是()A. 硅胶可防止食物受潮是由于其具有吸水性B. 葡萄糖用于医疗输液是因为它属于强电解质C. 可用作食用碱,因为的水溶液显碱性D. 酸性重铬酸钾用于检查酒驾是利用其强氧化性2.下列事实中,不能用勒夏特列原理解释的是()A. 新制氯水中加后,溶液漂白性增强B. 反应:达平衡后,增大压强,气体颜色变深C. 盛有、混合气体的烧瓶置于冰水中,气体颜色变浅D. 纯碱溶液在加热时,去除油污的效果更好3.常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体。
N A代表阿伏加德罗常数的值,下列说法正确的是()A. 的硫酸溶液含有数目为B. 该反应释放分子数目为C. 反应中每摩尔转移的电子数目为D. 若溶于水完全电离,其断裂的共价键数目为4.反应NH4HS(S)NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使平衡发生移动的是()A. 减少部分固体B. 压强温度不变充入少量ArC. 容积、温度一定、充入HeD. 增加部分固体5.在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图象的说法正确的是()A. 依据图a可判断正反应为吸热反应B. 在图b中,虚线可表示压强增大C. 若正反应的,图c可表示升高温度使平衡向逆反应方向移动D. 由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的6.下列说法正确的是()A. 的溶液一定显酸性B. 相同物质的量浓度的下列溶液中: 、 、 ,则由大到小的顺序是:C. 电离平衡常数只与弱电解质本身有关,与其它外部因素无关D. 的硫化钠溶液中:7.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是()A. 的醋酸中:B. 饱和小苏打溶液中:C. 饱和食盐水中:D. 的纯碱溶液中:8.对Ca(OH)2(K sp=5.5×10-6)、Mg(OH)2(K sp=1.2×10-11)、AgCl(K sp=1.56×10-10)三种物质,下列说法正确的是()A. 的溶解度最小B. 的溶解度最小C. AgCl的溶解度最小D. 同一温度下越大的溶解度也越大9.下列说法正确的是()A. 热化学方程式中,化学式前面的化学计量数只能表示物质的量B. 1 moL 生成1 mol 时放出的热量就是氢气的燃烧热的值C. 用的硫酸和适量的稀的溶液反应可以测量中和热的值D. 条件相同,用16g固体硫或32 g固体硫分别在中充分燃烧,测定的硫的燃烧热不同10.下列说法不正确的是()A. 的HA溶液与的MOH溶液任意比混合:B. 中和相同体积、相同物质的量浓度的 硫酸, 盐酸和 醋酸所需相同浓度的NaOH溶液的体积关系:C. 稀氨水中部分粒子的浓度大小关系:D. 和两种盐溶液中,则HX为强酸11.常温下,下列各组离子在相应的条件下可能大量共存的是()A. 能使pH试纸变红的溶液中:、、、B. 的溶液中:、、、C. 在的溶液中:、、、D. 由水电离产生的的溶液中:、、、12.室温条件下,现有四种溶液: pH=2的CH3COOH溶液; pH=2的HCl溶液;pH=12的氨水;④pH=12的NaOH溶液.下列有关说法正确的是()A. 由水电离出的: ④B. 将 、 溶液混合后,,消耗溶液的体积:C. 等体积的 、 、④溶液分别与足量铝粉反应, 生成的的物质的量最大D. 向溶液中加入100mL水后,溶液的pH: ④13.室温下 10mL0.1mol/L 的醋酸溶液加水稀释后,下列说法正确的是()A. 溶液中导电粒子的数目减少B. 溶液中不变C. 醋酸的电离程度增大,也增大D. 再加入的 NaOH 溶液,混合液的14.常温下,下列溶液中的微粒浓度关系正确的是()A. 新制氯水中加入固体NaOH:B. 的溶液:C. 的氨水与的盐酸等体积混合:D. 溶液与 NaOH溶液等体积混合:15.下列离子方程式正确的是()A. 氢氧化铁溶于氢碘酸中:B. 向溶液中通入过量:C. 向溶液中滴加等体积的溶液:D. 向碘化亚铁溶液中滴加溴的四氯化碳溶液16.化学上常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时,沉淀就达完全.已知:常温下K sp[M(OH)2]=1×10-21.则溶液中M2+沉淀完全时的pH为()A. 7B. 6C. 5D. 417.有关 100ml 0.1mol/L NaHCO3、 100ml 0.1mol/LNa2CO3两种溶液的叙述不正确的是()A. 溶液中水电离出的个数:B. 溶液中阴离子的物质的量浓度之和:C. 溶液中:D. 溶液中:18.某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则()A. M点所示溶液导电能力强于Q点B. N点所示溶液中C. M点和N点所示溶液中水的电离程度相同D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积19.在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是()前10 min内的平均反应速率B. 保持其它条件不变,升高温度,反应达平衡时C. 若起始时只充入 mol ,反应达平衡时的转化率为D. 若起始时充入 mol 、 mol 和 mol ,达到平衡前正逆20.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是()A. 实验 反应后的溶液中:B. 实验 反应后的溶液中:C. 实验 反应后的溶液中:D. 实验 反应后的溶液中:二、双选题(本大题共1小题,共2.0分)21.为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是()A. 加入固体,增大B. 加入少量水,不变C. 加入固体,减小D. 滴加少量溶液,减小三、简答题(本大题共5小题,共58.0分)22.X、Y、Z、R、W为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q 的水溶液中加入少量WY2,立即产生大量气泡.请回答下列问题:(1)X的氢化物与R的氢化物相遇,生成物中存在的化学键类型有______ .W 在元素周期表中的位置为______ .(2)XY3-离子的立体构型是______ ;ZY42-中的一个Y原子被Z替换后形成Z2Y32-,则Z2Y32-离子中心原子的杂化轨道类型为______ 杂化.Z2Y32-在稀硫酸中的反应为______ .(3)已知:氢气、Z的固态单质、气态J的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562,.0 kJ/mol,则气态J分解生成固态Z和氢气的热化学方程式为:______ .(4)在酸性溶液中,WY4-能被Q还原为W2+,该反应的离子方程式是______ .(5)第二周期中第一电离能介于Be与x元素之间的元素分别是______ ,与w同周期的最外层仅有一个未成对电子的原子分别是______ ,其中价电子数目最多的原子其电子排布图为______ .23.现有常温下的下列五种溶液:[已知:K a(CH3COOH)=K b(NH3•H2O)].pH=2的CH3COOH溶液;pH=2的HCl溶液;0.01mol•L-1的氨水;④0.01mol•L-1的NaOH溶液;⑤0.01mol•L-1 CH3COOH溶液与0.01mol•L-1的氨水等体积混合后所得溶液.(1)将溶液稀释相同倍数后,溶液pH:______ (填“>”、“<”或“=”).(2)若将 、 混合后所得溶液pH=7,则消耗溶液的体积:______ (填“>”、“<”或“=”).(3)上述五种溶液中,水的电离程度最大的是______ (填序号),该溶液中各离子浓度由大到小的顺序是______ .(4)取 、 溶液各10mL分别加入质量不等的Zn粒,反应完全后产生等量H2,则:______ (填序号)溶液中所放入Zn的质量较大.(5)若改变温度后,测得④溶液pH=10.在该温度下,将 、④混合后,测得溶液pH=7,则所得溶液中c(Na+)-c(CH3COO-)= ______ mol•L-1(填精确值).24.能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.(1)有机物M经过太阳光光照可转化为N,转化过程如下:则M、N相比,较稳定的是______.(2)CO可用于合成燃料甲醇.在有催化剂存在的10L恒容密闭容器中充入2mol CO 和4mol H2,发生如下反应:CO(g)+2H2(g)CH3OH(g).测得CO的平衡转化率与温度、压强的关系如图所示:判断上述反应达到平衡状态的依据是______(填字母编号).A.CH3OH的生成速率与CO的消耗速率相等B.CH3OH、CO、H2的浓度都不再发生变化C.混合气体的密度不变D.混合气体的相对平均分子质量不变下列措施中,能使上述平衡体系中的值增大的是______(填字母编号).A.降低温度 B.充入He(g),使体系压强增大 C.再充入1mol CO和2mol H2 100℃时反应在5min末达到平衡,则从反应开始至达平衡,v(H2)=______ mol/(L•min);该温度下反应的平衡常数K=______.25.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1mol•L-1的盐酸进行滴定,完成下列问题:(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)______ ,用酚酞作指示剂时,滴定到溶液颜色由______ 色刚好变成______ 色为止;(4)某同学根据三次实验分别记录有关数据如下表:请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)= ______ 。
四川省新津中学高二化学下学期入学考试试题(无答案)(2021年整理)
四川省新津中学2016-2017学年高二化学下学期入学考试试题(无答案)四川省新津中学2016-2017学年高二化学下学期入学考试试题(无答案)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(四川省新津中学2016-2017学年高二化学下学期入学考试试题(无答案))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为四川省新津中学2016-2017学年高二化学下学期入学考试试题(无答案)的全部内容。
- 1 -四川省新津中学2015级高二入学考试化学试题可能用到的相对原子质量:H 1 O 16 S 32 Na 23 Mg 24 Cu 64第Ⅰ卷(选择题共42分)每小题只有一个选项符合题意。
每小题2分。
一、选择题(本题共21个小题,每小题只有一个选项符合题意,每小题2分,共42分)1.物质应用与其性质密切相关.下列说法错误的是( )A.硅胶可防止食物受潮是由于其具有吸水性B.葡萄糖用于医疗输液是因为它属于强电解质C.Na2CO3可用作食用碱,因为Na2CO3的水溶显碱性D.酸性重铬酸钾用于检查酒驾是利用其强氧化性2.下列事实中,不能用勒夏特列原理解释的是()A.新制氯水中加CaCO3后,溶液漂白性增强B.反应:H2(g)+I2(g )2HI(g)达平衡后,增大压强,气体颜色变深C.盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅D.纯碱溶液在加热时,去除油污的效果更好- 2 -- 3 -3. 常温下,将0.1L0.1mol/LNa 2S 2O 3溶液与一定量的pH=2的硫酸溶液混合,放出VL 气体。
N A 代表阿伏加德罗常数的值,下列说法正确的是( ) A .pH=2的硫酸溶液含有H +数目为0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
- 1 - / 9 四川省新津中学2018届高三理综(化学部分)下学期开学考试试题 7.化学与社会、生活密切相关。对下列现象或事实解释错误的是 选项 现象或事实 解释 A 纳米铁粉可将水体中NO3-转化为N2 纳米铁粉具有还原性 B 氯气泄漏,用蘸有肥皂水的毛巾捂住口鼻 肥皂水显碱性 C 利用SiO2和焦炭混合物在高温下制粗硅 碳元素的非金属性比硅强 D “钡餐”作为造影剂检查肠胃疾病 BaSO4难溶于水和盐酸 8.阿伏加德罗常数值为NA,下列说法中正确的是 A.一定条件下3.2gSO2与足量O2反应转移电子数为0.1NA B.2.9g异丁烷和正丁烷混合物含有C-H键数目为0.5NA C.50mL12 mol/L浓盐酸与足量MnO2共热转移电子数0.3NA D.标准状况下,3.36L三氯甲烷中含有氯原子0.45NA
9.某液态烃的球棍模型为:,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是 A.R能使溴的四氯化碳溶液褪色 B.R一定是2,2-二甲基丁烷 C.R不溶于水且密度比水大 D.R的一氯代物可能有2种 10.某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是 ① 氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去 ②装置I中充满黄绿色气体后,再加热盛有Al铝粉的硬质玻璃管 ③装置II是收集装置,用于收集氯化铝 ④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同 ⑤a处使用较粗的导气管实验时更安全 A. ①②B. ②③⑤ C. ①④ D. ③④⑤ 1l.短周期主族元素W、X、Y、Z的原子序数依次增大,W的某些氧化物是引起酸雨的主要物质,X氢化物的水溶液能与石英反应生成气体,Y单质在空气中燃烧发出耀眼白光,军事上常- 2 - / 9
用于制造照明弹,Z的K层和L层电子数之和是M层电子数的2倍。下列说法中正确的是 A.最高价氧化物的水化物的酸性:WB.氢化物的沸点:X>Y C.氢元素、W元素、X元素可形成离子化合物 D.简单离子半径:Y>X 12.利用废铅蓄电池填料(主要成分为PbO2、PbO、PbSO4等)作阴极,采取固相直接电解法可提取金属Pb,其装置如图所示(已知:PbSO4+3OH-=HPbO2-+S042-+H2O)。下列说法中错误的是 A.b与外接电源的负极相连 B.PbO2放电时电极反应式为:PbO2+4e-+2H2O=Pb+4OH- C.电解过程中左室水的电离程度减弱(忽略溶液温度变化) D.与传统无膜电解法相比,该电解方法可提高铅元素利用率
l3.已知H2R为二元弱酸,25℃用Na2R溶液吸收H2R,吸收液的pH与C(HR-)/C(R2-)的关系如下图所示: 下列说法中正确的是 A.NaHR溶液中:c(Na+)- 3 - / 9
B.25℃Ka1(H2R)的值为10-7.2 C.Na2R溶液中:c(Na+>c(R2-)>c(HR-)>c(OH-) D.当吸收液呈中性时:c(R2- )>c(HR-)
26.(15分)Na2S2O3·5H2O常用作冲洗照相底片的定影剂,实验室以Na2S、Na2CO3、SO2为原料,利用下图装置可制取少量Na2S2O3·5H2O,其实验原理为Na2CO3+SO2=Na2S2O3+CO2;2Na2S+3SO2==2Na2SO3+3S;Na2SO3+S=Na2S2O3。回答下列问题: (1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,锥形瓶中的现象是: ①导管口有气泡冒出;②__________________。 (2)通过注射器取样,监控锥形瓶中溶液pH=7~8,锥形瓶中酸性不能过强的原因是_______。当锥形瓶中溶液的pH接近7时,应进行的操作是__________________________。 (3)反应结束后将锥形瓶中混合液经如下处理可得Na2S2O3·5H2O粗晶体:
①趁热过滤的目的是______________________。 ②粗晶体中含有Na2CO3、Na2SO3、Na2SO4等杂质,利用下列提供的试剂,检验粗产品中含有Na2CO3。 可选试剂: a.品红溶液 b.酸性高锰酸钾溶液 c.澄清石灰水 d.NaOH溶液 e.稀硫酸 实验方案:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、_____(填试剂序号)、澄清石灰水,若______(填现象),则证明产品中含- 4 - / 9
有Na2CO3。 (4)粗晶体中Na2S2O3·5H2O质量分数的测定:称取2.500g粗晶体溶于水,配成100mL溶液,取25.00mL溶液于锥形瓶中,用0.4000 mol/L的酸性高锰酸钾标准溶液滴定,消耗标准溶液的体积为10.00mL,Na2S2O3·5H2O的质量分数为______ (忽略杂质对滴定的影响;S2O32-被酸性高锰酸钾溶液氧化为SO42-)。 27.(14分)用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
回答下列问题: (1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示: 成分 Ni2+ Fe2+ Cu2+ Ca2+ Mg2+ Mn2+ H+ SO42- 浓度(mol/L) c 0.013 0.0007 0.0013 0.0030 0.004 0.01 1.8
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。 (2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。 (3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。 (4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母) a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3 (5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。 ①试写出萃取时反应的离子方程式______________。 ②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。 - 5 - / 9
③“操作X”的名称是________________。 28.(14分)乙苯()是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷: 乙苯脱氢制苯乙烯:
△H1=akJ/mol 乙苯氯化制β-氯苯乙烷:
△H2=bkJ/mol 回答下列问题: (1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。 化学键 C-H C-C H-H C=C 键能/kJ/mol 412 348 436 612
(2)已知 +HCl(g) △H=-54kJ/mol H2 (g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。 (3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示: 时间/min 0 10 20 30 40 压强/×100 kPa 1.0 1.2 1.3 1.4 1.4 平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。 (4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示: ①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变- 6 - / 9
大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。 ②b 点气体总体积______(填“<”“>”或“=”)c 点气体总体积。 ③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。 35.[化学:选修3——物质结构与性质](15 分) 磷元素是组成遗传物质核酸的基本成分之一,而锡元素(Sn)形成的某些化合物能够促进核酸的合成。回答下列问题。 (1)基态磷原子电子占据的最高能层符号是____,占据该能层的电子中能量最高的电子其电子云在空间有_____个伸展方向,原子轨道呈_____形。 (2)锡元素可形成白锡、灰锡、脆锡三种单质。研究灰锡晶体的结构最常用的仪器是_____。灰锡晶体与金刚石结构相同,但灰锡不稳定,其原因是_____。 (3)固态PCl5结构中存在PCl4+和PCl6-两种结构单元,其晶胞如右图所示。
①PCl4+的空间结构为________,PCl3的键角小于PCl4+键角的原因为___________。 ②已知晶胞的边长为anm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______g.cm-3。 36.[化学:选修5——有机化学基础](15 分) 6-硝基胡椒基酸K是合成心血管类药物米络沙星的中间体,在实验室中合成路线如下图所示(部分反应条件已经略去):
