2018年高考化学一轮复习课件 第7章 第2节 化学平衡状态和平衡移动
【高考】化学一轮复习化学平衡状态化学平衡的移动优秀PPTppt课件

原平衡体系―充―入―惰―性―气―体→体系总压强增大―→体系中各组 分的浓度不变―→平衡不移动。
②恒温、恒压条件:
原平衡体系――充―入―惰―性―气―体―→ 容器容积增大,各反 ―→ 应气体的分压减小
(3)同等程度地改变反应混合物中各物质的浓度时,应视为压 强的影响。
典例剖析
1.对可逆反应 2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下
2HI(g)达到化学平衡状态的 ()
该反应是一个反应前后气体总体积不变的反应,无论是否达到平衡,只要温 度不变,其混合气体的压强就不会改变,A 错误;C 项没有给出表示的化学 反应速率是正反应速率还是逆反应速率,不能确定是否达到平衡,C 错误; 浓度具体比值还与投入起始量有关,不能作为平衡建立的标志,D 错误;由 于三种气体中只有 I2 是有颜色的,颜色不变说明 I2 的质量分数不变,已达到 了平衡,B 正确。
④在单位时间内生成n mol B,同时消耗q mol D,二者变化均表示v(逆)
不一定
典例剖析
1.一定温度下,可逆反应 H2(g)+I2(g) 标志是 A.混合气体的压强不再变化 B.混合气体的颜色不再变化 C.反应速率 v(H2)=12v(HI) D.c(H2)∶c(I2)∶c(HI)=1∶1∶2
②各物质的质量或各物质的质量分 数一定
③各气体的体积或体积分数一定
平衡状态 平衡
平衡 平衡
类型
判断依据
平衡状态
①在单位时间内消耗了m mol A,同时生
平衡
成m mol A,即v(正)=v(逆) 37、让我们享受人生的滋味吧,如果我们感受得越多,我们就会生活得越长久。——法朗士
10.伟大的人物都走过了荒沙大漠,才登上光荣的高峰。
高考理综高三一轮高考化学复习第7章第2讲化学平衡状态.docx

第 2 讲化学平衡状态[ 考纲要求 ] 1. 了解可逆反应的定义。
2. 理解化学平衡的定义。
3. 理解影响化学平衡的因素。
考点一可逆反应与化学平衡状态1.可逆反应(1)定义在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点①二同: a. 相同条件下; b. 正逆反应同时进行。
②一小:反应物与生成物同时存在;任一组分的转化率都小于( 填“大于”或“小于” )100%。
(3)表示2.化学平衡状态(1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。
(2)化学平衡的建立(3)平衡特点深度思考电解1.反应 2H2O2H2↑+ O2↑是否为可逆反应?点燃答案不是可逆反应,因为两个方向的反应条件不同。
2.向含有 2 mol 的 SO的容器中通入过量氧气发生2SO+ O催化剂SO的物质2SO,充分反应后生成22加热33的量 ______2 mol(填“ <”、“ >”或“=”,下同),SO2的物质的量______0 mol ,转化率________100%。
答案<><题组一极端假设法解化学平衡状态题的应用1.一定条件下,对于可逆反应X(g) +3Y(g)X、 Y、 Z 的起始浓度分别为c1、c2、 c3( 均不为零 ) ,达到平衡时, X、 Y、Z 的浓度分别为0.1 mol ·L-1、 0.3- 1- 1mol·L、0.08 mol ·L,则下列判断正确的是() A. c ∶c=3∶112B.平衡时, Y 和 Z 的生成速率之比为2∶3C. X、 Y 的转化率不相等D. c1的取值范围为0 mol ·L-1<c1<0.14 mol ·L-1答案D解析平衡浓度之比为 1∶3,转化浓度亦为 1∶3,故 c1∶c2=1∶3, A、C 不正确;平衡时 Y 生成表示逆反应, Z 生成表示正反应且 v Y( 生成 ) ∶v Z( 生成 ) 应为 3∶2, B 不正确;由可逆反应的特点可知 0<c1<0.14 mol ·L-1。
高2021届高2018级高三化学一轮复习专项训练学案课件第七章课时2化学平衡状态化学平衡移动

2.下列说法中,可以证明反应 N2+3H2 2NH3 已达平衡状
态的是ห้องสมุดไป่ตู้
()
A.一个 N≡N 键断裂的同时,有三个 H—H 键形成
B.一个 N≡N 键断裂的同时,有三个 H—H 键断裂
C.一个 N≡N 键断裂的同时,有六个 N—H 键断裂
D.一个 N≡N 键断裂的同时,有六个 N—H 键形成
ΔH = - 196.6
kJ·mol-1 知,2 mol SO2 与 1 mol O2 在恒压密闭容器中充
分反应,可放出 196.6 kJ 的热量
( ×)
(6)对反应 NO2(g)+SO2(g) SO3(g)+NO(g),当每消耗 1
mol SO3 的同时生成 1 mol NO2 时,说明反应达到平衡状态 ( ×)
在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡
状态的标志
(× )
(4) 在 2 L 密 闭 容 器 内 , 800 ℃ 时 反 应 2NO(g) +
O2(g) 2NO2(g)体系中,当该容器内颜色保持不变时能说
明该反应已达到平衡状态
( √)
(5) 由 2SO2(g) + O2(g) 2SO3(g)
平衡状态的是
()
①单位时间内生成 n mol H2 的同时生成 n mol HI ②一个 H—H 键断裂的同时有两个 H—I 键断裂
③百分含量 w(HI)=w(I2) ④反应速率 v(H2)=v(I2)=12v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内的压强不再变化
⑧条件一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体颜色不再变化
高考化学一轮总复习第七章第24讲化学平衡状态化学平衡的移动课件

2.化学平衡状态 (1)概念 一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反 应的物质的 浓度 保持不变的状态。
(2)化学平衡的建立 从 正 反应开始建立 从 逆 反应开始建立
(3)平衡特点
■多维思考·查漏补缺 一、思维诊断——易错易混辨析
电解 (1)2H2O 点燃 2H2↑+O2↑为可逆反应( ) (2)二次电池的充、放电为可逆反应( ) (3)对反应 A(g)+B(g) C(g)+D(g),压强不随时间而变,说明反应已达平衡状态 () (4)对于 NO2(g)+SO2(g) SO3(g)+NO(g)反应,当每消耗 1 mol SO3 的同时生成 1 mol NO2 时,说明反应达到平衡状态( )
气体密度不再变化,说明容器体积不再变化,即气体的物质的量不再变化,反应
达到平衡状态,①符合题意;无论是否平衡,反应的 ΔH 都不变,②不符合题意;
反应开始时,加入 1 mol N2O4,随着反应的进行,N2O4 的浓度逐渐变小,故 v 正
(N2O4)逐渐变小,直至达到平衡,③不符合题意;N2O4 的转化率不再变化,说明
2.化学平衡向正反应方向移动,反应物的转化率一定增大吗?(举例说明) ________________________________________________________________________ ________________________________________________________________________。
AN. 2O①4 的②浓度不再变化,B反.应②达④到平衡状态,④符合题意,故选 D。
C.③④
D.①④
3.在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强, ②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量, ⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种 气体的百分含量 (1)能说明 2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是________________。 (2)能说明 I2(g)+H2(g) 2HI(g)达到平衡状态的是________________。 (3)能说明 2NO2(g) N2O4(g)达到平衡状态的是________________。 (4)能说明 C(s)+CO2(g) 2CO(g)达到平衡状态的是________________。
【高考】化学一轮复习化学平衡及平衡移动ppt课件

cp (C)cq (D) cm ( A)cn (B)
Q > k,未达平衡,反应逆向进行。
Q = k,反应达平衡。 Q < k,未达平衡,反应正向进行。
(3) 判断反应的热效应。 (4) 平衡常数的计算(平衡计算)
练习1.在一个不传热的固定容积的密闭容器中可逆反应 mA(g)+nB(g) pC(g)+qQ(g) 当m、n、p、q为任意整 数时,达到平衡的标志是 ①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q ⑥单位时间内m mol A断键反应,同时pmol C也断键反应
4、 应用: (1) 利用K可以判断反应的热效应:
若升高温度, K 值增大,正反应是吸热反应; 若升高温度, K 值减小,正反应是放热反应。
(2) 借助K判断在某温度下,某时刻反应是否达平衡。若未达平 衡,反应进行的方向
浓度商Q:
对于可逆反应: mA(g)+nB (g)
pC(g)+qD(g)
Q
=
2NO2 (g)
N2O4 (g) △H<0
升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。
注:升高温度同时加快正逆反应速率,但吸热 反应的速率增加的更多,故升温使可逆反应向 吸热反应方向移动。即温度对吸热反应的速率 影响更大。
-
温度对化学平衡的影响:
速 率
时
间
关
A
B
系
图
D C
课堂练习
0
t1
t2
t3
V”正 = V”逆 平衡状态Ⅱ
t(s)
2018届高考化学大一轮复习教师用书:第7章 第2节 考点2 化学平衡的移动 含解析 精品
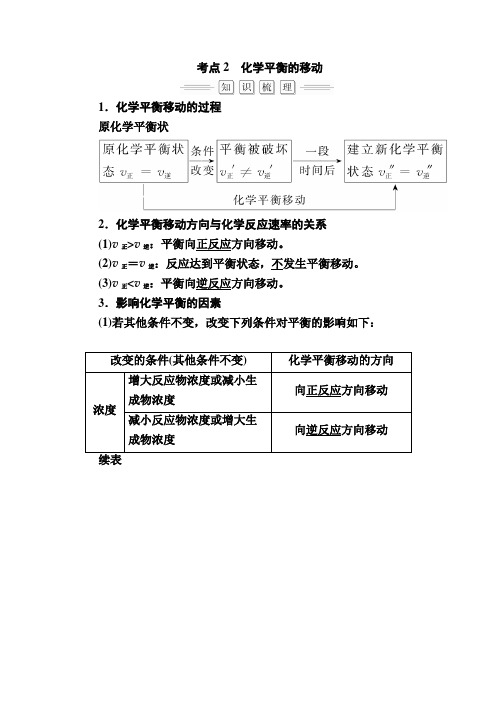
考点2 化学平衡的移动 1.化学平衡移动的过程 原化学平衡状
2.化学平衡移动方向与化学反应速率的关系 (1)v正>v逆:平衡向正反应方向移动。 (2)v正=v逆:反应达到平衡状态,不发生平衡移动。 (3)v正3.影响化学平衡的因素 (1)若其他条件不变,改变下列条件对平衡的影响如下:
改变的条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
续表 (2)勒夏特列原理 如果改变影响化学平衡的条件(浓度、压强、温度等)之一,平衡将向着减弱这种改变的方向移动。 易错警示 (1)固体或纯液体用量的改变,对平衡没有影响。 (2)当反应混合物中不存在气态物质时,压强的变化对平衡没有影响。
(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g)等,压强的变化对其平衡也无影响。但通过改变体积增大(或减小)压强,会使各物质浓度增大(或减小),混合气体的颜色变深(或浅)。 (4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于增大(减小)压强。
判断正误,正确的画“√”,错误的画“×”。 (1)增大反应物的量,化学反应速率加快,化学平衡正向移动。(×) (2)化学平衡发生移动,速率一定改变。速率改变,化学平衡一定发生移动。(×) (3)合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动。(×) (4)C(s)+CO2(g)2CO(g) ΔH>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大。(√) (5)二氧化氮与四氧化二氮的平衡体系,加压后颜色加深。(×) (6)对“H2(g)+I2(g)2HI(g)”无论恒温恒容,还是恒温恒压,充入稀有气体,平衡均不移动。(√) (7)CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下改变压强,平衡不发生移动,反应放出的热量不变。(√) (8)恒温恒容条件下,反应2NO2(g)N2O4(g)达到平衡后,再向容器中通入一定量的N2O4(g)重新达到平衡后,NO2的体积分数增大。(×)
高三化学人教版复习讲义第7章 第2节 化学平衡状态和平衡移动
第二节 化学平衡状态和平衡移动1.可逆反应[示例] 含有2 mol SO 2和2 mol O 2在一定条件下的密闭容器中发生2SO 2(g)+O 2(g)2SO 3(g),平衡时的O 2物质的量范围为1 mol<n (O 2)<2 mol 。
2.化学平衡状态 (1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态。
(2)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:以上过程可用如图表示:若开始加入生成物,从逆反应建立平衡,则v -t图为。
(3)特征[深度归纳]化学平衡状态的判定(1)一般标志(2)等价标志①全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间而变化。
②对同一物质而言,断裂的化学键的物质的量与形成的化学键的物质的量相等。
③对于有色物质参加或生成的可逆反应,体系的颜色不再随时间而变化。
④绝热体系的温度不变,说明反应处于平衡状态。
⑤全部是气体的非等体积反应,恒压条件下,若密度不再变化;对于有固体参与或生成的反应,恒容条件下,若密度不再变化。
[应用体验]正误判断(正确的打“√”,错误的打“×”)(1)Cl 2+H2O HCl+HClO,PCl3+Cl2PCl5均为可逆反应。
(2)在化学平衡的建立过程中,v正一定大于v逆。
()(3)对于反应A(g)+B(g) 2C(g)+D(g),当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志。
()(g)+O2(g) 2SO3(g)反应,(4)在相同温度下,相同容器(恒容)发生2SO当分别向容器中充入2 mol SO2、1 mol O2与2 mol SO3平衡时,c(SO2)相同。
()(g) N2O4(g)反应,当v正(NO2)=v逆(N2O4)时,反应达平衡(5)对于2NO状态。
()答案:(1)√(2)×(3)×(4)√(5)×⊙考法1极端转化法确定可逆反应某时刻的量1.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L -1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是()A.c1∶c2=3∶1B.平衡时,Y和Z的生成速率之比为2∶3C.X、Y的转化率不相等D.c1的取值范围为0<c1<0.14 mol·L-1D[平衡浓度之比为1∶3,转化浓度亦为1∶3,故c1∶c2=1∶3,A、C不正确;平衡时Y的生成表示的是逆反应速率,Z的生成表示的是正反应速率,且v Y(生成)∶v Z(生成)=3∶2,B不正确;由可逆反应的特点可知0<c1<0.14 mol·L -1,D正确。
高考化学一轮复习 第二节 化学平衡状态 化学平衡的移动习题讲解课件
0.18 mol mol×20%
×100%=90%。
ppt精选
15
(3)由图 1 可以看出,当 N2 与 H2 物质的量之比为 1∶3 时,NH3 的平衡体积分数最大,为 42%。设平衡时转化的 N2 的物质的量 为 x mol,由三段式:
n(起始)(mol):
N2 + 3H2
1
3
2NH3 0
n(转化)(mol):
11
命题点 2 1.解析:选项 A 可以用温度变化来解释化学平衡的移动;选
项 B 说明离子积随着温度的升高而增大,即温度升高,水 的电离平衡正向移动;选项 C 是催化剂对化学反应速率的 影响,与化学平衡无关;选项 D 中浓度与溶液 pH 的关系 说明浓度对 NH3·H2O 的电离平衡的影响。 答案:C
ppt精选
8
考点二 [教材知识层面] 2.(1)正 (3)逆 3.正 逆 减小 增大 不 吸热 放热 不 能 4.减弱这种改变
ppt精选
9
[高考考查层面] 命题点 1 1.解析:A 是固体,其量的变化对平衡无影响;而增大 B 的浓
度,正反应速率增大,平衡向正反应方向移动,v(正)>v(逆); 升高温度,v(正)、v(逆)均增大,但 v(逆)增大的程度大,平 衡向逆反应方向移动;此反应为反应前后气体分子数不变的 反应,故增大压强,平衡不移动,但 v(正)、v(逆)都增大; 催化剂不能使化学平衡发生移动,B 的转化率不变。 答案:B
ppt精选
12
2.解析:催化剂只能改变反应途径,不能影响平衡的移动,A 不符合题意;高压有利于合成氨反应的平衡右移,B 符合题 意;采用高温会使合成氨反应的平衡左移,但此温度下催化 剂的活性较高,C 不符合题意;循环操作与平衡移动没有直 接关系,D 不符合题意。 答案:B
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节化学平衡状态和平衡移动考纲定位考情播报1.了解化学反应的可逆性及化学平衡的建立。
2.掌握化学平衡的特征。
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。
2016·全国甲卷T27/全国乙卷T27(1)(2)/全国丙卷T27(2)(3)2015·全国卷ⅠT28(4)/全国卷ⅡT27(2)(3)2014·全国卷ⅠT28(3)/全国卷ⅡT26(2)(3)2013·全国卷ⅠT28(2)(3)(4)/全国卷ⅡT28(1)2012·全国卷T27(4)考点1| 可逆反应与化学平衡状态[基础知识整合]1.可逆反应2.化学平衡状态(1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态。
(2)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:以上过程可用如图表示:(3)特征[应用体验]催化剂1.向含有2 mol的SO2的容器中通入过量氧气发生2SO2(g)+O2(g)加热2SO3(g)ΔH=-Q kJ·mol-1(Q>0),充分反应后生成SO3的物质的量________2 mol(填“<”“>”或“=”,下同),SO2的物质的量________0 mol,转化率________100%,反应放出的热量________Q kJ。
[提示]<><<2.T℃时,将a mol H2O(g)和a mol CO(g)充入体积为V L的密闭容器中,发生反应:H2O(g)+CO(g)H2(g)+CO2(g)。
请回答下列问题:(1)反应刚开始时,c0(H2O)________(填“>”“<”或“=”,下同)c0(CO)________c0(H2)。
(2)随着反应的进行,c(H2O)逐渐________(填“增大”“减小”或“不变”,下同),c(CO2)逐渐________。
(3)当反应达到平衡状态时,c(H2)将________,单位时间消耗H2O的物质的量与消耗H2的物质的量是否相等?________,CO2的体积分数将________。
[提示](1)=>(2)减小增大(3)不变是不变[考点多维探究]角度1极端转化法确定可逆反应某状态的量1.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()A.Z为0.3 mol·L-1B.Y2为0.4 mol·L-1C.X2为0.2 mol·L-1D.Z为0.4 mol·L-1A[假设反应正向进行到底:X2(g)+Y2(g)2Z(g)起始浓度(mol·L-1) 0.1 0.3 0.2改变浓度(mol·L-1) 0.1 0.1 0.2终态浓度(mol·L-1) 0 0.2 0.4假设反应逆向进行到底:X2(g)+Y2(g)2Z(g)起始浓度(mol·L-1) 0.1 0.3 0.2改变浓度(mol·L-1) 0.1 0.1 0.2终态浓度(mol·L-1) 0.2 0.4 0平衡体系中各物质的浓度范围为0<X2<0.2,0.2<Y2<0.4,0<Z<0.4。
]2.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L -1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是()A.c1∶c2=3∶1B.平衡时,Y和Z的生成速率之比为2∶3C.X、Y的转化率不相等D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1D[平衡浓度之比为1∶3,转化浓度亦为1∶3,故c1∶c2=1∶3,A、C不正确;平衡时Y生成表示逆反应速率,Z生成表示正反应速率且v Y(生成)∶v Z(生成)应为3∶2,B不正确;由可逆反应的特点可知0 mol·L-1<c1<0.14 mol·L-1。
]极端转化法确定各物质物理量的范围可逆反应中各物质的物理量(浓度、物质的量、体积、质量等),可运用极端假设法判断:假设反应正向或逆向进行彻底,求出各物质物理量的极大值和极小值,从而确定它们有关物理量的范围。
注意:反应物物理量范围的最小值对应生成物的最大值;反应物物理量范围的最大值对应生成物的最小值。
角度2化学平衡状态的判定3.将FeCl3溶液和KI溶液混合,发生反应:2Fe3+(aq)+2I-(aq)2Fe2+(aq)+I2(aq)。
下列各项能判断上述可逆反应达到平衡状态的是()【导学号:95812173】A.溶液颜色不再变化B.c(K+)不再变化C.c(Fe3+)与c(Fe2+)之和不再变化D.v正(I-)=2v正(I2)A[A项,溶液颜色不再变化,说明Fe3+、Fe2+及I2的浓度不再变化,反应达到平衡状态;B项,钾离子浓度始终不变,因此c(K+)不变不能用于判断反应是否达到平衡状态;C项,由铁元素守恒知,铁离子和亚铁离子的浓度之和始终不变,因此c(Fe3+)与c(Fe2+)之和不变不能用于判断反应是否达到平衡状态;D 项,v正(I-)和v正(I2)同为正反应速率,v正(I-)=2v正(I2)不能用于判断反应是否达到平衡状态。
]4.(2017·安阳模拟)一定温度下某容积固定的密闭容器中,对可逆反应A(g)+B(g)2C(g),下列叙述能说明反应已达到平衡的是() A.容器内的压强不再变化B.混合气体的密度不再变化C.消耗B的速率是生成C的速率的1 2D.单位时间内生成a mol B,同时生成2a mol CD[该反应为等体反应,且容积固定,故p、ρ不变不能说明达到平衡,A、B错;消耗B与生成C均为正向,C错。
]5.在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量(1)能说明2SO2(g)+O2(g)2SO3(g)达到平衡状态的是________(填序号,下同)。
(2)能说明I2(g)+H2(g)2HI(g)达到平衡状态的是________。
(3)能说明2NO2(g)N2O4(g)达到平衡状态的是________。
(4)能说明C(s)+CO2(g)2CO(g)达到平衡状态的是________。
(5)能说明A(s)+2B(g)C(g)+D(g)达到平衡状态的是________。
(6)能说明NH2COONH4(s)2NH3(g)+CO2(g)达到平衡状态的是________。
(7)能说明5CO(g)+I2O5(s)5CO2(g)+I2(s)达到平衡状态的是________。
[答案](1)①③④⑦(2)⑤⑦(3)①③④⑤⑦(4)①②③④⑦(5)②④⑦(6)①②③(7)②④⑦化学平衡状态的判定方法及注意事项1.方法2.注意事项(1)化学平衡状态判断“三关注”关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2)不能作为“标志”的四种情况①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下的体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g)H2(g)+I2(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g)H2(g)+I2(g)。
④全是气体参加的反应,恒容条件下体系的密度保持不变。
总之,要抓住“变量不变”即可——如果所给的物理量随着反应的进行是一个变量,在某时间段内不变,就可以说明反应达到平衡状态;如果该物理量始终是一个定值,就不能作为判断的依据。
考点2| 化学平衡移动[基础知识整合]1.化学平衡的移动一定条件下的平衡体系,条件改变后,平衡可能发生移动,如下所示:2.化学平衡移动与化学反应速率的关系v正>v逆,平衡向正反应方向移动;v正=v逆,反应达到平衡状态,平衡不发生移动;v正<v逆,平衡向逆反应方向移动。
3.影响化学平衡的因素若其他条件不变,改变下列条件对平衡的影响如下:勒夏特列原理:如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
4.充入惰性气体与平衡移动的关系 (1)恒温、恒容条件原平衡体系――→充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
[应用体验]1.已知在K2Cr2O7的溶液中存在平衡取两试管各加入5 mL 0.1 mol/L的K2Cr2O7溶液。
(1)向1号试管中加入几滴浓H2SO4,橙色________,说明平衡向________方向移动。
(2)向2号试管中加入几滴浓NaOH溶液,橙色________,说明平衡向________方向移动。
[提示](1)变深逆反应(2)变为黄色正反应2.将充入NO2的球放入热水,颜色变化为________,放入冰水中颜色变化为________,说明2NO2(g)N2O4(g)的ΔH________0。
[提示]红棕色变深红棕色变浅<[考点多维探究]角度1化学平衡移动的判断1.对于一定条件下的可逆反应【导学号:95812174】甲:A(g)+B(g)C(g)ΔH<0乙:A(s)+B(g)C(g)ΔH<0丙:A(g)+B(g)2C(g)ΔH>0达到化学平衡后,改变条件,按要求回答下列问题:(1)升温,平衡移动方向分别为(填“向左”“向右”或“不移动”)甲________;乙________;丙________。
此时反应体系的温度均比原来________(填“高”或“低”)。
混合气体的平均相对分子质量变化分别为(填“增大”“减小”或“不变”)甲________;乙________;丙________。
(2)加压,使体系体积缩小为原来的1 2①平衡移动方向(填“向左”“向右”或“不移动”) 甲________;乙________;丙________。
