物理化学课件(重庆大学)物理化学习题.docx
物理化学.ppt

液体的蒸气压与温度的关系为:
lg p* / Pa 10.296 3265/T / K
试求三相点的温度和压力,并求三相点时的摩尔升 华焓、摩尔蒸发焓及摩尔熔化焓。 解:
fus Hm sub Hm vap Hm (108.17 62.51)kJ mol1 45.66kJ mol1
dp*
sub Hm RT 2
dT
dln
p* / Pa dT
sub H m RT 2
ln10 5650K
T2
sub Hm 8.314 ln10 5650J mol 1 108.17103 J mol 1 108.17kJ mol 1
例:在熔点附近的温度范围内,TaBr5固体的蒸气压
纯组分的V-L、V-S平 衡,Vm (g) 相变Vm ,g ~ i.g.,
Hm C
例1 酚的精制采取减压蒸馏方法。已知酚的正常沸点为 181.9℃,如真空度为86.7kPa,酚的沸点应为多少?已
知酚的蒸发热为 48.1103 J mol,1 外压为100.0Pa。
解:
T1,p1 △H
3265 542.0
4.272
p* 18.7 103 Pa 18.7kPa
例:在熔点附近的温度范围内,TaBr5固体的蒸气压
与温度的关系为:lg p* / Pa 14.696 5650/T / K ,
液体的蒸气压与温度的关系为:
lg p* / Pa 10.296 3265/T / K
解:
dp trsHm dT TtrsVm
物理化学(下)课件 第13章
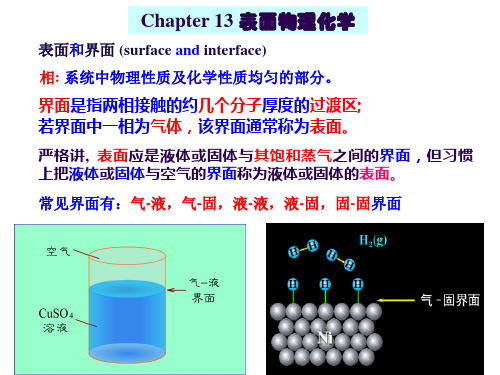
界面现象的本质
液体内部分子所受的力可以彼此抵销,但表面分子受到体相 分子的拉力大,受到气相分子的拉力小(因为气相密度低), 所以表面分子有被拉入体相的趋向。
S T ( A)T ,P,nB
-T ( T ) A,P,nB
左边:在温度不变时可逆扩大
单位表面积所吸的热, 是一正值。
Ramsay和Shields经验公式
Vm2 / 3 k (Tc - T - 6.0)
式中Vm为摩尔体积,k 为普适常数, 对非极性液体,k = 2.2×10-7 J·K-1 。
影响表面张力的因素
如果刺破线圈中央的液膜,线圈内侧 张力消失,外侧表面张力立即将线圈 绷成一个圆形,清楚的显示出表面张 力的存在。
表面张力的表现
界面张力与温度的关系
温度升高,界面张力下降,当达到临界温度 Tc 时,界面张力趋 向于零。这可用热力学公式说明:根据全微分的性质: NhomakorabeaS
( A)T ,P,nB -( T ) A,P,nB
当温度、压力和组成恒定时,可逆使表面积增加dA所需 要对体系作的功,称为表面功。用公式表示为:
W ' dA
为比例系数,当T, P 及组成一定的条件下,它在数值上 等于增加单位表面积对体系所做的可逆非膨胀功。
界面中的热力学公式
原来的热力学函数关系只考虑体积功。当考虑了表面功,热力 学基本公式中应相应增加 dA一项, 故
(1) 分子间相互作用力 对纯液体或纯固体,表面张力决定于分子间形成的非化学 键能的大小,一般非化学键越强,表面张力越大。
最新物理化学化学平衡例题PPT课件

例3: PCl5(g)的分解反应 PCl5(g) = PCl3(g) + Cl2(g),在 523.2 K,100 kPa下反应达到平衡后,测得平衡混合物的密 度为2.695103 kg.m-3,试计算:
(1)PCl5(g) 的离解度; (2)该反应的KpӨ ; (3)该反应的ΔrGmӨ 。
物理化学化学平衡例题
解:(1)由于压力较低,可以看作是理想气体反应,于是有
γB=1,fB = pBγB = pB,
aB
fB p
pB p
所以 KaӨ = KfӨ = KpӨ ,Qa = Qf = Qp,
Qp
p p CO2 H2 pCO pH2O
由于各气体的分压相等,所以Qp=1.0
ΔrGm = – RTlnKpӨ + RTlnQp = – (8.314 J·mol-1·K-1)× (973 K) × ln0.71 = 2771 J·mol-1>0
pC O 2Kpp 1.23Pa
方法2:先导出KӨ与T的关系,由此关系式求出KӨ(1000 K)。
lnKp(298K)R rG Tm87.6
由
ln Kp T
p
r Hm RT2
其中 ΔrHmӨ(T) = (267103 + 4.0T) J.mol-1 代入上式, 得:
dlnKp
2671034.0TdT RT2
在该条件下正向反应不能自发进行。
(2) ΔrGm = – RTlnKpӨ + RTlnQ
= (8.314 J-1 K-1 mol-1)(973 K)
[ln
1.5105 2
1]
1.6106 5.0105 0.71
-22316 J-1 mol-1 < 0
物理化学第三章习题答案精品PPT课件

H 2 n fus H m (273.15K ) 60.12kJ
H 56.21kJ
S S1 S2 S3
S1
nC p,m
(l )
ln
T2 T1
28.45J K 1
S3
nC
p,m
(
s)
ln
T1 T2
13.87 J
K 1
S2
n fus H m T2
220.10J K 1
S 205.52J K 1
nR ln
p1 p2
?
S1 nSm 0.04 205.14 8.21J K 1
S2 S1 S ?
H nC p,m (T2 T1) ? G H (T2S2 T1S1) ?
6.1mol某双原子理想气体,从300K、pθ等温可逆压缩到10pθ, 计算该过程的Q、W、∆U、∆H、∆S、∆A和∆G。
可逆地压缩到100 kPa,计算该过程的Q、W、∆U、∆H、
∆S、∆A和∆G 。S巳m 知 (298.15K) = 130.59 J·K-
1解·m:o1l-01m。ol理想气体 绝 热 可逆10mol理想气体
298.15K,50 kPa
T2,100kPa
T2
(
p2
)
R C p ,m
T2 363.27K
T1
p1
Q0
W U nCV ,m (T2 T1) 13.57kJ
H nCp,m (T 2T1) 18.99kJ
G H (T2S2 T1S1) H S(T2 T1)
10mol理想气体 S10mol理想气体 298.15K,100kPa 298.15K,50 kPa
S nR ln 100 57.63J K 1 50
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
练习1
1.指出下列各过程中,物系的AU、AH、AS、4 AG中何者为零?
(1)理想气体自由膨胀过程;
(2)实际气体节流膨胀过程;
(3)理想气体由(/?!,?!)状态绝热可逆变化到血,互H犬态;
(4)H2和C12在刚性绝热的容器中反应生成HC1;
(5)0°C、//时,水结成冰的相变过程;
(6)理想气体卡诺循环。
2.a mol A与b mol B的理想气体,分别处于(T,V,p A)与⑺匕/花)的状态,等温等容混合为⑺匕“)状态,那么△"、AH、AS、AA、AG何者大于零,小于零,等于零?
3.一个刚性密闭绝热箱中,装有咼与Cb混合气体,温度为298K,今用光引发,使其化合为HCl(g),光能忽略,气体为理想气体,巳知A f/7^(HC1) = -9
4.56kJ mor1,试判断该过程中△{/、AW. AS、4 AG是大于零,小于零,还是等于零?
4.在一绝热恒容箱内,有一绝热板将其分成两部分,隔板两边各有1 mol N2, 其状态分别为298K、泸与298K、10/,若以全部气体为体系,抽去隔板后,则Q、W、AU、AH、A5中,哪些为零?
判断和改错
5.P I V】Y=P2V2Y的关系式只能用于绝热可逆过程。
6.因为Q,W不是系统的性质,而与过程有关,所以热力学过程中(Q-W)的值也
应由具体过程决定。
7.爛差AS就是过程的热温商。
&在孤立系统中发生的任何过程都是自发过程。
9.可逆绝热过程必定是等嬌过程。
10.同一物质,当温度升高时,嫡值增大。
11.自发过程一定是不可逆过程。
12.爛增加的放热反应是自发反应。
13.孤立系统中的嫡值总是有增无减。
14.系统的混乱度越大,则其嬌值越大。
15.在标准压力及指定温度下,任何稳定单质的生成焙值为零。
16.在两个不同温度的热源之间工作的热机以卡诺热机的效率最大。
17.当理想气体反抗一定外压,作绝热膨胀时,内能总是减小。
18.在绝热过程中,系统所作的功只由系统的始末态决定。
19.内能是状态的单质函数,所以两个状态相同时,其内能值必然相同。
20.卡诺热机的效率只与两个热源的温度有关而与工作物质无关。
21.不可逆过程一定是自发过程。
22.热力学第一定律与热力学第二定律是人们经验的总结,它不能从逻辑上或用其它理论方法来加以证明。
23.利用弹式量热容器测量蔡的燃烧热,这个实验过程是绝热定容过程。
7
24.101325PaJ00°Clmol液态水经定温蒸发成水蒸气(若水蒸气可视为理想气体), 因温度不变,所以△ U = 0,411 = 0 o .
25.n mol理想气体从同一始态出发,分别经一定温可逆膨胀过程和一绝热自由膨
胀过程,其终态温度必定不同。
6.水可以在定温定压条件下电解形成氧气和氢气,此过程中AH =Q P o
27.当热量由系统传给环境时,系统的内能必定减少。
28.一定量的气体,从始态A变化到终态B,系统吸收100 J的热量,对外作功200 J,这不符合热力学第一定律。
29.在标准压力及指定温度下,金刚石是单质,所以其恰值为零。
30.公式dH = nCpdT只适用于理想气体的定压变温过程。
练习2
1.平衡常数K二1的反应,在标准态下反应,反应朝什么方向进行?
2.在空气中金属不被氧化的条件是什么?
3•反应C(s) + ILO(g) = CO(g) + IL(g),在673K、p下达到平衡, 巳知△忆二133.5kJ ・nio「,问下列条件变化时,对平衡有何影响?
(A)增加温度;(B)增加水蒸气的分压;
(0增加总压;(D)通入弘;
(E)增加碳的数量。
4.苯(A)与甲苯(B)形成理想混合物,当把5mol苯与5mol甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是:
(A) * = 0.5 ;(B) y A < 0.5 ;
(C) *>0.5 ;(D)无法确定。
5.二组分理想溶液的沸点的论述正确的是:
(A)沸点与溶液组成无关;
(B)沸点在两纯组分的沸点之间;
(C)小于任一纯组分的沸点;
(D)大于任一纯组分的沸点。
6.等温等压下,1 molC6H6与lmolCeHsCHs形成了理想溶液,现耍将两种组分完
全分离成纯组分,则最少需要非体积功的数值是:
(A) RT[n0.5;(B) 2/?71n0.5 ;
(C) -2/?71/?0.5 ;(D) ^RTln0.5。
7.由A及B二种液体组成理想溶液,A、B的饱和蒸气压分别为几、x 为液相组成,y为气相组成,若p\ > p B( *表示纯态),贝归
(A) X A>%B ; (B) x A > ;
(C)无法确定;(D) x A < o
8.挥发性溶质溶于溶剂形成的稀溶液,溶液的沸点会:
(A)降低;(B)升高;
(C)不变;(D)可能升高或降低。
9.将少量挥发性液体加入溶剂中形成稀溶液,则溶液的沸点一定高于和同压力下纯溶剂剂的沸点。
溶液的凝固点也一定低于相同压力下纯溶剂的凝固点。
10.在一个给定的系统屮,物种数可以因分析问题的角度的不同而不同,但独立组分数是一个确定的数。
11・单组分系统的物种数一定等于1。
12.自由度就是可以独立变化的变量。
13.相图中的点都是代表系统状态的点。
14.恒定压力下,根据相律得出某一系统的f= 1,则该系统的温度就有一个唯一确定的值。
15.单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述。
16•根据二元液系的叶x图可以准确地判断该系统的液相是否是理想液体混合
物。
17.在相图中总可以利用杠杆规则计算两相平畅时两相的相对的量。
18.杠杆规则只适用于八%图的两相平衡区。
19.对于二元互溶液系,通过精镭方法总可以得到两个纯组分。
20.二元液系中,若A组分对拉乌尔定律产生正偏差,那么B组分必定对拉乌尔定律产生负偏差。
21・恒沸物的组成不变。
22.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A的摩尔分数成正比。
23.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
24.两组分理想溶液,在任何浓度下,其蒸气压:
(A)恒大于任一纯组分的蒸气压;
(B)恒小于任一纯组分的蒸气压;
(0 介于两个纯组分的蒸气压之间;
(D) 与溶液组成无关。
25.标准平衡常数与标准反应自由能的关系:,那么,为什么反应的平衡态与标准态是不相同的?
26.欲使反应产物的平衡浓度最大,反应物的投料比一般为多大?
27.对于计量系数二0的理想气体化学反应,哪些因素变化不改变平衡点?。
