常见酸碱滴定终点的指示方法(附常见酸碱指示剂变色范围)
酸碱中常见指示剂的选择与应用知识点总结

酸碱中常见指示剂的选择与应用知识点总结在化学实验中,酸碱滴定是一种常见的定量分析方法。
为了判断滴定反应的终点,常会使用酸碱指示剂。
酸碱指示剂是一种可以根据溶液的酸碱性质改变颜色的化学物质。
在选择和应用酸碱指示剂时,需要考虑指示剂的酸碱性质、变色范围和与被测溶液的适配性等因素。
本文将对酸碱中常见指示剂的选择与应用做出总结,并提供相应的知识点。
一、选择指示剂1. 酚酞酚酞是一种常用的指示剂,广泛应用于酸碱滴定中。
它呈现无色时溶于酸性溶液,溶液呈现红色;而在碱性溶液中呈现鲜艳的品红色。
酚酞的变色范围为pH值为6.8-8.2,适用于大多数酸碱滴定反应的终点判断。
2. 中性红中性红是一种红色酸碱指示剂,变色范围为pH值为6.8-8.4。
它在弱酸性溶液中呈现橙黄色,而在强碱性条件下呈现红色。
中性红适用于酸碱滴定反应的终点判断,特别在测定弱酸的时候较为常用。
3. 甲基橙甲基橙是一种橙色酸碱指示剂,变色范围为pH值为3.1-4.4。
在强酸性条件下呈现红色,而在弱碱性到中性条件下呈现橙黄色。
由于甲基橙的变色范围较窄,因此主要用于测定酸性物质的滴定。
4. 溴酚蓝溴酚蓝是一种绿色酸碱指示剂,变色范围为pH值为5.2-6.8。
在酸性溶液中呈现黄色,而在碱性溶液中呈现蓝色。
溴酚蓝的使用较为广泛,适用于酸碱滴定反应的终点判断。
5. 酸性紫酸性紫是一种紫色酸碱指示剂,变色范围为pH值为1.2-2.8。
它在酸性溶液中呈现红色,而在碱性溶液中呈现紫色。
酸性紫主要用于酸性物质测定的滴定。
二、应用知识点总结1. 指示剂的选择应根据被测溶液的性质确定。
不同的指示剂适用于不同pH范围内的滴定反应。
因此在选择指示剂时需了解被测溶液的pH范围,选择对应的指示剂。
2. 指示剂的浓度也会影响滴定结果。
指示剂的浓度过高或过低都可能影响终点的准确判断。
一般来说,指示剂的浓度在0.1%-0.5%之间较为适宜。
3. 指示剂的添加量也应适量。
过少的指示剂可能导致颜色变化不明显,而过多的指示剂可能会影响溶液的成分,进而影响滴定反应的准确性。
化学物质的酸碱指示剂与酸碱滴定指示范围

化学物质的酸碱指示剂与酸碱滴定指示范围化学中,酸碱指示剂是一种重要的试剂,用于判断溶液的酸碱性质。
通过改变颜色来指示溶液的酸碱特性,酸碱指示剂在酸碱滴定中起着至关重要的作用。
本文将就化学物质的酸碱指示剂与酸碱滴定指示范围进行详细探讨。
一、酸碱指示剂的分类酸碱指示剂根据颜色变化的特点可分为几种不同的类型,其中常用的有以下几种:1. 酚酞类指示剂:酚酞是一种常用的酸碱指示剂,其溶于酸性溶液时呈现红色,溶于碱性溶液时呈现无色。
这种指示剂的pH变化范围一般在8.2-10.0之间。
2. 甲基橙类指示剂:甲基橙是另一种常用的酸碱指示剂,其溶于酸性溶液时呈现红色,溶于碱性溶液时呈现黄色。
甲基橙的变色范围一般在3.1-4.4之间。
3. 酚酞-甲基橙混合指示剂:酚酞和甲基橙可以混合使用,以扩大酸碱指示剂的使用范围。
这种混合指示剂通常在酸性溶液呈现红色,碱性溶液呈现黄色,其变色范围约在3.1-10.0之间。
4. 酚酞-溴酚绿混合指示剂:酚酞与溴酚绿的混合使用,可以扩大酸碱指示剂的适用范围。
这种混合指示剂呈现红色的pH范围约在4.0-6.0之间,呈现黄色的pH范围约在3.0-7.0之间。
二、酸碱滴定指示范围的确定酸碱滴定是一种常用的化学分析方法,通过酸和碱之间的中和反应确定物质的含量。
在进行酸碱滴定时,选择合适的指示剂非常重要,以确保滴定结果的准确性。
确定酸碱滴定指示剂的范围有几种方法:1. 颜色变化法:通过观察指示剂颜色的变化来确定其适用的范围。
可以将指示剂分别加入已知pH值的溶液中,观察颜色变化点。
根据颜色的变化确定指示剂适用的pH范围。
2. pH范围法:根据已有的文献资料,可以获取一些常用酸碱指示剂的适用pH范围。
根据这些范围来选择合适的指示剂。
3. 酸碱指示剂试验法:对于未知pH值的溶液进行酸碱指示剂试验,观察颜色变化,以确定适用的指示剂。
三、酸碱指示剂的应用酸碱指示剂广泛应用于实验室和工业生产中。
在实验室中,酸碱指示剂常用于酸碱滴定、中和反应等实验过程中。
常用酸碱指示剂指示变色范围对比图
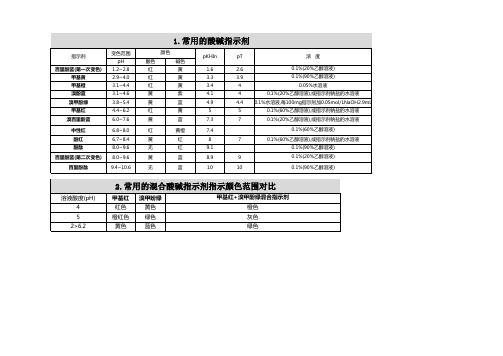
一份0.1%甲酚红钠盐水溶液三 份0.1%百里酚蓝钠盐水溶液
一份0.1%百里酚蓝50%乙等溶 液三份0.1%酚酞50%乙醇溶液 二份0.1%百里酚酞乙醇溶液一
份0.1%茜素黄乙醇溶液
3.常用的混合酸碱指示剂指示颜色范围对比
1
2
3
4
5
6
7
8
3.2--
10
0.1%(90%乙醇溶液)
溶液酸度(pH) 4 5
2>6.2
2.常用的混合酸碱指示剂指示颜色范围对比
甲基红 红色
橙红色 黄色
溴甲盼绿 黄色 绿色 蓝色
甲基红+溴甲酚绿混合指示剂 橙色 灰色 绿色
3.常用的混合酸碱指示剂指示颜色范围对比
指示剂溶液的组成
一份0.1%甲基黄乙醇溶液 一份0,1%亚甲基蓝乙醇溶液
10.2
黄
紫
1.常用的酸碱指示剂指示颜色范围对比
1
2
3
4
5
6
7
8
百里酚蓝(第一次变色)
1.2~2.8
甲基黄
2.9~4.0
甲基橙
3.1~4.4
溴酚蓝
3.1~4.6
溴甲酚绿
3.8~5.4
甲基红 溴百里酚蓝
中性红 酚红
4.4~6.2
6.0~7.6 6.8~8.0 6.7~8.4
酚酞
8.0~9.6
百里酚蓝(第二次变色)
一份0.1%中性红乙醇溶液
7.0
蓝紫
一份0.1%亚甲基蓝乙那溶液
pH7.0紫蓝
一份0.1%甲酚红钠盐水溶掖 8.3
三份0.1%百里酚蓝钠盐水溶液
酸碱指示剂的颜色变化范围

酸碱指示剂的颜色变化范围引言:酸碱指示剂是化学实验室常用的一种试剂。
它们能够在发生酸碱反应时改变颜色,以帮助我们判断溶液的酸碱性质。
不同的酸碱指示剂在不同的pH值下都有自己独特的颜色变化范围。
本文将介绍几种常用的酸碱指示剂及其颜色变化范围。
一、酸碱指示剂的基本原理:酸碱指示剂是由一种或多种感受酸碱性的化学物质组成。
它们可以根据溶液中氢离子(酸性)或氢氧根离子(碱性)的浓度来改变颜色。
一般来说,酸性溶液会使指示剂呈现不同的颜色,而碱性溶液则会呈现另一种颜色。
在中性条件下,指示剂的颜色一般是中间的,也称为中间色。
二、几种常用酸碱指示剂:1. 酚酞指示剂(Phenolphthalein):酚酞指示剂是最常用的酸碱指示剂之一。
它在酸性条件下呈无色或淡粉红色,而在中性到碱性条件下呈现鲜艳的品红色。
它的pH范围一般在8.2-10.0之间,所以常用于测定微弱酸的滴定过程。
2. 酚酞指示剂(Methyl Orange):酚酞指示剂是另一种常用的酸碱指示剂。
它在酸性条件下呈红色,而在碱性条件下则变为黄色。
它的pH范围一般在3.1-4.4之间,所以常用于测定强酸的滴定过程。
3. 甲基橙指示剂(Methyl Red):甲基橙指示剂也是常见的酸碱指示剂。
它在酸性条件下呈红色,中性到碱性条件则呈黄色。
它的pH范围一般在4.2-6.3之间,所以常用于测定强酸和弱酸的滴定过程。
4. BTB指示剂(Bromothymol Blue):BTB指示剂是一种常用的酸碱指示剂,它在酸性条件下呈黄色,中性到碱性条件则呈蓝色。
它的pH范围一般在6.0-7.6之间,所以常用于测定碱和中性溶液的滴定过程。
三、酸碱指示剂的颜色变化范围与实际应用:不同的酸碱指示剂对于不同pH值的溶液有不同的应用范围。
根据酸碱指示剂的颜色变化范围,我们可以通过观察溶液的颜色来判断其酸碱性。
例如,如果我们要测定一种溶液的pH值,并且知道该溶液的酸度程度较弱,我们可以选择使用酚酞指示剂。
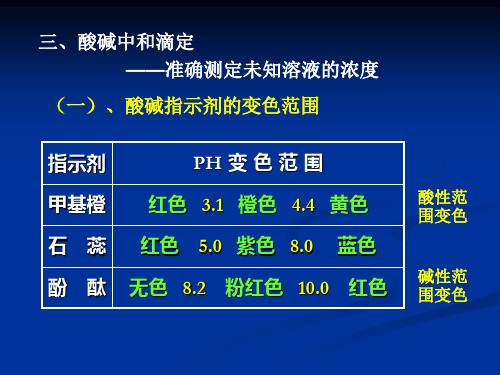
酸碱中和滴定
2、原理: (1)反应实质:H+ + OH- = H2O
C标准液.V标准液
C待测液=
V待测液
3、主要仪器 酸式滴定管、 碱式滴定管 滴定管夹、 铁架台、 锥形瓶
(1)、滴定管的特点: ① 标有使用温度和规格(25mL、50mlL) ② “0”刻度在上、下端有一段无刻度。 ③ 酸式为活塞 碱式为胶管(内嵌玻璃珠) ④ 最小分刻度:0.1mL,读数估读到0.01mL 可用于精确量取液体
甲基橙 HCl滴定NaOH(加指示剂) 黄→橙 NaOH滴定HCl(加指示剂) 红→橙
酚酞 红→无 无→粉红
注:
1、强酸强碱中和用甲基橙或酚酞 2、强酸弱碱中和用甲基橙(NH4Cl)
强碱弱酸中和用酚酞(CH3COONa)
滴定过程中的PH变化及终点判断
用0.1000 mol/L的盐酸溶液滴定未知浓度的 NaOH溶液20.00 mL,消耗盐酸20.00mL。
具体分析如下:
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。 (偏高)
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。(偏高)
(3)滴定前,用待测液润洗锥形瓶。(偏高)
(4)取待测液时,移液管用蒸馏水洗涤后,未用待测液润 洗。(偏低)
(5)取液时,移液管尖端的残留液吹入锥形瓶中。(偏高)
(6)读取标准液的刻度时,滴定前平视,滴定后俯视。(偏 低)
滴定管——自来水冲洗→蒸馏水清洗2~3次→ 待盛液润洗
锥形瓶——自来水冲洗→蒸馏水清洗2~3次 (不用待盛液润洗)
3、装液[滴定管中加入液体]
➢取一定体积待测液于锥形瓶
待装液润洗→装液→挤气泡充满滴定管→ 调整管内液面处于“0”或以下有刻度区域 →放一定体积的溶液→放指示剂
化学酸碱滴定指示剂常用酸碱指示剂的颜色变化与选择

化学酸碱滴定指示剂常用酸碱指示剂的颜色变化与选择化学中的酸碱滴定是一种定量分析方法,常用于测定溶液中酸碱的含量。
在滴定过程中,为了准确地确定酸碱的滴定终点,常会添加酸碱指示剂。
酸碱指示剂是一种可以通过颜色变化来指示溶液酸碱性质的化学物质。
不同的指示剂适用于不同的酸碱滴定反应,并且具有不同的颜色变化规律。
本文将介绍化学中常用的酸碱指示剂及其颜色变化与选择。
一、酸碱指示剂的颜色变化规律酸碱指示剂可以根据其分子结构中的色基实现颜色变化。
一般来说,酸性指示剂在酸溶液中呈红色或橙色,而在碱性溶液中呈黄色或无色;碱性指示剂则相反,在酸性溶液中呈黄色或无色,而在碱溶液中呈红色或橙色。
当溶液的酸碱性发生转变时,指示剂的颜色也会随之改变。
具体的颜色变化规律因每种指示剂的结构而异。
二、常用的酸碱指示剂及其选择1. 酚酞(Phenolphthalein)酚酞是一种常用的酸碱指示剂,它在酸性溶液中呈无色,而在碱性溶液中呈红色。
因此,酚酞适用于酸溶液与碳酸盐碱溶液的滴定。
但需要注意的是,酚酞只适用于中性或弱碱滴定,不适用于强酸滴定。
2. 苯酚蓝(Bromothymol Blue)苯酚蓝是一种酸性指示剂,它在酸性溶液中呈黄色,而在碱性溶液中呈蓝色。
因此,苯酚蓝适用于强酸与弱碱之间的滴定反应。
3. 甲基橙(Methyl Orange)甲基橙是一种酸碱指示剂,它在酸性溶液中呈红色,而在碱性溶液中呈黄色。
甲基橙常用于强酸与强碱之间的滴定。
4. 甲基紫(Methyl Violet)甲基紫是一种酸碱指示剂,它在酸性溶液中呈红色,而在碱性溶液中呈绿色。
甲基紫适用于测定强酸与弱碱之间的滴定终点。
5. 由于篇幅限制,本文只介绍了常用的几种酸碱指示剂,实际上有很多其他的指示剂也被广泛应用于化学滴定中,如溴酸溴酚绿、溴锑绿等。
三、选择酸碱指示剂的注意事项在选择酸碱指示剂时,需要根据滴定反应的特性来确定。
首先要了解滴定反应的酸碱性质,是酸性滴定还是碱性滴定,以及酸和碱的强弱程度。
滴定指示剂选择方法

常见酸碱指示剂的变色范围指示剂颜色变化变色范围(pH)石蕊红—蓝5.0~8.0甲基橙红—黄3.1~4.4酚酞无—红8.0~10.0酸碱中和和滴定指示剂的选择之一(1)酚酞:酸滴定碱时:颜色由红刚好褪色。
碱滴定酸时:颜色由无色到浅红色(2)甲基橙:酸滴定碱时:颜色由黄到橙色。
碱滴定酸时:颜色由红到橙色一般不选用石蕊。
酸碱中和和滴定指示剂的选择之二为了减小方法误差,使滴定终点和等当点重合,需要选择适当的指示剂。
强酸与弱碱相互滴定时,应选用甲基橙。
强碱与弱酸相互滴定时,应选用酚酞。
强酸与强碱相互滴定时,既可选用甲基橙,也可选用酚酞作指示剂。
注意,中和滴定不能用石蕊作指示剂。
原因是石蕊的变色范围(pH5.0~8.0)太宽,到达滴定终点时颜色变化不明显,不易观察。
酸碱中和滴定指示剂的选择之三常用的指示剂多是弱酸或弱碱,如石蕊;酚酞和甲基橙是比较复杂的有机酸。
指示剂的分子和离子具有不同的颜色,酸或碱溶液能影响指示剂的电离平衡,因此在酸或碱溶液中指示剂会显示不同的颜色。
中和滴定时选择指示剂应考虑以下几个方面:(1)指示剂的变色范围越窄越好,pH稍有变化,指示剂就能改变颜色。
石蕊溶液由于变色范围较宽,且在等当点时颜色的变化不易观察,所以在中和滴定中不采用。
(2)溶液颜色的变化由浅到深容易观察,而由深变浅则不易观察。
因此应选择在滴定终点时使溶液颜色由浅变深的指示剂。
强酸和强碱中和时,尽管酚酞和甲基橙都可以用,但用酸滴定碱时,甲基橙加在碱里,达到等当点时,溶液颜色由黄变红,易于观察,故选择甲基橙。
用碱滴定酸时,酚酞加在酸中,达到等当点时,溶液颜色由无色变为红色,易于观察,故选择酚酞。
(3)强酸和弱碱、强碱和弱酸中和达到滴定终点时,前者溶液显酸性,后者溶液显碱性,对后者应选择碱性变色指示剂(酚酞),对前者应选择酸性变色指示剂(甲基橙)。
(4)为了使指示剂的变色不发生异常导致误差,中和滴定时指示剂的用量不可过多,温度不宜过高,强酸或强碱的浓度不宜过大。
常见酸碱指示剂变色范围及颜色

常见酸碱指示剂变色范围及颜色
酸碱指示剂是一种化学试剂,可以通过颜色的变化来判断溶液的酸碱性质。
常见的酸碱指示剂有酚酞、甲基橙、溴酚蓝、酚红、甲基红、甲基紫等。
下面我们来看一下它们的变色范围及颜色。
酚酞:酚酞是一种常用的酸碱指示剂,它的变色范围是pH值在8.2-10.0之间。
在酸性溶液中,酚酞呈现黄色,而在碱性溶液中则呈现红色。
甲基橙:甲基橙是一种酸碱指示剂,它的变色范围是pH值在3.1-4.4之间。
在酸性溶液中,甲基橙呈现红色,而在碱性溶液中则呈现黄色。
溴酚蓝:溴酚蓝是一种常用的酸碱指示剂,它的变色范围是pH值在3.0-4.6之间。
在酸性溶液中,溴酚蓝呈现黄色,而在碱性溶液中则呈现蓝色。
酚红:酚红是一种酸碱指示剂,它的变色范围是pH值在6.0-8.0之间。
在酸性溶液中,酚红呈现黄色,而在碱性溶液中则呈现红色。
甲基红:甲基红是一种酸碱指示剂,它的变色范围是pH值在4.4-6.2之间。
在酸性溶液中,甲基红呈现红色,而在碱性溶液中则呈现黄色。
甲基紫:甲基紫是一种酸碱指示剂,它的变色范围是pH值在0.0-
1.6之间。
在酸性溶液中,甲基紫呈现红色,而在碱性溶液中则呈现绿色。
总的来说,酸碱指示剂的变色范围和颜色是根据它们的分子结构和酸碱性质来决定的。
在实验中,我们可以根据需要选择合适的酸碱指示剂来判断溶液的酸碱性质,从而进行相应的化学反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱滴定判断终点的方法有两类,即指示剂法和电位滴定法。
本文重点跟大家分享指示剂法的相关知识。
所谓指示剂法就是依靠颜色的改变,来指示终点的方法。
但大家都知道终点并不是化学计量点,为了减少终点误差,要求终点尽量靠拢化学计量点,而酸碱指示剂是多种多样的,变色情况也不相同,这样在酸碱滴定中,就存在一个如何选择指示剂的实际问题,为此有必要首先研究一下有关酸碱指示剂的各种问题。
⑴.酸碱指示剂的定义
酸碱指示剂一般为有机弱酸或弱碱,当溶液pH 值变化时,它们由于结构的改变而发生颜色的改变。
例如:甲基橙:有机弱碱,pH<3.1红色;pH >4.4黄色(红色为其酸色,黄色为其碱色)。
酚酞:二元弱酸,pH<8.0无色;pH >10.0红色(无色为其酸色,红色为其碱色)。
必须注意:酸碱指示剂结构的变化(即颜色的变化)具有可逆性。
如甲基橙当pH变小时(酸度增大),它由黄色变为红色;反之,当pH增大时(酸度降低),它又可由红色变为黄色。
所以无论在酸滴定碱中,还是碱滴定酸中它都可以使用。
⑵.指示剂的变色范围
酸碱指示剂变色范围
既然每一种指示剂都有一定的变色范围,其幅度在1-2个pH单位之间,所以当溶液pH变化时,指示剂在它的变色范围内会出现一些过渡色。
如:甲基橙在pH3.1逐渐变为4.4时,其颜色变化为红-橙红-橙-黄。
在滴定过程中,我们希望指示剂的酸色和碱色之间能发生突变,这样使颜色变化敏锐,观察更为准确。
要作到这一点,从外部因素考虑则希望在滴定接近化学计量点时溶液的pH值能有一个突然的大幅度的改变,从而使指示剂发生酸碱色互变,从内部原因考虑,就必须设法使指示剂的变色范围更窄一些,变色更敏锐一些,为此引出了混合指示剂。
混合酸碱指示剂变色范围。
