化工原理定性分析的四个步骤
《化工原理》第十三讲

容易在光滑表面形成。原因是需要较大的过热度,暴沸之 后过热度丧失,蒸发过程不平稳,暴沸对传热过程不利
(4)大容积饱和沸腾 曲线 ①自然对流阶段 ②泡状沸腾阶段
nucleate boiling
③膜状沸腾阶段film boiling
问: 1、沸腾曲线分为几个阶段?各有什么特点? 2、工业生产中沸腾操作一般总是设法控制在什么阶段?为什么?
五、有相变的对流传热 特点:对流传热系数较无相变时大,为什么?
1、蒸汽冷凝
(1)蒸汽冷凝的特点 气相主体不存在温度差,没有热阻,蒸汽冷凝给热的热阻 几乎全部集中在冷凝液膜中
工业上使用饱和蒸汽作为加热介质的原因:
一是饱和蒸汽有恒定的温度
二是有较大的对流传热系数
(2)冷凝液在壁面上的流动方式
•膜状冷凝
•滴状冷凝
滴状冷凝系数比膜状冷凝系数可以高达几倍甚至十几 倍,为什么? 但工业上冷凝器的设计却又总是按膜状冷凝来处理, 为什么?
因为即使采用了促进滴状冷凝的措施也不能持久
(3)影响冷凝传热的因素
不凝气体导致的附加热阻,蒸汽中有1%的不凝气体时,冷 凝给热系数将降低60% 蒸汽过热的影响,即壁温的影响,壁温与蒸汽的饱和温度比较 蒸汽的流速和流向对膜层厚度的影响
难点
流体无相变时管内强制湍流对对流传 热系数的影响因素及其影响机理
§4-5 对流传热系数关联式
一、获得α的方法
1、解析法
对所考察的流场建立动量传递、热量传递的衡算方程和速率方 程,在少数简单的情况下可以联立求解流场的温度分布和壁面 热流密度,然后将所得结果改写成牛顿冷却定律得形式,获得 给热系数的理论计算式,如:管内强制层流时的对流传热系数 求解
化工原理ppt课件
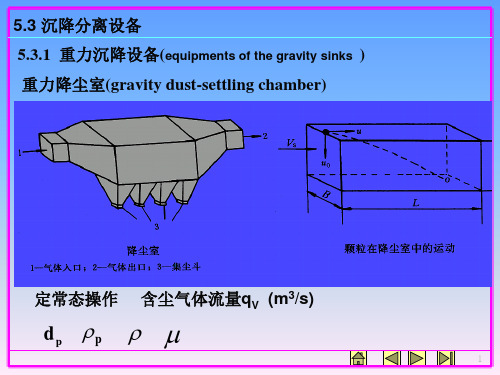
B
•
•••••
• •
H
u hor izont al
qV BH
设在水平方向上,颗粒与气体流同速。
工程处理方法:寻找颗粒得以分离的条件,从时间上考虑。
((停沉rseemt留降tlain时时ingin间间dgu::rdau颗trioa粒nti)o随n同)t 气流uh在t 降尘h室为中颗的粒时距间离段底平 r面的u距horL离izontal
A
B
D
B D 4
ui
qV A B
ui 的大小影响到器内进口旋涡、锥形底口灰 卷起情况、气流经过设备的总压降均有关。
27
两种常用旋风分离器的各部位尺寸比例
28
根据实验气体旋转圈数N一般去3-5. 例1:已知含尘气体中尘粒速度为2300kg/m3.气体温度为500℃, µ=0.036cp流量为1000m3/h.采用某种形式的旋风分离器,D=400mm, B=D/4,A=D/2,H=2D,d=D/2.试估算临界直dpc(即dmin)
16
2
理 论 上 :i
dp d pc
两边同时取自然对数:
lni
2 ln d p d pc
d p d pc 注意:dmin或者d pc指能够100%被沉降分离的最小颗粒粒径。
17
5.3.2 离心沉降(centrifugal settling) 和 离心沉降设备
在离心力的作用下,使流体中的颗粒产生沉降运动(离心力 方向上的运动),称为离心沉降。
分离器。以旋风分离器为例,分析离心分离设备的工作原理、 生产指标与设备尺寸、操作条件的关系。
处理物料为含尘气体,连续稳定的操作状况。
21
(1)旋风分离器的构造及工作状态
化工原理第四章传热

4-2.2
平面壁的稳态热传导
t Q R
dt Q A d
单层平面壁的稳态热传导
t1
△t
1、过程分析 假设Ⅰ:一维稳态热传导,即t=f(x) 假设Ⅱ:无限大平壁 A 2、模型 Q (t t )
1 2
A
Q
t2
可改写为:
t t Q A R
Am,3 2 rm,3l
Ф
t4
数学模型
★
1 1 Am,1
t1
t4
其中,
t1
Am,1 2 rm,1l Am,2 2 rm,2l
rm ,1
t4 Ф
r r r2 r1 r r rm ,2 3 2 rm ,3 4 3 r r r4 ln 2 ln 3 ln r1 r2 r3
非稳态传热——传热面各点温度t、传热速率Q 、热通量q等 物理量不仅为位置的函数,同时也随时间而改变。 Q, q, t……=f (x,y,z, τ)
化工原理
等温面 在温度场中,温度相同的各点组成的面。
等温面
温度梯度 等温面法线方向上的温度变化率。
t1>t2
对于一维稳定温度场, t=f(x),温度梯度表示为:
★ Q
t t t R 2 lrm Am
其中,
r2 r1 rm r ln 2 r1
Am 2 rml
rm——半径的对数平均值;当r2/r1<2时,rm≈ (r1+r2)/2
化工原理
多层圆筒壁的热传导
Q t1 t4 t t 3 2 R Am 2 Am,2 3 Am,3
dt grad (t ) d
研究有机化合物的一般步骤和方法
研究有机化合物的一般步骤和方法
(1)分离、提纯(分析、元素定量分析)──确定实验式; (3)相对分子质量的测定(质谱法)──确定分子式; (4)分子结构的鉴定(化学法、物理法)。
【思考与交流】 1、下列物质中的杂质(括号中是杂质)可以用什么方法除去。 (1)酒精(水) (2)壬烷(己烷) (3)KNO3(NaCl) (4)乙酸乙酯(乙醇) (5)甲烷(乙烯) (6)NaCl(泥沙) (7)溴水(水) (8)CO2(HCl)
明确:不同化学环境的氢原子(等效氢原子)因产生共振时 吸收的频率不同,被核磁共振仪记录下来的吸收峰的 面积不同。所以,可以从核磁共振谱图上推知氢原子的 类型及数目。
[练习2]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是 A HCHO B CH3OH C HCOOH D CH3COOCH3
二、元素分析与相对分子质量的测定
元素定量分析的原理:
将一定量的有机物燃烧,分解为简单的无机物,并作定 量测定,通过无机物的质量推算出组成该有机物元素原子的 质量分数,然后计算出该有机物分子所含元素原子最简单的 整数比,即确定其实验式(又称为最简式)
定量分析确定物质的步骤:
计算组成各原子的整数比
相对分子质量的测定—质谱法
(由于分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中 的质荷比最大的就是未知物的相对分子质量)
[例2].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
定量分析的一般步骤

表14-1 标准筛的筛号和孔径 缩分的目的:使粉碎后的试样量逐渐减少,一 般采用四分法。
例 题 :有 试 样 2 0 k g , 粗 碎 后 最 大 粒 度 为 6 m m 左
筛号/目 3 6 10 20 40 60 80 100 120 140 200
右 , 设 K 值 为 0 .2 , 应 保 留 试 样 量 为 多 少 ?
03
酸性熔剂K2S2O7(熔点419 ℃)、KHSO4(熔点219℃)溶解碱性试样
灼烧时
2KHSO4=K2S2O7+H2O
04
分解金红石 TiO2 + 2K2S2O7 = Ti(SO4)2 + 2K2SO4
✓ 碱熔法
碱性熔剂Na2CO3 ,K2CO3 ,NaOH ,KOH, Na2O2 或混合 例: 钠长石
要采取一系列减小误差的措施,对整个分析过程进
01
行质量控制 要采用行之有效的方法对分析结果进行评价,及时
ห้องสมุดไป่ตู้02
发现分析过程中的问题,确保分析结果的可靠性 03 14-4 分析结果准确度的保证和评价
分析结果的评价(对分析结果是否“可取”作出判断)
实验室内的质量评价
实验室间的质量评价
○ 对于一种新的试验方法,要检查其准确度和精密度 ● 在工业生产的质量控制和日常分析测试数据的有效性检验时,常用质量控制图(P421图 14-1)。
强氧化性酸---HClO4
1
2
高沸点203℃;除K+ 、NH4+外,其它盐均溶 于水;
浓热高氯酸具有强的脱水和氧化能力常用于不 锈钢、硫化物的分解和破坏有机物;
3
4
注意安全:浓度低于85%的纯高氯酸十分稳定, 但有强脱水剂(如浓硫酸)或有机物、某些还 原剂等存在一起加热时,就会发生剧烈的爆炸。
化工原理の传热实验

化工原理の传热实验一、实验目的1、学习传热系数的测定方法;2、学习传热膜系数及其准数联式的测定方法。
二、实验原理本实验有套管换热器4套,列管式换热器4套,首先介绍套管换热器。
套管换热器管间进饱和蒸汽,冷凝放热以加热管内的空气,实验设备如图2-2-5-1(1)所示。
传热方式为:冷凝—传导—对流 1、传热系数可用下式计算: ]/[2k m W t A qK m⋅∆⋅=(1)图2-2-5-1(1) 套管换热器示意图 式中:q ——传热速率[W] A ——传热面积[m 2] △t m —传热平均温差[K] ○1传热速率q 用下式计算: ])[(12W t t C V q p S -=ρ (2) 式中:3600/h S V V =——空气流量[m 3/s]V h ——空气流量[m 3/h]ρ——空气密度[kg/m 3],以下式计算:]/)[273(4645.031m kg t R p Pa ++=ρ (3)Pa ——大气压[mmHg]Rp ——空气流量计前表压[mmHg] t 1——空气进换热器前的温度[℃]Cp ——空气比热[K kg J ⋅/],查表或用下式计算:]/[04.01009K kg J t C m p ⋅+= (4) t m =(t 1+t 2)/2——空气进出换热器温度的平均值(℃) t 2——空气出口温度[℃]②传热平均面积A :][2m L d A m π= (5)式中:d m =传热管平均直径[m]L —传热管有效长度[m ]③传热平均温度差△t m 用逆流对数平均温差计算:T ←——T t 1——→t 22121ln t t t t t m ∆∆∆-∆=∆ (6) 式中:T ——蒸汽温度[℃]2、传热膜系数(给热系数)及其关联式空气在圆形直管内作强制湍流时的传热膜系数可用下面准数关联式表示:nr m e P R Nu 0α= (7)式中:N u ——努塞尔特准数R e ——雷诺准数 P r ——普兰特准数αo ——系数,经验值为0.023 m ——指数,经验值为0.8n ——指数,经验值为:流体被加热时n=0.4,流体被冷却n=0.3 为了测定传热膜系数,现对式(7)作进一步的分析:λαdNu =(8) α——空气与管壁间的传热膜系数[W/m 2·k] 本实验可近似取α=K[传热系数],也可用下式计算:)(m W i t t A q -=α (9)A i ——传热管内表面积[m 2] t W ——管壁温[℃]t m ——空气进、出口平均温度[℃] d ——管内径[m]λ——空气的导热系数[W/m ·k],查表或用下式计算:λ=0.0244+7.8×10-5t m (10) μρdu =Re (11)u ——空气在加热管内的流速[m/s]μ——空气定性温度(t m )下的粘度[pa ·s],查表或用下式计算:μ=1.72×10-5+4.8×10-8t m (12)d ,ρ——意义同上。
化工原理第四章对流传热

【解】在确定各物理量时,先确定定性温度。
一般情况下,用进出设备流体的温度的平均值
(算术平均值),即:
t t进+t出 =20+40=30℃
2
2
查数据手册,30℃时水的物性数据为:
Cp=4183J/(K.kg) ρ=996kg/m3 μ=8.01×10-4Pa.s λ=0.618W/(m.K)
【注意事项】
(1)定性温度取流体进出温度的算术平均值tm; (2)特征尺寸为管内径d;
(3)流体被加热时,n=0.4;
流体被冷却时,n=0.3。
(4)若l/d<60 ,进行校正:
'
1
d
0.7
l
3/24/2020
(2)圆形直管内的湍流(高粘度流体)
0.027 ( du )0.8 ( c p )0.33 ( )0.14
(1)什么是定性温度 【定义】确定物性参数 数值的温度称为定性温 度。
Re du
T1
t2
Pr c p
T2
t1
3/24/2020
(2)定性温度的取法 ①流体进、出口温度的平均值
②膜温
tm
t1
t2 2
t tm tw 2
th T1
热Φ 流 体
th,w
t2
Φ
冷 流 tc,w 体
式中 tw——壁面上的温度;
bt
Q bt A(tw t) 当流体被冷却时:
Q
bt'
A(T
Tw )
bt’
3/24/2020
4、牛顿冷却定律
令:
bt
Q
bt
A(t w
t)
流体被加热: Q A(tw t)
定量分析的一般步骤

定量分析的一般步骤第二章分析试样的采取和预处理方法教学要求:1、掌握定量分析的一般步骤;2、掌握试样采取得一般原则、无机和有机试样的分解方法;3、了解试样的制备和保存方法试样的分析过程,一般包括下列步骤:试样的采取和制备、试样的预处理、干扰组分的掩蔽和分离、定量测定、分析结果的计算和评价。
§2-1 分析试样的采取和制备试样采取得重要性和意义:分析试样的采集: 指从大批物料中采取少量样本作为原始试样,所采试样应具有高度的代表性,采取的试样的组成能代表全部物料的平均组成,否则分析结果再准确也是毫无意义的。
一、采取试样的一般原则1、现场勘察并收集资料;2、代表性;3、采用量符合要求;4、合理保存二、固体试样的采取(一)矿石试样1、采样点的布设(汽车、火车、轮船、矿堆、传送带等)2、湿存水的去除(100-105o C烘干)3、制备制备试样分为破碎,过筛,混匀和缩分四个步骤。
粗碎(过4-6号筛)、缩分、中碎(过20号筛)、缩分、碾磨、缩分、分析试样。
大块矿样先用压碎机破碎成小的颗粒,再进行缩分。
常用的缩分方法为“四分法”,将试样粉碎之后混合均匀,堆成锥形,然后略为压平,通过中心分为四等分把任何相对的两份弃去,其余相对的两份收集在一起混匀,这样试样便缩减了一半,称为缩分一次。
每次缩分后的最低重量也应符合采样公式的要求。
如果缩分后试样的重量大于按计算公式算得的重量较多,则可连续进行缩分直至所剩试样稍大于或等于最低重量为止。
然后再进行粉碎、缩分,最后制成100-300克左右的分析试样,装入瓶中,贴上标签供分析之用。
通常试样的取样量可按下面的经验公式(亦称采样公式)计算:m = Kd a式中:m为采取拭样的最低重量(公斤);d为试样中最大颗粒的直径(毫米);K和a为经验常数,可由实验求得,通常K值在0.02-1之间,a 值在1.8—2.5之间。
地质部门规定a值为2,则上式为:m=Kd2筛号(网目) 20 40 60 80 100 120 200筛孔大小/mm 0.83 0.42 0.25 0.177 0.149 0.125 0.074一般要求通过100-200目筛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工原理定性分析的四个步骤
一、试样的外表面观察和准备
拿到试样后的第一步工作是对试样的外表进行初步的观察。这种观
察虽然不能代替以后的分析工作,但准确认真的观察却能给我们提供一
些重要的参考性资料,大有益于以后工作的顺利进行。对于分析工作者
来说,一方面要力求弄清这个试样“是什么”;同样重要的,也要尽可
能弄清它“不是什么”。这样,可以简化分析步骤,节省时间和精力,
使必须做的工作做得更好。
二、初步试验
有些元素可以使无色火焰呈现出具有特征的颜色。这种性质对于分
析单一化合物很有帮助。复杂物质中如果存在着几种具有焰色反应的物
质,则因颜色的互相干扰而不能得到满意的结果。作焰色试验时,要求
被试验的物质具有较大的挥发性。因此,除用铂丝蘸取试样外,还要蘸
取浓HCI;或者以浓HCI润湿试样后,再以铂丝蘸取。这样,在灼烧时
便产生挥发性较大的氯化物,焰色反应较为明显。
三、阳离子分折
用于溶解试样的酸包括盐酸、硝酸和王水,硫酸因有较多的沉淀作
用,不适于作溶剂。在盐酸和硝酸都可用的情况下,如果需要考虑防止
挥发损失,则一般应选择硝酸,因为硝酸盐不象氯化物那样易于挥发,
在蒸发除去过量酸时不致遭到较大的损失;当然,王水只有在两种酸都
不溶的情况才使用。每种酸在使用时都要力求不太过量,而且尽量使用
稀的。过量太多的酸,尤其是浓酸,会给分析带来一系列的麻烦。
四、阴离子分析
按照本书的顺序阴离子的分析放在阳离子分析之后进行(也有先分
析阴离子的)。因此,在分析阴离子时有可能充分利用阳离子分析中已
经得出的结论,对各种阴离子存在的可能性作出一些推断。例如,从已
经鉴定出的阳离子以及试样的溶解性出发,可以推断某些阴离子有无存
在的可能。假设阳离子中有xx,而试样又溶于水,那么阴离子的第二组
不能存在;如果这个水溶液呈酸性,则第一组的大部分也不能存在。
