CNAS-CL36:2007《医学实验室安全认可准则》
丙型肝炎病毒核酸荧光定量检测法的性能验证

丙型肝炎病毒核酸荧光定量检测法的性能验证崔燕红;赵一琳;宛传丹【摘要】目的对基于QIGEN cube全自动核酸提取仪与ABI 7500核酸扩增仪的丙型肝炎病毒(HCV)-RNA定量检测系统进行性能评估.方法参照《临床实验室对商品定量试剂盒》WS/T 420-2013的性能验证方案,采用质量控制(质控)血清与临床标本评价所用商品试剂盒的精密度、正确度、线性范围与检测下限;同时参照《医学实验室质量和能力认可准则在分子诊断领域的应用说明》标准,统计分析实验偏差并与厂家声明的性能指标进行比较.结果精密度验证结果显示,2个浓度水平(level 1、level 2)质控品的批内变异系数(CV批内)分别为0.3%、0.9%,批间变异系数(CV批间)分别为0.4%、1.11%,均小于厂家声明值(5%).线性范围试验显示,在1.0×102~1.0×108 kU/L范围内呈良好线性(R2=0.999,P<0.001),高于厂家声明区间(2.0×101~1.0×109 kU/L).正确度验证结果显示,室间质评中的5个浓度水平质控品的实测值与质控样本理论值间偏倚分别为0.10、0、0、0.26和0.26,均小于0.4对数值(log值).最低定量检测下限为1.0×102 kU/L,高于厂家声明的最低检测限(0.5×102 kU/L),但与定量限(1.0×102 kU/L)一致.结论本实验室建立的HCV-RNA定量检测系统在精密度、正确度、线性范围与检测下限方面的性能指标均满足卫生行业标准与ISO 15189医学实验室质量认可准则的要求,能为临床提供可靠的检验报告.【期刊名称】《实用检验医师杂志》【年(卷),期】2018(010)003【总页数】5页(P168-172)【关键词】丙型肝炎病毒;核酸定量检测;性能验证;精密度;正确度;线性范围【作者】崔燕红;赵一琳;宛传丹【作者单位】215500 江苏常熟,常熟市医学检验所分子生物学实验室;215500 江苏常熟,常熟市医学检验所分子生物学实验室;215500 江苏常熟,常熟市医学检验所分子生物学实验室【正文语种】中文丙型肝炎病毒(hepatitis C virus,HCV)是导致慢性肝炎的重要嗜肝病毒之一,全球感染人数很多。
ISO15189实验室认可质量手册之质量管理体系

质量管理体系1 总则质量体系是为实施质量管理所需的组织结构、程序、过程和资源,它以满足质量方针和质量目标的需要为准。
质量体系运行的有效性和适应性是确保检测工作准确性和可靠性的先决条件。
本实验室的质量管理体系是文件化的管理体系,实验室的政策、过程、计划、程序和作业指导书均形成文件。
文件是实验室全体人员行动的依据,应让执行文件者容易得到并能充分理解所有文件,故实验室管理层应确保这些文件易于理解方能真正贯彻执行。
2 质量管理体系文件化的建立、实施和维持2.1 本实验室质量管理体系建立的依据标准是CNAS-CL02:2008《医学实验室质量和能力认可准则》、CL35《实验室信息系统的应用说明》、CL36《基因扩增检验领域的应用说明》、CL38《临床化学检验领域的应用说明》、CL39《临床免疫学检验领域的应用说明》、CL41《体液学检验领域的应用说明》、CL42《临床微生物学检验领域的应用说明》、CL43《临床血液学检验领域的应用说明》。
建立质量管理体系过程大致分三步:质量管理体系的策划与准备;组织结构的确定和资源配置;质量管理体系文件的编制;2.2 检验科主任负责质量管理体系的策划、质量方针和质量目标的制定;2.3 检验科主任批准质量方针和质量目标,批准质量手册和程序文件;2.4 检验科管理层负责质量体系的组织、建立;组织相关人员编写、审核质量手册、程序文件和作业指导书等文件;组织实施并确保质量体系有效运行和持续改进;2.5 各专业组组长负责领取、保管质量手册、程序文件和作业指导书,负责传达这些文件至本组所有人员并确保每人均能理解,带领全组人员贯彻实施文件化的质量管理体系;2.6 质量体系贯穿于本实验室一切检测工作及与检测工作有关的全过程,适用于从标本采集到出具检测报告及投诉处理等全部质量活动;2.7 质量手册作为纲领性文件应为全科人员熟悉和掌握,全体人员在深入理解质量手册内容的基础上,熟悉质量体系的其他各类文件;2.8 质量负责人或检验科主任指定专人不定期对质量手册内容的有效性进行审查,对存在缺陷的内容请示检验科主任后进行修改,以保证质量手册的现行有效性;2.9 质量手册内容的修改必须由检验科主任批准。
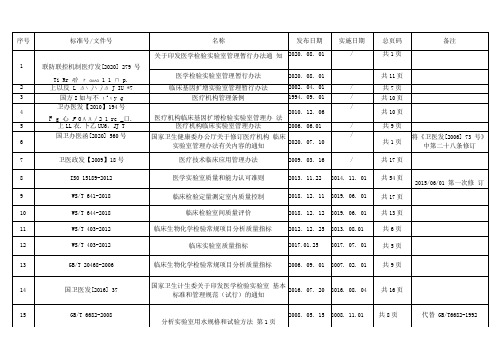
医学检验 法律法规 目录新 20210226
34
联防联控机制医疗发[2020] 313号
关于印发医疗机构新型冠状病毒核酸检测 工作手册(试行第二版)的通知
2020. 12. 28
/
共27页
35
国家联防联控机制医疗发(2020)311
关于转发国家联防联控机制医疗发(2020) 311号文件加强集中隔离点新冠病毒核酸 样本采集检测工作的通知
2020. 12. 28
2002. 04. 01
/
共7页
3
国方I如与不ιjιyq
医疗机构管理条例
1994. 09. 01
/
共10页
4
卫办医发【2010】194号
F g心FOΛΛ∕2 1 rc_口.
医疗机构临床基因扩增检验实验室管理办 法
2010. 12. 06
/
共10页
5
上LL衣.卜乙UU6,IJ T
医疗机构临床实验室管理办法
临床生物化学检验常规项目分析质量指标
2006. 09. 01
2007. 02. 01
共9页
14
国卫医发[2016] 37
国家卫生计生委关于印发医学检验实验室 基本标准和管理规范(试行)的通知
2016. 07. 20
2016. 08. 04
共16页
15
GB/T 6682-2008
分析实验室用水规格和试验方法 第1页
2006. 06.01
/
共9页
6
国卫办医函[2020] 560号
国家卫生健康委办公厅关于修订医疗机构 临床实验室管理办法有关内容的通知
2020. 07. 10
/
共1页
将《卫医发[2006] 73号》中第二十八条修订
ISO15189技术要素

人员资质
CNAS-CL36 分子诊断 分子诊断实验室操作人员应
经过有资质的培训机构培训合格取得上 岗证后方可上岗;签发分子病理报告的 医师应至少具有中级病理学专业技术职 务任职资格,并有从事分子病理工作的 经历.
5.1人员
岗位描述:实验室应对所有人员的岗位进行描述,包 括职责、权限和任务.
CNAS-CL36 分子诊断: 实验室应至少具有2名检验/检查人员
5.1人员
新员工入岗前介绍:实验室应有程序向新员工介绍组 织及其将要工作的部门或区域、聘用的条件和期限、 员工设施、健康和安全要求〔包括火灾和应急事件 以及职业卫生保健服务.
培训:实验室应为所有员工提供培训,包括以下内容: a>质量管理体系;b>所分派的工作过程和程序; c>适用的实验室信息系统;d>健康与安全,包括防 止或控制不良事件的影响;e>伦理;f>患者信息的 保密.
信息的有效传输; e> 提供安全设施和设备,并定期验证其功能. 示例:应急疏散装置、冷藏或冷冻库中的对讲机和警报系统,
便利的应急淋浴和洗眼装置等.
5.2.2 实验室和办公设施
CNAS-CL36 分子诊断 5.2.2 原则上分四个独立的工作区域:试剂
贮存和准备区;样品制备区;扩增区;扩 增产物分析区.如使用自动分析仪〔扩增产 物闭管检测,扩增区和扩增产物分析区可合 并.具体实验室分区应依据其所使用的技术 平台境条件 通用要求:
应依据所用分析设备和实验过程的要求, 制定环境温湿度控制要求并记录.应有 温湿度失控时的处理措施并记录.
必要时,实验室可配置不间断电源 〔UPS和〔或双路电源以保证关键设 备〔如需要控制温度和连续监测的分 析仪、冰箱等的正常工作.
ISO15189《质量手册》

医学检验实验室质量手册依据CNAS-CL02:2012《医学实验室质量和能力认可准则》编制人:审核人:批准人:文件编号:BJLT-QM-A1版本号:A1发布日期:实施日期:文件密级:□普通■秘密□机密□绝密目录01.修订页 (1)02.授权书 (3)03.批准令 (4)04.公正性声明 (6)05.质量方针与质量目标 (9)第一章实验室概况 (9)第二章质量手册说明 (9)第三章质量手册管理 (10)第四章管理要求 (13)1.组织和管理责任 (13)2.质量管理体系 (26)3.文件控制 (30)4.服务协议 (32)5.受委托实验室的检验 (34)6.外部服务和供应 (37)7.咨询服务 (39)8.投诉的解决 (41)9.不符合的识别和控制 (43)10.纠正措施 (45)11.预防措施 (47)12.持续改进 (49)13.记录控制 (51)14.评估和审核 (54)15.管理评审 (57)第五章技术要求 (59)1.人员 (59)2.设施和环境条件 (66)3.实验室设备、试剂和耗材 (70)4.检验前过程 (76)5.检验过程 (81)6.检验结果质量的保证 (87)7.检验后过程 (90)8.结果报告 (92)9.结果发布 (94)10.实验室信息系统管理 (97)附件1内部组织结构图 (100)附件2外部组织结构图 (100)附件3质量管理体系运行图 (101)附件4程序文件目录 (102)附件5管理体系职责分配表 (104)附件6量值溯源图 (108)01.修订页序号修订内容摘要修订人修订日期审批人审批日期1 2. 3. 4 5 6 7 8 9 1002.授权书授权医学检验实验室有限公司实验室主任按照依据CNAS-CL02:2012《医学实验室质量和能力认可准则》建立的质量管理体系,管理临床实验室与检验有关的工作,全面负责临床实验室的行政,业务,人事,运营,物资,医疗,科研,教学,技术,质量,安全工作,并承担其个人应承担的管理责任。
2018年最新ISO15189:2012质量手册(CNAS-CL02:2012)

ISO15189-2012质量管理体系文件(质量手册)质量手册文件编号:TJDX-1-2018第C版依据ISO15189:2012《医学实验室—质量和能力的要求》编制编制:审核:批准:生效日期:2018年01月01日授权书检验科为TJDX附属协和医院下属机构,具有独立、明确的法律地位。
检验科为患者和临床医疗部门提供医学检验结果,同时提供医学实验室解释和咨询服务。
为确保检验科的运作符合ISO15189:2012《医学实验室——质量和能力的要求》,现授权给本院检验科负责本院的医学检验工作,由此引起的法律责任由法人单位承担。
授权检验科主任负责检验科的日常运作和质量管理体系的有效运行。
为保证维护检验科各项检验的公正性、独立性、可信性,不受任何外来因素干扰,维护检验科管理层和员工在做出公正判断时免受内外部的影响和压力,同时要求相关各科室对检验科的工作予以支持和配合。
TJDX附属协和医院院长:2018年01月01日批准令本手册依据ISO 15189:2012《医学实验室——质量和能力的要求》的规定而制定,它阐述了TJDX附属协和医院检验科的质量方针和质量目标,并对TJDX附属协和医院检验科的质量管理体系提出了具体要求,适用于TJDX附属协和医院检验科全面质量管理工作。
本手册第C版已经审定,现予批准,并于批准之日起生效。
批准人签字:批准人职务:TJDX附属协和医院检验科主任批准日期:2018 年01月01日01 目录章节号章节名称页号授权书 (2)批准令 (3)01 目录 (4)02 修订页 (6)03 检验科概况 (7)04 公正性/保密性声明 (8)1 质量手册说明 (9)2 质量手册管理 (10)3 质量方针、目标 (12)4 管理要求13 4.1 组织和管理责任 (13)4.2 质量管理体系 (23)4.3 文件控制 (26)4.4 服务协议 (29)4.5 受委托实验室的检验 (31)4.6 外部服务和供应 (33)4.7 咨询服务 (35)4.8 投诉的解决 (36)4.9 不符合的识别和控制 (37)4.10 纠正措施 (39)4.11 预防措施 (40)4.12 持续改进 (41)4.13 记录控制 (42)4.14 评估和审核 (44)4.15 管理评审 (45)5 技术要求47 5.1 人员 (47)5.2 设施和环境条件 (50)5.3 实验室设备、试剂和耗材 (52)5.4 检验前过程 (55)5.5 检验过程 (58)5.6 检验结果质量保证 (61)5.7 检验后过程 (62)5.8 结果报告 (63)5.9 结果发布 (66)5.10 实验室信息管理................................................................... (69)附件1 内部组织结构图 (72)附件2 外部组织结构图 (73)附件3 授权签字人情况表 (74)附件4 质量管理体系图 (75)附件5 程序文件目录 (76)附件6 关键岗位人员任命书 (77)附件7 检测能力表 (78)附件8 全检验科工作人员一览表 (85)附件9 质量管理体系职责分配表 (86)附件10 实验室平面图 (87)附件11 量值溯源图 (88)附件12 仪器设备一览表 (89)02 修订页序号文件编号页码需更改的内容更改内容批准人批准日期12345678910111213141516171819202103检验科概况检验科现有面积XXX平方米,其中工作用房XXX平方米,就医者候诊面积XXX平方米,候诊厅内配有候诊椅、饮水机、空调机、电视机和广播系统,实验室按国家生物安全Ⅱ级标准建设。
ISO15189医学实验室认可流程与设计
证认可监督管理委员会的上级则是国家质量监督检4.1 组织和管理责任4.2 质量管理体系4.3 文件控制4.4 服务协议4.5 受委托实验室的检验4.6 外部服务和供应4.7 咨询服务4.8 投诉的解决4.9 不符合的识别和控制4.10 纠正措施4.11 预防措施4.12 持续改进4.13 记录控制4.14 评估和审核4.15 管理评审5.1 人员5.2 设施和环境条件5.3 检验科设备、试剂和耗材5.4 检验前过程5.5 检验过程5.6 检验结果的质量保证5.7 检验后过程5.8 结果报告5.9 结果发布5.10 检验科信息管理15个管理要素10个技术要素医学实验室认可11应用说明(2012最新版)CNAS-CL02:2012《医学实验室质量和能力认可准则》CNAS-CL35:2012《医学实验室质量和能力认可准则在实验室信息系统的应用说明》CNAS-CL36:2012《医学实验室质量和能力认可准则在分子诊断领域的应用说明》CNAS-CL37:2012《医学实验室质量和能力认可准则在组织病理学检查领域的应用说明》CNAS-CL38:2012《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学定性检验领域的应用说明》 CNAS-CL40:2012《医学实验室质量和能力认可准则在输血医学领域的应用说明》CNAS-CL41:2012《医学实验室质量和能力认可准则在体液学检验领域的应用说明》CNAS-CL42:2012《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明》 CNAS-CL43:2012《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》CNAS-CL51:2014《医学实验室质量和能力认可准则在细胞病理学检查领域的应用说明》来访、电话、传真以及其他电子通讯方式。
实验室准备-成立认可决策层。
ISO15189基因诊断最新应用说明
CNAS-CL36医学实验室质量和能力认可准则在分子诊断领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Molecular Diagnostics中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据分子诊断领域的特性而对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A、B为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件于2012年制定,本次为第1次修订换版。
医学实验室质量和能力认可准则在分子诊断领域的应用说明1 范围本文件规定了CNAS对分子诊断领域的认可要求,包括:病原体核酸和人体基因等领域涉及的核酸扩增试验、杂交试验(包括原位杂交试验)、核酸电泳分析等。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南CNAS-RL02 能力验证规则CNSA-CL31 内部校准要求临床技术操作规范·病理学分册,人民军医出版社,2004医疗机构临床基因扩增检验实验室工作导则病理科建设与管理指南(试行),卫办医政发〔2009〕31号3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展分子诊断工作至少2年。
15189对分子诊断设备的要求及应用中的问题(发送版)
检测,比较所得到的结果。
5.3 实验室设备
用于定性检验的试剂,选择阴性和弱阳性的样 品进行试剂批号验证。 用于定量检验的试剂,应进行新旧试剂批间的 差异验证,方法和要求参照附录A.6要求。 耗材的抑制物验收:对关键耗材应检测是否存 在核酸扩增的抑制物,方法和要求参照附录A.6 要求。
试剂质检
强调采用患者标本进行试剂质检的意义: • PCR实验时两个关键步骤:
5.2 设施和环境条件
工作区域应符合如下要求: • c)实验室各分区应配置固定和移动紫外线灯,波长为 254nm,照射时离实验台的高度一般为60~90cm; • e)样品制备区应配置二级生物安全柜和洗眼器,实验室 附近应有喷淋装置。 • 所有分子病理实验室均应设置独立的标本前处理区,包括 切片区和脱蜡区,用于组织切片、脱蜡、水化、染色等。 脱蜡、水化及染色应在通风设施中进行。
辅助设备(5.2设施和环境条件)
1、加样器 2、金属浴 3、离心机 4、冰箱 5、生物安全柜 6、UPS 7、纯水器(能除RNA酶)
第三部分 ISO15189 在分子诊断领域的 应用说明简介: 5.2 、 5.3 、 5.5及附录
医学实验室质量和能力认可准则 在分子诊断领域的应用说明 CNAS-CL36
卫生部负责第三类医疗技术的临床应用管理工作。
第三类医疗技术目录由卫生部制定公布,并根据临床 应用实际情况,予以调整。
省级卫生行政部门负责第二类医疗技术临床应用管理 工作。 第二类医疗技术目录由省级卫生行政部门根据本辖区 情况制定并公布,报卫生部备案。
医疗技术临床应用 能力审核
属于第三类的医疗技术首次应用于临床前,必须经过卫生部组
5.2 设施和环境条件
• 5.2.3用以保存临床样品和试剂的设施应设置目标温度和允许 范围,并记录。实验室应有温度失控时的处理措施并记录。 • 5.2.6 不同的实验区域应当有其各自的清洁用具以防止交叉污 染。工作结束后应立即对工作区进行清洁,必要时进行消毒 及去污染。
PCR质量控制(共64张PPT)
淋病奈瑟菌有自溶的特性,标本采集后应立即送检。
标本保存
靶核酸(尤其是RNA)易受核酸酶的作用而迅速降解,因此标本的 保存对于核酸扩增测定的有效性极为重要(避免反复冻融) 靶核酸为DNA的标本2-8℃保存1-3天,靶核酸为RNA的标本应- 20℃下保存 -20℃下保存1个月
恒温金属浴
维护:75%乙醇擦拭加热孔
校准: 校准单位:厂家、计量院、内部校准
温度准确度(±1℃ )(应涵盖试验过程中所涉及的温度) 孔间温度的均一性(±1℃ )(内部校准应规定测定孔的选择、测量
时间、各孔温度偏差允许范围)
移液器
维护: 75%乙醇擦拭
校准:校准周期、外校(厂家、计量所)、
校准量程(应涵盖试验过程中所涉及的量程)
常用质控规则的符号及定义
符号
定义
12S 一个质控测定值超出±2s控制限。
13S 一个质控测定值超出±3s控制限。
22S 两个连续的质控测定值同时超出+2s或-2s控制限。
R4S 同一批测定中,两个不同浓度质控物的测定值之间
的差值超出4s控制限。
41S 四个连续的质控测定值同时超出+1s或-1s控制限。 10X 十个连续的质控测定值同时处于均值的同一侧。
5ml灭菌离心管,离心,去上清,留沉淀用于核酸提取。
3)结果高于检测用上限肝,则素报告,“高因于检其测上是限”,T如a果q需酶要精的确定强量结抑果,制则应剂用,阴性且血清在(浆核)将酸样本提进行取10过0-10程00倍中稀释很后再重新进行检
测,结果乘上稀释倍数;
难完全去除。 2)修复的设备必须经校准、检定(验证)或检测满足要求后方
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNAS-CL36 医学实验室安全认可准则 (ISO 15190:2003)
Accreditation Criteria for the Safety of Medical Laboratories
中国合格评定国家认可委员会
CNAS-CL36˖20071义44义
2007041620070430Ⳃ㿔…………………………………………………………………………………..2㿔…………………………………………………………………………………..31㣗……………………………………………………………………….………..42㾘㣗⫼ӊ…………………………………………………………………..43䇁Н…………………………………………………………….………..…44亢䰽㑻………………………………………………………………………..…65ㅵ⧚㽕∖………………………………………………………………………..…76䆒䅵………………………………………………………………………..…87ǃǃӊǃẔ䆄………………………………………………108䰽䆚…………………………………………………………………………139џӊǃӸǃџ㘠Ϯ⮒⮙ⱘ………………………………………1310䆁…………………………………………………………………..…………1311ϾҎ䋷ӏ……………………………………………………………………..…1412㺙ϾҎ䰆㺙˄PPE˅ˈⴐǃ䴶ǃ䎇䰆㺙㕂.…1513㡃㸠Ў………………………………………………………………..…1814㸠Ў………………………………………………………………..…1915⇨⒊㛊………………………………………………………………………...…2016⫳⠽ǃ㔽………………………………………………...2017……………………………………………………………………...2118………………………………………………………………………...2219䰆☿……………………………………………………………………………...2420㋻⾏………………………………………………………………………...2521⬉⇨䆒………………………………………………………………………...2522ḋⱘ䖤䗕……………………………………………………………………...2623⠽㕂………………………………………………………………………...26䰘A˄䌘䰘˅ⱘ㸠䅵㒆㽕…………………………..28䰘B˄䌘䰘˅偠Ḍ………………………………………..30䰘C˄䌘䰘˅⫳ⓣⱘ∵ǃ⏙⋕˄˅⍜↦………..43CNAS-CL36˖20072义44义2007041620070430㿔
㾘њЁḐ䆘䅸Ӯ˄㣅㓽˖CNAS˅偠ⱘ㽕∖ˈㄝ䞛⫼GB19781˖2005˄ISO15190˖2003,IDT˅DŽ偠ⱘˈǃ㛑ϧ䮼ⱘ⊩㾘㽕∖ˈ偠ⱘ㸠Ў佪䙉ⱘⳌ⊩⊩㾘DŽ䗖⫼Ѣ乚ⱘ㉏偠ˈгҹ䗖⫼Ѣ乚ⱘ㉏Ԑ偠DŽ偠ϡҙ⒵䎇䋼䞣㛑ⱘ㽕∖ˈ䖬䆕偠ⱘDŽCNAS偠Ⳍⱘ䅸䖬CNAS-CL05lj偠⫳⠽䅸NJˈЁ䚼ℒ䗖⫼Ѣⱘ㽕∖䖯㸠㾷䞞㸹䇈DŽЎ乚ϡ⾥Ҫ乚㉏⾥ⱘ䅸⌏ˈCNASḍϡ乚ⱘ⾥⡍⚍ˈ䗖⡍乚ⱘ㋏⫼䇈DŽ偠⍝ċ㑻ǃČ㑻䰆∈ⱘ⫳⠽˄䳔㽕BSL-3ǃBSL-4偠˅ˈ䖬乏ヺCNAS-CL05lj偠⫳⠽䅸NJⱘ㽕∖DŽCNAS-CL36˖20073义44义
2007041620070430,62㿔㾘њ偠ゟ㓈⦃ⱘ㽕∖DŽϢℸ㉏ϔḋˈ㽕∖⹂ϧҎ䋳㒜䋷ӏˈϨҹϟϾҎ䋷ӏ˖—ҪӀЁⱘ㞾䑿;
—㛑ⱘҪҎⱘDŽ↣乍ӏ䛑䳔㽕䖯㸠亢䰽䆘ԄˈⳂⱘѢ㛑⍜䰸䰽DŽ⊩⍜䰸䰽ˈϟⱘӬ乎Փ⾡䰽ⱘ亢䰽㟇㛑Ԣⱘ∈˖1˅Փ⫼ҷ⊩˗2˅Փ⫼䰆⊩˗3˅Փ⫼ϾҎ䰆䆒DŽ佪㗗㰥ⱘˈ䌍⫼㽕ⱘDŽⳂⶹⱘ偠乚ЁՓ⫼ˈԚг㛑䗖⫼ѢҪ乚DŽ✊㗠ˈЎ⹂ˈ䳔㽕3㑻4㑻䰆∈ⱘҎ㉏⮙ԧⱘ偠ヺ䰘㽕∖DŽㅵϡկ䅸ˈԚ㹿ǃϧϮҪ⫼Ѣ䆹ⳂⱘDŽ䰙ǃ⊩㾘⎉Ⲫⱘѯ⡍ϧ乬ҹ䗖⫼DŽCNAS-CL36˖20074义44义
2007041620070430偠䅸
1㣗㾘њ偠Ё㸠Ўⱘ㽕∖DŽ2㾘㣗⫼ӊ
ϟ⫼ӊ⫼䳔ⱘDŽѢⱘ⫼ӊˈՓ⫼⫼⠜DŽѢⱘ⫼ӊˈՓ⫼⠜˄䅶˅DŽISO15189˖2003偠—䋼䞣㛑ⱘϧ⫼㽕∖3䇁Н
䞛⫼ISO15189㾘ⱘҹϟ䇁НDŽ3.1⇨⒊㛊aerosols㉦Ѣ⇨ԧǃ⚳䳒Ёⱘԧ㋏DŽ3.2䰆㜤antisepsisՓ⫼䰆㜤ҹ䰆ℶӸЈ㕂Ёⱘ⊩DŽ[BS6324-1]3.3䰆㜤antiseptic⫼ѢⲂ㙸㒘㒛㦠ⱘDŽ3.4⫳⠽biologicalagents㛑䍋ǃ䖛Ё↦ⱘ⫳⠽ԧˈ佄ⱘǃ㒚㚲ⱘ⫳ѢҎԧⱘDŽ
⊼˖⫳⠽亢䰽㑻㾕4DŽ3.5⏙⋕˄˅cleaning䰸㾕ϡ㾕ⱘ㉏∵ⱘ䖛DŽ3.6Ӵ䅵controlofinfectionplan䰶偠⫼Ѣ䰤ӴⱘDŽCNAS-CL36˖20075义44义20070416200704303.7∵decontamination⫳⠽ԧ↦⠽䰸㟇Ҫ䖒ϔ∈ⱘ䖛DŽ
3.8⍜↦disinfectant⍜↦⫼ⱘDŽ[BS6324-1]3.9⍜↦disinfection⫳⠽˄䗮ϡ㒚㦠㢑㚲˅䞣ⱘ䖛ˈ乏♁⏙䰸䚼ⱘ⫳⠽DŽ
3.10ergonomicsⷨおҎ⦃Ё⥛ⱘ⾥DŽ⊼˖䆹䇁⫳⠽ǃ⫳⧚ǃҎԧҎ-⬠䴶DŽ3.11亢㔽˄⚳㔽˅extractionhood˄fumehood˅㕂Ѣ偠䆒Ϟⱘ㔽ˈ⫼ҹぎ⇨⚳䳒䙓⦃DŽ3.12䰽hazardⱘ┰⑤DŽ[IEC61010-1˖2001]3.13䰽⠽hazardouswaste┰➗ǃ➗ǃ⟚ǃ㜤㱔ǃ↦ǃˈҎ⦃ⱘ⠽DŽ
3.14materialsafetydatasheet(MSDS)կ䆺㒚ⱘ䰽䄺⼎ⱘ䗮DŽ3.15⫳⠽microbiologicalsafetycabinet˄MSC˅⫳⠽biologicalsafetycabinet亢DŽ䗮䖛⇨Ёⱘ⇨ԧ䖛Ⓒˈ䰆ℶ㗙⦃㾺⧚┰䰽䰽⫳⠽ѻ⫳ⱘ⇨⒊㛊DŽ
