药物临床试验英文缩写汇编

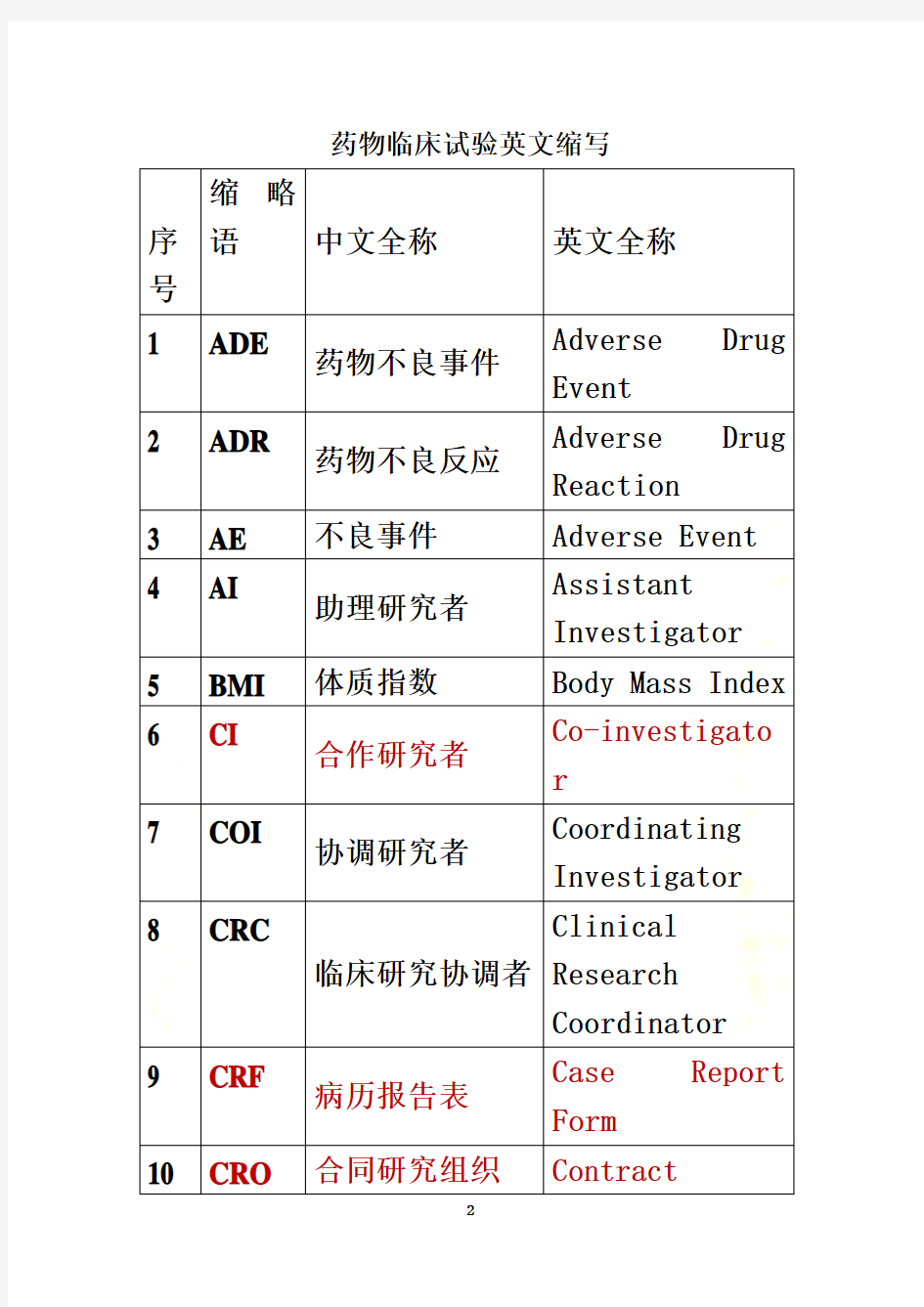
药物临床试验英文缩写汇编
药物临床试验英文缩写号
1 ADE
药物不良事件Adverse Drug Event
2 ADR
药物不良反应Adverse Drug Reaction
3 AE 不良事件Adverse Event
4 AI
助理研究者Assistant Investigator
5 BMI 体质指数Body Mass Index
6 CI
合作研究者Co-investigato
r
7 COI
协调研究者Coordinating Investigator
Research Organization
11 CSA
临床研究申请Clinical Study Application
12 CTA
临床试验申请Clinical Trial Application
13 CTX
临床试验免责Clinical Trial Exemption
14 CTP
临床试验方案Clinical Trial Protocol
15 CTR
临床试验报告Clinical Trial Report
16 DSM
数据安全及监控
Data Safety and
18 EDP 电子数据处理系
统Electronic Data Processing
19 FDA 美国食品与药品
管理局Food and Drug Administration
20 FR 总结报告Final Report
21 GCP药物临床试验质
量管理规范Good Clinical Practice
22 GLP
药物非临床试验
质量管理规范Good Laboratory Practice
23 GMP
药品生产质量管
理规范Good Manufacturing Practice
27 ICH
国际协调会议International Conference on Harmonization
28 IDM
独立数据监察Independent Data Monitoring
29 IDMC
独立数据监察委
员会Independent Data Monitoring Committee
30 IEC
独立伦理委员会Independent Ethics Committee
31 IND
新药临床研究Investigational New Drug
35 MA
上市许可证Marketing Approval/Author ization
36 MCA
英国药品监督局Medicines Control Agency
37 MHW
日本卫生福利部Ministry of Health and Welfare
38 NDA
新药申请New Drug Application
39 NEC 新化学实体New Drug Entity
40 NIH
国家卫生研究
所(美国)National Institutes of
44 PSI
制药业统计学
家协会Statisticians in the Pharmaceutical Industry
45 QA
质量保证Quality Assurance
46 QC 质量控制Quality Control
47 RA
监督管理部门Regulatory Authorities
48 SA 现场评估Site Assessment
49 SAE
严重不良事件Serious Adverse Event
50 SAP
统计分析计划
Statistical
54 SFDA
国家食品药品
监督管理局StateFoodandDr ugAdministratio n
55 SDV
原始数据核准Source Data Verification
56 SEL
受试者入选表Subject Enrollment Log
57 SI 助理研究者Sub-investigator
58 SI
申办研究者Sponsor-Investig ator
59 SIC
受试者识别代
码Subject Identification Code
Screening Log
63 T&R
受试和参比试
剂Test and Reference Product
64 UAE 预料外不良事
件Unexpected Adverse Event
65 WHO
世界卫生组织World Health Organization
66 WHO-
ICDR A WHO国际药品
管理当局会议
WHO
International
Conference of
Drug Regulatory
Authorities
药物临床试验英文缩写
ALP 碱性磷酸酶
消耗函数
Alpha
spending
function
ALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准
助理研究者Assistant
investigator
AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间
曲线下面积
ce
空白对照Blank
control
Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查
盲法Blinding
method
盲法/设盲Blinding/mas
king
Block 层
Block size 每段的长度Carryover 延滞效应
临床等效应
Clinical
equivalence
临床研究
Clinical
study
临床试验的总结报告Clinical
study report
Clinical trial 临床试验
Cmax 峰浓度
合作研究者
Co-investigat
or
Comparison 对照
Compliance 依从性
Composite 复合变量
置信水平Confidence
level
一致性检验Consistency
test
协议/合同Contract/
agreement
对照组Control
group
协调委员会Coordinating
committee
Crea 肌酐
病例报告表CRF(case
report form)
management
Database 建立数据库
描述性统计分析Descriptive
statistical
analysis
DF 波动系统Dichotomies 二分类Diviation 偏差
记录/文件Documentati
on
剂量-反应关系Dose-reactio
n relation
Double 双模拟
电子数据采集系统Electronic
data capture
EDC
电子数据处理系统Electronic
data
processing
EDP
应急信件Emergency
envelope
End point 终点
终点指标Endpoint
Criteria
Endpoint 终点指标
伦理委员会Ethics
committee
Excellent 显效
排除标准Exclusion
criteria
析因设计Factorial
design
Failure 无效失败Final point 终点
固定剂量法Fixed-dose
procedure
强制滴定Forced
titration
assessment
variable
GLU 血糖
成组序贯设计Group
sequential
design
健康经济学评价Health
economic
evaluation,
HEV
假设检验Hypothesis
test
Hypothesis 假设检验
Informed
consent IC
知情同意
Initial
meeting
启动会议Inspection 检察/视察Institution
inspection
机构检查
Institution
review
board, IBR
机构审查委员会
Intention-to –treat ITT 意向性分析(-统计学)
Interactive 互动式语音应答系统
Conference of Harmonizati on ICH 求国际技术协调会国际协调会议
Investigation
al Product
试验药物Investigator 研究者Investigator’
s brochure,
IB
研究者手册
Last observation carry 最接近一次观察的结转
国内药物临床试验法规与技术规范
国内药物临床试验法规与技术规范1.中华人民共和国药品管理法(2001) https://www.360docs.net/doc/164570038.html,/policy.do?method=view&id=310 2.中华人民共和国药品管理法实施条例(2002) https://www.360docs.net/doc/164570038.html,/policy.do?method=view&id=309 3.药品注册管理办法(2007) https://www.360docs.net/doc/164570038.html,/WS01/CL0053/24529.html 4.药品注册管理办法(修改草案)(2014) https://www.360docs.net/doc/164570038.html,/article/cazjgg/201402/20140200394953.shtml 5.药物临床试验质量管理规范(2003) https://www.360docs.net/doc/164570038.html,/WS01/CL0053/24473.html 6.国际多中心临床试验指南(试行)(2014) https://www.360docs.net/doc/164570038.html,/plus/view.php?aid=521 7.医疗卫生机构开展临床研究项目管理办法的通知(2014) https://www.360docs.net/doc/164570038.html,/plus/view.php?aid=520 8.药物临床试验机构资格认定办法(试行)(2004) https://www.360docs.net/doc/164570038.html,/WS01/CL0058/9346.html 9.药物临床试验机构资格认定标准(2004) https://www.360docs.net/doc/164570038.html,/WS01/CL0058/9346.html 10.药物临床试验机构资格认定检查细则(试行)(2014) https://www.360docs.net/doc/164570038.html,/plus/view.php?aid=522 11.药物临床试验机构资格认定复核检查标准(2009) https://www.360docs.net/doc/164570038.html,/WS01/CL0087/42913.html 12.药物临床试验机构资格认定复核检查工作细则(2010) 13.药品注册现场核查管理规定(2008) https://www.360docs.net/doc/164570038.html,/policy.do?method=view&id=323 14.药物临床试验生物样本分析实验室管理指南(试行)(2011) https://www.360docs.net/doc/164570038.html,/WS01/CL0844/67395.html 15.国家食品药品监督管理总局关于药物临床试验信息平台的公告(2013)
临床试验常用的英文缩写
专业术语 缩略语英文全称中文全称 DCF data clarification form 数据澄清表,用于纸质query SDV source data verification 原始数据核对 ADE Adverse Drug Event药物不良事件 ADR Adverse Drug Reaction药物不良反应 AE Adverse Event不良事件 AI Assistant Investigator助理研究者 ? BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRAClinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表
CRO Contract Research Organization 合同研究组织CSAClinical Study Application 临床研究申请 CTAClinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMBData Safety and monitoring Board数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统 EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告 GCPGood Clinical Practice 药物临床试验质量管理规范 GLP Good Laboratory Practice 药物非临床试验质量管理规范GMPGood Manufacturing Practice 药品生产质量管理规范 IB Investigator’s Brochure 研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on Harmonization国际协调会议
抗肿瘤药物临床试验技术指导原则
抗肿瘤药物临床试验技术指导原则 一、概述 恶性肿瘤是严重威胁人类生命的一类疾病,尽管现有治疗手段取得了一定疗效,但多数肿瘤患者生存时间有限,缺乏有效的可以治愈的药物,亟需开发新的药物来满足需要。在抗肿瘤药物的风险效益评估中,医护人员和患者可能愿意承受相对较大的安全性风险,所以抗肿瘤药物的临床研究除遵循一般药物临床研究原则外,还应考虑其特殊性。由于肿瘤生物学研究的进展,一些新的作用机制、作用靶点的抗肿瘤药物不断涌现,呈现出不同于以往传统细胞毒类药物的安全性和有效性特点;肿瘤疾病的药物治疗也从以往的单纯追求肿瘤缩小向延长患者的生存期、提高生存质量转变,这些改变使抗肿瘤药物临床疗效评价终点指标也出现较大改变。因此,传统的抗肿瘤药物开发模式已经变得不适宜,需要更多地探索能加快和促进开发进程的临床研究策略。 本指导原则将对抗肿瘤药物临床研究一般考虑进行阐述,重点阐述在不同临床研究阶段中需要重点考虑的问题,旨在为抗肿瘤药物临床研究的设计、实施和评价提供方法学指导。申请人在进行临床研究时,还应当参照国家食品药品监督管理局(以下简称SFDA)既往发布的相关指导原则和《药物临床试验质量管理规范》(GCP)要求进行,对于一般药物临床研究需要遵从的原则以及与其他指导原则重复内容在本文中不再赘述。 本指导原则主要适用于抗肿瘤新化合物的临床研究,抗肿瘤生物制品也可参考部分内容,不适用于中药制剂。药物类别上主要针对细胞毒
类抗肿瘤药物临床研究,由于非细胞毒类药物(如信号传导抑制剂,生物反应调节剂,激素类等)是目前新药开发的主要方向,本指导原则也将尽可能对此类别药物临床研究的不同之处进行阐述。 本指导原则中的观点仅代表SFDA当前对抗肿瘤药物临床研究的一般性认识,不能涵盖在新药研发中遇到的所有情况,申请人在研究中应始终坚持具体问题具体分析的原则。尤其应注意的是,抗肿瘤药物研究理论和技术的快速发展,很可能对将来抗肿瘤药物开发模式产生影响,因此申请人可以积极探索更为科学合理的研究方法,并及时寻求SFDA 药品注册部门的建议。 二、临床研究的总体考虑 抗肿瘤药物的临床研究过程通常分为Ⅰ期、Ⅱ期和Ⅲ期临床试验。Ⅰ期临床试验主要目的是对药物的耐受性、药代动力学进行初步研究,为后期研究给药方案的设计提供数据支持;Ⅱ期临床试验主要是探索性的研究,如给药剂量探索、给药方案探索、瘤肿有效性探索等,同时也观察安全性;Ⅲ期临床试验则在Ⅱ期基础上进一步确证肿瘤患者临床获益情况,为获得上市许可提供足够证据。 需要指出,这种临床研究的分期并不是固定的开发顺序。在本指导原则中,尽管对Ⅰ、Ⅱ期探索性试验和Ⅲ期确证性试验区别对待,但统计假设的建立和检验也可以成为Ⅱ期临床试验的一部分,同样,部分探索性研究也可能成为Ⅲ期临床试验的一部分。 由于Ⅲ期临床试验需要提供生存获益的疗效数据,试验周期较长,因此可以采用探索的开发模式,按照预定的中期分析计划,依据不断积累的信息,对临床试验方案进行调整。
药物临床试验期间安全性数据快速报告常见问答
药物临床试验期间安全性数据快速报告 常见问答 2019年4月
前言 2018年1月25日原国家食品药品监督管理总局发布了《关于适用国际人用药品注册技术协调会二级指导原则的 公告》,要求“自2018年5月1日起,药物临床研究期间报告严重且非预期的药品不良反应适用《E2A:临床安全数据的管理:快速报告的定义和标准》《Ml:监管活动医学词典(MedDRA)》和《E2B ( R3 ):临床安全数据的管理:个例安全报告传输的数据元素》”。 2018年4月27日药品审评中心发布了《药物临床试验期间安全性数据快速报告的标准和程序》,进一步明确了我国药物临床试验期间非预期严重不良反应(SUSAR)快速报告的重点内容和报告途径。 本问答文件是在上述基础上,对于我国药物临床试验期间安全性数据快速报告实施以来部分共性问题的统一解释和澄清,供申请人 / CRO 参考和遵循。 随着快速报告工作的逐步完善,本问答文件后续也将不断进行增补和更新,在使用过程中,需注意采用最新的版本。
目录 █快速报告的范围 (3) █快速报告的时限 (7) █提交方式 (8) █关于购买第三方服务 (9) █Gateway账户申请及测试 (9) █申请人之窗与XML格式文件 (10) █E2B数据元素相关要求 (12) █破盲与阳性对照药、安慰剂报告问题 (12) █受理号填写 (14) █MedDRA词典 (15) █其它潜在严重安全性风险信息 (15) █咨询途径和方法 (16)
快速报告的范围 Q1. 《药物临床试验期间安全性数据快速报告的标准和程序》(以下简称《标准和程序》)中第一条“申请人获准开展药物(包括中药、化药及生物制品)临床试验后,对于临床试验期间发生的所有与试验药物肯定相关或可疑的非预期且严重的不良反应都应向国家药品审评机构进行快速报告”。此处的药物包含范围是什么?疫苗是否包含在内? A1. 此处的药物包含与注册申请有关的中药、化药、生物制品。疫苗包含于生物制品中,因此,疫苗临床试验也需按照上述《标准与程序》进行可疑且非预期严重不良反应的快速报告。 Q2. 疫苗临床试验,是否可以按照2014年发布的《疫苗临床试验严重不良事件报告管理规定(试行)》,而不必执行《药物临床试验期间安全性数据快速报告的标准与程序》? A2. 疫苗临床试验应该执行《药物临床试验期间安全性数据快速报告的标准与程序》。 2014年发布《疫苗临床试验严重不良事件报告管理规定(试行)》时,我国 尚未加入ICH,而目前我国已加入ICH并成为管委会成员。2018年1月25 日原国家食品药品监督管理总局发布《关于适用国际人用药品注册技术协
完整word版,临床试验常见英文缩写
临床试验常见英文缩写 ADR(Adverse drug reaction)不良反应 AE(Adverse event)不良事件 SAE(Serious Adverse Event)严重不良事件 CRF(Case report form/case record form)病例报告表 CRO(Contract research organization)合同研究组织 EC(Ethics Committee)伦理委员会 GCP(Good clinical practice)药品临床试验管理规范 EDC(Electronic data capture)电子数据采集 IB(Investigator's Brochure)研究者手册 ND (Not Done) 未做 NA (Not Applicable) 不适用 UK (Unknown) 未知 PI(Principal investigator )主要研究者 Sub-I(Sub-investigator) 助理研究者 QA(Quality assurance) 质量保证 QC(Quality control) 质量控制 SDV(Source data verification)原始资料核对 SD(Source data)原始数据 SD(Source document ) 原始文件 SFDA 国家食品药品监督管理局 SOP(Standard operating procedure) 标准操作规程 IRB 机构审查委员会 ICF(Informed Consent Form) 知情同意书 TMF(trial master file)研究管理文件夹 临床试验常见英文单词 A ?Active control ,AC 阳性对照,活性对照阳性对照,活性对照?Adverse drug reaction ,ADR 药物不良反应药物不良反应?Adverse event ,AE 不良事件 ?Approval 批准 ?Assistant investigator 助理研究者 ?Audit 稽查 ?Audit report 稽查报告 ?Auditor 稽查员 B ?Bias 偏性,偏倚 ?Blank control 空白对照 ?Blinding/masking 盲法,设盲 ?Block 层 C ?Case history 病历 ?Case report form/case record form ,CRF 病例报告表,病例记录表?Clinical study 临床研究
药物临床试验英文缩写汇编
药物临床试验英文缩写汇编
药物临床试验英文缩写号 1 ADE 药物不良事件Adverse Drug Event 2 ADR 药物不良反应Adverse Drug Reaction 3 AE 不良事件Adverse Event 4 AI 助理研究者Assistant Investigator 5 BMI 体质指数Body Mass Index 6 CI 合作研究者Co-investigato r 7 COI 协调研究者Coordinating Investigator
Research Organization 11 CSA 临床研究申请Clinical Study Application 12 CTA 临床试验申请Clinical Trial Application 13 CTX 临床试验免责Clinical Trial Exemption 14 CTP 临床试验方案Clinical Trial Protocol 15 CTR 临床试验报告Clinical Trial Report 16 DSM 数据安全及监控 Data Safety and
18 EDP 电子数据处理系 统Electronic Data Processing 19 FDA 美国食品与药品 管理局Food and Drug Administration 20 FR 总结报告Final Report 21 GCP药物临床试验质 量管理规范Good Clinical Practice 22 GLP 药物非临床试验 质量管理规范Good Laboratory Practice 23 GMP 药品生产质量管 理规范Good Manufacturing Practice
临床试验与实验室中常见的中英文名词与缩写
中国创新药咨询与服务先锋CRO 临床试验以及实验室中常见的英文缩写
药物临床试验英文缩写 缩略语英文全称中文全称 ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应 AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者 BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统 EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范GCP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator’s Brochure 研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on Harmonization 国际协调会议 IDM Independent Data Monitoring 独立数据监察 IDMC Independent Data Monitoring Committee 独立数据监察委员会 IEC Independent Ethics Committee 独立伦理委员会 IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会 IVD In Vitro Diagnostic 体外诊断 IVRS Interactive Voice Response System 互动语音应答系统 MA Marketing A pproval/Authorization 上市许可证 MCA Medicines Control Agency 英国药品监督局 MHW Ministry of Health and Welfare 日本卫生福利部 NDA New Drug Application 新药申请 NEC New Drug Entity 新化学实体 NIH National Institutes of Health 国家卫生研究所(美国)
常用临床试验缩写
临床监查员专业术语、缩略语中英对照表 缩略语英文全称中文全称 ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应 AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者 BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator’s Brochure研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on Harmonization 国际协调会议 IDM Independent Data Monitoring 独立数据监察 IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会 IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会 IVD In Vitro Diagnostic 体外诊断 IVRS Interactive Voice Response System 互动语音应答系统
最新药物临床试验工作总结-(1)
药物临床试验机构工作总结 根据江苏省三级综合医院医疗技术水平标准(2017版)和江苏省省级临床重点专科评分标准的相关要求,我院自2017年1月份启动创建国家药物临床试验机构。依照《药物临床试验质量管理规范》(2003版)的标准有序开展各项工作。以质量控制为抓手,注重内涵建设;加强机构办管理人员及各专业科室相关人员的培训;强化临床试验相关的伦理审查;规范伦理委员会的管理;大大提高了临床试验质量和管理水平。现对2017年的工作总结如下: 一、建立健全组织管理机构 我院自2017年1月份启动国家药物临床试验机构创建工作,3月份召开了创建动员大会。先后成立了国家药物临床试验工作领导小组、组织管理机构、机构伦理委员会和机构工作实施方案。机构办公室配置机构药房,资料档案室、质控小组。根据各临床专业的综合实力及科研技术水平遴选了17个临床专业研究团队。 二、制定规章制度、标准操作规程 机构办公室严格按照《药物临床试验质量管理规范》(2003版)
和《药物临床试验机构资格认定标准》的具体要求,起草制定了药物临床试验管理制度20条、各类人员职责14条、药物临床试验标准操作规程89条、药物临床试验设计规范5条并汇编成书100本,汇编印发应知应会手册300册。 三、强化药物临床试验培训,保证试验过程规范,结果科学可靠 积极组织专业人员参加院、内外GCP及相关技术规范培训:2017年的3-6月份有关院领导带领办公室成员先后到省、市级具有国家药物临床试验机构资质的6家医院调研参观学习;4-5月份组织两次38人次参加的江苏省药物临床试验法规、技术及实务操作和伦理审查技术高级培训班;7月份邀请有关药物临床试验知名专家,在我院举办由中国药理学会药物临床试验专业委员会主办的国家级药物临床试验质量管理规范培训班,约240人参加。目前共有129人次取得了国家级、省级药物临床试验培训证书。在创建期间组织院内培训8次约300人次,涉及内容包括对17个临床专业科室的研究者、质量管理员、药品管理员的专题培训及药物临床试验安全性评价与不良事件处理、进行心肺复苏、呼吸机、除颤仪等设备使用的SOP进行培训。四、 五、完成试验设施设备的配备 2017年8月份完成了机构办公室、伦理委员会办公室及各申报专
阿尔茨海默病治疗药物临床研究技术指导原则
指导原则编号: 治疗阿尔茨海默病药物临床试验 技术指导原则 (第二稿)
二OO七年三月 目录 一、概述 (4) 二、有效性和安全性评价要点 ........................................ 6.. (一)适应症定位................................................ 6.. (二)受试人群.................................................. 6... (三)有效性评价.............................................. 8.. (四)安全性评价............................................. 1..0 (五)临床试验的质量控制....................................... 1.0 三、分期试验设计 (11) (一)1期临床试验: (11) (二) ............................................... n期临床试验13 (三) .............................................. 皿期临床试验14 四、预防和控制疾病进展药物的临床试验............................ 1. 5 (一)............................................................ 轻度认知功能损害(MCI )者的临床试验.. (15) (二)............................................................ 控制疾病进展药物的临床试验 .................................................... 1.5
最新药物临床试验机构筹建工作总结及整改措施
药物临床试验机构筹建工作总结及整改措施我院xx年开始药物临床试验机构的筹建及申请工作,医院高度重视,建立了组织机构和伦理委员会,建立了各项管理制度,制定了各项试验设计规范、SOP等,研究人员进行了临床试验技术和GCP培训,并与xx年向国家药品食品监督管理局提交了资格认定申请,受理编号:XX XXXX年XX月XX日国家药监局专家专家对我院药物临床试验机构xx专业资格认定进行了现场检查,对我院的工作给予充分的肯定,并给出了综合评定意见,认为我院:专业技术力量较强,医疗设备齐全,专业病原病种充足,能满足药物临床试验的需要,医院领导重视药物临床试验机构的建设,成立了管理机构并制定了相关的管理制度、设计规范和SOP,机构人员接受过不同层次的GCP和药物临床试验技术培训,基本具备开展药物临床试验的条件。 但SFDA药品认证管理中心专家组也指出了检查中我们尚存在的一些问题。针对这些问题,医院领导组织有关人员进行了认真的讨论和研究,并做出如下整改: 1. 机构选派部分研究和管理人员到XX临床试验基地进行进修学习,学习结束后,重新制定和完善了部分管理制度、技术设计
规范和SOP,使其符合本专业的特点及GCP要求并具有可操作性。 2. 机构和专业分别选派具有相应的专业技术职称,参见过GCP 培训,并有参加过药物临床试验的经历并掌握临床试验相关技术的及相关法律的人员,设专业质控员和机构办公室质控员,分别从专业和实验全过程对药物临床实验进行监督检查,实现并强化药物临床实验的三级质控,完善药物临床试验质量保证体系与制度,确保我院承担的国家药物临床试验过程规范,结果真实可靠,保证受试者和申办单位的合法权益。 3. 选派机构主要研究和管理人员参加了国家级的GCP培训并取得了培训证书。同时在院内继续进行GCP知识和试验技术知识培训,并从认定工作结束后开始定期派机构管理人员对GCP知识和试验技术知识掌握情况进行抽查和督促,使所有试验相关人员熟悉GCP知识和试验技术知识, 4. 进一步完善了药物临床试验资料保存条件,设立专职人员负责药物临床试验资料的保存和管理,添置资料保存柜,更换较大的适合药物临床试验资料保存的资料保存室。 XXXX 医院
抗肿瘤药物临床试验终点技术指导原则
精心整理 一、概述 临床试验终点(EndPoint)服务于不同的研究目的。在传统的肿瘤药物的研发中,早期的临床试验目的是评价安全性以及药物的生物活性,如肿瘤缩小。后期的有效性研究通常评价药物是否能提供临床获益,例如生存期延长或症状改善等。 年代, (ObjectiveResponseRate,ORR SurrogateEndPoint)支持该药物的上市申 ,但可能能合 SFDA)可将该药物从市场中撤出。 本指导原则的目的是为申请人开展抗肿瘤药物临床试验终点指标的选择提供参考,以使其符合某种药物上市申请的有效性评价要求。本指导原则主要适用于国内、外均未上市的抗肿瘤新化合物的临床试验研究,新生物制品也可参考部分内容。本指导原则中仅讨论用于治疗肿瘤患者的药物的终点,未讨论用于预防或降低肿瘤发生率的药物的终点。 二、关于临床试验终点的一般性考虑
本节回顾了抗肿瘤药物研发中的一般性问题。对常用的抗肿瘤药物临床试验终点进行了探讨,并对采用了这些终点的肿瘤临床试验设计中的相关问题进行了讨论。本节中将讨论的临床试验终点包括总生存期(OverallSurvival,OS)、基于肿瘤测量的终点如无病生存期(Disease-FreeSurvival,DFS)、ORR、完全缓解(CompleteResponse,CR)、疾病进展时间(TimetoProgression,TTP)、无进展生存期(Progression-FreeSurvival,PFS)和基于症状评价的终点。抗肿瘤药物审批所用的重要临床试验终点比较见下表。
)的历 果出现显着差别。随机化研究通过进行直接结果的比较,可将这些差别最小化。如果药物的毒性可以接受,总生存期显着的改善可视为有临床意义,通常能支持新药的上市批准。 生存期研究实施和分析中存在的困难包括大型试验随访期较长,以及随后的抗肿瘤治疗可能会混淆生存期的分析。 (二)基于肿瘤测量的临床试验终点
临床试验常用的英文缩写
专业术语 缩略语 英文全称 中文全称 数据澄清表,用于纸质 query 原始数据核对 DCF SDV data clarification form source data verification ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应 AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者 BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRA Clinical Research Associate 临床监查员(临床监察员) CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统 EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范 GLP Good Laboratory Practice 药物非临床试验质量管理规范 GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator's Brochure 研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on Harmonization 国际协调会议
FDA 新药临床试验用样品制备技术指导原则
新药临床试验用样品制备技术指导原则 1997年2月 美国FDA发布 2009年6月 药审中心组织翻译 苏威制药公司翻译 北核协会审核 药审中心最终核准
目录 Ⅰ. 目的 (1) Ⅱ. 简介 (1) Ⅲ. 成份控制 (3) Ⅳ. 生产和工艺控制 (3) Ⅴ. 收率计算 (4) Ⅵ. 设备的识别标志 (4) Ⅶ. 包装和贴签操作 (5) Ⅷ. 留样 (5) Ⅸ. 记录保存 (6)
新药临床试验用样品制备技术指导原则 Ⅰ. 目的 本指导原则适用于新药的研究与开发。目的是帮助相关人员更好的执行现行的药品生产质量规范(GMP)有关章节(联邦法规第21主题,第210和211部分)。 Ⅱ. 简介 本指导原则草案的说明(53FR 5835)指出,本规范将会在§ 10.90(b)(21 CFR 10.90 (b))中发布,作为指导规范以为药品的临床申报提供规程或标准。当局目前也正在考虑是否进一步修订§ 10.90(b),但还没有做最后决定。 虽然当局决定发布本指导原则,但最后还是以本指导原则的最终版本§ 10.90(b)为准。 即称之为指导原则,它并不对FDA或其他任何人以任何方式产生约束。 当局建议本指导原则最终版本的定位是基于现行的GMP规范。本指导原则应对为临床试验目的而研制的临床新药的有关人员提供帮助。虽然在本指导原则中没有提及其它可替代的方法,但有关人员可以采用不同的方法。如果采用的方法违背或偏离了本指导原则最终版本中所列的操作和程序,希望能与当局进一步讨论以防止花费了更多的资金和人力。但是,也可能在最终决定时未能被FDA所接受。本指导原则不对FDA 产生约束,而且也不对任何个人提供或授予任何权利、任何特权或任何利益。 随着FDA对法规的不断修订和各方提出的意见和对需求,本指导原则可能随时修订。 关于FDA怎样应用CGMP规范审批临床新药制备的问题已经提出过。临床人用的新药制剂定义为:如FDA-1571指出,包括药物制剂(如药物剂型)的临床用新药申请(与“新药豁免临床研究的注意事项通知”一致)通常归类于IND(21 CFR PART 312)。临床用兽用新药的定义为:临床用新药申请应包括药物制剂(如药物剂型),(21 CFR 511.1)。大部分不清楚的地方是随着药物临床试验阶段的进展,研究用新药的产品质量标准和生产方法也应随之而改变。 FDA认识到随着临床试验的推进会导致生产工艺和质量标准发生变更。分析方法可能也需要重新建立,或者在不同阶段要使用不同方法,例如配方的改变可能使过去的分析方法不再适用。所以在临床研究结束时,应更好地建立适当的分析方法,而且操作规程和控制应制定得更具体,因为上述操作规程和控制方法是基于不断得到的科
药物临床试验英文缩写
药物临床试验英文缩写 缩略语英文全称中文全称 ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应 AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者 BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者 COI Coordinating Investigator 协调研究者 CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统 EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范GCP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator’s Brochure 研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ICH International Conference on 国际协调会议 Harmonization IDM Independent Data Monitoring 独立数据监察 IDMC Independent Data Monitoring Committee 独立数据监察委员会 IEC Independent Ethics Committee 独立伦理委员会 IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会 IVD In Vitro Diagnostic 体外诊断 IVRS Interactive Voice Response System 互动语音应答系统 MA Marketing Approval/Authorization 上市许可证 MCA Medicines Control Agency 英国药品监督局 MHW Ministry of Health and Welfare 日本卫生福利部 NDA New Drug Application 新药申请 NEC New Drug Entity 新化学实体
药物临床试验设计技术规范
北京中医药大学东方医院 临床试验设计技术规范 总编制:科研处 审核:刘文娜 批准:金章安 二○○四年九月
目录 1药物临床试验方案设计技术规范............................ 2病例报告表设计技术规范.................................. 3知情同意书设计技术规范.................................. 4药物临床试验总结报告设计技术规范 ........................
药物临床试验方案设计技术规范 临床试验方案是指记录试验背景、原理及目的,描述试验设计、试验方案、试验组织、数据处理与统计分析方法以及试验过程管理的书面文件。临床试验方案设计基本要求: 1.试验方案的设计要符合代表性:是指受试对象对于患病人群的同质性,即受试对象应具有患该病人群的共同特征。 2.试验方案的设计要符合合理性:是指立题的依据、假说的建立,应具有科学性。 3.试验方案的设计要符合重复性:是指在同一条件下临床试验的重现程度。 4.试验方案的设计要符合随机性:是指受试对象应遵循“同等可能性”原则分配至试验组和对照组,且受试样本必须为随机样本。 5.应在充分了解所试验药物的临床前药理、毒理实验、临床预试验情况、处方组成与方解、工艺、质量资料及药政管理部门对申请临床试验的审查意见的基础上,制定针对性强、完善的试验方案。 6.试验方案的设计必须符合伦理道德及科学性原则,还必须满足统计学设计的要求,从而达到安全性评价与有效性评价的目的。 主要内容如下: 1.标题页:包括研究标题、临床批件号、药物名称/适应症/临床试 验的类期、申办者信息、主要研究者姓名、研究单位、方案设计者、方案版本号、方案制定与修改时间、统计分析单位、原始资料保存地点等。
临床试验常用术语缩写
专业术语 CRA Clinical Research Associate 临床监查员(临床监察员) CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表 CRO Contract Research Organization 合同研究组织 ECRF 电子化病历报告表 CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请 CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案 CTR Clinical Trial Report 临床试验报告 DSMB Data Safety and monitoring Board 数据安全及监控委员会 EDC Electronic Data Capture 电子数据采集系统 EDP Electronic Data Processing 电子数据处理系统 FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告 GCP Good Clinical Practice 药物临床试验质量管理规范 GLP Good Laboratory Practice 药物非临床试验质量管理规 GMP Good Manufacturing Practice 药品生产质量管理规范 IB Investigator's Brochure 研究者手册 IC Informed Consent 知情同意 ICF Informed Consent Form 知情同意书 ECG Electrocardiogram 心电图 ICH International Conference on Harmonization 国际协调会 IDM Independent Data Monitoring 独立数据监察 IDMC Independent Data Monitoring Committee 独立数据监察委员会 IEC Independent Ethics Committee 独立伦理委员会 IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会 IVD In Vitro Diagnostic 体外诊断 MA Marketing Approval/Authorization 上市许可证 IVRS Interactive Voice Response System 互动语音应答系统 MCA Medicines Control Agency 英国药品监督局 MHW Ministry of Health and Welfare 日本卫生福利部 NDA New Drug Application 新药申请 NEC New Drug Entity 新化学实体 NIH National Institutes of Health 国家卫生研究所(美国) PI Principal Investigator 主要研究者 PL Product License 产品许可证 PMA Pre-market Approval (Application ) 上市前许可(申请) PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会 QA Quality Assurance 质量保证 QC Quality Control 质量控制 RA Regulatory Authorities 监督管理部门 SA Site Assessment 现场评估 SAE Serious Adverse Event 严重不良事件 SAP Statistical Analysis Plan 统计分析计划 SAR Serious Adverse Reaction 严重不良反应 SD Source Data/Document 原始数据 /文件 SD Subject Diary 受试者日记 Subject identification code (SIC )受试者识别代码 SFDA State Food and Drug Administration 国家食品药品监督管理局 SDV Source Data Verification 原始数据核准 SEL Subject Enrollment Log 受试者入选表 SI Sub-investigator 助理研究者 SI Sponsor-Investigator 申办研究者 SIC Subject Identification Code 受试者识别代码 pd pharmacodynamics 药物效应动力学 SOP Standard 缩略语 英文全称 中文全称 ADE Adverse Drug Event 药物不良事件 AE Adverse Event 不良事件 BMI Body Mass Index 体质指数 COI Coordinating Investigator 协调研究者 ADR Adverse Drug Reaction 药物不良反应 AI Assistant Investigator 助理研究者 CI Co-investigator 合作研究者
