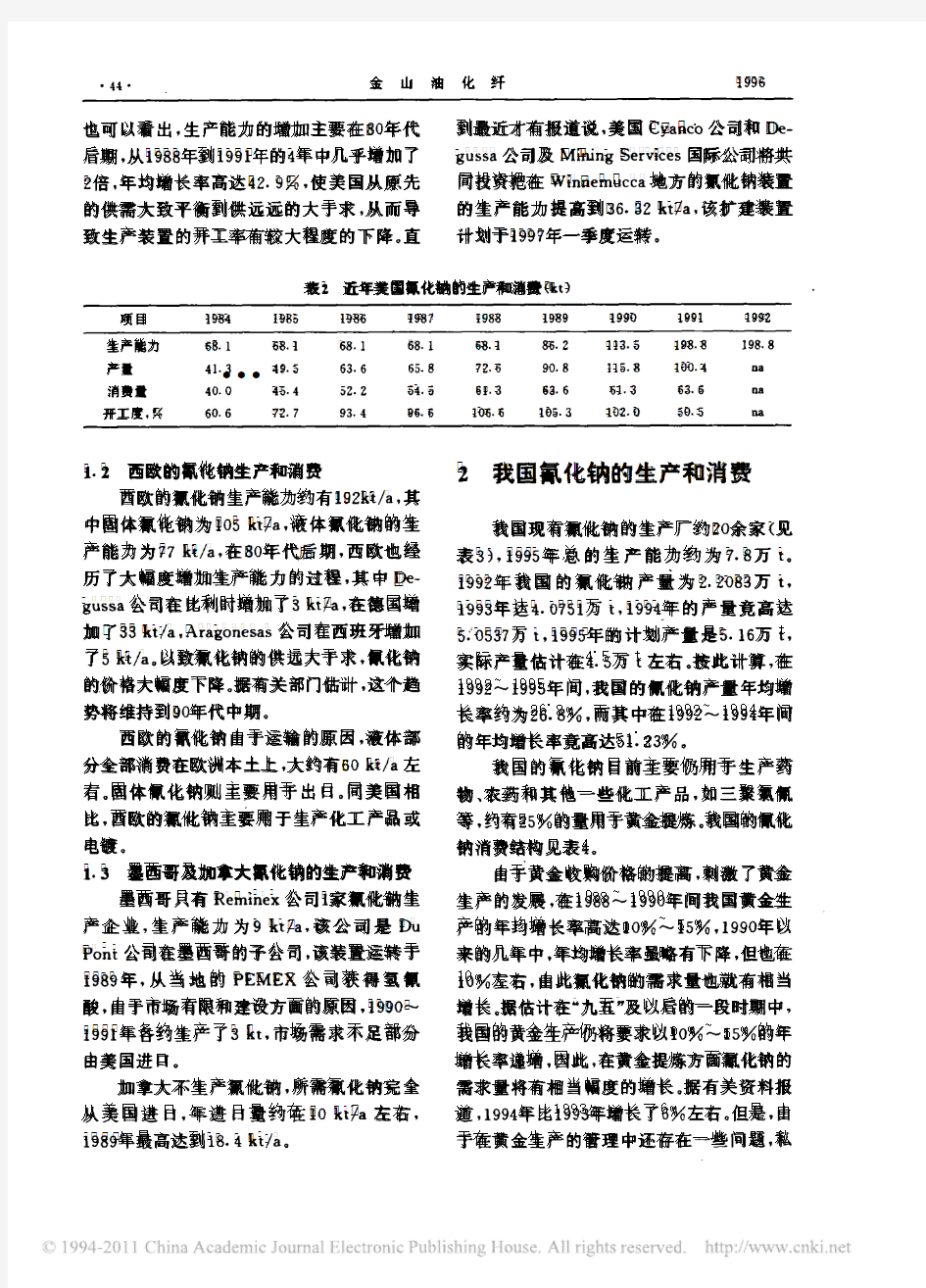
国内外氰化钠的生产和消费

氰化法提金的基本原理
氰化法提金的基本原理? (2006-1-10) 氰化法提金的基本原理?氰化法提金浸出的主要影响因素? 氰化法提金是从金矿石中提取金的主要方法之一。氰化物对金溶解作用机理的解释目前尚不一致,多数认为金在氰化溶中有氧存在的情况下可以生成一 种金的络合而溶解其基本反应式为: 4Au+8KCN+O 2+2H 2 O— 4KAu(CN) 2 +4KOH 一般认为金被氰化物溶解发生两步反应: 2Au+4KCN+O 2+2H 2 O— 2(CN 2+H 2 O+2KOH 2Au+4KCN+O 2 +H 2 O 2 —2KAu(CN) 2 +2KOH 金的表面在氰化物溶液中逐渐地由表及里地溶解。溶液中氧的浓度与金的溶解速度有关. 浸出时氰化物浓度一般为,金的溶解速度随氰化物浓度的提高而呈直线上升到最大值。然后缓慢上升,当氰化物浓度达时,金的溶解速度和氰化物浓度无关,甚至下降(因氰化物水解)。 金的溶解速度随氧浓度上升而增大,采用富氧溶被或高压充气氰化可以强化金的溶解。氰化试剂溶解金银的能力为:氰化铵>氰化钙氰化钠>氰化钾。氰化钾的价格最贵,目前多数使用氰化钠,氰化物的耗量取决于物料性质和操作因素,常为理论量的20-200倍. 物料性质影晌金的浸出率。氰化法虽是目前提金的主要方法,但某些含金矿物原料不宜直接采用氰化法处理,若矿石中铜、砷、锑、铋、硫、磷、磁铁矿、白铁矿等组分含量高时将大大增加氰化物耗量成消耗矿桨中的氧。降低金的浸出率,矿石中含碳高时,碳会吸附已溶金而随尾矿损失。预先氧化焙烧或浮选方法可除去有害杂质的影晌。氰化物水解反应为:KCN+H 2 OyKOH+HCN因此会挥发出有毒的HCN;加入石灰是氰化物水解减弱,上式反应向左方向进行,减少氰化物的损失。石灰还有中和酸类物质作用并可沉淀矿浆中得有害离子,使金的溶解处于最佳条件,常用石灰作保护碱。石灰加入量使矿浆值达到11~12 为宜,矿浆lang=EN-值过高时对溶金不利。金粒大小主要影晌氰化时间,粗拉金(>74微米)的溶解速度慢。所以氰化前采用混汞、重选或浮选预先回收粗粒金是合理的。在磨矿过程中使细金粒充分单体解离仍是提高金的浸出率重要因素。 氰化时矿泥含量和矿浆浓度直接影晌组分扩散速度。矿浆浓度应小于 30~33%。矿泥多时矿浆浓度应小于22-25%,但浓度不宜过低,否则增加氰化物的消耗。 氰化时间取决于物料性质、氰化方式及氰化条件而异。一般搅拌氰化浸出时
氰化钠生产工艺
2.5.1 氰化钠生产工艺 我国目前生产氰化钠产品的工艺方法主要有四种:氨钠法、安氏法、丙烯腈副产法、轻油裂解法。本项目中采用轻油裂解法,此工艺技术成熟可靠,操作安全,行之有效,是目前国内大部分生产氰化钠企业采用的工艺路线。 轻油裂解法工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用30%液碱溶液吸收,当NaCN含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。 此工艺方法的特点: (1)C5-C6轻油性质稳定,且以石油焦为载体,反应温度高。轻油的工艺利用率为100%,液氨的工艺收率为90%以上。 (2)采用循环封闭式的生产方法,系统生产连续化,坚持微负压操作,确保无泄漏操作,反应安全。 (3)此工艺生产工序简单明了,生产技术装备较简单。 整个装置分为原料储运系统、反应裂解系统、炉气处理系统、成品吸收系统以及废水、废渣处理系统。 工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,温度1C o 450,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用
30%液碱溶液吸收,当NaCN 含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。 其主要反应方程式如下: C 5H 12+5NH 3 电弧 C o 14505HCN+千卡 HCN + NaOH NaCN+H 2O 工艺流程示意图如图3-1所示: 图3-1 工艺流程示意图 2.5.2 主要设备及布置 主要设备见表2-3: 表2-3主要设备一览表
氰化钠安全管理制度正式样本
文件编号:TP-AR-L6739 There Are Certain Management Mechanisms And Methods In The Management Of Organizations, And The Provisions Are Binding On The Personnel Within The Jurisdiction, Which Should Be Observed By Each Party. (示范文本) 编制:_______________ 审核:_______________ 单位:_______________ 氰化钠安全管理制度正 式样本
氰化钠安全管理制度正式样本 使用注意:该管理制度资料可用在组织/机构/单位管理上,形成一定的管理机制和管理原则、管理方法以及管理机构设置的规范,条款对管辖范围内人员具有约束力需各自遵守。材料内容可根据实际情况作相应修改,请在使用时认真阅读。 一、氰化钠化验安全管理 1、氰化钠进厂后,要由专管人员开具请验单, 由化验室派专门人员去氰化钠仓库取样。 1.1取样时要由专管人员和投料人员一起到现场 监督取样。 1.2取样的数量、取样时间、结存量、取用人、 核对人、用途等项目要注册清楚。 1.3取好样后,要清理好现场,方可离开,由投 料人员护送到化验室进行化验。 2、化验过程要由投料人员监督,氰化钠的分析 过程中严禁在酸性条件下工作,以免产生有毒气体,
危害人们的健康,化验结束应由化验人员和投料人员双方签字。 3、化验完毕所剩下的氰化钠要由投料人员护送回仓库,并登记清楚,化验过程中所用容器和现场都应清理,消毒清楚,分析后的母液要倒入处理缸中处理,不能乱倒,最后开好报告单,送交给仓库保管员。 二、液体氰化钠卸料安全管理 1、液体氰化钠槽车到厂后,投料人员接仓库管理员通知后,打开投料室,用取样瓶从槽车中取好样放回投料室,关好(锁好)投料室铁门(注:整个过程必须有 2 名投料人员在场)。 2、凭送检单通知质检科取样化验,化验人员取好样品后,投料员把多余的液体氰化钠倒入地缸,锁好大门,一名投料员跟随化验员到化验室。
轻油裂解法生产氰化钠的危险性分析
轻油裂解法生产氰化钠的危险性分析 氰化钠属剧毒危险化学品,主要用于冶金、电镀、医药及一些精细化工生产。轻油裂解法生产氰化钠是我国研究开发的生产工艺,为目前国内部分中小企业所采用。由于该生产工艺中采用的原料、中间产品和最终产品多为易燃易爆或剧毒有害物质,生产操作中潜在的危险性较大,加之有些中小企业资金短缺,设备简陋,人员素质低下,事故隐患很多。因此,有必要对其安全性进行深入分析,采取有效措施控制和减少事故发生。 一、生产工艺简介 轻油裂解法生产氰化钠工艺流,主要原料为轻油(或汽油)、液氨和烧碱。产品为液体氰化钠(简称液氰)、固体氰化钠(简称固氰)。生产过程主要分为三个阶段:氰化氢气体的制备与净化、液氰制备、固氰制备。 1.氰化氢气体的制备与净化 液氨经汽化器汽化后与汽油在文丘里管中混合,然后通过预热器加热到250℃~280℃进入裂解炉底部。炉内三相石墨电极浸入石油焦粒沸腾床层中,由于大电流导电发热作用,原料气在1450℃高温、微负压条件下发生裂解反应: CnH2n+n+nNH3→nNCN+(2n+1)H2 2NH3→N2+3H2 CnH2n+2→nC+(n+1)H2 生成以氰化氢、氢气为主并含有少量氮气和炭粉的裂解物,经换热冷却及旋风、布袋除尘器先后脱除炭粉,得到纯净裂解炉气。 2.液氰制备
纯净裂解炉气通入中和罐,与其中的液体氢氧化钠发生中和反应: HCN+NaOH→NaCH+H2O 生成液氰。未反应的气体进入尾气吸收罐用液碱进一步吸收后,通过真空泵排至烟囱。尾气的主要成分是氢气。 3.固氰制备 液氰被送入节发器中,在负压条件下加热蒸发,蒸出的水蒸气用水冷凝,不凝气用真空泵抽送至烟囱。经蒸发浓缩后的母液进入结晶器,用水冷却降温,固液混合物排放到离心机中进行固液分离,固体产品称重装桶。为进一步减少固氰含水量,有的厂家在离心分离后增加一道烘干除水工序。 二、生产过程的危险性分析 1.火灾爆炸危险性 生产中火灾爆炸危险性大且数量钦的物料主要有汽油、氨、氢气、氰化氢。其部分理化参数如表1所示。 表1 主要火灾爆炸危险物料的燃烧爆炸相关参数表 汽油库、氨库、高位汽油箱、氨氧化器中储存有较多的易燃易爆物质,正常情况下就有可燃蒸气散发出来。若设备、设施存在隐患或操作不当,可能发生化学性爆炸。
氰化钠生产工艺
氰化钠生产工艺 我国目前生产氰化钠产品的工艺方法主要有四种:氨钠法、安氏法、丙烯腈副产法、轻油裂解法。本项目中采用轻油裂解法,此工艺技术成熟可靠,操作安全,行之有效,是目前国内大部分生产氰化钠企业采用的工艺路线。 轻油裂解法工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用30%液碱溶液吸收,当NaCN含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。 此工艺方法的特点: (1)C5-C6轻油性质稳定,且以石油焦为载体,反应温度高。轻油的工艺利用率为100%,液氨的工艺收率为90%以上。 (2)采用循环封闭式的生产方法,系统生产连续化,坚持微负压操作,确保无泄漏操作,反应安全。 (3)此工艺生产工序简单明了,生产技术装备较简单。 整个装置分为原料储运系统、反应裂解系统、炉气处理系统、成品吸收系统以及废水、废渣处理系统。 工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,温度1C o 450,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用
30%液碱溶液吸收,当NaCN 含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。 其主要反应方程式如下: C 5H 12+5NH 3 电弧 C o 14505HCN+千卡 HCN + NaOH NaCN+H 2O 工艺流程示意图如图3-1所示:
危险化学品物料的危险、有害性分析 3.1.1 危险化学品识别 XXXXXXXXX公司生产氰化钠(30%液体)产品中,使用的原料列入国家安全生产监督管理局2003年第1号公告《危险化学品名录》的有: 氰化钠、氰化氢、氢气、氢氧化钠、液氨等6种。 根据GB50016《建筑设计防火规范》、GB50160《石油化工企业设计防火规范》、GB5044《职业性接触毒物危害程度分级》、HG24001《化工行业职业性接触毒物危害程度分级》等规范和标准,上述危险化学品分类编号及其火灾危险、职业危害汇总于表3-1。 表3-1 产品及原料危险、危害特性 系统内物质按《建筑设计防火规范》的火灾危险性分类,属于甲类物质的有氰化氢、氢气,这些物质火灾危险性最大;氨为乙类物质。 系统内会产生职业危害物质:属极度危害(Ⅰ级)的有氰化氢和氰化钠;轻度危害(Ⅳ级)的有氢氧化钠和液氨。 氰化氢和液氨属于腐蚀品,对人体会造成灼烫伤害。 分析结果:系统内危险化学品涉及易燃液体、有毒品和腐蚀品,其
氢氰酸生产工艺
氢氰酸生产工艺 1、氢氰酸的用途 氰化氢HCN亦名无水氢氰酸。是一种剧毒化学品在常温常压下极易扩散。 这种性质使它在运输和使用中受到限制,甚至还可能被恐怖分子用来危害人类。鉴于这些,主要的氢氰酸生产国家开始对氢氰酸的生产和使用进行了严格的限制。 在美国一些主要道路上已被禁止运输氢氰酸,一些出口商必须从相关政府获得出口证书,同时保证它的合法使用才可以出口。 氢氰酸的用途很广,可用于制造尼龙、杀虫剂、丙烯腈和丙烯酸树脂、金银铜等的电镀、金银等的采矿业、制药灭鼠药、有机合成等离子蚀刻等。 尤其是已二醇和甲基丙烯酸酯树脂,对氢氰酸的需求就显示出很大的市场强劲。仅在美国2007年对氢氰酸的需求量将达84.8万吨,就世界范围来说全世界氢氰酸年产量约120万吨左右,且每年以1~1.5的速度递增,其中74%来源于直接法生产,其余来自丙烯腈的副产。 为了确保使用安全、减少对环境的影响、提高生产效率、合理利用资源,必须加快对氢氰酸合成技术与生产工艺的研究,以满足不断增长的市场需求。 2、氢氰酸生产工艺 生产HCN的传统工艺主要有Andrussow法以及由它引出的一系列氨氧化法、BMA 法、丙烯腈副产法、轻油裂解法。 在国外主要使用直接法,也就是Andrussow法。 我国主要采取丙烯腈副产法生产氰化氢。主要氢氰酸生产企业有上海石化股份有限公司、大庆石化总厂、抚顺石化公司、河北诚信、安徽曙光等。 2.1、安氏法 氨氧化法就是在氨氧化催化剂的存在下,将氨源和氧源以及可氨氧化的有机物高温转化为氰化物的方法。 最传统的氨氧化法是Andrussow法,是由德国I.G公司安德罗索夫(L.Andrussow)提出,并在德国首先实现工业化生产氢氰酸的一种方法。 Andrussow法亦称安氏法或直接法,采用的主要原料是甲烷、氨气和氧气,故又叫甲烷氨氧化法。它是20世纪50年代完成的工业生产方法,是生产氢氰酸的主要方法。
氰化钠安全管理制度范本
内部管理制度系列 氰化钠安全管理制度(标准、完整、实用、可修改)
编号:FS-QG-43804氰化钠安全管理制度 Sodium cyanide safety management system 说明:为规范化、制度化和统一化作业行为,使人员管理工作有章可循,提高工作效率和责任感、归属感,特此编写。 一、氰化钠化验安全管理 1、氰化钠进厂后,要由专管人员开具请验单,由化验室派专门人员去氰化钠仓库取样。 1.1取样时要由专管人员和投料人员一起到现场监督取样。 1.2取样的数量、取样时间、结存量、取用人、核对人、用途等项目要注册清楚。 1.3取好样后,要清理好现场,方可离开,由投料人员护送到化验室进行化验。 2、化验过程要由投料人员监督,氰化钠的分析过程中严禁在酸性条件下工作,以免产生有毒气体,危害人们的健康,化验结束应由化验人员和投料人员双方签字。 3、化验完毕所剩下的氰化钠要由投料人员护送回仓库,
并登记清楚,化验过程中所用容器和现场都应清理,消毒清楚,分析后的母液要倒入处理缸中处理,不能乱倒,最后开好报告单,送交给仓库保管员。 二、液体氰化钠卸料安全管理 1、液体氰化钠槽车到厂后,投料人员接仓库管理员通知后,打开投料室,用取样瓶从槽车中取好样放回投料室,关好(锁好)投料室铁门(注:整个过程必须有2名投料人员在场)。 2、凭送检单通知质检科取样化验,化验人员取好样品后,投料员把多余的液体氰化钠倒入地缸,锁好大门,一名投料员跟随化验员到化验室。 3、化验员化验时,投料员在旁监督,直到化验结果出来;化验员、投料员双人签字,方可回车间卸料。 4、卸料时,2名投料人必须同时在场,一名投料员操作,另一名投料员在旁监护。投料员应先把槽车里的液体氰化钠打入或放入槽区内的地缸,再用液下泵把地缸的氰化钠抽入贮槽。为了防止直接接触氰化钠,操作时,投料员应使用个人防护用品(如橡胶手套、防毒口罩等)。卸料过程中,同时
氰化钠安全管理制度标准版本
文件编号:RHD-QB-K6739 (管理制度范本系列) 编辑:XXXXXX 查核:XXXXXX 时间:XXXXXX 氰化钠安全管理制度标 准版本
氰化钠安全管理制度标准版本 操作指导:该管理制度文件为日常单位或公司为保证的工作、生产能够安全稳定地有效运转而制定的,并由相关人员在办理业务或操作时必须遵循的程序或步骤。,其中条款可根据自己现实基础上调整,请仔细浏览后进行编辑与保存。 一、氰化钠化验安全管理 1、氰化钠进厂后,要由专管人员开具请验单,由化验室派专门人员去氰化钠仓库取样。 1.1取样时要由专管人员和投料人员一起到现场监督取样。 1.2取样的数量、取样时间、结存量、取用人、核对人、用途等项目要注册清楚。 1.3取好样后,要清理好现场,方可离开,由投料人员护送到化验室进行化验。 2、化验过程要由投料人员监督,氰化钠的分析过程中严禁在酸性条件下工作,以免产生有毒气体,
危害人们的健康,化验结束应由化验人员和投料人员双方签字。 3、化验完毕所剩下的氰化钠要由投料人员护送回仓库,并登记清楚,化验过程中所用容器和现场都应清理,消毒清楚,分析后的母液要倒入处理缸中处理,不能乱倒,最后开好报告单,送交给仓库保管员。 二、液体氰化钠卸料安全管理 1、液体氰化钠槽车到厂后,投料人员接仓库管理员通知后,打开投料室,用取样瓶从槽车中取好样放回投料室,关好(锁好)投料室铁门(注:整个过程必须有2 名投料人员在场)。 2、凭送检单通知质检科取样化验,化验人员取好样品后,投料员把多余的液体氰化钠倒入地缸,锁好大门,一名投料员跟随化验员到化验室。
3、化验员化验时,投料员在旁监督,直到化验结果出来;化验员、投料员双人签字,方可回车间卸料。 4、卸料时,2 名投料人必须同时在场,一名投料员操作,另一名投料员在旁监护。投料员应先把槽车里的液体氰化钠打入或放入槽区内的地缸,再用液下泵把地缸的氰化钠抽入贮槽。为了防止直接接触氰化钠,操作时,投料员应使用个人防护用品(如橡胶手套、防毒口罩等)。卸料过程中,同时应注意防止地缸氰化钠溢出(如有溢出, 投料员应把地凹中的液氰扫入地缸,然后用漂白粉清洗)。 5、卸完料后,通知质检科取样化验,化验员到后,投料员从贮槽人孔中取小瓶液体氰化钠,让化验员取好小样后(样品为0.6g 左右),把多余的液体氰化钠倒入地缸锁好贮槽取样人孔。用漂白粉清洗取
金属钠的应用及生产工艺
金属钠的应用及生产工艺 张 莉1,王树轩2 (11青海省计量测试研究所,青海西宁 810001;21中国科学院青海盐湖研究所,青海西宁 810008) 摘要:介绍了金属钠的应用和生产工艺,并结合青海盐湖资源综合开发现状,分析了建设金属钠装置的优势及可行性。 关键词:金属钠;工艺;装置 中图分类号:T Q11016 文献标识码:B 文章编号:1006-8996(2006)04-0096-02 1 金属钠的应用 111 用途 金属钠主要用于生产含铅汽油添加剂和石油脱硫剂、氧化剂、漂白剂、染料、农药、医药中间 体、催化剂、香料、有机化合物生产用的钠化合物。此外,难熔金属生产和核反应堆也有少量消费。 [1]金属钠生产铅钠合金,进而生产抗爆剂四乙基铅是其主要的传统用途。金属钠法生产三苯膦即三 苯基膦(TPP )主要用于石油化工生产催化剂和医药工业的原料。[1]硼氢化钠是良好的还原剂,性能稳定 且具有选择性,主要用作醛类、酮类、酰氯类还原剂、塑料的发泡剂和医药中间体等,此外还用作高能燃 料、机制纸的漂白剂及造纸工业含汞污水处理等。目前我国硼氢化钠的应用已逐渐广泛。[2]叠氮化钠主 要由金属钠生产,其最大的用途就是生产安全气囊,为车祸、空难等事故提供安全保护。此外,叠氮化钠还用于多种有机和无机物的生产合成,是一种前景广阔的钠化合物产品。钠硫蓄电池是一种高温(300 ~350℃ )蓄电池,由于其充放电时无副反应,理论上充放电效率为100%,与常用的铅蓄电池相比,其优越性要大的多,因而是本行业的发展方向。[3]在核能利用方面,金属钠可作为核反应堆的冷却剂。难熔 金属如钛(熔点1725℃)、锆(1857℃)、铌(2468℃ )的冶炼中,常采用金属钠作还原剂。112 消费现状与预测 目前金属钠的消费中,靛兰生产占60%~70%,医药中间体30%~40%,农药和核反应堆用量约占5%。2004年靛兰产量419万吨(实际产量可能还大些),同比增长2516%,对金属钠需求量2125万吨;医药中间体消耗金属钠116万吨;加上农药和核反应堆的用量,以及0175万吨的净出 口量,2004年金属钠的消费量在416万吨以上,而国内实际产量只有414万吨。 [4]随着我国工业发展和结构调整,金属钠消费和需求集中在以下几个领域。①氰化钠生产。我国金矿属于低品位贫矿床,冶炼黄金每年需氰化钠4~5万吨,氨法生产每吨氰化钠需消耗钠约500千克[3]。由于丙烯腈工业副产的HC N 绝大部分以NaC N 回收,因此氨法生产氰化钠将不会再有大的发展。②靛兰染料。靛兰燃料生产是金属钠的最大用户,我国是靛兰染料出口大国,加入WT O 以后,靛兰染料出口大幅度增加,外贸部门对靛兰染料敞开收购,靛兰染料吨产品消耗金属钠01503吨[5]。预计2006年靛兰产量将达到10万吨以上,消耗金属钠量在415万吨左右[4]。③甲醇钠、乙醇钠。我国制药工业近年 来发展迅速,需要消耗大量甲醇钠、乙醇钠等中间体,主要由金属钠制造。[5]除个别厂家采用碱法生产的 甲醇钠、乙醇钠产品外,绝大多数均采用金属钠生产,目前对金属钠需求量在112~115万吨/年左右。④氢化钠、硼氢化钠、硼氢化钾。氢化钠、硼氢化钠、硼氢化钾是重要的还原剂,在有机合成和医药合成中有着广泛用途,随着国内外有机化学工业的快速发展,用量大幅度增加。目前,国内用量较小,主要消费渠道是出口,年耗金属钠1500余吨。⑤四乙基铅。由于含铅汽油已基本被淘汰,铅钠合金和四乙基铅在燃油领域的用量已极度萎缩,但在化工等领域尚有少量用途。⑥其它精细化工。金属钠作为化学试 收稿日期:2006-04-29 作者简介:张 莉(1964— ),女,山西临汾人,工程师。第24卷 第4期2006年8月 青海大学学报(自然科学版)Journal of Qinghai University (Nature Science ) Vol 124No 14Aug 12006
乙醛生产工艺技术
乙醛生产工艺技术 制备原理: 通过控制乙醇的氧化可以获得乙醛。目前最重要的乙醛合成法是Wacker法。利用 PdCl2、CuCl2作催化剂,使空气和乙烯与水反应生成乙醛。 生产方法: 瓦克法(Wacker process),又称Hoechst-Wacker法,最早是指乙烯在含有四氯钯酸盐催化剂的水中,被空气中的氧气氧化为乙醛的反应。[1][2][3][4][5][6] 这是第一个工业化的有机金属(有机钯)反应,亦是均相催化和配位催化中很重要的一个反应,在1960年代后发展很快,在石油化工发达的国家已大幅取代了乙炔水合法,用于从烯烃制取醛、酮类。反应中的钯配合物与烯烃配合物蔡氏盐类似,不过后者是一个异相催化剂。 此反应形式上与氢甲酰化反应类似,都是工业上用于醛类的反应。但两者不同的是,氢甲酰化所用的是铑基催化剂,而且氢甲酰化是一个增碳过程。 还有一种方法,就是在汞盐(如HgSO4)的催化下,乙炔和水化合,生成乙醛。这种方法生产的乙醛纯度高,但操作人员容易发生汞中毒。现在科学家们正在研究用非汞催化剂,并已取得初步成效。 2003年的全球乙醛产量约106吨/年,[6]而主要的生产方法为Wacker过程,即通过氧化乙烯制备: 2CH2=CH2+O2→2CH3CHO 除此法之外,还可以通过在汞盐的催化下水解乙炔形成烯醇异构化得到乙醛。在Wacker 过程发明之前,该合成方法也作为主要的生产工艺[7]乙醛还可小规模的通过乙醇的脱氢反应和氧化反应进行制备。有些乙醛还可通过一氧化碳的氢化加成得到,但是该法无法用于商用生产。
这一反应很容易发生,将乙烯和空气通入含有铜盐的氯化钯(Ⅱ)-盐酸水中,乙烯几乎全部转化为乙醛。而氯化钯则被还原为钯,在氯化铜的作用下得到再生。氯化铜被还原生成的氯化亚铜又可被空气、纯氧或其他氧化剂再氧化为二价铜。这一过程形式上可以表示为: 工艺流程: 乙烯均相络合催化氧化制乙醛 以PdCl2-CuCl2为催化剂在水溶液中对烯烃进行氧化,生成相应的醛或酮的方法称为瓦克(Wacker)法。这是一种液相氧化法,由于反应在液相中进行,使用的又是络合催化剂,故又称作均相络合催化氧化法。氧化最容易在最缺氢的碳上进行,对乙烯而言, 两个碳原子都具有两个氢,氧化时双键打开同时加氧,得到乙醛:
氰化钠化学品安全技术说明书2018
氰化钠化学品安全技术说明书 第一部分化学品及企业标识 化学品中文名:氰化钠 化学品英文名:Sodium cyanide 企业名称: 企业地址: 邮编:传真: 联系电话: 企业应急电话: 产品推荐及限制用途:用于提炼金、银等重金属和淬火,并用于塑料、农药、染料等有机合成工业。: 第二部分危险性概述 紧急情况概述:不燃。受高热或与酸接触会产生剧毒、易燃的氰化氢气体。与硝酸盐、亚硝酸盐、氯酸盐反应剧烈,有发生爆炸的危险。在潮湿空气或二氧化碳中即缓慢发出微量氰化氢气体。 GHS危险性类别:根据《化学品分类和危险性公示通则》(GB 13690-2009)及《化学品分类和标签规范》(GB 30000-2013),该产品属于急性毒性-经口,类别2急性毒性-经皮,类别1皮肤腐蚀/刺激,类别3严重眼损伤/眼刺激,类别2A生殖毒性,类别2特异性靶器官毒性-反复接触,类别1危害水生环境-急性危害,类别1危害水生环境-长期危害,类别1
标签要素: 象形图: 警示词:危险 危险性说明:吞咽致命、皮肤接触致命、怀疑对生育能力或胎儿造成伤害、长期或反复接触可致器官损害、对水生生物毒性极大并且有长期持续影响。 防范说明: 预防措施: 避免吸入粉尘、烟气、气体、烟雾、蒸汽、喷雾;避免接触眼睛、皮肤或衣服;操作后彻底清洗;作业场所不得进食、饮水或吸烟;戴防护手套、穿防护服;得到专门指导后操作。在阅读并了解所有安全预防措施之前,切勿操作;按要求使用个体防护装备;禁止排入环境。事故响应: 食入:立即呼叫中毒控制中心或就医。 皮肤接触:用大量肥皂水和水轻轻地清洗。立即呼叫中毒控制中心或就医。立即脱去所有被污染的衣服。被污染的衣服须经洗净后方可重新使用。如发生皮肤刺激,就医。 如眼镜接触:用水细心地冲洗数分钟。如带隐形眼镜并可方便地取出,则取出隐形眼镜,继续冲洗。如果眼睛刺激持续:就医。 如果接触或有担心,就医。如感觉不适,就医。
有关氰化钠使用的安全教育内容及要求
氰化钠安全教育内容及要求 一、氰化钠的危害性: 氰化物进入人体的途径主要有三种,一是从呼吸道吸入氰化氢气体或含氰化物的粉尘,二是通过口腔进入胃中,此时口腔粘膜和胃肠道吸收,三是破损的皮肤与氰化物接触直接进入血液,潮湿的皮肤与高浓度的氰化物接触时,也会吸收氰化物导致中毒。 1、吸入氰化氢气体的危害 氰化钠是我矿黄金生产的必需品,有剧毒,对人及动物的危害性很强,其特点是毒 性大、作用快。尤其是氰化氢剧毒气体的作用极为迅速。在氰化氢浓度高(0.1mg/L)的空气中,人将立即死亡或速死。在氰化物为中等浓度时,人在2~3分钟内就会出现初期症状,大多数情况下,在1小时内死亡,有时也有在24小时后才出现死亡的刺激皮肤和通过皮肤吸收,亦有生命危险。在高温下,特别是和刺激性气体混合而使皮肤血管扩张时,由于容易吸收HCN,所以更危险。 2、误服氰化钠的危害。 误服0.1克氰化钠就可使人立即死亡,0.2克氰化钠就可以毒死一头大象。牛一次摄入氰化物的致死量为0.39~0.92g,羊为0.04~0.10g,马为0.39g,狗为0.03~0.04g, 3、吸入微量粉末或者皮肤长时间接触的危害 吸入微量粉末,或者皮肤长时间接触也可导致中毒,特别是皮肤有伤口或擦破时会严重中毒。 4、人对中低浓度氰化氢气体(HCN)的反应 HCN浓度(ppm)发生的反应 5~18 头痛、眩晕 5~13 疲劳、头痛、无力、手、脚震颤并疼痛、恶心 4.2~12.4(平均8.3) 头痛、虚弱、嗅、味觉改变,喉头刺激、恶心、呕吐、呼吸加快 2~8(平均5) 甲状腺增大,血尿SCN-含量增加,但仍低于吸烟者 5、由于氰化物中毒途径的不同,导致的危害程度也不一样。氰化钠中毒对人生理系统的危害 ①神经系统 由于CN-可使神经纤维蜕髓鞘现象和脑组织坏死及空泡变性等退行性病变发生,所以可出现头痛、眩晕、注意力分散、健忘、无力、睡眠障碍、视力减退并出现五彩视、皮肤感觉异常、性功能减退,还可发生热带性神经病变,弥漫性神经退行性疾病侯群。由于视神经萎缩,神经性耳聋及影响骨髓感觉神经而引起共济失调等,如患烟草性弱视神经萎缩等疾病。 ②呼吸和消化系统 咳嗽、呼吸急促、有窒息感。嗅觉和味觉改变,恶心、呕吐、胃灼热感及胸腹都有压迫感。异氰酸酯类可引起过敏性哮喘。这类症状休息后大部分可消失,严重者还发生胃炎和肝脾肿大。 ③心血管系统 ④心动过速或过缓、心悸、心前区疼痛、血管紧张力降低及血循环变慢,心音低钝,血压普遍降低,部分人可出现心电图变化。 ⑤肌肉和皮肤
乙二醛的生产工艺及技术进展分析
乙二醛的生产工艺及技术进展分析 目前,乙二醛的生产方法较多,有乙炔氧化法、乙烯氧化法、草酸还原水解法、乙二醇气相氧化法及乙醛硝酸氧化法等。其中工业生产方法主要有乙二醇气相氧化法和乙醛硝酸氧化法两种。 2.1. 乙二醇气相氧化法 乙二醇气相氧化法是生产乙二醛的传统方法,目前我国的乙二醛生产厂家均采用该方法进行生产。乙二醇预热气化后,与循环气混合进入催化反应器,在650-670℃下反应,产物以水激冷,形成乙二醛水溶液,再经过脱色、真空吸滤等后处理过程得到乙二醛产品。乙二醇的单程转化率为80%-85%。以尾气循环量来调节含氧量,产品含乙二醛的浓度一般为30%-40%。该法原料乙二醇易得、工艺流程短、过程简单,不足之处是产品质量较差,含有一定量的甲醛、醇和酸等杂质,需要经过进一步的纯化处理,才能满足医药等行业的质量要求。 目前,乙二醇气相氧化法制备乙二醛的技术进展,主要表现在新型催化剂的研制以及后处理两个方面。 2.1.1催化剂的研究 对乙二醇法氧化部分的研究主要是对催化剂的研究,提高乙二醇的转化率和生成乙二醛的选择性,降低甲醛的生成。所用催化剂主要有磷-铜催化剂和电解银催化剂。磷-铜催化剂具有来源广、价格低、收率高等优点(收率在50%以上),最初国内生产厂家大多采用该催化剂,但该催化剂副反应多、质量差、乙二醇消耗高。电解银催化剂是一种较理想的催化剂,国内湖南衡阳第二化工厂曾采用,其产品各项质量指标明显优于磷-铜催化产品,但成本较高。 大连轻化工研究所研制的磷锡铜催化剂与磷-铜催化剂相比,在空速、乙二醇与空气(或氧气)物质的量比基本相同条件下,具有反应时间短、温度低、得
率高的优点,尤为突出的是转化为甲醛的量仅为磷-铜催化剂的1/10-1/15。另外,还研制开发出银-磷催化剂,研究表明,在乙二醇进料速度3 L/min,反应温度600℃,乙二醇浓度90%,空气流量3 000 m3/h时,采用磷-银催化剂,可以使乙二醛收率达到80%以上。 复旦大学邓景发等发明了一种银-磷催化剂,该催化剂是将电解银浸渍于磷酸或磷酸钠盐中,再干燥、焙烧制得或将磷蒸汽缓慢通到灼热的电解银上制得。将该催化剂用于乙二醇制备乙二醛的反应中,当反应温度为550℃,乙二醇、氧、氮和水的分子比为1∶1.5∶80∶34时,乙二醛的收率为81.4%,二氧化碳的收率为13.3%。采用该催化剂,在乙二醇溶液中不需要再添加磷化合物,在制醛过程中,催化剂中的磷不会产生损失,而且催化剂的使用寿命较长,经过22 d试验,发现催化剂的活性和选择性均没有发生变化,另外,使用该催化剂,原有的生产设备也无需进行改动。 湖北恒日化工股份有限公司段小六等开发出一种由乙二醇氧化生产乙二醛的银/磷/硒复合催化剂。该催化剂的制备是将电解银用30%的磷酸浸渍8 h,在120-150℃条件下干燥制得银-磷催化剂,再加入0.06%的稀土金属硒,然后在500-600℃下焙烧、造粒制得银/磷/硒复合催化剂。将空气、循环气、惰性气体经过混合后,与乙二醇一起进入混合过滤器,经过净化混合,进入置有银/磷/硒复合催化剂的催化床进行氧化催化反应,反应生成的气体经过急冷后送入吸收塔反复吸收,得到乙二醛水溶液,再分别用活性炭、阴离子树脂、阳离子树脂脱色、过滤得产品。催化床置有的银/磷/硒催化剂的质量百分组成分别为99.8、0.14和0.6,催化反应温度为590-610℃,反应气急冷到200-250℃送入吸收塔反复吸收,可以得到含量为39.5%-40.5%的乙二醛水溶液。采用该催化剂催化氧化乙二醇的反应中,银表面有两个活性中心,一种能催化醇生成醛,另外一种能使醇深度氧化生成副产物二氧化碳。而加入磷后,含磷化合物与银表面通过强相互作用,在表面某些位置上形成一稳定的表面化合物,消除了部分引起醇深度氧化的银表面活性中心,因此磷的加入提高了反应的选择性。再加入稀土金属硒,使催化剂的选择性能得到进一步的提高,反应活性好,还可以保护乙二醇氧化生成乙二醛后不被深度氧化而生成酸,从而对生成的醛起到保护作用。与银-磷催化剂相比,
氰化法提金的基本原理1121212
氰化法提金的基本原理?888 (2006-1-10) 氰化法提金的基本原理?氰化法提金浸出的主要影响因素? 氰化法提金是从金矿石中提取金的主要方法之一。氰化物对金溶解作用机理的解释目前尚不一致,多数认为金在氰化溶中有氧存在的情况下可以生成一种金的络合而溶解其基本反应式为:4Au+8KCN+O2+2H2O— 4KAu(CN)2+4KOH 一般认为金被氰化物溶解发生两步反应: 2Au+4KCN+O2+2H2O— 2(CN2+H2O+2KOH 2Au+4KCN+O2+H2O2—2KAu(CN)2+2KOH 金的表面在氰化物溶液中逐渐地由表及里地溶解。溶液中氧的浓度与金的溶解速度有关. 浸出时氰化物浓度一般为,金的溶解速度随氰化物浓度的提高而呈直线上升到最大值。然后缓慢上升,当氰化物浓度达时,金的溶解速度和氰化物浓度无关,甚至下降(因氰化物水解)。金的溶解速度随氧浓度上升而增大,采用富氧溶被或高压充气氰化可以强化金的溶解。氰化试剂溶解金银的能力为:氰化铵>氰化钙氰化钠>氰化钾。氰化钾的价格最贵,目前多数使用氰化钠,氰化物的耗量取决于物料性质和操作因素,常为理论量的20-200倍. 物料性质影晌金的浸出率。氰化法虽是目前提金的主要方法,但某些含金矿物原料不宜直接采用氰化法处理,若矿石中铜、砷、锑、铋、硫、磷、磁铁矿、白铁矿等组分含量高时将大大增加氰化物耗量成消耗矿桨中的氧。降低金的浸出率,矿石中含碳高时,碳会吸附已溶金而随尾矿损失。预先氧化焙烧或浮选方法可除去有害杂质的影晌。氰化物水解反应为:KCN+H2OyKOH+HCN因此会挥发出有毒的HCN;加入石灰是氰化物水解减弱,上式反应向左方向进行,减少氰化物的损失。石灰还有中和酸类物质作用并可沉淀矿浆中得有害离子,使金的溶解处于最佳条件,常用石灰作保护碱。石灰加入量使矿浆值达到11~12为宜,矿浆lang=EN-值过高时对溶金不利。金粒大小主要影晌氰化时间,粗拉金(>74微米)的溶解速度慢。所以氰化前采用混汞、重选或浮选预先回收粗粒金是合理的。在磨矿过程中使细金粒充分单体解离仍是提高金的浸出率重要因素。 氰化时矿泥含量和矿浆浓度直接影晌组分扩散速度。矿浆浓度应小于30~33%。矿泥多时矿浆浓度应小于22-25%,但浓度不宜过低,否则增加氰化物的消耗。 氰化时间取决于物料性质、氰化方式及氰化条件而异。一般搅拌氰化浸出时间常大于24小时,有时长达40小时以上,氰化碲时需72小时,渗滤氰化浸出需五天以上。 从氰化浸出液中提金的方法有哪些方法? 从氰化浸出液中提金的方法比较多,如果用炭浆法(CIP).炭浸法(CIC),磁碳法(MCIP)或树脂交换法可以去固液分离作业。一般氰化矿浆经固液分离得到贵液(含金溶液).从贵液中提金的方法有锌置换沉淀法、活性炭吸附法、离子交换树脂吸附法或电解沉积法。用金属锌丝或锌粉从贵液中把金置换沉淀是常用的方法。贵液在进入置换沉淀作业之前经澄清以除去其中的矿泥和悬浮物,因这些杂质对下一步的置换沉淀作业有害. 锌置换沉淀金的基本原理是:在贵液中的锌会溶解于溶液中而使金沉淀出来,贵液中的离子Au(CN)2-与Zn作用的反应式通常写成: 2KAu(CN) 2+3Zn+4KCN+2H2O 2Au↓+2K2Zn(CN)4+K2ZnO2+H2
氰化钠事故的处置
氰化钠事故的处置 一、氰化钠的危险性 氰化钠为剧毒化学品,致死剂量为0.1-0.3g。当与酸类物质、氯酸钾、亚硝酸盐、硝酸盐混放时,或者长时间暴露在潮湿空气中,易产生剧毒、易燃易爆的HCN气体。当HCN 在空气中浓度为20ppm 时,经过数小时人就产生中毒症状、致死。 氰化钠和HCN(氰化氢)毒物危险程度分级为I级(极度危害)。 氰化钠属毒害感染性类危险化学品,其特性表现为: ①在水中的溶解度越大,其毒性越大,越易被人、畜吸收; ②呈固体状时的颗粒度越小,容易飞扬,越易引起中毒; ③呈液体状时的沸点越低,挥发性越强,空气中的浓度越大,越易从呼吸道进人人体引起中毒; ④绝大多数有机毒害品不仅有毒,而且有易燃、易爆、易腐蚀的危险性; ⑤无机毒害品一般本身不燃,但其中的氰化物遇酸会产生剧毒、易燃的氰化氢气体等。 二、氰化钠事故的特点 (一) 极易造成人员中毒 氰化钠具有剧毒危害,能通过呼吸系统、消化系统和皮肤进入人体,对呼吸酶有强烈抑制作用。中毒初期症状表现为面部潮红、心动过速、呼吸急促、头痛和头晕,然后出现焦虑、木僵、昏迷、窒息,
进而出现阵发性抽搐、抽筋和大小便失禁,最后出现心动过缓、血压骤降和死亡。 (二) 严重污染环境 氰化钠及其与水作用产生的氰化氢对大气、水域及土壤会造成严重的环境污染,对环境生物尤其是水生物会造成严重危害。 (三) 引发燃烧爆炸 氰化钠自身不燃烧,但遇潮湿空气或与酸类接触会产生剧毒、易燃的氰化氢气体,其爆炸极限为 5.6%-40%。与氯酸盐、硝酸盐等接触会剧烈反应,引起燃烧爆炸。 三、氰化钠中毒及其处理 (一)中毒机理 氰化物进入人体后迅速离解出氰基(CN-),氰离子在体内能迅速与氧化型细胞色素氧化酶(Fe3+)结合,并阻碍其被细胞色素还原为还原型细胞色素氧化酶(Fe2+),结果就失去了传递氧的功能,引起组织缺氧,导致组织内窒息。 (二)中毒表现 1. 轻度中毒 有头痛、头晕、乏力、胸闷、流泪、流涕、恶心、呕吐、呼吸困难,口中有苦杏仁味等。 2. 重度中毒 除轻度中毒症状逐渐加重外,由于缺氧加重,引起气急、胸部紧迫感、心律不齐、烦躁不安、抽搐、意识障碍,昏迷、血压下降,
乙醛
化学品安全技术说明书 化学品中文名:乙醛; 醋醛 化学品英文名:acetaldehyde; acetic aldehyde 企业名称: 生产企业地址: 邮编: 传真: 企业应急电话: 电子邮件地址: 技术说明书编码: √纯品混合物 有害物成分浓度CAS No. 乙醛75-07-0 危险性类别:第3.1类低闪点液体 侵入途径:吸入、食入 健康危害:急性中毒低浓度引起眼、鼻及上呼吸道刺激症状及支气管炎。高浓度吸入尚有麻醉作用。表现有头痛、嗜睡、神志不清及支气管炎、肺水肿、腹 泻、蛋白尿肝和心肌脂肪性变。可致死。误服出现胃肠道刺激症状、麻 醉作用及心、肝、肾损害。对皮肤有致敏性。反复接触蒸气引起皮炎、 结膜炎。慢性中毒类似酒精中毒。表现有体重减轻、贫血、谵妄、视 听幻觉、智力丧失和精神障碍。 环境危害:对大气可造成污染,对水生生物有毒作用。 燃爆危险:极易燃,其蒸气与空气混合,能形成爆炸性混合物。在空气中久置后能形成有爆炸性的过氧化物。容易自聚。 皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。如有不适感,就医。 眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。如有不适感,就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。呼吸、心跳停止,立即进行心肺复苏术。就医。 食入:饮水,禁止催吐。如有不适感,就医。
危险特性:极易燃,甚至在低温下的蒸气也能与空气形成爆炸性混合物,遇火星、高温、氧化剂、易燃物、氨、硫化氢、卤素、磷、强碱、胺类、醇、酮、 酐、酚等有燃烧爆炸危险。在空气中久置后能生成有爆炸性的过氧化物。 受热可能发生剧烈的聚合反应。蒸气比空气重,沿地面扩散并易积存于 低洼处,遇火源会着火回燃。 有害燃烧产物:一氧化碳。 灭火方法:用抗溶性泡沫、二氧化碳、干粉、砂土灭火。 灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至 灭火结束。处在火场中的容器若已变色或从安全泄压装置中产生声音, 必须马上撤离。遇到大火,消防人员须在有防爆掩蔽处操作。 应急行动:消除所有点火源。根据液体流动和蒸气扩散的影响区域划定警戒区,无关人员从侧风、上风向撤离至安全区。建议应急处理人员戴正压自给式呼 吸器,穿防静电服。作业时使用的所有设备应接地。禁止接触或跨越泄 漏物。尽可能切断泄漏源。防止泄漏物进入水体、下水道、地下室或密 闭性空间。小量泄漏:用砂土或其它不燃材料吸收。使用洁净的无火花 工具收集吸收材料。大量泄漏:构筑围堤或挖坑收容。用飞尘或石灰粉 吸收大量液体。用硫酸氢钠(NaHSO4)中和。用抗溶性泡沫覆盖,减少蒸 发。喷水雾能减少蒸发,但不能降低泄漏物在受限制空间内的易燃性。 用防爆泵转移至槽车或专用收集器内。喷雾状水驱散蒸气、稀释液体泄 漏物。 操作注意事项:密闭操作,全面排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴过滤式防毒面具(半面罩),戴化学安全防护眼 镜,穿防静电工作服,戴橡胶手套。远离火种、热源,工作场所严禁吸 烟。使用防爆型的通风系统和设备。防止蒸气泄漏到工作场所空气中。 避免与氧化剂、还原剂、酸类接触。充装要控制流速,防止静电积聚。 搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防 器材及泄漏应急处理设备。倒空的容器可能残留有害物。 储存注意事项:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过29℃,包装要求密封,不可与空气接触。应与氧化剂、还原剂、酸类等分开存放, 切忌混储。不宜大量储存或久存。采用防爆型照明、通风设施。禁止使 用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适 的收容材料。
氰化钠生产工艺
我国目前生产氰化钠产品的工艺方法主要有四种:氨钠法、安氏法、丙烯腈副产法、轻油裂解法。本项目中采用轻油裂解法,此工艺技术成熟可靠,操作安全,行之有效,是目前国内大部分生产氰化钠企业采用的工艺路线。 轻油裂解法工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用30%液碱溶液吸收,当NaCN含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。 此工艺方法的特点: (1)C5-C6轻油性质稳定,且以石油焦为载体,反应温度高。轻油的工艺利用率为100%,液氨的工艺收率为90%以上。 (2)采用循环封闭式的生产方法,系统生产连续化,坚持微负压操作,确保无泄漏操作,反应安全。 (3)此工艺生产工序简单明了,生产技术装备较简单。 整个装置分为原料储运系统、反应裂解系统、炉气处理系统、成品吸收系统以及废水、废渣处理系统。 工艺过程为,将轻油和氨气按比例在雾化器中混合,预热至280℃在电弧中裂解反应,温度1C o 450,以石油焦作载体,密闭在高温条件下进行氨化,反应产生氰氢酸气体,经除尘、冷却至50℃,再用30%液碱溶液吸收,当NaCN含量达30%以上即为液体氰化钠成品,尾气再用20%液碱溶液吸收。
其主要反应方程式如下: C 5H 12+5NH 3 电弧 C o 14505HCN+11H 2-243.3千卡 HCN + NaOH NaCN+H 2O 工艺流程示意图如图3-1所示: 3.1.1 危险化学品识别 XXXXXXXXX 公司生产氰化钠(30%液体)产品中,使用的原料列入国家安全生产监督管理局2003年第1号公告《危险化学品名录》的有: 氰化钠、氰化氢、氢气、氢氧化钠、液氨等6种。 根据GB50016《建筑设计防火规范》、GB50160《石油化工企业设计防火规范》、GB5044《职业性接触毒物危害程度分级》、HG24001《化工行业职业
