双水相萃取牛血清蛋白

双水相萃取法
双水相萃取法的应用及研究进展 摘要:双水相萃取技术作为一项新的分离技术日益受到重视,它与传统的萃取及其它分离技 术相比具有操作条件温和、处理、量大、易于连续操作等优点,从而使其能广泛应用于生物分离工程中。本文介绍了双水相的形成、双水相萃取技术的基本原理以及影响物质分配系数的因素。同时对双水相萃取技术的研究进展及其应用进行了综述。 关键词:双水相萃取分离纯化进展 一:方法 随着基因工程、蛋白质工程、细胞培养工程、代谢工程等高新技术研究工作的广泛开展,各种高附加值的生化新产品不断涌现,对生化分离技术也提出了越来越高的要求。包括精馏、吸收、萃取、蒸发、结晶在内传统的分离技术有三大特点:分离过程伴随有相的变化;筛分过程不能实现分子级别的分离;精制过程成本极高,这些特征对于节约能源、生物分离、环境 保护、资源开发、替代能源、高纯材料等当代化学工程与科学技术发展不相适应。围绕以上几个问题的讨论就构成了分离技术研究与发展的主流,即新型分离技术产生的背景。双水相萃取技术始于20世纪60年代,从1956年瑞典伦德大学Albertsson发现双水相体系[2]到1979年德国GBF的Kula等人将双水相萃取分离技术应用于生物产品分离,虽然只有20多年的历史,但由于其条件温和,容易放大,可连续操作,目前,已成功的应用于蛋白质、核酸和病毒等生物产品的分离和纯化,双水相体系也已被成功的应用到生物转化及生物分析中。 双水相现象是当两种聚合物或一种聚合物与一种盐溶于同一溶剂时,由于聚合物之间或聚合物与盐之间的不相溶性,使得聚合物或无机盐浓度达到一定值时,就会分成不相溶的两相,因使用的溶剂是水,因此称为双水相原则上,无论是天然的还是合成的亲水聚合物,绝大多数在与另一种聚合物水溶液混合时都可分成两相,构成双水相体系。 双水相萃取与水一有机相萃取的原理相似,都是依据物质在两相间的选择性分配,但萃取体系的性质不同。当物质进入双水相体系后,由于表面性质、电荷作用和各种力(如憎水键、氢键和离子键等)的存在和环境的影响,使其在上、下相中的浓度不同。对于某一 物质,只要选择合适的双水相体系,控制一定的条件,就可以得到合适的分配系数,从而达到分离纯化之目的。 二:讨论 双水相萃取是一项可以利用不复杂的设备,并在温和条件下进行简单的操作就可获得较高收率和有效成分的新型分离技术。因此,广泛应用于生物化学、细胞生物学和生物化工等领域。然而有关双水相分配的基础研究还不够,工业化的一些关键问题还没有解决。为此,有必要加强这方面的基础研究,解决大规模萃取生物活性物质的工艺条件和设备方面的问题,促进双水相萃取技术的不断发展。 影响双水相萃取的因素比较复杂,主要包括静电作用、疏水作用和界面张力等。通过对各个因素的调节,可以极大地提高蛋白质的选择性,达到向一相富集的目的。A 1}'帅的组分性质千差万别,从晶体到无定形聚合物、从非极性到极性、从电解质到非电解质、从无扫L 小分子到有扫L高分子甚至生物大分子,这些都不可避免地造成理论计算的复杂性,以至 于现在还没有一套比较完善的理论来衡量各个影响因素之问的关系和解释生物大分子在体 系中的分配扫L理.有关A丁PS分配模型的研究中,较为成功的有的渗透维里模型,以及晶格模型。前者在预测聚合物的成相行为和蛋白质的分配上有较高的准确度;后者在粒子的能
牛的牛血清白蛋白残留检测酶联免疫分析(ELISA)
牛的牛血清白蛋白残留检测酶联免疫分析(ELISA) 试剂盒使用说明书 本试剂仅供研究使用 目的:本试剂盒用于测定牛血清,血浆及相关液体样本中类牛血清白蛋白残留检测的含量。 实验原理: 本试剂盒应用双抗体夹心法测定标本中牛的牛血清白蛋白残留检测水平。用纯化的牛的牛血清白蛋白残留检测抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入类牛血清白蛋白残留检测,再与HRP标记的类牛血清白蛋白残留检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的类牛血清白蛋白残留检测呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中牛的牛血清白蛋白残留检测浓度。 试剂盒组成: 试剂盒组成48孔配置96孔配置保存 说明书1份1份 封板膜2片(48)2片(96) 密封袋1个1个 酶标包被板1×48 1×96 2-8℃保存 标准品:2700ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存 样本处理及要求: 1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。仔细收集上 清,保存过程中如出现沉淀,应再次离心。 2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心 20分钟左右(2000-3000转/分)。仔细收集上清,保存过程中如有沉淀形成,应该再次离心。 3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。仔细收集上清,保存过程 中如有沉淀形成,应再次离心。胸腹水、脑脊液参照实行。
考马斯亮蓝标准曲线制作
标准曲线制作—考马斯亮蓝法测蛋白质含量 一、标准曲线 一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。 二、蛋白质含量测定方法 1、凯氏定氮法 2、双缩脲法 3、Folin-酚试剂法 4、紫外吸收法 5、考马斯亮蓝法 三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)、试剂: 1、考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,雍蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3PO4。 2、标准蛋白质溶液: 纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15mol/LNaCl (0.9%NaCl)配制成100ug/ml蛋白溶液。 (二)、器材: 1、722S型分光光度计使用及原理()。 2、移液管使用()。 (三)、标准曲线制作: 1、 2、以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、
40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。 1)、利用标准曲线查出回归方程。 2)、用公式计算回归方程。 3)、或用origin作图,测出回归线性方程。即A595nm=a×X( )+6 一般相关系数应过0.999以上,至少2个9以上。 4)、绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。 (四)、蛋白质含量的测定: 样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm,然后利用标准曲线或回归方程求出样品蛋白质含量。 一般被测样品的A595nm值在0.1—0.05之间,所以上述样品如果A595nm值太大,可以稀释后再测A595nm值,然后再计算。 (五)、注意事项: 1、玻璃仪器要洗涤干净。 2、取量要准确。 3、玻璃仪器要干燥,避免温度变化。 4、对照:用被测物质以外的物质作空白对照。
双水相体系萃取(精)
双水相萃取技术 早在1896年,Beijerinck发现,当明胶与琼脂或明胶与可溶性淀粉溶液相混时,得到一个混浊不透明的溶液,随之分为两相,上相富含明胶,下相富含琼脂(或淀粉,这种现象被称为聚合物的不相溶性(incompatibility,从而产生了双水相体系(Aqueous two phase system,ATPS。 传统的双水相体系是指双高聚物双水相体系,其成相机理是由于高聚物分子的空间阻碍作用,相互无法渗透,不能形成均一相,从而具有分离倾向,在一定条件下即可分为二相。一般认为只要两聚合物水溶液的憎水程度有所差异,混合时就可发生相分离,且憎水程度相差越大,相分离的倾向也就越大。可形成双水相体系的聚合物有很多,典型的聚合物双水相体系有聚乙二醇(polyethylene glycol,略作PEG/葡聚糖(dextran,聚丙二醇(polypropylene glycol/聚乙二醇和甲基纤维素(methylcellulose/葡聚糖等。另一类双水相体系是由聚合物/盐构成的。此类双水相体系一般采用聚乙二醇(polyethylene glycol作为其中一相成相物质,而盐相则多采用硫酸盐或者磷酸盐。 萃取原理 双水相萃取与水-有机相萃取的原理相似,都是依据物质在两相间的选择性分配。当萃取体系的性质不同时,物质进入双水相体系后,由于表面性质、电荷作用和各种力(如憎水键、氢键和离子键等的存在和环境因素的影响,使其在上、下相中的浓度不同。物质在双水相体系中分配系数K可用下式表示: K= C上/ C下 其中K为分配系数,C上和C下分别为被分离物质在上、下相的浓度。 分配系数K等于物质在两相的浓度比,由于各种物质的K值不同,可利用双水相萃取体系对物质进行分离。其分配情况服从分配定律,即,“在一定温度一定压强下,如果一个物质溶解在两个同时存在的互不相溶的液体里,达到平衡后,该物质在两相中浓度比等于常数”,分离效果由分配系数来表征。
双水相萃取和超临界萃取的方法与特点
双水相萃取和超临界萃取的方法与特点 专业生物工程092 课程酶工程 老师王明力 学生吴志洪 学号 0908110342 2012年12月25日
双水相萃取和超临界萃取的方法与特点 摘要:双水相萃取技术是一种高效温和的新分离技术,它与传统的萃取及其它分离技术相比具有操作条件温和、处理量大、易于连续操作等优点,从而使其能广泛应用于生物分离工程中。同时文章简要介绍了超临界流体萃取的基本原理和特点及其应用,其中超临界CO2萃取是最常用的.随着研究的深入和认识的加强,超临界流体技术作为一项可持续的绿色工艺,将具有广泛的应用前景。 关键词:双水相萃取超临界流体萃取 Abstract: Phasepartitioning technology is a kind of high efficient mild new separation technique ,and the traditional extraction and other separation technology compared with mild conditions, large quantity of operation, easy for operation, which makes its advantages such as extensively applied in biological separation engineering.And his article introduces the basic principle of supercritical fluid extraction and it,s application ,The supercritical CO2extraction is the most commonly used.With the deepening of research and understanding of the strengthen, supercritical fluid technology as a sustainable green technology, has a broad prospect of application.
第七章 双水相萃取
第七章双水相萃取 第一节概述 基因工程产品如蛋白质和酶往往是胞内产品,需经细胞破碎后才能提取、纯化,细胞颗粒尺寸的变化给固—液分离带来了困难,同时这类产品的活性和功能对pH值、温度和离子强度等环境因素特别敏感,由于它们在有机溶剂中的溶解度低并且会变性,而且大部分蛋白质分子有很强的亲水性,不能溶于有机溶剂中,因此传统的溶剂萃取法并不适合。采用在有机相中添加表面活性剂产生反胶束的办法可克服这些问题,但同样存在相的分离。因此基因工程产品的商业化迫切需要开发适合大规模生产的、经济简便的、快速高效的分离纯化技术。其中双水相萃取技术,又称水溶液两相分配技术是近年来出现的引人注目、极有前途新型分离技术。双水相萃取就是针对生物活性物质的提取所开发的一种新型液一液萃取分离技术。 双水相萃取法的特点是能够保留产物的活性,整个操作可以连续化,在除去细胞或细胞碎片时,还可以纯化蛋白质2~5倍,与传统的过滤法和离心法去除细胞碎片相比,无论在收率上还是成本上都要优越得多见表11.1所示。双水相萃取法和传统的酶粗分离方法(如 盐析或有机溶剂沉淀等)相比也有很大的优势,如以 -半乳糖苷酶为例,用沉淀或双水相萃 取纯化的比较见表11.2。除此以外,处理量相同时,双水相萃取法比传统的分离方法,设备需用量要少3~10倍,因此已被广泛地应用在生物化学、细胞生物学和生物化工领域,进行生物转化、蛋白质、核酸和病毒等产品的分离纯化和分析等。用此法来提纯的酶已达数十种,其分离过程也达到相当规模,如甲酸脱氢酶的分离已达到几十千克湿细胞规模,半乳糖苷酶的提取也到了中试规模等。 近年来又进行了双水相萃取小分子生物活性物质,如红霉素、头孢菌素C、氨基酸的研究和亲和双水相萃取的研究,大大扩展了应用范畴并提高了选择性;使双水相萃取技术具有更大的潜力和宽阔的前景。 双水相萃取现象最早是1896年由Beijerinck在琼脂与可溶性淀粉或明胶混合时发现的这种现象被称为聚合物的“不相溶性”。本世纪60年代瑞典Lund大学的AlbertssonPA及其同事们最先提出双水相萃取技术并做了大量的工作。70年代中期西德的KulaMR和KronerKH 等人首先将双水相系统应用于从细胞匀浆液中提取酶和蛋白质,大大改善了胞内酶的提取效果。虽然双水相技术在应用方面取得了很大的进展,但几乎都是建立在实验基础上,至今还没有一套比较完善的理论来解释生物大分子在体系中的分配机理。1989年,Diamond等以Ftory—Huggins理论为基础,推导出生物分子在双水相体系中的分配模型,但尚有局限性,仍需继续探索,不断完善。 双水相萃取技术真正工业化的例子也很少,其原因是成本较高,使它在技术上的优势被削弱。双水相萃取中,原材料成本占了总成本的85%以上并且总成本随生产规模的扩大而增加很多。因此产业化成了问题,若要发挥其技术优势,降低原材料成本是关键。合成价格低廉并且具有良好的分配性能的聚合物及将其从后续的操作过程中回收是双水相萃取技术研究中的一个主要方向。 一、双水相的形成 在聚合物—盐或聚合物—聚合物系统混合时,会出现两个不相混溶的水相,典型的例子如在水溶液中的聚乙二醇(PEG)和葡聚糖,当各种溶质均在低浓度时,可以得到单相匀质液体,但是,当溶质的浓度增加时,溶液会变得浑浊,在静止的条件下,会形成两个液层,实际上是其中两个不相混溶的液相达到平衡,在这种系统中,上层富集了PEG,而下层富集了葡聚糖。
双水相萃取分离
双水相萃取技术应用 摘要:双水相萃取技术作为一种新型的分离技术日益受到重视,它与传统的萃取方法相比有独特的优点。本文总结了双水相萃取形成的原理,萃取过程的基本理论、萃取体系的特点,综述了双水相萃取技术在生化工业、分析检测、稀有金属分离等方面的应用,介绍了该技术的最新进展,指出了该技术工业化存在的问题,并对今后的发展作了展望。 关键词:双水相萃取分离应用 引言 双水相萃取技术(Aqueous two—phase extraction,简称ATPE)与传统的萃取分离技术不同,有其独特的优点,是一种新型的分离技术。双水相萃取在诸多方面有着广泛的应用,具有良好的应用前景。 1、双水相萃取技术的基本原理 1.1双水相体系的形成 当一定浓度的某种有机物水溶液与其它有机物水溶液,或者有机物水溶液与无机盐水溶液以一定体积比混合时,能够自然分相并形成互不相溶的双水相或者多水相体系,这就是双水相体系。 从溶液理论来说,当2种有机物或者有机物与无机盐混合时,是分相还是混合成一相,取决于混合时的熵变和分子间的相互作用力。由于双水相体系本身的复杂性,体系的熵很难准确计算,分子间的相互作用力也不清楚,所以双水相的形成机理很复杂。对于高聚物/高聚物双水相体系,用传统的理论来解释,是由于界面张力等因素形成两相之间的不对称,使得在空间上产生阻隔效应,使两相之间无法相互渗透,不能形成均一相,从而具有分离倾向,一般这种分离倾向的大小和形成双水相的2种物质的疏水性成线性关系。对于有无机盐存在的双水相体系,以及新开发的表面活性剂双水相体系,这种解释就无能为力了。 表1是各种双水相体系的成相原理。由表1可知,不同的成相原理可以解释不同组成的双水相体系.但各种原理并不能普遍适用。而且各种原理问的相互关
双水相萃取
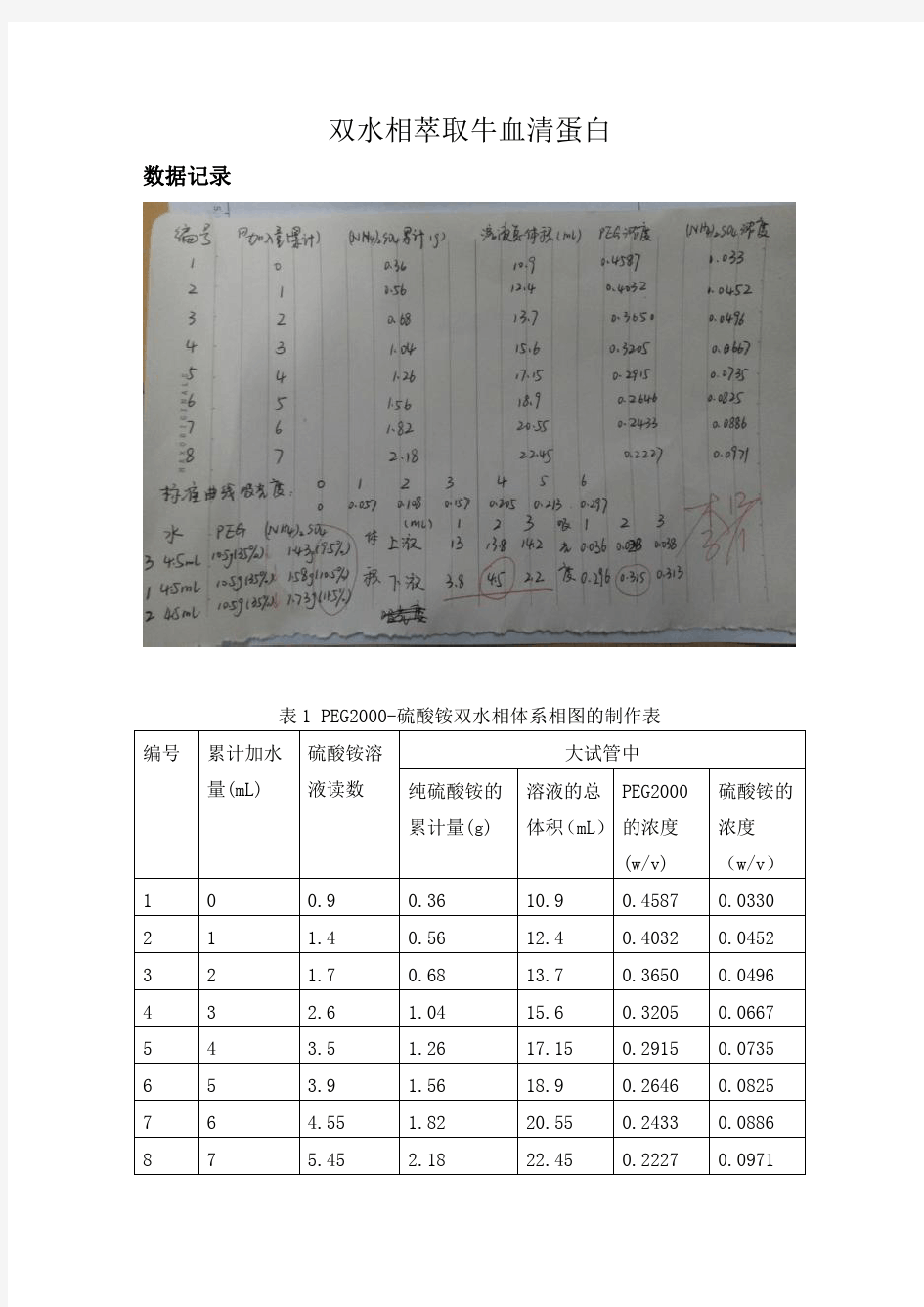
实训1 双水相萃取相图的制作 一、实训目的 1. 学习双水相分离萃取的原理和方法 2. 学习双水相萃取相图的制作 二、实训原理 双水相萃取法是利用物质在互不相容的两个水相间分配系数的差异来进行萃取的方法。 两水相的形成:高聚物与无机盐在水中由于盐析的作用会形成两个相,如PEG 与硫酸盐或碱性磷酸盐。两种亲水性高聚物在水中由于聚合物的不相容性也会形成两个相。但是它们只有达到一定的浓度时,才能形成两相,双水相形成的定量关系可用相图来表示。 相图是一根双节线, 把均匀区和两相区分隔开来。 当成相组分的配比取在:线的下方时,为均相区; 曲线的上方时,为两相区;在曲线上,则混合后,溶液恰好从澄清变为浑浊。 相图中TMB 称为系线;T 代表上相组成;B 代表下相组成;同一条系线上各点分成的两相具有相同的组成,但体积比不同。 V T / V B = BM / MT 三、实训器材、试剂、材料 1.器材:试管,离心机,天平,离心管,三角瓶,滴定管。 2.试剂:聚乙二醇2000(PEG2000),硫酸铵。 四、实训操作步骤 1.PEG2000(NH 4)2SO 4双水相体系相图的测定 (1)取10%(g/ mL )PEG2000溶液10mL 于三角瓶中。 (2)用40%(g/mL )(NH 4)2SO 4溶液装入滴定管中滴定至三角并中溶液出现浑浊,记录)NH4)2SO 4溶液消耗的体积。加入1mL 水使溶液澄清,继续用(NH 4)2SO 4溶液滴定至浑浊,重复7~8次,记录每次(NH 4)2SO 4溶液消耗的体积,计算每次出现浑浊时体系中PEG2000和(NH 4)2SO 4的浓度(g/mL )。 (3) 以(NH 4)2SO 4的浓度(g/mL )为横坐标,PEG2000的浓度(g/mL )为纵坐标,绘制PEG2000- (NH 4)2SO 4双水相体系相图。 2. 相图制作表 10%PEG2000 10mL 温度T=20℃ PEG2000 % (NH 4)2SO 4 % 两相 均相
牛血清蛋白标准曲线定制
00.20.40.60.8 2 4 6 8 10 12 14 牛血清蛋白的显色浓度μg/ml A 595处吸光度 A595nm处测得的吸光度 回归方程对应的吸光度 表一 考马斯亮兰G250染色法测定牛血清蛋白标准曲线家养表及样品595nm 处测得的OD 值 项目 试管 编号 1 2 3 4 5 6 7 样1 样2 100μg/mL 牛血清蛋白溶液 /ml 0.00 0.20 0.30 0.40 0.50 0.60 0.70 0.80 1.00 1.00 各管中血清蛋白显色浓度 μg/mL 0.00 3.33 5.00 6.67 8.33 10.0 11.67 13.33 考马斯亮兰试剂ml 各加 入5ml 后摇匀 3分钟后 开始测 定20分 钟测完 A595处测定各管OD 值 0.000 0.186 0.277 0.365 0.451 0.527 0.596 0.664 0.398 0.404 表二 考马斯亮兰G250染色定制牛血清蛋白标准曲线数据处理统计表 项目 试管 编号 1 2 3 4 5 6 7 牛血清蛋白标准显色浓度 μg/mL 0.00 3.33 5.00 6.67 8.33 10.0 11.67 13.33 A595处测定的OD 值 0.000 0.186 0.277 0.365 0.451 0.527 0.596 0.664 回归方程对应浓度下的OD 值 0.0192 0.185 0.269 0.352 0.435 0.518 0.602 0.684 线性回归方程斜率 0.0192 线性回归方程截距 0.0499 线性回归方程 y=0.0499x+0.0192 实验数据的相关因素 0.9960
双水相萃取技术研究论文
双水相萃取技术 姓名:小行星学号: 2015xxxx专业:化工工艺 摘要:双水相萃取是一种新型的萃取分离技术,本文介绍了双水相体系的形成 及特点,重点介绍了双水相萃取技术的应用和双水相萃取的主要设备, 对双水相萃取技术应用前景及展望 关键字:双水相萃取分离技术应用展望 1、引言 溶剂萃取法是分离技术中最重要的方法之一。传统的溶剂萃取分离是依据被分离物质在两个互不相溶液相中的溶解性不同而达到分离目的。一般的萃取体系包括有机相和水相两部分,迄今为止,已有若干种分类方法。随着近年来分离技术在生命科学、天然药物提纯及各类抗生素药物等方面应用的迅速发展,新型的萃取技术应运而生。例如对于生物物质来说,分离的对象复杂,既包括可溶物,如蛋白质和核酸,也包括悬浮的小颗粒,如细胞器和整个细胞;由于生物物质极易变性和失活,传统的有机相和水相的两相萃取不能解决生物物质失活等问题,给分离带来很大的难度,而双水相萃取技术能够很好的解决这一难题。 双水相萃取(Aqueoustwo-phase extraction, ATPE)[1]是两种水溶性不同的聚合物或者一种聚合物和无机盐的混合溶液,在一定的浓度下,体系就会自然分成互不相容的两相,被分离物质进入双水相体系后由于表面性质、电荷间作用和各种作用力(如憎水键、氢键和离子键)等因素的影响,在两相间的分配系数K不同,导致其在上下相的浓度不同,达到分离目的,这种现象在1896年被 B eijerinck首次发现,随后双水相萃取技术作为一种新型的分离技术日益受到重视,与传统的萃取及其他分离技术相比具有操作条件温和、处理量大、易于连续操作等优点,随着生物、医药等行业的蓬勃发展,从而使双水相萃取技术能越来越广泛应用于生物工程、药物分析和金属分离等方面。 2、双水相体系 简而言之,双水相萃取是利用溶质在两个互不相溶的水相中的溶解度不同
第8章双水相萃取技术
第8章双水相萃取技术 第8章双水相萃取技术 1双水相萃取现象:最早是1896年由Beijernek在琼脂和可溶性淀粉或明胶混合时发现的,这种现象称之为聚合物的“不相溶性”。70年代中期西德的Kula和Kroner等人首先将双水相系统应用于从细胞匀浆 液中提取酶和蛋白质,大大地改善了胞内酶的提取效果。 双水相萃取技术:某些亲水性高分子聚合物的水溶液超过一定浓度后可形成两相,并且在两相中水分均占很大比例,即形成双水相系统。利用亲水性高分子聚合物的水溶液可形成双水相的性质进行物质分离的方法称双水相萃取技术,又称水溶液两相分配法。 2双水相萃取技术基本原理:①双水相的形成一聚合物的不相容性:混合是熵增加的过程,可自发进行。但是,分子间的相互作用力也会随分子量的增大而增大。当两种高分子聚合物之间存在相互排斥作用时,由于分子量较大,分子间的相互排斥作用与混合过程的熵增加相比占主导地位,一种聚合物分子的周围将聚集同种分子而排斥异种分子,当达到平衡时,即形成分别富含不同聚合物的两相。这种含有聚合物分子的溶液发生分相的现象称为聚合物的不相容性。 双水相的形成一系统举例:绝大多数天然的或合成的亲水性聚合物水溶液,在与第二种亲水性聚合物混合,并达到一定浓度时,就会产生两相,两种高聚物分别溶于互不相溶的两相中。如用等量的 1.1 %右 旋糖酐溶液和0.36 %甲基纤维素溶液混合,静止后产生两相,上相中含右旋糖酐0.39 %,含甲基纤维素 0.65 %;而下相含右旋糖酐 1.58 %,含甲基纤维素0.15 %。聚合物与无机盐的混合溶液也可形成双水相,例如,PEG^磷酸钾、PEG^磷酸铵、PEG^硫酸钠等常用于生物产物的双水相萃取。PEG^无机盐系统的上 相富含PEG下相富含无机盐。 Dextran-PEG体系的相图:(1)TKB称为双节线,双节线以下的区域为均相区,以上的区域为两相区。(2)TMB称为系线,是连接双节线上两点的直线,在系线上各点处系统的总浓度不同,但均分成组成相同而体积不同的两相。 萃取原理:双水相萃取与水-有机相萃的原理相似,都是依据物质在两相间的选择性分配。当萃取体系的性质不同时,物质进入双水相系后,由于表面性质、电荷作用和各种力(如疏水键、氢键和离子键等)的存在和环境因素的影响,使其在上、下相中的浓度不同。 几个常用的术语:(1)分配系数:、二G/C2 = C_/C=.(分配系数K等于物质在两相的浓度比,由于各种物质的K值不同,可利用双水相萃取体系对物质进行分离)。(2)萃取率: 该相中被提取物质的量 Y%= 100% %=体系中被提取物质的总量% 双水相体系萃取分离的特点:条件温和;操作方便;回收率高、提纯的倍数可达2-20倍,如体系选择 适当,回收率可达80%-90%A上,且分离速度快。 3双水相相图的操作:①把刻度离心管放置于电子天平上,调零;②向刻度离心管滴加一定量50% PEG-6000(简称A),记录重量;③调零,再滴加40%硫酸铵溶液(简称B),振荡,继续滴加B,直到混合物 呈现混浊状态,显示已形成不溶的两相,记录B的重量;④电子天平调零,然后,向混合物滴加一定重量 的水(0.4-0.5ml),经振荡后,重新呈现澄清状态,此现象表明溶液又回复成单相,记录此时的W重量;⑤ 电子天平调零。接着,再一次滴加B;⑥重复上述步骤。最后可得一系列成单相的点。 双水相相图的绘制:以PEG-6000和硫酸铵构成的双水相系统的相图曲线可根据如下公式计算获得: X=[0.4B/(A+B+W)]100% , 丫二[0.5A/(A+B+W)]100% (公式符号含义:Y :在某成单相点时 PEG-6000占总量的百分数;X :在某成单相点时硫酸盐占总量的百分数; A :在某成单相点时PEG-6000溶 液在系统中的总量(g);B:在某成相点时硫酸铵溶液在系统中的总量(g);W:在某成单相点时水在系统中的总量(g))。以丫为纵坐标,X为横坐标,丫对X作图得双水相系统相图。相图中曲线左边部分为单相区(含 曲线),曲线以右为双相区。 4双水相萃取的应用:①分离和提取各种蛋白质(酶):PEG /硫酸铵双水相体系提取 a -淀粉粉酶和蛋白酶时a -淀粉粉酶收率90%分配系数为19.6,蛋白酶的收率高于60%分离系数高达15.1 :②提取抗生素;③双水相电泳分离氨基酸、蛋白质④基因工程药物的分离与提取:用PEG 4000/磷酸盐从大肠杆 菌碎片中提取人生长激素,用PEG -磷酸酯/磷酸盐提取a 1-干扰素和3 -干扰素。 5双水相萃取分离技术的发展方向:①新型双水相体系的开发:用变性淀粉取代葡聚糖;用羟基纤维 素取代聚乙二醇。②后续色谱纯化工艺研究:双水相萃取与层析技术。③金属亲和双水相萃取技术:利用金属离子和蛋白质中精氨酸、组氨酸的亲和作用。
【2017年整理】标准曲线制作考马斯亮蓝法测蛋白质含量
【2017年整理】标准曲线制作考马斯亮蓝法测蛋白质含量标准曲线制作—考马斯亮蓝法测蛋白质含量 一、标准曲线 一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。 二、蛋白质含量测定方法 1、凯氏定氮法 2、双缩脲法 3、Folin-酚试剂法 4、紫外吸收法 5、考马斯亮蓝法 三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)、试剂: 1、考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% HPO,34 加蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝 乙醇,8.5%(W/V)HPO。 G—250,4.7%(W/V)34 2、标准蛋白质溶液: 纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同 0.15mol/LNaCl配制成100ug/ml蛋白溶液。 (二)、器材: 1、722S型分光光度计使用及原理 2、移液管使用
(三)、标准曲线制作: 1、 试管编号 0 1 2 3 4 5 6 100ug/ml标准蛋白(ml) 0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.15mol/L NaCl (ml) 1 0.9 0.8 0.7 0.6 0.5 0.4 考马斯亮蓝试剂 (ml) 5 5 5 5 5 5 5 摇匀,1h内以1号管为空白对照,在595nm处比色 A595nm 2、以A为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、595nm 40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。 1)、利用标准曲线查出回归方程。 2)、用公式计算回归方程。 3)、或用origin作图,测出回归线性方程。即A=a×X( )+6 595nm一般相关系数应过0.999以上,至少2个9以上。 4)、绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。 (四)、蛋白质含量的测定: 样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A,然后利用标准曲线或回归方程求出样品蛋白质含量。 595nm 一般被测样品的A值在0.1—0.05之间,所以上述样品如果A值太595nm595nm 大,可以稀释后再测A值,然后再计算。 595nm (五)、注意事项: 1、玻璃仪器要洗涤干净。 2、取量要准确。
蛋白质标准曲线测试方法
试剂与器材 一、试剂 考马斯亮蓝试剂: 考马斯亮蓝G―250 100 mg溶于50 mL 95%乙醇中,加入100 mL 85%磷酸,用蒸馏水稀释至1000 mL。 二、标准和待测蛋白质溶液 1. 标准蛋白质溶液 结晶牛血清蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度用9gl/L NaCl配制成 0.1 mg/mL蛋白溶液。 三、器材 试管1.5×15 cm(×6),试管架,移液管管0.5 mL(×2);1 mL(×2);5 mL(×1);恒温水浴;分光光度计。 操作方法 一、制作标准曲线 取7支试管,按下表平行操作。 试管编号0 1 2 3 4 5 6 7 8 9 10 标准蛋白溶 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 液(mL) 9gl/LNaCl 0.1 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0 (mL) 考马斯亮蓝 4mL 试剂 蛋白质浓度 0 10 20 30 40 50 60 70 80 90 100 ug/ml 摇匀,1h内以0号管为空白对照,在595 nm处比色 绘制标准曲线:以A595 nm为纵坐标,标准蛋白含量为横坐标,在坐标纸上绘制标准曲线。 二、未知样品蛋白质浓度测定 测定方法同上,取1样品,加4ml考马斯亮蓝溶液,使其测定值在标准曲线的直线范围内。根据所测定的A595 nm值,在标准曲线上查出其相当于标准蛋白的量,从而计算出未知样品的蛋白质浓度(ug/mL)。(超出范围应稀释样品。) 注意事项 在试剂加入后的5-20 min内测定光吸收,因为在这段时间内颜色是最稳定的。 测定中,蛋白-染料复合物会有少部分吸附于比色杯壁上,测定完后可用乙醇将蓝色的比色杯洗干净。 利用考马斯亮蓝法分析蛋白必须要掌握好分光光度计的正确使用,重复测定吸光度时,比色杯一定要冲洗干净,制作蛋白标准曲线的时候,蛋白标准品最好是从低浓度到高浓度测定,防止误差。
考马斯亮蓝G-250标准曲线法测定蛋白含量
考马斯亮蓝G-250标准曲线法测定蛋白含量 实验目的: 学习和掌握考马斯亮蓝G-250 测定蛋白质含量的原理和方法。 实验原理: 考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。考马斯亮蓝G-250 在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm 波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。蛋白质与考马斯亮蓝G-250 结合在2min 左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h 内保持稳定。该法是1976年Bradford 建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry 法还高4 倍,可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。 材料、主要仪器和试剂 1.实验材料 新鲜绿豆芽 2.主要仪器 (1)分析天平、台式天平 (2)刻度吸管 (3)具塞试管、试管架 (4)研钵 (5)离心机、离心管 (6)烧杯、量筒 (7)微量取样器 (8)分光光度计 3.试剂 (1)牛血清白蛋白标准溶液的配制:准确称取100mg 牛血清白蛋白,溶于100mL 蒸馏水中,即为1 000μg/mL 的原液。 (2)蛋白试剂考马斯亮蓝G-250 的配制:称取100mg 考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1 000mL。此溶液在常温下可放置一个月。 (3)乙醇 (4)磷酸(85%) 四、操作步骤 1.标准曲线制作 (1)0~100μg/mL 标准曲线的制作:取6 支10mL 干净的具塞试管,按表1 取样。盖塞后,将各试管中溶液纵向倒转混合,放置2min 后用1cm 光经的比色杯在595nm 波长下比色,记录各管测定的光密度OD595nm,并做标准曲线。
双水相萃取技术
三、双水相萃取 3.1 双水相萃取的原理及特点 3.1.1 双水相萃取的原理 双水相萃取与水-有机相萃取的原理相似,都是依据物质在两相间的选择性分配,但萃取体系的性质不同。当物质进入双水相体系后,由于表面性质、电荷作用和各种力(如憎水键、氢键和离子键等)的存在和环境因素的影响,使其在上、下相中的浓度不同。分配系数K等于物质在两相的浓度比,由于各种物质的K值不同,可利用双水相萃取体系对物质进行分离。 3.1.2 双水相萃取的特点 双水相体系萃取具有如下特点:(1)含水量高(70%~90%),是在接近生理环境的温度和体系中进行萃取,不会引起生物活性物质失活或变性;(2)分相时间短,自然分相时间一般为5~15min; (3)界面张力小(10-7~10-4mN/m),有助于强化相际间的质量传递;(4)不存在有机溶剂残留问题; (5)大量杂质能与所有固体物质一同除去,使分离过程更经济;(6)易于工程放大和连续操作。由于双水相萃取具有上述优点,因此,被广泛用于生物化学、细胞生物学和生物化工等领域的产品分离和提取。 3.2 双水相萃取在分离和提取各种蛋白质(酶)上的应用 用聚乙二醇(PEG)/羟丙基淀粉酶(Reppal PEG)体系经两步法可从黄豆中分离磷酸甘油酸激酶(PGK)和磷酸甘油醛脱氢酶(GAPDH)。在黄豆匀浆中加入PEG4000,可絮凝细胞碎片及大部分杂蛋白。在上清液中加入PEG4000(12%)-ReppalPES(40%),PGK在上相、GAPGH在下相的收率均在80%以上。萃取过程的放大采用离心倾析机连续处理匀浆液,用离心萃取器完成双水相体系的两相分离,整个工艺具有处理量大、接触时间短、酶收率高的特点。用PEG/(NH4)2SO4双水相体系,经一次萃取从A-淀粉酶发酵液中分离提取α-淀粉酶和蛋白酶,萃取最适宜条件为PEG1000(15%)-(NH4)2SO4(20%),pH=8,α-淀粉酶收率为90%,分配系数为19.6,蛋白酶的分离系数高达15.1。比活率为原发酵液的1.5倍,蛋白酶在水相中的收率高于60%。通过向萃取相(上相)中加进适当浓度的(NH4)2SO4可达到反萃取。实验结果表明,随着(NH4)2SO4浓度的增加,双水相体系两相间固体物析出量也增加。固体沉淀物既可干燥后生产工业级酶制剂,也可将固体物加水溶解后用有机溶剂沉淀法制造食品级酶制剂. Harris用双水相体系从羊奶中纯化蛋白,研究了牛血清清蛋白(OSA)、牛酪蛋白、β-乳球蛋白在PEG/磷酸盐体系中的分配以及PEG相对分子质量、pH值和盐的加入对3种蛋白分配的影响。实验结果表明。增加NaCl浓度,可提高分配系数,最佳pH为5。对OSA和牛酪蛋白,可得到更高的分配系数。在含有疏水基葡聚糖中,蛋白质和类囊体薄膜泡囊的分配研究表明,苯甲酰基葡聚糖和戊酰基葡聚糖具有疏水性。疏水基影响氨基酸、蛋白质和薄膜泡囊在双水相体系中的分配,在只有磷酸盐缓冲溶液的PEG8000/葡聚糖双水相体系中,大部分β-半乳糖苷酶被分配在上相,但在下相中加入少量的苯甲酰基葡聚糖(取代程度为0.054)或戊酰基葡聚糖(取代程度为0.12)时,β-半乳糖苷酶的分配系数就降低了100倍。在对牛血清清蛋白、溶菌酶、脂肪酶和β-乳球蛋白的分配进行的观察中发现具有相似的现象。类囊体薄膜泡囊的分配受疏水基的影响特别大,薄膜泡囊被分配在含有疏水基的一相中。在含有N,N-二甲基甲酰胺的聚合物双水相中,利用逆流分配可对玉米醇溶蛋白进行分级分离。Miyuki在PEG/K3PO4双水相体系中用两步法对葡糖淀粉酶进行了萃取纯化。用第一步萃取后含有酶的下相和PEG组成双水相作为第二步萃取体系,称作两步法。葡糖淀粉酶的最佳分配条件是PEG4000(第一步)、PEG1500(第二步),pH=7,纯化系数提高了3倍。
标准曲线制作考马斯亮蓝法测蛋白质含量
标准曲线制作考马斯亮蓝法测蛋白质含量
标准曲线制作—考马斯亮蓝法测蛋白质含量 一、标准曲线 一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。 二、蛋白质含量测定方法 1、凯氏定氮法 2、双缩脲法 3、Folin-酚试剂法 4、紫外吸收法 5、考马斯亮蓝法 三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)、试剂: 1、考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,雍蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3PO4。 2、标准蛋白质溶液: 纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15mol/LNaCl配制成100ug/ml蛋白溶液。 (二)、器材: 1、722S型分光光度计使用及原理()。 2、移液管使用()。 (三)、标准曲线制作: 1、 试管编号0 1 2 3 4 5 6 100ug/ml标准蛋白(ml)0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.15mol/L NaCl (ml) 1 0.9 0.8 0.7 0.6 0.5 0.4 考马斯亮蓝试剂(ml) 5 5 5 5 5 5 5 摇匀,1h内以1号管为空白对照,在595nm处比色 A595nm 2、以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、
药品的配制(磷酸缓冲液的配制) 一、药品的配制步骤 (一)、实验准备: 1、准备所需的药品和玻璃仪器。 2、洗涤。(怎样洗涤算干净?) (二)、计算: 1、百分比浓度计算: 1)、G/V比 例如配1% NaCl,称1g NaCl溶于100ml 水。 2)、V/V比: 例如配75%乙醇100ml,75%×100%=100%×X, X=75ml。取75ml无水乙醇,加25ml蒸馏水。 乙醇:乙醚:丙酮=2:1:2配500ml,各取200 ml,100 ml,200 ml混合。3)G/V比:用的较少,如计算灰分中某种元素如Fe的含量。 2、摩尔浓度计算:注:药品的分子量一般在标签中注明。 1)、0.1M或0.1mol/L NaCl配100ml。 M=质量/体积(L)称取NaCl0.1×0.1×40=0.4g 摩尔数=G(g)/摩尔质量2)、0.1mMNaCl配100ml mM=毫摩尔数/体积(L)称取NaCl0.1×0.1×40=0.4g 毫摩尔数=G(mg)/摩尔质量 3)、0.1uNaCl配100ml mM=微摩尔数/体积(L)称取NaCl0.1×0.1×40=0.4mg 微摩尔数=G(ug)/摩尔质量称取NaCl0.1×0.1×40=0.4ug 3、混合溶液配制的计算: 如配3uMEDTA,2.25mM NBT以及60uM 溶液100ml,用50mM磷酸缓冲液配制。 注意:1、分别标定体积计算 2、分别配制再混合,但总体积不能为100ml
双水相萃取的特点
双水相萃取的特点 双水相萃取是一种可以利用较为简单的设备, 并在温和条件下进行简单操作就可获得较高收率和纯度的新型分离技术。与一些传统的分离方法相比, 双水相萃取技术具有以下独有的特点。 ( 1) 两相间的界面张力小, 一般为10- 7—10- 4mN·m- 1 ( 一般体系10- 3—2×10- 2mN·m- 1 ) ,因此两相易分散, 而且它比一般的有机萃取两相体系界面张力低的多, 这样有利于强化相际间的物质传递。 ( 2) 操作条件温和, 由于双水相的界面张力大大低于有机溶剂与水相之间的界面张力, 整个操作过程可以在常温常压下进行, 对于生物活性物质的提取来说有助于保持生物活性和强化相际传质。 ( 3) 双水相体系中的传质和平衡速度快, 回收率高, 分相时间短, 传质过程和平衡过程速度均很快, 自然分相时间一般为5—15min, 因此相对于某些分离过程来说, 能耗较低, 而且可以实现快速的分离。 ( 4) 大量杂质能够与所有固体物质一起去掉, 与其他常用固液分离方法相比, 双水相分配技术可省去1—2 个分离步骤, 使整个分离过程更经济。 ( 5) 含水量高, 一般为75%—90% , 在接近生理环境的体系中进行萃取, 不会引起生物活性物质失活或变性。 ( 6) 一般不存在有机溶剂的残留问题, 现已证明形成双水相的聚合物( 如PEG) 对人体无害, 可用于食品添加剂、注射剂和制药, 因此
对环境污染小。 ( 7) 聚合物的浓度、无机盐的种类和浓度, 以及体系的pH 值等因素都对被萃取物质在两相间的分配产生影响, 因此可以采用多种手段来提高选择性和回收率。 ( 8) 易于连续化操作, 设备简单, 并且可直接与后续提纯工序相连接, 无需进行特殊处理。例如可以采用高分配系数和高选择性的多级逆流分配操作。 ( 9) 分配过程因素较多, 可以采取多种手段来提高分配选择性或过程收率。
双水相萃取的应用
双水相萃取在蛋白质分离纯化中的应用双水相萃取技术( Aqueous two-phase extraction ,ATPE) 是指亲水性聚合物水溶液在一定条件下形成双水相,由于被分离物在两相中分配的不同,便可实 现分离;其双水相体系可由高聚物/高聚物双水相体系、高聚物/无机盐双水相体系、低分子有机物/无机盐双水相体系、表面活性剂双水相体系等组成,被广泛用于生物化学、细胞生物学和生物化工等领域的产品分离和提取。同时,双水相萃取技术作为一种新型的分离技术日益受到重视;此方法可以在室温环境下进行,双水相中的聚合物还可以提高蛋白质的稳定性,收率较高【1】。 1、近年来双水相萃取技术研究综述概述 由于双水相萃取技术在生物工程、医药分析、金属及一些煤矿等化学分析中具有重要作用,因此也一直是分离提纯领域研究的热点。特别是在近几年,随着生物工程技术、生物化学技术、高分子技术的发展,双水相萃取技术的研究也取得了较快的发展。 2008年,郭宪厚【2】对双水相萃取技术进行了综述,阐述了双水相萃取技术的基本原理、特点、工艺流程、物质分配平衡的影响因素及其在生命科学,复杂中药体系的分离以及重金属回收等方面的应用,并对双水相萃取技术的发展前景作了展望。2009年,徐长波、王巍杰【3】对双水相萃取技术进行了综述,并发表了《双水相萃取技术研究进展》,以此综述了双水相萃取技术基本原理、特点、应用及热力学模型,并对双水相萃取技术存在的问题和发展趋势作了论述。2010年,马春宏、朱红【4】等,发表了《双水相萃取技术的应用研究进展》,对双水相萃取技术的具体应用进行了相关综述,简单介绍了双水相萃取技术及其原理、特点, 综述了双水相体系在生物工程( 其中包括萃取分离抗生素、酶、分离提纯蛋白质和萃取其他生物活性物质) 、药物分析和金属分离等方面的应用。2010年,姜大雨、朱红【5】对离子液体双水相萃取的应用研究进行了综述,指出了离子液体双水相的研究取得的一些阶段性的成果,介绍了离子液体双水相体系及其优点, 综述了离子液体双水相体系在生物工业分析、药物分析和金属分离等方面的应用,同时展望了离子液体双水相体系的应用前景。2010年,谭志坚、李芬芳、邢建敏
