大容量输液制剂的生产工艺
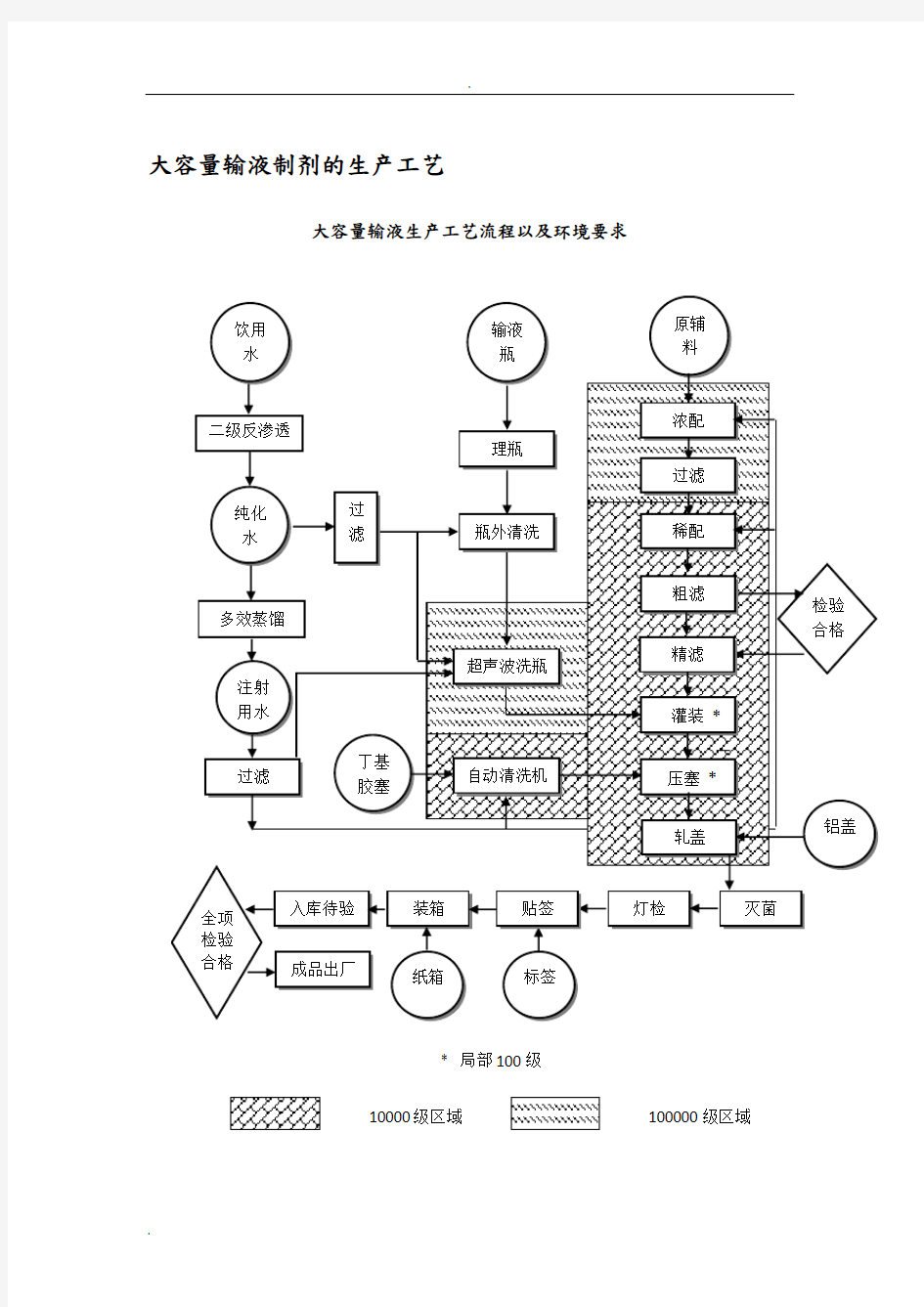

大容量输液制剂的生产工艺
大容量输液生产工艺流程以及环境要求
大容量输液认证检查要点
大输液又名可灭菌大容量注射剂,是指将配制好的药液灌入大于50 ml的输液瓶或袋,加塞、加盖、密封后用蒸汽热压灭菌而制备的灭菌注射剂。
1、机构与人员
a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点
a)洁净区:
我国《药品生产质量管理规》对最终灭菌的无菌药品生产厂房洁净度级别的要:
浓配或采用密闭系统的稀配应在100000级洁净区进行;
稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区进行;
物料、中间品应经过物流缓冲间或传递柜进、出洁净区。称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统
应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施
这些气体因与产品直接接触,不得对产品带来污染。应对系统进行验证。PQ测试项目包括洁净度级别、含水量、含油量等。
d)注射用水(WFI)系统
以纯化水为原水,经多效蒸馏制得。制水系统应能提供足够量的符合质量要求的注射用水。
注射用水制备和分配系统材质应无毒、耐腐蚀,设计和安装应避免死角和盲管;
储罐应密闭,并安装有经完整性检查合格的无菌级别的疏水性过滤器,设有保温装置;
管道通过卡箍连接,有一定的倾斜度,最低位出水,阀门用隔膜
阀而不是球阀;
注射用水的储存应采用80o C以上保温或65o C以上保温循环,应有温度控制和指示装置;
设有必要的取样口包括注射用水储罐的入水口、总出水口和总回水口,并便于取样;储罐、增压泵、管道可以排空便于清洁、消毒或灭菌。
e)纯蒸汽系统
纯蒸汽通常用于与产品接触物品的灭菌及产品的最终灭菌,质量应符合要求,纯蒸汽系统应经过验证并定期监测。
3、设备
a)配制系统
称量用秤的精度应符合物料的称量要求,并定期校验,贴有合格标志。
配制罐体积应与生产批量相匹配,材质应符合要求,禁用铁类容器或露铁搪瓷桶,配有搅拌、降温等装置,可定容。配制罐宜自带称量系统或液位电极、或液位标尺,如采用玻璃液位管应能拆卸,以便清洗。
因配制需要在低于30℃、 CO2饱和的注射用水溶解原辅料,应有有效的控温装置,CO2输送管道终端应连有0.45 μm或精度更高的疏水性过滤器。配有粗滤所需要的0.45μm 过滤器。
配有终端过滤所需要的2个0.22μm过滤器及过滤器完整性测试设备。过滤器的安装应符合工艺要求,一个0.22μm的过滤器应可能接近灌封机(欧盟无菌药品附录要求),与产品直接接触的过滤器材
质应不得吸附药液组分和释放异物(应有验证数据支持)。
反复使用的过滤芯应灭菌干燥后保存,并规定有灭菌有效期和使用次数。
配制系统宜采用密闭系统,并配有自动清洗、消毒或灭菌装置。
管道通过卡箍连接,使用结束应能排空。
b)大输液生产联动线
理瓶机:将拆包取出的输液瓶按顺序排列起来,并逐个送至洗瓶机。
洗瓶机:应安装在100000级洁净区。洗瓶能力应能满足工艺需要,洗净后瓶子的清洁度符合要求。
灌封系统:应安装在10000级洁净区,能有效控制装量,灌装过程中药液无溅壁现象,在药液灌装完成后,要立即封口,以免药液被污染或空气氧化,瓶子封口完好。
灌装头、灌装管道等灌装器具应按规定的程序清洁、消毒或灭菌。
控制与显示关键参数的仪表如:温度,传送速度应经过定期校验,并贴有合格校验标签。
c)灭菌设备
用高压灭菌釜对产品进行湿热灭菌的方法包括冷空气重力置换法、预真空法、脉冲真空法、蒸汽-空气和蒸汽-水-空气灭菌法、过热水浸没灭菌法。
企业应根据产品特性选择合适的灭菌设备,能满足产品的最终灭菌和生产用器具的灭菌要求。
灭菌设备应具灭菌温度、时间自动监测、记录装置,其能力应与生产批量相适应。仪表经过校验,并贴有校验合格标志。
直接与产品接触的器具和产品的灭菌应用纯蒸汽。检漏用色水宜经过灭菌处理。
d)文件
每台主要设备都应建立设备使用标准操作程序(SOP)、清洁、消毒或灭菌标准操作程序、维护保养标准操作程序、使用记录和设备档案。
4、物料的管理要点及检查重点
a)物料的采购
应由具有产品专业知识的人员负责,从企业质量审计合格的供应商处采购。
b)原辅料的检验、贮存及分发
物料应保存于企业规定的适宜的环境中并有明确的标识,质控部门应按批取样、检验、签发。取样应具有代表性,样品应按企业控标准进行检验。原辅料应经质量部门签发后在有效期使用。不合格的原辅料不得用于生产。
c)包装材料
大容量输液灌装的瓶子或袋子经检验合格后方可投入使用。药品标签和说明书应与药品监督管理部门批准的容、式样、文字相一致,经企业质量管理部门校对无误后印制、发放、使用。标签发放、使用、销毁应有记录。
d)不合格品
不合格物料、产品应专区存放,应有易于识别的明显标志,并按有关规定及时处理,并有记录。对不合格产品应查明原因并采取必要的纠正措施。
e)退回产品、收回产品
应按相关程序处理并作适当记录。
5、验证的管理要点及检查重点
a)HVAC系统及洁净室的验证
新车间应进行前验证,包括IQ、OQ和PQ,车间运行一定时间或停止运行后再次使用前应进行再验证。
验证测试项目应重点检查洁净度级别(尘埃粒子、微生物)、高效过滤器完整性(DOP)、压差、温、湿度(应能满足生产工艺要求)、局部100级区的气流流型、洁净室的清洁及消毒措施等。
b)压缩空气、氮气、二氧化碳等辅助系统的验证
新系统应进行前验证,包括IQ、OQ和PQ,系统运行一定时间后应进行再验证。
气体储存及分配系统材质应无毒,并设终端过滤器。
验证测试项目应包括洁净度级别(尘埃粒子、微生物)、含水量、含油量等。
c)注射用水系统的验证
新的注射用水系统应进行前验证,包括IQ、OQ和PQ。
注射用水储罐和分配系统选用材质应无毒、耐腐蚀,管道的设计和安装应避免了死角、盲管,储罐应安装有疏水性过滤器,储罐和管道应能排空,注射用水及分配系统的保温效果应能达到设计要求(80o C以上保温或65o C以上保温循环)。
注射用水质量应不低于中国药典(2005年版)注射用水质量标准,验证测试时间应不少于3周,并应监测季节变化对水质的影响。
企业应根据验证结果规定注射用水系统的清洗、灭菌周期。
企业应制定注射用水系统监测计划,包括对微生物、毒素、理化指标,并按计划对水质进行监测并有完整记录,鼓励企业做趋势分析、年度回顾。
d)大容量输液联动机组的验证
新系统应进行前验证,包括IQ、OQ和PQ,系统运行一定时间后应进行再验证。
洗瓶机清洗安瓿后的洁净程度(清洗后往安瓿中加入注射用水,振摇后检查澄明度和不溶性颗粒)。
灌装机装量准确性、灌装后对瓶子或袋子密封的效果等。
e)湿热灭菌工艺的验证
中国药典(2005年版)要求,对热稳定的产品,可采用过度杀灭法,其无菌保证水平(SAL)应≤10-12,热稳定较差产品的标准灭菌时间F0一般不低于8分钟,此情况下,应在生产全过程中,对产品中污染的微生物严加监控,并采取各种措施降低微生物污染水平,确保被灭菌产品达到无菌保证要求。
在注射液生产中,产品的最终灭菌和与产品直接接触的器具如过
滤器的灭菌等采用湿热灭菌。该产品最终灭菌的工艺参数为121°C 20分钟。进行灭菌验证时,被灭菌物品的数量和装载方式、灭菌温度和时间或F0必须在验证方案中明确规定,至少进行3次空载热分布试验,每种装载方式都至少进行3次负载热穿透试验,并选用合适的生物指示剂。
空载热分布试验和负载热穿透试验至少用12个热电偶,应有热电偶分布示意图,热电偶在每次使用前后均应进行校正。
121°C蒸汽灭菌通常选用中嗜热脂肪芽孢杆菌作为生物指示剂。
验证过程中应考虑灭菌参数的上限和下限,保证灭菌效果和产品质量。
f)工艺验证
工艺验证应在洁净室系统、压缩空气及氮气系统、工艺用水系统、热力灭菌系统、检测方法等验证合格且人员经相关培训考核合格后进行。
应连续3批产品验证合格。验证的批量应与工艺规程规定的相同,关键工艺控制参数如配制工序中的pH值、温度、搅拌时间、瓶输送带速度、灌装工序中的装量、最终灭菌的温度及时间等是应在工艺规程规定的围之。
采集的用于检验的样品应足够,能反映整批产品的质量。如检查安瓿是否清洗干净时,应在清洗安瓿的前、中、后期取样对安瓿的洁净度进行检查;检查装量时,应在灌装的前、中、后期采集了足够的样品并分别进行检验;成品应按灭菌柜次取样并分别作无菌试验等。
工艺验证应包括最差条件,如从配制到灌装或灭菌的时间间隔要
求、灌装期间进入灌装间人员的数量、设备出现故障时进行必要的检修等。
灌装期间应对灌装间进行微生物监测,监测结果应作为产品放行审核的一部分。
变更控制和偏差管理应符合规定,对出现的偏差应进行了调查和记录等。
g)清洁验证
不同产品共用生产设备,或产品不稳定生成了降解产物,或清洁过程引入了外来物质如清洁剂等,应进行清洁验证。清洁验证是对某一具体的清洁程序进行验证。
重点检查清洁程序的可操作性、清洁过程中是否引入了外来物质、允许残留量计算的依据、化学残留量检测方法的灵敏度、是否考虑了所有共用设备、管道中的残留等。
清洁验证判断标准应包括目测、漂洗液取样检验和棉签擦拭取样检验。棉签擦拭取样检验应做回收率试验作为取样、检测方法的依据。
清洁验证通常与工艺验证同时进行,并应包括最差条件如产品批量、生产完成后到清洁的时间间隔、清洁液用量等。
h)检验方法验证
采用药典未收载的检验方法时,应进行检验方法验证。检验方法验证容应包括准确度、精密度、专属性、检测限、定量限、线性、围、耐用性等。微生物限度检查和无菌试验方法的验证过程和容应符合《中国药典》的指导原则。
i)验证文件
验证文件应包括验证主计划、验证方案、SOP、验证报告。验证计划应明确验证项目、验证顺序、组织机构职责等,验证方案应包括验证目的、围、职责、方法、接受标准、相关文件、变更控制及再验证等,SOP应具体,具有可操作性,验证报告应汇总验证全过程、结果、结论及建议等。
6、生产管理
a)配制及粗滤过程
原料含量换算及称量过程应有记录并有第二人复核。
配制工艺参数如溶液的温度、通入CO2的时间、搅拌速度及时间等应在验证过的工艺规程规定的围之,如有偏差应有记录并进行调查。
配制好的药液质量如PH值、含量等应符合要求。不合格的中间产品不得进入下一道工序。
配制完成后,按要求用0.45μm折叠式过滤芯对药液进行了过滤。
设备清洁、消毒或灭菌应按规定的程序进行,并有录。清洁后的设备宜干燥保存,不应有积水。
物料、中间品、设备应有明确的状态标识。如配制的药液应标明产品名称、批号、批量、工序名称(待粗滤或已粗滤)、日期/时间、操作人员等。
b)精滤及灌封过程
安瓿经洗瓶机清洗,洁净度符合要求。
一些重要参数如传送速度等控制在验证的围,应有灭菌/热原应
有自动监测记录。安瓿灭菌后在规定的时间围使用。
应按程序对粗滤后的药液用0.22μm过滤芯进行了精滤。精滤前、后应对过滤器进行完整性试验并合格。
应按规定程序进行灌封。正式灌装前应检查装量、安瓿高度、残氧率以及灌封出的药液澄明度。灌装过程中应按规定定期取样检查装量、外观。
从配液开始到灌封开始的时间间隔不应超过6小时。灌装过程应在规定时间完成。
操作人员应按标准操作程序进行灌装操作,操作应熟练符合规。
应按规定程序及时清场并有记录。
洁净区消毒剂宜临用新配,并轮换使用消毒剂以避免产生耐药菌株。
c)产品灭菌
配药操作从溶解开始到灭菌结束需控制在24小时完成,药液从灌装封到灭菌结束应控制在4小时完成。
灭菌温度应为121℃,保温时间应为20分钟。产品灭菌的批量与装载方式应与验证时一致。现场核对产品灭菌釜灭菌参数的设定与相应的文件规定是否一致。应有灭菌柜自动监测记录。
灭菌结束后应进行检漏并有记录。
d)目检及包装
目检人员的视力应符合要求并按文件规定对产品进行目检。照度为2000LX~3000Lx。标签及其上面打印的批号、生产日期、有
效期应有人员核对并有记录。
e)文件
生产工艺应与注册批准工艺一致。工艺规程应完整包括:品名、剂型、处方和确定的批量、生产工艺的操作要求、物料、中间产品、成品的质量标准和技术参数及贮存注意事项、物料平衡的计算方法、成品容器、包装材料的要求。
批生产记录应能反映生产的全过程,特别是关键的数据及参数不得遗漏。记录应真实、准确、完整、及时,修改数据应保留原始数据仍可辨认。
批记录审核应包括物料的批号及用量、关键的工艺参数如产品灭菌的温度、时间及自动监测记录、产品精滤用滤芯的规格及完整性测试记录、从配制到灌装、灌装过程以及从灌装到灭菌的时间间隔、物料平衡计算及记录、偏差调查及处理记录等。
7、质量管理
a)质量管理部门根据需要设置的实验室应与药品生产区分开。
生物检定、微生物限度检定应分室进行。
b)应有与药品生产规模、品种、检验要求相适应的场所、仪器、设
备以及足够数量的经过培训、考核合格的质量管理和检验人员。
c)企业应有经过批准的书面的物料、中间品、成品的质量标准
和检验操作规程。
d)用于配料的物料应经检验合格,配料用的注射用水使用点,
在配料进行前应取样作毒素检查。
e)应按文件规定及时完成中间产品取样检测,如粗滤前应对配
制的药液取样进行pH 与含量等,不合格中间品不得进入下
一道工序。如采用特殊处理方式,如某些产品因中间品检验
需要较长时间,未等检验结果就进入下一道工序,应有相应
文件规定,并经过验证。
f)无菌产品应按灭菌柜次取样并分别做无菌试验,应包括灭菌
釜冷点取样,取样数量与检验用量应符合中国药典要求。
g)无菌检验供试品处理方法应经过方法学验证。检验用培养基
至少应按干粉批号每批进行灵敏度试验,试验用检定菌品种
应符合中国药典要求。
h)无菌试验结果判断:阳性对照管培养48~72小时应生长良好,阴性对照不得有菌生长。若供试品管中任何一管显浑浊并确认有菌生长,判供试品不符合规定,除非能充分证明试验结果无效,即生长的微生物非供试品所含。无菌试验经确认无效后方可重试。
i)毒素检测每批鲎试剂应做灵敏度复核试验,测试应按药典规
定的方法进行检验。
j)对超出规定围的测试结果,应调查原因并采取纠正措施,避免再次发生。
k)质量管理部门应按规定行使了对物料、中间产品的使用、成品放行的决定权。
l)质量管理部门应按规定行使了对不合格产品的处理程序。
m)质量管理部门应进行药品放行审核并有记录。审核容应包括:配料、称重过程中的复核情况;各生产工序检查记录;清场记录;中间产品质量检验结果;偏差处理;成品检验结果等。符合要求并有审核人
员签字后方可放行,不合格产品不得出厂。大容量输液工艺生产设备
非PVC软袋大输液的生产工艺及市场前景
非PVC软袋大输液的生产工艺及市场前景 非PVC软袋大输液的生产工艺及市场前景 摘要 目前国内软袋包装大部分仍是以玻璃瓶为主,只有少数大型制药企业有能力生产非PVC 软袋输液,因此非PVC软袋大输液的生产技术将成为今后国家鼓励发展和使用的高新技术产品之一。非PVC 软袋技术在发达国家临床应用已十余年,而在我国则是刚刚起步。与传统玻璃瓶及塑料瓶输液相比,非PVC 多层共挤膜输液工艺设计中的关键生产工序实现全密闭,有效避免了二次污染。在使用过程中,非PVC 多层共挤膜包装输液能够依*自身的张力将药液压迫滴出,无需形成空气回路,是一种全新概念的全密闭静脉输液产品。而且该种产品具有重量轻、密闭强度高、不易破碎、不怕冷冻及便于运输、节省空间等优点。非PVC新型输液包装材质机械强度高、表面光滑,而且能够阻止水气渗透,不含任何对人体有害的增塑剂、填充剂、润滑剂,无热源、无溶出物、无不溶性微粒,这些指标均达到或超过了发达国家药典的标准。可以说,非PVC 软袋输液是输液生产工艺和技术的一场革命。本文对非PVC在药品输液剂包装中的使用进行了分析,对我国及FDA对药品内包材料的要求作了简要的阐述,分析了目前输液剂包装存在的不足,阐述了非PVC膜的特点及在国内输液剂中使用的可能性和在国际上使用的发展趋势。 关键词输液剂;非PVC;生产工艺;应用 目录 引言 (3) 1研究背景与目的 (3) 1.1研究背景 (3) 1.2研究目的 (3) 2我国非PVC软袋大输液的现状 (4) 2.1当前软袋大输液发展情况 (4) 2.2我国非PVC软袋大输液的应用情况 (4) 3非PVC软袋大输液的可行性 (5) 3.1目前其它类输液剂包装存在的不足 (5) 3.2应用非PVC软袋大输液的可行性 (6) 3.3非PVC软袋大输液的优点 (6) 4非PVC软袋大输液生产的工艺 (8) 4.1基本工艺流程 (8) 4.2非PVC软袋大输液大输液生产工艺 (9) 5非PVC软袋大输液的市场前景 (9) 结语 (11) 致谢 (11) 参考文献 (12)
注射用水工艺流程
合肥工业大学2011年大学生暑期“三下乡”社会实践活动 优秀调查报告(论文)申报表 报告(论文)标 注射用水工艺流程题 申报者情况第一作者所在学院 医学工程学 院 学历本科专业年级 合作者所在学院 医学工程学 院 学历本科专业年级 指导教师工作单位 医学工程学 院 职务(职称)辅导员 摘要: 注射用水:指符合中国药典注射用水项下规定的水。注射用水为蒸馏水或去离子经蒸馏所得的水,故又称重蒸馏水。 注射用水是生产塑瓶输液的主要原料,注射用水是否合格直接影响产品的质量,是塑瓶输液生产中极其重要的环节。因此对于注射用水生产的各个环节行业内有严格的规定。 关键字:注射用水生产工艺,注射用水的质量检测 校社会 实践领 导小组 意见 学院(社团)推 荐意 签章: 日 签章: 年月年月日
注射用水工艺流程 、摘要 注射用水:指符合中国药典注射用水项下规定的水。注射用水为蒸馏水或去离子经蒸馏所得的水,故又称重蒸馏水。 注射用水是生产塑瓶输液的主要原料,注射用水是否合格直接影响产品的质量,是塑瓶输液生产中极其重要的环节。因此对于注射用水生产的各个环节行业内有严格的规定。 1、对贮水容器(贮罐)的基本要求: ①采用316L不锈钢制作,内壁电抛光并作钝化处理; ②贮水罐上安装0.2 am疏水性的通气过滤器(呼吸器),并 可以加热消毒或有夹套; ③能经受至少121 C高温蒸汽的消毒; ④排水阀采用不锈钢隔膜阀; ⑤若充以氮气,须装0.2 勺疏水性过滤器 过滤。 2、对管路及分配系统的基本要求: ①采用316L不锈钢管材内壁电抛光作钝化处理; ②管道采用热熔式氩弧焊焊接,或者采用卫生夹头分段连 接; ③阀门采用不锈钢聚四乙烯隔膜阀,卫生夹头连接; ④管道有一定的倾斜度,便于排除存水;
大容量注射剂生产工艺流程图
目录 1.大容量注射剂生产区概况 2.需要验证的关键工序及工艺验证3.工艺流程的实施 4.操作过程及工艺条件 5.技术安全、工艺卫生及劳动保护6.物料平衡及技经指标 7.设备一览表 8.岗位定员 9.附件(含设备操作、清洁规程)10.变更记录
1.大容量注射剂生产区概况 本生产区面积904㎡,其中1万级净化区域167㎡,10万级净化区域174㎡。 大容量注射剂车间采用10万级和1万级(局部百级)空气净化洁净级别,10万级区域设置缓冲、更衣、洗涤、洁具、称量、配碳、浓配、洗瓶等,1万级区域设置缓冲、更衣更鞋、稀配、化验、灌装、加塞、轧盖、洗涤、存放、洁具等功能间,所有隔断采用无粉尘产生的静电喷涂彩钢板,结合处采用圆角处理,不易产生积灰;人员经过三次更衣和二次更鞋后进入洁净区操作,物料进入洁净区均采用传递窗或气闸进行传递,人流、物流的进入相对分开,保证了洁净区空气洁净度要求;生产设备均采用优质不锈钢材料制造,采用洗瓶、灌装、压塞、轧盖联动线生产,其中洗瓶出口、灌装、加塞采用百级层流保护,灭菌器采用水浴式灭菌器。 1.1 大容量注射剂生产工艺流程图(见后页) 1.2 大容量注射剂生产区工艺布局布置图(见后页) 1.3 大容量注射剂生产区工艺设备布置图(见后页) 1.4 大容量注射剂生产区送回风口平面布置图(见后页) 2.需要验证的关键工序及工艺验证 以上项目按验证文件规定,均已在规定周期内进行相关的验证,验证方案及报告见相应文件。
大容量注射剂生产工艺流程图
3.工艺流程的实施 3.1 批生产指令的签发 3.1.1 批生产指令由车间技术负责人根据生产计划表起草,并依据产品工艺规程于生产前一个工作日制定。 3.1.2 批生产指令应经QA质监员审核并签字,由车间主任签字批准后生效。 3.2 生产批记录的发放 3.2.1 除配制工序和包装工序外,工序相应的生产批记录于生产当日由车间工艺质监员发放给各工序负责人,并于工序结束当日填写完整返回车间工艺质监员处汇总。 3.2.2 配制工序和包装工序的生产批记录于生产前一天由车间工艺质监员随同批生产指令或批包装指令一同发放,并于工序结束当日填写完整返回车间工艺质监员处汇总。 3.2.3 所有生产工序必须按批生产(包装)指令执行。 3.3 工艺用水的管理使用 3.3.1 纯化水、注射用水系统由工程设备科管理,制水工序制备而得。 3.3.2 按照SMP-ZL-qa024,纯化水每周生产第一个工作日由QA质监员取样送QC检验,注射用水在生产期间每天下午三点由QA质监员取样送QC检验, QC检验合格后出具报告单由QA质监员交至车间工艺质监员。 3.3.3 车间配料岗位投料前,确认所用注射用水经检验符合规定,记录使用注射用水的批号检验报告单附批生产记录中。 3.3.4 车间在没有收到工艺用水检验报告单的情况下,不得进行生产操作。 3.4 各工序取(留)样一览 3.5 批包装指令的签发 3.5.1 车间技术负责人在灭菌工序完成后对半成品数量、质量等方面进行审核并对照生产工艺检查已完成的工作是否按工艺执行。 3.5.2 车间技术负责人计算理论成品率和预计成品率后根据SMP-JS-016判定生产是否异常,如有异常按SMP-JS-012调查分析原因。 3.5.3 批审查通过后车间技术负责人依据产品工艺规程于包装前一个工作日签发批包装指令。批包装指令应经QA质监员审核并签字,由车间主任签字批准后生效。
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点 -------------制备注射用水 一.用于蒸馏器 1)水源:去离子水 2)冷却水:洁净的软水(即生活用水) 二.蒸馏水质量检查 1)生产时:每台每隔2小时检查氯化物,酸碱度,易氧化物的铵盐2)贮藏时:每星期全项检查一次 三.蒸馏水贮藏条件 1)容器:不锈钢罐或搪瓷罐 2)温度:80摄氏度以下 3)时间: 不超过12小时 -------------洗输液瓶 一.常水冲洗 1)温度: 60摄氏度~70摄氏度 2)压力: 不低于9.81×10Pa 3)时间: 不低于三秒 4)次数: 2~3次 二.精洗 1)次数: 2~3 次 2)压力: 不低于9.81×Pa 3)时间: 不少于3秒 4)末道滤材: 0.8~1.2um微孔滤膜 5)蒸馏水澄明度: 200ml容量瓶不得有可见异物 -------------配液 一.浓配 1)活性炭用量: 0.02%(g/ml) 2)煮沸时间: 10~15min 3)药液浓度不低于50% 二.稀配 1)活性炭用量0.01%(g/ml) 2)药液温度: 40~60摄氏度 质量检查: 1)含量:97.5%~102.5%
2)PH: 应符合规定 三.滤材 1)炭脱: 砂棒或钛合金制成的滤棒 2)初滤: 垂熔玻璃滤器 3)精滤: 0.8~1.2um 微孔滤膜 四.微孔滤膜 1)磨砂棒灯检: 均无亮点 2)起泡点试验: 合格 五.无菌要求 配料间空气菌落数: 9cm培养皿,暴露空间30minih 小于15个 六.药液温度控制: 含盐品种: 40~50摄氏度 七.药液温度控制: 含糖品种: 50~60摄氏度 -------------洗涤纶薄膜 质量要求 1)乙醇浓度: 95% 2)浸泡时间: 大于8小时 3)加盐煮沸: 100摄氏度. 30min,消除静电效应 4)漂洗水澄明度: 200ml容量瓶仅允许有微量白点 -------------洗涤橡皮塞 一.NaOH 1)浓度: 1%(g/ml) 2)温度: 100摄氏度 3)时间: 30分钟 二.HCl 1)浓度: 1%(g/ml) 2)室内温度15~25摄氏度浸泡 3)时间30分钟 三.洗胶塞水澄明度检查: 200ml容量瓶检查允许微量白点 -------------灌装 一.药液澄明度: 200ml容量瓶检查应无异物 二.容量 1)500ml : 500~510ml 2)250ml : 250~255ml 三.药渡稀释到灌装时间: 不超过4小时 四.空气菌落数: 9cm培养皿,暴露空间30min<10个 -------------轧盖
常见输液反应及处理流程
常见输液反应及处理流程 一、发热反应 临床表现 多发生于输液后数分钟至1小时,患者表现为发冷、寒战、发热。轻者体温在39°C左右,停止输液后数小时内可自行恢复正常;严重者初起寒战,继之高热,体温可达40°C以上,并伴有头痛、恶心、呕吐、脉速等全身症状。 处理流程 发热反应轻者,立即减慢点滴速度或停止输液→及时通知医生; 发热反应重者,立即停止输液→保留剩余溶液和输液器,必要时送检做细菌培养,查找发热反应的原因; 高热患者,给予物理降温→严密观察生命体征的变化→必要时给予抗过敏药物或激素治疗。 二、循环负荷过重反应(急性肺水肿) 临床表现 患者突然出现呼吸困难、胸闷、咳嗽、咯粉红色泡沫痰(像粉色的雪沫,急性肺水肿之特征样表现),严重时痰液可从口、鼻涌出。听诊肺部布满湿啰音,心率快且节律不齐。 处理流程 出现上述临床表现→立即停止输液→迅速通知医生进行抢救。 如果病情允许,可协助患者取端坐位,双腿下垂,减少下肢静脉回流,减轻心脏负担,安慰患者减轻其紧张心理,给予高流量吸氧,6-8L/min,提高肺泡内压力,减少肺泡内毛细血管渗出液的产生。 湿化瓶内加入20%-30%乙醇溶液,减低肺泡内泡沫表面的张力,使泡沫破裂消散,改善气体交换,减轻缺氧症状,再给予镇静、平喘、强心、利尿和扩血管药物,以稳定患者紧张情绪,扩张周围血管,加速液体排出,减少回心血量,减轻心脏负担。 必要时四肢轮扎,有效减少回心血量。
三、静脉炎 临床表现 延静脉走向出现条索状红线,局部组织发红、肿胀、灼热、疼痛,有时伴有畏寒、发热等全身症状。 处理流程 停止在此部位静脉输液,患肢抬高、制动,局部用50%硫酸镁或95%乙醇溶液行湿热敷,每日2次,每次20分钟,超短波理疗,每日1次,每次15-20分钟。 中药治疗,将如意金黄散加醋调和成糊状,局部外敷,每日2次,清热、止痛、消肿,合并感染者,给予抗生素治疗。 四、空气栓塞 临床表现 患者感到胸部异常不适或有胸骨后疼痛,随即发生呼吸困难和严重的发绀,并伴有濒死感。听诊心前区可闻及响亮的、持续的“水泡声”。心电图呈现心肌缺血和急性肺心病的改变。 处理流程 出现上述临床表现,立即将患者置于左侧头低脚高位,以利气体浮向右心室尖部,避免堵塞肺动脉入口,高流量吸氧,提高患者血氧浓度,纠正缺氧,有条件可用中心静脉导管抽出空气,严密观察患者表情变化,如有异常及时对症处理。 五、过敏反应 按患者临床表现轻重,分轻度过敏反应及过敏性休克两种。 (一)轻度过敏反应
500mL大输液车间生产工艺解析
目录 1 前言..............................................................................1.1 输液剂概念 (1) 1.1.1 输液剂的定义 (1) 1.1.2 输液剂的特点 (1) 1.1.3 输液剂的质量要求 (1) 1.1.4 输液剂的应用 (2) 1.2 输液剂生产工艺 (2) 1.3 设计任务 (2) 1.3.1 设计药品 (2) 1.3.2 设计任务简介 (3) 2 右旋糖酐70葡萄糖注射液简介 (3) 2.1 处方组成 (3) 2.2 药理作用 (4) 3 工艺流程设计 (4) 3.1 工艺流程简图 (5) 3.2 工艺流程论证 (7) 4 工艺计算 (13) 4.1 计算基准 (13) 4.2 物料衡算 (13) 5 定型设备选择 (14) 5.1 选择设备型号、规格、数量 (14) 5.1.1 BSY50/500型玻璃瓶大输液生产线 (14) 5.1.2 QG180型启盖机 (15) 5.1.3 QJW6型外洗机 (15) 5.1.4 QJB24(16)型超声波洗瓶机 (16) 5.1.5 GFA1型灌封机 (16) 5.1.6 上瓶机、卸瓶机、灯检机、贴签机 (17) 6 车间GMP设计要求 (20) 6.1 GMP简述 (20) 6.2 车间GMP设计要求 (20) 6.2.1 大输液生产车间设计一般性要求 (21) 7 车间工艺设计 (21) 7.1 生产工艺流程图 (21) 8 结束语 (22) 参考文献 (23)
1 前言 1.1 输液剂概述 1.1.1 输液剂的定义 输液(infusion solution)是通过静脉滴注输入体内的大剂量(一次给药在100mL以上)注射液。它不仅可以补充必要的营养、热能和水分,以维持体内水、盐(电解质〕的平衡,而且对改善血液循环,防止和治疗休克,调节酸碱平衡,稀释和排泄毒素,经静脉滴注给药等均有重要作用。通常包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。使用时通过输液器调整滴速,持续而稳定的进入静脉,以补充体液, 电解质或提供营养物质。例如:生理盐水, 等渗葡萄糖注射液, 水解蛋白注射液及右旋糖酐注射液等。近年又出现了治疗行输液。由于其用量大而且是直接进入血液的,故质量要求高,生产工艺亦与小针注射剂有一定差异。 1.1.2 输液剂的特点 输液剂能够补充营养、热量和水分,纠正体内电解质代谢紊乱;维持血容量以防治休克;调节体液酸碱平衡医学教育`网搜集整理;解毒,用以稀释毒素、促使毒物排泄;抗生素、强心药、升压药等多种注射液加入输液剂中静脉滴注,起效迅速,疗效好,且可避免高浓度药液静脉推注对血管的刺激。 1.1.3 输液剂的质量要求 除应符合注射剂一般要求外,尚有下列特殊要求:①应具有适宜的渗透压,等渗或略高渗;②输液的pH值力求接近人体血液的pH值;③应无毒副作用,输入体内不会引起血象的异常变化,不损害肝、肾等脏器,某些输液还要求无致
输液反应的应急预案、流程及处理方法(20200913015933)
输液反应时应急预案、流程及处理 1、患者发生输液反应时,应立即撤除所输液体,重新更换液体和输液器。 2、病情紧急的患者准备好抢救的药品及物品,同时报告医生,并遵医嘱给药。 3、情况严重者应就地抢救,必要时进行心肺复苏。 4、建立护理记录,记录患者生命体征,一般情况和抢救过程。 5、发生输液反应时,应及时报告院感办、护理部和药剂科。并按要求填写输液反应报告卡,上报护理部。 6、将保留液体、输液器分别送药剂科和消毒供应中 心。 7、患者家属有异议时,立即按有关程序对输液器具进行封存。
流程:
输液反应的处理 输液反应是医疗活动中极为常见的现象,其本身并无致死性。但它可诱导病人基楚疾病恶化而带来生命危险。临床中应重在防范;一旦发生,判断要准确,处置要果断。 ㈠发热反应处理方法: 1?不要拨掉静脉针头,一定保留好静脉通道,以备抢救用药。一旦拨掉 静脉通道,当病人需抢救时再建静脉通道,会错过抢救时机; 2?换上一套新的输液器管道及与原液体性质不同的液体(如原来是糖水则换成生理盐水),可暂不加药,待病情稳定后再议加药; 3?五联用药: ①吸氧;②静注地塞米松10--15mg (小儿0.5-1mg/kg.次)或氢化可的松100mg(小儿5--10mg/kg.次);③肌注或静注苯海拉明20--40mg (小儿0.5-- 1mg/kg.次);④肌注复方氨基比林2ml (小儿0.1ml/kg.次)或口服布洛芬悬液;⑤如未梢发凉或皮色苍白可肌注或静注654-2 5mg小儿0.1--0.5mg/kg. 次)。一般在用药30分钟后汗出热退而平稳下来。 ㈡急性肺水肿 处理方法:
注射剂生产车间工程设计[001]
注射剂生产车间工程设计 最终灭菌小容量注射剂车间GMP设计 (1)最终灭菌小容量注射剂生产过程包括原辅料的准备、配制、灌封、灭菌、质检、包装等步骤,按工艺设备的不同型式可分为单机生产工艺和联动机组生产工艺两种,其流程及环境区域划分(见图A B)。
关于水针各单机设备和联动机组设备的具体内容详见前。 (2)按照GMP的规定最终灭菌小容量注射剂生产环境分为三个区域:一般生产区、10万级洁净区、1万级洁净区。一般生产区包括安瓿外清处理、半成品的灭菌检漏、异物检查、印包等;10万级洁净区包括物料称量、浓配、质检、安瓿的洗烘、工作服的洗涤等;1万级洁净区包括稀配、灌封,且灌封机自带局部100级层流。洁净级别高的区域相对于洁净级别低的区域要保持5~10Pa的正压差。如工艺无特殊要求,一般洁净区温度为18~26℃,相对湿度为45%~65%。各工序需安装紫外线灯。 (3)车间设计要贯彻人、物流分开的原则。人员在进入各个级别的生产车间时,要先更衣,不同级别的生产区需有相应级别的更衣净化措施。生产区要严格按照生产工艺流程布置,各个级别相同的生产区相对集中,洁净级别不同的房间相互联系中设立传递窗或缓冲间,使物料传递路线尽量短捷、顺畅。物流路线的一条线是原辅料,物料经过外清处理,进行浓配、稀配;另一条线是安瓿瓶,安瓿经过外清处理后,进入洗灌封联动线清洗、烘干.两条线汇聚于灌封工序。灌封后的安瓿再经过灭菌、检漏、擦瓶、异物检查,最后外包成整个生产过程。具体进出水针车间的人流、物流路线(见图)所示。
(4)辅助用房的合理设置是制剂车间GMP没计的一个重要环节。厂房内设置与生产规模相适应的原、辅材料,半成品、成品存放区域,且尽可能靠近与其联系的生产区域,减少运输过程中的混杂与污染。存放区域内应安排待验区、合格品区和不合格品区;贮料称量室,并且要有利于包括空调风管在内的公用管线的布置。 (5)水针生产车间内地面一般做耐清洗的环氧自流坪地面,隔墙采用轻质彩钢板,墙与墙、墙与地面、墙与吊顶之间接缝处采用圆弧角处理,不得留有死角。 (6)水针生产车间需要排热、排湿房间有浓配间、稀配间、工具清洗间、灭菌间、洗瓶间、洁具室等,灭菌检漏需考虑通风。公用工程包括给排水、供气、供热、强弱电、制冷通风、采暖等专业设汁应符合GMP原则。 车间设计举例图 车间设计举例图是水针生产联动机组工艺车间布置图采用浓配加稀配的配料方式,具体布置(见图)。
年产5200万瓶大输液葡萄糖注射液车间GMP工艺设计
年产5200万瓶大输液葡萄糖注射液车间GMP工艺设计
课程设计说明书 题目: 年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计 院系: 制药工程系 专业班级: 制药工程07-1班 学号: 2 0 0 7 1 3 2 8 6 学生姓名: 张世平 指导教师: 江章应 1 月 6 日
安徽理工大学课程设计(论文)任务书 化学工程学院制药工程系 学号学生姓名张世平专业(班级) 制药工程07-1班 设计题目年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计 设技术参数计(1)年工作日 255天。 (2)生产班制一天两班,按每班6h生产计。(3)产品规格 500ml/瓶,玻璃瓶。 设计要求(1)根据上述条件设计一条完整的GMP生产线,写出完整的设计说明书,完成相关的附图。 (2)合理选择设计方案、工艺操作参数和计算公式,计算准确。 (3)设计计算说明书书写规范,文字准确简练,图标清晰规范。 (4)设备主要技术参数符合国家标准。 (5)前言、后记及参考文献。 工 作 量 设计计算说明书一份,GMP工艺流程图一份。 工作计划设计时间二周 12月27日—布置设计任务; 12月28日至12月31日)—完成设计方案的选定和初步设计计算; 1月4日至1月7日—完成设计计算说明书抄写及绘图、装订。 参考资料<制药工艺给水系统>、<制药工程课程设计>、<药厂反应工程与车间设计>等
指导教师签字系主任签字 12月20日 目录 第一章前言 1.1 简介 大输液为大容量注射剂,是中国医药行业五大类重要制剂之一,在临床上应用广泛。随着中国医疗技术的进步和人民生活水平的提高,近十多年来,输液剂的研究取得了令人瞩目的成绩。当前,中国经批准上市的新品种达100余种;输液产量从1990年的6.34亿瓶增加到的35亿瓶,输液剂的种类也发生了很大的变化,进一步满足了临床治疗的需要。 输液又名打点滴或者挂水。是由静脉滴注输入体内的大剂量 (一次给药在100ml以上)注射液。一般包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。使用时经过输液器调整滴速,持续而稳定地进入静脉,以补充体液、电解质或提供营养物质。由于其用量大而且是直接进入血液的,故质量要求高,生产工艺等亦与小针注射剂有一定差异。
输液反应的应急预案、流程及处理方法
患者发生输液反应时的应急预案、流程及处理 1、患者发生输液反应时,应立即撤除所输液体,重新更换液体和输液器。 2、病情紧急的患者准备好抢救的药品及物品,同时报告医生,并遵医嘱给药。 3、情况严重者应就地抢救,必要时进行心肺复 苏。 4、建立护理记录,记录患者生命体征,一般情况和抢救过程。 5、发生输液反应时,应及时报告院感科、医教科和药剂科。并按要求填写输液反应报告卡,上报医教科。 6、将保留液体、输液器进行封存。 7、患者家属有异议时,立即按有关程序对输液器具进行封存。
输液反应处理流程
严密观察病悄变化 药剂科、咲教科、院感科输液反应的处理
输液反应是医疗活动中极为常见的现象,其本身并无致死性。但它可诱导病人基楚疾病恶化而带来生命危险。临床中应重在防范;一旦发生,判断要准确,处置要果断。 一、发热反应处理方法: 1?不要拨掉静脉针头,一定保留好静脉通道,以备抢救用药。一旦拨掉静脉通道,当病人需抢救时再建静脉通道,会错过抢救时机; 2?换上一套新的输液器管道及与原液体性质不同的液体(如原来是糖水则换成生理盐水),可暂不加药,待病情稳定后再议加药; 3. 按医嘱给予对症处理:吸氧、糖皮质激素、镇静解热剂等处理。 二、急性肺水肿 1. 注意控制输液速度和输液量尤其对老人、小儿和心肺功能不全的病人。 2. 一旦出现上述症状,立即停止输液并通知医生进行紧急处理。如 病情允许,使病人呈端坐位,双腿下垂,以减少下肢静脉回流,减轻心 脏负担。 3. 高流量氧气吸入。 4. 遵医嘱给予镇静剂、平喘、强心、利尿和扩血管药物。 5. 给予心理安慰,解除病人的紧张情绪。 6. 必要时进行四肢轮扎。方法:用橡胶止血带或血压计袖带适当加压四肢,以阻断静脉回流,但动脉血仍可通过。每5? 10 min 轮流放松一个肢体上的止血 带。症状缓解后,逐渐解除止血带。 三、静脉炎 1. 严格执行无菌操作,对血管壁有刺激性的药物应充分稀释后再用。 2. 有计划地更换输液部位,以保护静脉。 3?停止在出现炎症的静脉输液,并将该肢体抬高、制动,局部用50 %硫酸 镁溶液湿敷,2次/ d ,每次20 min。 4. 红外光局部照射,1次/ d ,每次15? 20 min。
输液反应-抢救流程图
输液反应抢救流程图 立即停止输液,保留通道并更换液体(5%葡萄糖液或生理盐水);保留输液袋发热反应:发冷、寒战、并伴有恶心、呕吐、头痛、脉快、周身不适等症状 肺水肿:胸闷、气短、咳粉红色泡沫样痰; 空气栓塞:胸部异常不适,频死感,随即出现呼吸困难,严重紫绀 ? 气道阻塞 紧急评估 有无气道阻塞 呼吸异常有无呼吸,呼吸的频率和程度 有无脉搏,循环是否充分 神志是否清楚呼之无反 应,无脉搏 无上述情况或经处理 解除危及生命的情况 后 发热反应肺水肿 如在输液过程中出现胸闷、 清除气道异物, 保持气道通畅: 大管径管吸痰 气管切开或插管 心肺复苏 空气栓塞气短、咳 在输液过程中患者出现发粉红色泡沫样痰等症状时,详询患者热、寒战,而无胸闷、气短、或家属后排除心脏本身疾患,则考虑呼吸困难、胸部异常不适等输液反应所致,常因输液速度过快导症状,详询病史无其它原因,致左心衰症状 则按输液发热反应对症处理如输液时患者出现胸部异常不适,频死感,随即出现呼吸困难,严重紫绀,应考虑空气栓塞,则按以下 ●吸氧 ● 寒战时,肌内注射异丙嗪25mg 或静脉注射 ● 高热者物理降温温度较高者应用退热药如安痛定肌肉注射、口服布洛芬、应用退热栓等; ●肌注或静注苯海拉明20— 40mg ●静注地塞米松 10—15mg ●如末梢发凉或皮肤苍白可肌注或静注 6542,5mg●一般在用药 30 分钟后汗出热退而平稳下来。●端坐卧位,两腿下垂,以减 少静脉回流; ●吸氧 ●强心剂,西地兰0.4-0.6mg ⑤利尿,静脉注射速尿 40-80mg,以减少血容量。 血管扩张剂,可选用消心痛 10-20mg 舌下含服或硝普钠 20ug/分、酚妥拉明 0.1mg/分静 脉滴注。 ● 氨茶碱,静脉缓慢注射 ● 糖皮质激素,静脉注射地塞 米松 10-20mg 方法处理 ●立即使病人左 侧卧位和头低脚 高位; ●氧气吸入
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点 -------------制备注射用水 一.用于蒸馏器 1)水源:去离子水 2)冷却水:洁净的软水(即生活用水) 二.蒸馏水质量检查 1)生产时:每台每隔2小时检查氯化物,酸碱度,易氧化物的铵盐 2)贮藏时:每星期全项检查一次 三.蒸馏水贮藏条件 1)容器:不锈钢罐或搪瓷罐 2)温度:80摄氏度以下 3)时间: 不超过12小时 -------------洗输液瓶 一.常水冲洗 1)温度: 60摄氏度~70摄氏度 2)压力: 不低于9.81×10Pa 3)时间: 不低于三秒 4)次数: 2~3次 二.精洗 1)次数: 2~3 次 2)压力: 不低于9.81×Pa 3)时间: 不少于3秒 4)末道滤材: 0.8~1.2um微孔滤膜 5)蒸馏水澄明度: 200ml容量瓶不得有可见异物 -------------配液 一.浓配 1)活性炭用量: 0.02%(g/ml) 2)煮沸时间: 10~15min 3)药液浓度不低于50% 二.稀配 1)活性炭用量0.01%(g/ml) 2)药液温度: 40~60摄氏度 质量检查: 1)含量:97.5%~102.5%
2)PH: 应符合规定 三.滤材 1)炭脱: 砂棒或钛合金制成的滤棒 2)初滤: 垂熔玻璃滤器 3)精滤: 0.8~1.2um 微孔滤膜 四.微孔滤膜 1)磨砂棒灯检: 均无亮点 2)起泡点试验: 合格 五.无菌要求 配料间空气菌落数: 9cm培养皿,暴露空间30minih 小于15个 六.药液温度控制: 含盐品种: 40~50摄氏度 七.药液温度控制: 含糖品种: 50~60摄氏度 -------------洗涤纶薄膜 质量要求 1)乙醇浓度: 95% 2)浸泡时间: 大于8小时 3)加盐煮沸: 100摄氏度. 30min,消除静电效应 4)漂洗水澄明度: 200ml容量瓶仅允许有微量白点 -------------洗涤橡皮塞 一.NaOH 1)浓度: 1%(g/ml) 2)温度: 100摄氏度 3)时间: 30分钟 二.HCl 1)浓度: 1%(g/ml) 2)室内温度15~25摄氏度浸泡 3)时间30分钟 三.洗胶塞水澄明度检查: 200ml容量瓶检查允许微量白点 -------------灌装 一.药液澄明度: 200ml容量瓶检查应无异物 二.容量 1)500ml : 500~510ml 2)250ml : 250~255ml 三.药渡稀释到灌装时间: 不超过4小时 四.空气菌落数: 9cm培养皿,暴露空间30min<10个 -------------轧盖
年产5200万瓶大输液(葡萄糖注射液)车间GMP工艺设计
课程设计说明书题目: 年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计 院系: 制药工程系 专业班级: 制药工程07-1班 学号: 2 0 07 1 328 6 学生姓名: 张世平 指导教师:江章应 2011年1月6 日
安徽理工大学课程设计(论文)任务书 化学工程学院制药工程系 学号 2007132 86 学生姓名张世平专业(班级) 制药工程07-1班 设计题目年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计设 技术参数计(1)年工作日255天。 (2)生产班制一天两班,按每班6h生产计。(3)产品规格500ml/瓶,玻璃瓶。 设计要求(1)根据上述条件设计一条完整的GMP生产线,写出完整的设计说明书,完成相关的附图。 (2)合理选择设计方案、工艺操作参数和计算公式,计算准确。 (3)设计计算说明书书写规范,文字准确简练,图标清晰规范。(4)设备主要技术参数符合国家标准。 (5)前言、后记及参考文献。 工 作 量 设计计算说明书一份,GMP工艺流程图一份。 工作计划设计时间二周 2010年12月27日—布置设计任务; 12月28日至12月31日)—完成设计方案的选定和初步设计计算;2011年1月4日至1月7日—完成设计计算说明书抄写及绘图、装订。 参考资料《制药工艺给水系统》、《制药工程课程设计》、《药厂反应工程与车间设计》等
指导教师签字系主任签字 2010年12月20日 目录 第一章前言 1.1简介 大输液为大容量注射剂,是我国医药行业五大类重要制剂之一,在临床上应用广泛。随着我国医疗技术的进步和人民生活水平的提高,近十多年来,输液剂的研究取得了令人瞩目的成绩。目前,我国经批准上市的新品种达100余种;输液产量从1990年的6.34亿瓶增加到2003年的35亿瓶,输液剂的种类也发生了很大的变化,进一步满足了临床治疗的需要。 输液又名打点滴或者挂水。是由静脉滴注输入体内的大剂量(一次给药在100ml以上)注射液。通常包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。使用时通过输液器调整滴速,持续而稳定地进入静脉,以补充体液、电解质或提供营养物质。由于其用量大而且是直接进入血液的,故质量要求高,生产工艺等亦与小针注射剂有一定差异。 1.2 输液的分类及临床用途 1.电解质输液用以补充体内水分、电解质,纠正体内酸碱平衡等。如氯化钠注射液、复方氯化钠注射液、乳酸钠注射液等。 2.营养输液用于不能口服吸收营养的患者。营养输液有糖类输液、氨基酸输液、脂肪乳输液等。糖类输液中最常用的为葡萄糖注射液。氨基酸输液与脂肪乳输液将在后面专门论述。 3.胶体输液用于调节体内渗透压。胶体输液有多糖类、明胶类、高分子聚合物类等,如右旋
输液反应的抢救流程
输液反应的抢救流程 This model paper was revised by the Standardization Office on December 10, 2020
输液反应的抢救流程 导语 简单说,输液反应就是热源反应所致的寒战高热,与“速发型过敏反应”不同,应给予准确判断。 一、过敏性休克的抢救程序 过敏性休克: %盐酸肾上腺素毫升静注、继以1毫升肌注或皮下注射、必要时重复抗组织胺药:如非那根25~50毫克肌注保证呼吸道通畅,必要时气管切开、吸氧氢化可的松200~400毫克加入100毫升葡萄糖液中静滴酌情选用血管活性药。 过敏性休克诊断要点及抢救措施 诊断: 1、有过敏接触史 2、表现胸闷、喉头堵塞感、继而呼吸困难、紫绀、濒死感,严重者可咳出粉红色泡沫样痰; 3、常有剧烈的肠绞痛,恶心、呕吐、或腹泻; 4、意识障碍,四肢麻木、抽搐、失语、大小便失禁、脉细弱、血压下降。 抢救: 1、立即应用肾上腺素; 2、静脉快速注入肾上腺皮质激素; 3、扩容; 4、吸氧或高压给氧; 5、给予钙剂及抗组织胺药物;
6、及时处理喉头水肿、肺水肿、脑水肿等; 措施: 1、%肾上腺素~毫升肌注或静注; 2、去甲肾上腺素1~4毫克溶于500毫升溶液中静滴; 3、地塞米松10~20毫克加5%葡萄糖100毫升(静滴); 4、10%葡萄糖酸钙20毫升,静脉缓注; 5、氨茶碱克加50%糖40毫升静脉缓注; 6、平衡晶水:500~1000毫升静滴。 二、肺水肿诊断要点及抢救措施 诊断: 1、严重的呼吸困难,端坐呼吸,口唇发绀,大汗淋漓; 2、阵发性咳嗽,伴有白色或粉红色泡沫样痰; 3、肺部可闻及湿性罗音与鼾鸣声或大量痰鸣音; 抢救: 1、吸氧或高压给氧; 2、选用血管扩张剂; 3、选用强心、利尿剂; 4、给激素药物; 5、四肢结扎、半坐位。
年产1000万瓶250ml大输液车间工艺设计
*****大学 年产1000万瓶250ml大输液车间工艺设计 专业:********** 班级: ********** 学号:**********
姓名:* * * 指导教师:* * * 二零一二年十一月一日 目录 一、前言2222222222222222222222222222222(2) 1.1 注射剂概述222222222222222222222222222(2) 1.2 大输液生产工艺2222222222222222222222222(3) 二、葡萄糖大输液简介2222222222222222222222222(3) 2.1 葡萄糖处方组22222222222222222222222222(3) 2.2 葡萄糖药理作用2222222222222222222222222(3) 三、工艺流程设计222222222222222222222222222(3) 3.1 工艺流程设计22222222222222222222222222(3) 3.2 工艺流程说明22222222222222222222222222(4) 四、工艺计算22222222222222222222222222222(4) 4.1 设计依据2222222222222222222222222222(4) 4.2 物料衡算2222222222222222222222222222(5) 五、定型设备选择222222222222222222222222222(6) 5.1 全套生产线概述2222222222222222222222222(6) 5.2设备一览表2222222222222222222222222222(10) 六、车间GMP设计要求22222222222222222222222222(11) 6.1大输液车间GMP要求22222222222222222222222(11)综述222222222222222222222222222222222(12)参考文献2222222222222222222222222222222(13)
大输液生产工艺流程资料讲解
一、制水岗位 (一) 准备与清场 1、操作者着一般区工作服,准备好检测试剂。 2、按清场记录要求清场,由质监员验收合格后方可操作。 (二) 电渗析器操作 1、开机程序: (1)先排尽饮用水污水,开F4、7、8、9、10,开滤过饮用水泵并同时缓开浓淡,极水阀(F1、F3、F2),使流量浓淡水为500L/h,极水80L/h; (2)开整流器:选择正反向电极,逐步升高电压至120~140V; (3)测淡水水质,合格后调整阀门(正向时开F6关F7,负向时开F4关F5) 将淡水导入淡水箱。 2、停机程序: (1)调整阀门(正向时开F7关F6,负向时开F4关F5)依次将电压转向开关调至零。 (2) 关闭整流器, 继续通水3~4min后关泵及阀门。 3、倒换电极: (1)应定期倒换电极,以防结垢; (2)调整阀门(正向开F7关F6,负向时开F4关F5)调节电压至零,调整流量(淡、浓)继续通水2~3min,按倒相钮,逐步升高电压到操作值; (3)测淡水水质合格后,方可将淡水导入淡水池。 4、化学清洗: (1)视情况每月一次,以免影响生产; (2)切断整流器电源,以2%的盐酸打入浓淡极室箱循环约2h; (3)待pH值稳定后,于用饮用水冲洗至与饮用水相近的pH值时方可运行。 (4)某些情况必须用2%NaOH进行清洗。 5、运行注意点 (1)开机应先通水后通电,停机应停电后停水; (2)开停机时应同时缓开、闭浓淡、极水阀,使浓淡水压平衡上升且高于极水压0.01~0.02mpa,但不得超过0.3mpa。 (3)操作者应常巡视,及时调整水压、流量、电压,并按时行水质检查,认
真填写操作记录。 (三)复床加混床树脂操作 1、制水 (1)开车:依次开交换柱F3、2、6、10、23后,开淡水泵,检验水质合格后,关F23、开F12 导入纯水箱。 (2)停车:关闭水泵,关F3、2、6、10、12。 2、再生再生前应配好5%的Hcl和NaOH。 (一)阳柱再生 (1)反洗:开F24、4、19及排水帽后,启动淡水泵,待树脂松散后,关闭泵及F24、4、19排水帽。 (2)加酸:开F15、22、3、2、19、18后启动酸泵,调节F1至排出液pH值为1时,关闭泵及所开阀门浸泡2h。 (3)冲酸:开F24、3、2、18、19用电渗析水冲至pH为7。 (二)阴柱再生 (1)反洗:开F24、4、20、18及排水帽后启动淡水泵,待树脂松散后关泵及所开阀门。 (2)加碱:开F14、22、3、7、20后动碱泵调节F5至排出水pH为14 时关泵及阀门,浸泡2h。 (3)冲碱:开F24、3、7、20、18用电渗析水冲至pH为7。 (三)混柱再生 (1)反洗分层:配好10%的Nacl液后,开F4、21及排水帽及启动淡水泵,至阴阳树脂分层后,关闭泵及所开阀门。 (2)加碱:开F14、22、3、7、20启动碱泵,等流出液pH为14时,关泵及所开阀门,浸泡2H。 (3)冲碱:开F24、3、11、21、18,启动淡水泵用淡水洗至pH为7,关泵及所开阀门。 (4)加酸:开F15、22、21、23启动酸泵,细心调节流量,开F24使酸液由此流出。 (5)冲酸:开F24、3、11、21、18用淡水洗至pH为7。
大输液基本的知识2018年
输液车间培训资料 ——药品基础知识及大容量注射液(大输液)生产工艺药品的定义:它是用于预防(疫苗)、治疗(对症下药)、诊断人体疾病(诊断试剂辅助疾病的诊断),有目的地调节人体机能(平时补充的微量元素)并规定有适应症(对症下药)、用法和用量的物质(举例说明:镇痛药物杜冷丁,吗啡)。它是一种特殊商品,正因为它的特殊性,所以它的生产、销售、使用都有特殊的要求。cGMP Good Manufacturing Practice(药品生产质量管理规范)就是药品行业的生产规范。 输液生产线的生产工艺流程:公用系统(司炉岗位,空压系统,空调系统,水处理系统)-配制岗位(产品内在质量的核心所在)-灌封岗位(产品外观质量的核心,同时也会影响产品内在质量-灌装部分的暴露)-装车岗位(复核产品外观质量)-灭菌岗位(最终灭菌药品,保险措施-药品在配制和灌装过程中的污染)-包装岗位(产品外观质量和内在质量)-翻箱岗位(最后一个岗位)一、概述 注射剂:通过,肌肉注射,静脉滴注或静脉推注直接直接进入人体血液系统,不经过肝脏的代谢,分为大容量注射剂(大于50ml)和小容量注射剂(小于50ml)。 大容量注射剂(大输液)的定义是指由静脉滴注输入体内的大剂量注射液,是注射剂的一个分支。 (一)输液种类 1、电解质输液补充体内水分、电解质、纠正体内酸碱平衡(N.S, COM-NS,乳酸钠林格注射液)
2、营养输液糖类输液、氨基酸输液、脂肪乳剂输液(GS) 3、胶体输液胶体输液有多糖、明胶类、高分子聚合物等(右旋20 或右旋40) 4、治疗性输液:抗生素,抗病毒(乳酸左氧氟沙星,替硝唑注射液, 甲硝唑注射液和利巴韦林注射液等) (二)输液的质量要求 由于输液是经静脉直接输入人体内部,因此必须确保输液质量,其质量要求有: 1.安全性:不能引起对组织刺激或发生毒性反应,必须经过必要的动物实验,确保使用安全。 2.稳定性;输液系水溶液,从制造到使用要经过一段时间,故要求具有必要的物理稳定性和化学稳定性,确保产品在贮存期内安全有效。 3.无菌:输液成品中不应含有任何活的微生物,必须达到药典无菌检查的要求。染菌输液引起脓毒症、败血病、内毒素中毒甚至死亡。 4.无热原:无热原是注射剂的重要质量指标,须进行热原检查。热原是微生物的代谢产物,致热能力强,大多数细菌都能产生霉菌甚至病毒,也能产生热原。含热原的输液注入人体,使人体发冷、寒战、体温升高、身痛、出汗、恶心呕吐等不良反应,严重者出现昏迷、虚脱,甚至生命危险。 热原组成:热原是微生物的一种内毒素,存在于细菌的细胞膜和固体膜之间。内毒素由磷脂、脂多糖、蛋白质组成的复合物。其中脂多糖是内毒素主要成分,具有特别强的热原活性。热原检查的方法:家兔法(家兔对热原的反应和人对热原反应相同),费时长,操作繁琐,鲎试验法:(体外热原试验)鲎的变形细胞溶解物与内毒素之间的胶凝反应。鲎试验法比家兔法灵敏十倍。操作简单,实
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点 大输液生产工艺质量控制要点 ........ 制备注射用水 一.用于蒸憾器 1)水源:去离子水 2)冷却水:洁净的软水(即生活用水) 二.蒸憾水质量检査 1)生产时:每台每隔2小时检査氯化物,酸碱度,易氧化物的钱盐2)贮藏时:每星期全项检査一次 三.蒸馅水贮藏条件 1)容器:不锈钢罐或搪瓷罐 2)温度:80摄氏度以下 3)时间:不超过12小时 -------- 洗输液瓶 一?常水冲洗 1)温度:60摄氏度?70摄氏度 2)压力:不低于9.81 X 10Pa 3)时间:不低于三秒 4)次数:2~3次 二精洗
1)次数:2-3次 2)压力:不低于9.81 X Pa 3)时间:不少于3秒 4)末道滤材:0.8-1.2um微孔滤膜 5)蒸馅水澄明度:200ml容量瓶不得有可见异物 一.浓配 1)活性炭用量:0.02%(g/ml) 2)煮沸时间:10-15min 3)药液浓度不低于50% 二.稀配 1)活性炭用量0.01%(g/ml) 2)药液温度:40~60摄氏度质量检査: 1)含量:97?5%~102.5% 2) PH:应符合规定 三.滤材 1)炭脱:砂棒或钛合金制成的滤棒 2)初滤:垂熔玻璃滤器 3)精滤:0.8-1.2um微孔滤膜 四.微孔滤膜 1)磨砂棒灯检:均无亮点 2)起泡点试验:合格 五.无菌要求 配料间空气菌落数:9cm培养皿,暴露空间30minih小于15个六?药液温度控制:含盐品种:40~50摄氏度 七?药液温度控制:含糖品种:50~60摄氏度 ........ 洗涤纶薄膜 质量要求 1)乙醇浓度:95% 2)浸泡时间:大于8小时 3)加盐煮沸:100摄氏度.30min,消除静电效应 4)漂洗水澄明度:200ml容量瓶仅允许有微量白点洗涤橡皮塞 一.NaOH 1)浓度:l%(g/ml) 2)温度:100摄氏度
