溶液 溶解度知识点梳理及经典练习(超详细)经典1

溶液溶解度知识点梳理及经典练习(超详细)经典1
一、溶液选择题
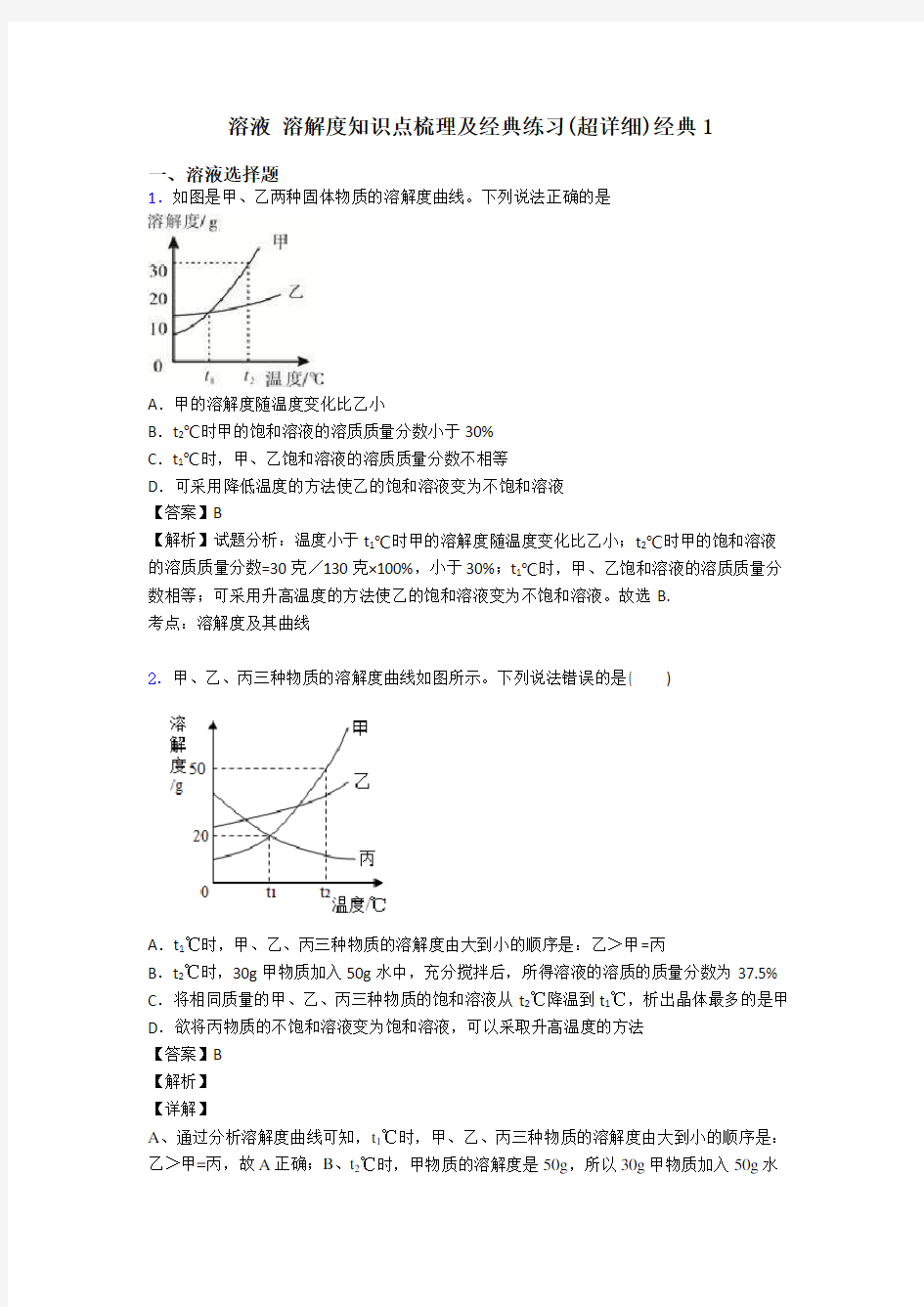
1.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.甲的溶解度随温度变化比乙小
B.t2℃时甲的饱和溶液的溶质质量分数小于30%
C.t1℃时,甲、乙饱和溶液的溶质质量分数不相等
D.可采用降低温度的方法使乙的饱和溶液变为不饱和溶液
【答案】B
【解析】试题分析:温度小于t1℃时甲的溶解度随温度变化比乙小;t2℃时甲的饱和溶液的溶质质量分数=30克/130克×100%,小于30%;t1℃时,甲、乙饱和溶液的溶质质量分数相等;可采用升高温度的方法使乙的饱和溶液变为不饱和溶液。故选B.
考点:溶解度及其曲线
2.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5% C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
【答案】B
【解析】
【详解】
A、通过分析溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙,故A正确;
B、t2℃时,甲物质的溶解度是50g,所以30g甲物质加入50g水
中,充分搅拌后,所得溶液的溶质的质量分数为×100%=33.3%,故B错误;C、将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,甲物质的溶解度变化最大,所以析出晶体最多的是甲,故C正确;D、丙物质的溶解度随温度的升高而减小,所以欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法,故D正确。故选B。【点睛】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
3.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。下列说法正确的是
A.硝酸钾的溶解度变大B.溶质的质量分数保持不变
C.所得溶液是饱和溶液D.所的溶液的质量为120g
【答案】C
【解析】
【分析】
【详解】
A、硝酸钾的溶解度只受温度一个外界因素的影响,温度不变,溶解度不变,故A不正确;
B、硝酸钾部分溶解,溶质的质量分数变大,故B不正确;
C、硝酸钾部分溶解,则溶液为饱和溶液,故C正确;
D、20g的硝酸钾部分溶解,溶液的质量小于120g,故D不正确。
故选C。
4.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
【答案】C
【解析】
溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质
量,叫做这种物质在这种溶剂中的溶解度。A.该温度下,KNO3的溶解度为
80g 2020
g g
+
=
100g x ,x=50g,故A错误;B. 乙溶液的质量分数为
50
10050
g
g g
+
×100%=33.3%,故B错
误;C. 降低温度,可以使甲溶液变成饱和溶液,硝酸钾溶解度随温度升高而增大,故C正确;D. 硝酸钾溶解度随温度升高而增大,升高温度,甲、乙两溶液的质量分数都不变,故D错误。
点睛∶硝酸钾溶解度随温度升高而增大,影响固体溶解度的因素是温度,溶质和溶剂本身的性质。
5.下列关于溶液的说法错误的是()
A.固体、液体、气体都可以做溶质
B.NH4NO3溶解过程中吸热,溶液温度降低
C.欲使100克KNO3溶液的质量分数由5%变成10%,可向其中加入5克KNO3固体D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a 与b的质量不一定相等
【答案】C
【解析】
试题分析:A、溶质可以是固体、液体、气体,故A说法正确;B、NH4NO3溶解过程中吸热,溶液温度降低,故B说法正确;C、溶质质量分数:,
故C错;D、如果硝酸钾溶液蒸发溶剂前,是饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定相等,如果硝酸钾溶液蒸发溶剂前,是不饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定不相等,故D说法正确。故选C。
考点:溶液的概念、组成及其特点;溶解时的吸热或放热现象;晶体和结晶的概念与现象;有关溶质质量分数的简单计算
6.如图是两种固体物质的溶解度曲线(不含结晶水,且在同一杯溶液中相互不干扰)。对此,下列判断正确的是( )
A.甲、乙在20℃时,溶液质量分数相等
B.30℃时,同一杯甲乙二者饱和溶液,甲溶质质量不一定比乙多
C.分别恒温蒸发30℃时两杯溶液,析出的甲比乙多
D.30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质
【答案】D
【解析】A. 甲、乙在20℃时,饱和溶液的溶质质量分数相等,错误;B. 30℃时,同一杯甲乙二者饱和溶液,甲溶质质量一定比乙多,错误;C. 分别恒温蒸发30℃时两杯两种物质的饱和溶液,析出的甲比乙多,错误;D. 30℃时,将60g甲的饱和溶液降温到20℃时,析
出5g甲物质,正确。故选D。
7.如图是A、B、C三种物质的溶解度曲线,下列说法不正确的是
A.t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A
B.当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A
C.t2℃时,A和C的饱和溶液中含有相同质量的溶质
D.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是B>C>A
【答案】C
【解析】A、由溶解度曲线可知,在t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A,正确;
B、A的溶解度随温度的升高而增大,当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A,正确;
C、由于不知道A和C的饱和溶液的质量,所以无法确定其中含有溶质的质量是否相同,错误;
D、由t2℃降温到t1℃,C的溶质质量分数不变,而A和B的溶解度减小,导致溶质质量分数减小,由图可知t1℃时B的溶解度大于t2℃时C的溶解度大于t1℃时A的溶解度,因此B>C>A,正确。
点睛:
固体溶解度曲线的作用可从点、线、面和交点四方面来理解:
1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以找到。溶解度曲线上的点有三个方面的作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.线:溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰。(2)根据溶解度曲线,判断或比较某一物质在不同温度下的溶解度大小。(3)根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并
且,还可以判断或比较析出晶体的质量大小(即曲线越陡,析出的晶体就越多)。3.面:对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。4.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
8.现用98%的浓硫酸配制1000mL溶质质量分数为20%的稀硫酸 ( 密度为 1.14g/mL)。下列说法正确的是
A.实验中需要用到的玻璃仪器有天平、烧杯、量筒、玻璃棒和胶头滴管等
B.配制该稀硫酸需要加水800mL
C.配制稀硫酸时用到玻璃棒,其作用是引流
D.该稀硫酸中,溶液质量:溶剂质量 =5:4
【答案】D
【解析】A、根据用浓硫酸配稀硫酸的步骤考虑需要的玻璃仪器;
B、根据用配制的溶液的总质量减去浓硫酸的质量就是加入水的质量,再除以水的密度就是水的体积;
C、根据浓硫酸的稀释方法考虑;
D、根据稀硫酸的溶质质量分数计算出溶液质量与溶剂质量之比.
解:A、用浓硫酸配稀硫酸的步骤:计算、量取、配制,所以用到量筒、烧杯、玻璃棒、胶头滴管,故A错误;
B、稀硫酸的质量:1000mL×1.14g/mL=1140g,含有溶质质量:1140g×20%=228g,浓硫酸的质量为:=232.65g所以需要水的质量:1140g-232.65g=907.35g,体积为907.35mL,故B错;
C、配制稀硫酸时用到玻璃棒,其作用是不断搅拌,散热,故C错;
D、溶质质量分数为20% 的稀硫酸中设溶质20g、溶液为100g,则溶剂为80g,所以溶液质量:溶剂质量=100g:80g=5:4;故D正确。
故选D。
点睛:解答本题的关键是要知道浓硫酸稀释的步骤、用到的仪器,溶质质量、溶剂质量的计算方法,知道浓硫酸稀释的注意事项。
9.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
【答案】D
【解析】
【分析】
【详解】
A.根据图示可知,甲的溶解度是102.5g没有指明是在70℃时,选项A不正确;
B.甲的溶解度在0℃到70℃时随温度的升高而增大,当温度大于70℃时,其溶解度随温度的升高而减小,选项B不正确;
C.20℃时,甲的溶解度为28.6 g 。即:在20℃时在100 g水中溶解28.6 g甲可达到饱和,20℃时,100 g甲的饱和溶液中溶质质量小于28.6 g,选项C不正确;
D.因为70℃时甲的溶解度最大,所以将其饱和溶液升高温度或降低温度,都会因为溶解度减小而使甲无法完全溶解,都有晶体析出,选项D正确。故选D。
10.根据下图的溶解度曲线,判断下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.向l00g水中加入60g甲充分搅拌后能形成饱和溶液
C.甲中混有少量乙时,可以用蒸发溶液的方法获得较纯净的乙
D.t2℃甲的饱和溶液降低温度后溶解度减小,溶质的质量分数也减小
【答案】D
【解析】A溶解度受温度影响,不指明温度不能比较溶解度的大小;B. 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t1℃甲的溶解度为60g,向l00g水中加入60g甲充分搅拌后能形成饱和溶液;C.甲的溶解度受温度较大,且随温度降低而减小,所以降温时甲析出,而乙由于受温度影响较小,且量少,几乎不析出,甲中混有少量乙时,可以用降温结晶的方法提纯乙;D. t2℃甲的饱和溶液降低温度后溶解度减小,溶质因析出而减少,溶剂不变,溶质的质量分数也减小。选D
点睛:在溶解度曲线图上,溶剂的量都是100g,所以分析溶质的质量分数时,只需要比较溶质的多少即可。溶解度变大时,溶质不变,溶解度减小时溶质质量等于减小后的溶解度
11.t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是()
A.烧杯①的溶液是硝酸钾溶液
B.烧杯①的溶液一定是不饱和溶液
C.若将烧杯①和烧杯②的溶液升温到t2℃时,溶质的质量分数相等
D.若烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解
【答案】C
【解析】
【分析】
【详解】
A.由图看出,t1℃时,硝酸钾的溶解度小于氯化钾的溶解度。t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后,烧杯②中有固体剩余,说明烧杯②中溶解的固体少,则烧杯②中加入的是硝酸钾,烧杯①的溶液是氯化钾溶液,选项A错误;
B.因为题中没有提供t1℃时氯化钾的溶解度,也没有说明具体加入的溶质质量,所以根据烧杯①中无剩余固体的现象,只能得出它可能是不饱和溶液,也可能是饱和溶液的结论,选项B错误;
C. t2℃时,硝酸钾和氯化钾的溶解度相等,若将烧杯①和烧杯②的溶液升温到t2℃时,氯化钾在t1℃时就全部溶解,而温度升高氯化钾的溶解度继续增大,虽然t1℃时硝酸钾有剩余,但随着温度的升高溶解度增大,到t2℃时两种物质的溶解度相等,所以等质量的硝酸
钾和氯化钾在t2℃时,都全部溶解,因此溶质的质量分数相等,选项C正确;
D. t1℃时,烧杯①中的物质完全溶解,升温到t2℃时,氯化钾的溶解度增大,能溶解的氯化钾增多,而t2℃时,氯化钾与硝酸钾的溶解度相等,因此若烧杯②的溶液升温到t2℃时,烧杯底部的固体物质全部溶解,选项D错误。故选C。
12.NaCl、KNO3两种固体物质的溶解度曲线如图所示。下列说法正确的是:
A.KNO3的溶解度大于NaCl的溶解度
B.将两种物质的饱和溶液从50℃降至20℃,析出KNO3最多
C.使NaCl从其饱和溶液中析出,最好采用蒸发溶剂的方法
D.20℃时,30gNaCl加入到50g水中充分溶解,所得溶液中NaCl的质量分数为37.5%【答案】C
【解析】A. 比较溶解度大小,一定指明温度,错误;B. 将等质量的两种物质的饱和溶液从50℃降至20℃,析出KNO3最多,错误;C. 提纯溶解度受温度影响不大的物质,采用蒸发溶剂的方法,正确;D. 20℃时,NaCl的溶解度是31.6g,故50g水最多能溶解15.8gNaCl,将30gNaCl加入到50g水中,不能全部溶解,所得溶液是饱和溶液,所得溶液中NaCl的质量分数为24.0%,错误。故选C。
点睛:考查学生溶解度曲线的应用能力。
13.根据下图判断,下列说法错误的是( )
A.NaCl和NH4Cl的溶解度都随温度升高而增大
B.将20℃时某NH4Cl溶液降温到0℃,其溶质质量分数一定减小
C.20℃时,20gNaCl加入到50g水中,搅拌后不能全部溶解
D.t℃时,NH4Cl饱和溶液和NaCl饱和溶液溶质质量分数相等
【答案】B
【解析】
A、由图可知,NaCl和NH4Cl的溶解度都随温度升高而增大,故正确;
B、将20℃时某NH4Cl溶液降温到0℃,不一定有晶体析出,故其溶质质量分数不一定减小,故错误;
C、20℃时,NaCl的溶解度的溶解度为36g,则50g水中最多能溶解18g氯化钠,故将
20gNaCl加入到50g水中,搅拌后不能全部溶解,故正确;
D、t℃时,NH4Cl和NaCl的溶解度相等,故NH4Cl饱和溶液和NaCl饱和溶液溶质质量分数相等,故正确。
点睛:
固体溶解度曲线的作用可从点、线、面和交点四方面来理解:
1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以找到。溶解度曲线上的点有三个方面的作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.线:溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰。(2)根据溶解度曲线,判断或比较某一物质在不同温度下的溶解度大小。(3)根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并且,还可以判断或比较析出晶体的质量大小(即曲线越陡,析出的晶体就越多)。3.面:对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。4.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
14.某固体物质的溶解度曲线如图所示,在100g水中加入120g固体,充分搅拌,在不同温度下存在①②③④四种状态.对这四种状态的描述正确的是
A.状态①为不饱和溶液, 状态②③④均为饱和溶液
B.状态①降温至10℃,有110g晶体析出
C.各状态的溶质质量分数:①>②>③>④
D.将状态②加水200g再降温至40℃可达到状态③
【答案】A
【解析】
A、溶解度曲线上的点对应是该温度的饱和溶液,溶解度曲线下方的点对应是该温度的不饱和溶液,①在溶解度曲线的下方为90℃该物质不饱和溶液,②③④在溶解度曲线上为一定温度下的饱和溶液,正确;
B、10℃时,该物质的溶解度为20g,此时100g水能溶解20g 溶质;状态①降温至10℃,有(120g-20g)=100g晶体析出,错误;
C、状态①的质量分数
=
120
100120
g
g g
+
×100%=54.5 %;②③④在溶解度曲线上为一定温度下的饱和溶液,一定温
度下,饱和溶液的溶质质量分数=
s
100s
+
×100%,状态②的质量分数
=
120
100120
g
g g
+
×100%=54.5 %;状态③的质量分数=
65
10065
g
g g
+
×100%=39.3 %;状态④
的质量分数=
35
10035
g
g g
+
×100%=25.9 %;各状态的溶质质量分数:④=③>②>①;错
误;D、将状态②加水200g时,溶液中有水300g,溶质120g,再降温至40℃时,若可达到状态③,则40℃时该物质的溶解度为40g,根据溶解度曲线可知40℃时,该物质的溶解度大于60g,错误。故选A。
点睛:一定温度下,饱和溶液的溶质质量分数=
s
100s
+
×100%。
15.如图是甲、乙两种固体物质的溶解度曲线。下列说法中不正确的是()
A.t1℃时,甲和乙的溶解度相同
B.t2℃时,将75g甲的饱和溶液与100g水混合可得到溶质质量分数为20%的甲溶液
C.t2℃时,各100g甲、乙饱和溶液降温至t1℃,甲析出固体的质量大于乙析出固体的质量
D.升高温度可以将甲的饱和溶液变为不饱和溶液
【答案】B
【解析】
【详解】
A.在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。t1℃时,甲和乙的溶解度相同,正确;
B.t2℃时,甲的溶解度为50g,75g甲的饱和溶液中溶质为25g,与100g水混合后,溶液总质量为175g,可得到溶质质量分数为25g÷175g×100%≈14.3%,错误;
C.t2℃时,各100g甲、乙饱和溶液降温至t1℃,甲的溶解度减小的比乙多,甲析出固体的质量大于乙析出固体的质量,正确;
D.甲的溶解度随温度升高而增大,升高温度可以将甲的饱和溶液变为不饱和溶液,正确。故选B。
【点睛】
溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%。
16.甲、乙两种物质的溶解度曲线如图,下列说法正确的是( )
A.t1℃时,甲、乙两种溶液的溶质质量分数相同
B.t1℃时,取少量甲的饱和溶液,加入少量乙,不能再溶解
C.t1℃时,取少量甲的饱和溶液升温到 t2℃,变成不饱和溶液
D.t2℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量甲>乙
【答案】C
【解析】
A.根据t1℃时,甲、乙两种物质的溶解度相等分析解答;
B.根据饱和溶液的概念分析解答;
C.根据影响物质溶解度的因素分析解答;
D.根据物质的溶解度分析解答。
解:A. t1℃时,甲、乙两种物质的溶解度相等,溶质质量分数不一定相等。故错误;
B. 根据饱和溶液的概念可知,t1℃时,取少量甲的饱和溶液,加入少量乙,能溶解乙,但不能溶解甲。故错误;
C. 由图可知,甲的溶解度随温度的升高而增大且变化较大。故t1℃时,取少量甲的饱和溶液升温到t2℃,变成不饱和溶液。正确;
D. 由于t2℃时甲、乙两种物质的溶解度大小关系是甲>乙,即等质量的水能溶解的溶质质量为甲>乙,所以用等质量的甲、乙、配成t2℃时饱和溶液所需水的质量是乙>甲。故错误。
故本题选C。
17.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是( )
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
【答案】D
【解析】
【分析】
【详解】
A、由于没有确定温度,甲和乙的溶解度无法确定,错误;
B、根据溶解度曲线可知,甲的溶解度随温度的升高而增大,错误;
C、 a1℃时,乙的溶解度为30g,a1℃时,30g的乙与100g的水形成饱和溶液,乙的饱和溶液中溶质与溶剂的质量比=30g:100g=3:10,错误;
D、a2℃时,甲的溶解度为50 g,根据溶解度的意义可知,a2℃时,甲的150g饱和溶液中溶质的质量为50g,溶剂的质量为100g, a1℃时,甲的溶解度为30 g,根据溶解度的意义可知,a1℃时,100g水中最多溶解30g的甲,将a2℃150g甲的饱和溶液降温到a1℃,溶剂的质量不变,析出晶体的质量=50g-30g=20g,正确。故选D。
【点睛】
溶液在降温过程中,溶剂的量一般保持不变。
18.向一定量的NaCl溶液中加入足量的AgNO3溶液,所得沉淀的质量为原NaCl溶液质量的一半.则原NaCl溶液中溶质的质量分数最接近于()
A.10% B.20% C.30% D.40%
【答案】B
【解析】
【分析】
【详解】
试题分析:假设生成氯化银的质量为a,设氯化钠的质量为x;
NaCl+AgNO=AgCl+NaNO
33
58.5143.5
x a
58.5:x=143.5:a,
解得x=58.5a/143.5,
所以原NaCl溶液中溶质的质量分数:ω= (58.5a/143.5÷2a)×100%≈20%,选项B正确。19.下图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.t2℃时a、b两种物质饱和溶液降温到t1℃时,析出晶体质量 a>b
B.t2 ℃时,将50g a物质放入50g水中充分溶解得到100g a的饱和溶液
C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系是b > a > c
D.在t1℃时,a、c溶液中溶质的质量分数一定相同
【答案】C
【解析】
A、t2℃时a、b两种物质饱和溶液降温到t1℃时,析出晶体质量 a>b错误,因为没有指明是等质量的饱和溶液;故选项错误;
B、t2℃时,将50ga物质放入50g水中充分溶解得到100ga的饱和溶液错误,因为在该温度下,a的溶解度是50g,所得溶液质量=25g+50g=75g;故选项错误;
C、将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系是b>a>c正确,因为降温后b的溶解度大于a,c的溶液由饱和变为不饱和,还是最小;故选项正确;
D、在t1℃时,a、c溶液中溶质的质量分数一定相同错误,因为没有指明是饱和溶液,故
选项错误。
点睛:
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
20.如图是甲、乙两种固体的溶解度曲线。下列说法中正确的是()
A.甲的溶解度大于乙的溶解度
B.t1℃时,50 g克水中溶解甲最多能形成65克溶液
C.t2℃时乙的饱和溶液降温至t1℃变为不饱和溶液
D.将t1℃时甲的饱和溶液升温至t2℃,溶质的质量分数增大
【答案】B
【解析】A.溶解度受温度影响,不指名温度,无法比较溶解的大小;B. t1℃时,甲的溶解度等于30g,50 g克水中溶解甲最多能溶解的溶质为15g,形成等于65克溶液;C. t2℃时乙的饱和溶液降温至t1℃时,溶解度变小,溶质析出,得到的仍是饱和溶液;D. 将t1℃时甲的饱和溶液升温至t2℃,溶解度变大,溶质的质量不变,溶质的质量分数不变。
点睛:在溶解度曲线图上,溶剂的量都是100g,所以分析溶质的质量分数时,只需要比较溶质
的多少即可。溶解度变大时,溶质不变,溶解度减小时溶质质量等于减小后的溶解度
八年级物理浮力复习知识点、题型整理及答案32554
《浮力》复习提纲 第一节:使用托盘天平测量物体质量的步骤: 0.估测被测物体质量,选择合适量程(称量)和分度值(感量)的天平,观察铭牌。 1.将托盘天平放在水平桌面(或实验台)上。水平放置 2.将游码拨至标尺左端的零刻线处。游码归零 3.调节平衡螺母,使横梁平衡。平衡螺母 4.把被测物体放在左盘内,按“先大后小”顺序选择适当砝码,用镊子向右盘里增减砝码并调节游码在标尺 上的位置,直到横梁平衡。左物右码 5.盘里砝码的总质量加上游码所对的刻度值,就等于被测物体的质量。被测物体质量=砝码值+游码值 6.取下物体,用镊子将砝码放回盒中,游码归零,实验完毕。 注:判断横梁平衡方法:a.指针指在分度盘的中线处;b.指针左右摆动幅度相同。(黑体字为口诀) 第二节:关于密度的计算: 1、密度:单位体积的某种物质的质量。密度是物质的一种特性(反映了相同体积的不同物质,质量一般不同)。同种物质的密度受状态和温度的影响,但在物态和温度不变时为一定值。不同物质的密度一般不同。 从公式ρ=m/v 分析:ρ与m 或v 没有关系,只有当ρ一定时,m 与v 成正比。 密度单位之间的换算:1g/cm 3=103 kg /m3, (即水的密度) 2、密度的测量时的注意: 1)量筒使用前必须观察它的分度值和量程,底部放水平,读数时与液面的底部相平。 2)用排水法测不规则固体体积时所用固体不吸水,不溶水,不与水发生化学反应。 3)测固体密度时必须先测量质量后测量体积,防止因固体沾水测量值偏大,测量液体密度时想尽办法减少容器内壁沾水而造成液体体积偏小。实验室常用量筒或量杯测量液体和不规则固体的体积。1mL=1cm 3 1L=1dm3。量筒的刻度是均匀的,量杯的刻度上密下疏。 3、计算合金密度:甲乙两种物体的密度分别为ρ1和ρ2:等质量混合,混合后的密度为2ρ1ρ2/ρ1+ρ2;等体积混合,混合后的密度为(ρ1+ρ2)/2。 一、浮力的定义:一切浸入液体(气体)的物体都受到液体(气体)对它竖直向上的力 叫浮力。 二、浮力方向:竖直向上,施力物体:液(气)体 三、浮力产生的原因(实质):液(气)体对物体向上的压力大于向下的压力,向上、向下的压力差 即浮力。 四、物体的浮沉条件: 1、前提条件:物体浸没在液体中,且只受浮力和重力。 2、请根据示意图完成下空。 下沉 悬浮 上浮 漂浮 F 浮 < G F浮 = G F 浮 > G F 浮 = G ρ液<ρ物 ρ液 =ρ物 ρ液 >ρ物 ρ液 >ρ物 3、说明: ① 密度均匀的物体悬浮(或漂浮)在某液体中,若把物体切成大小不等的两块,则大块、小块都悬浮(或漂 浮)。 ②一物体漂浮在密度为ρ的液体中,若露出体积为物体总体积的1/3,则物体密度为 2 3ρ 分析:F 浮 = G 则:ρ液V 排g =ρ物Vg ρ物=( V 排/V )·ρ液= 2 3ρ液 ③ 悬浮与漂浮的比较 相同: F 浮 = G 不同:悬浮ρ液 =ρ物 ;V 排=V 物 漂浮ρ液 <ρ物;V 排 高一数学集合知识点归纳及典型例题 Revised on November 25, 2020 集合 一、知识点: 1、元素: (1)集合中的对象称为元素,若a 是集合A 的元素,记作A a ∈;若b 不是集合A 的元素,记作A b ?; (2)集合中对象元素的性质:确定性、互异性、无序性; (3)集合表示方法:列举法、描述法、图示法; (4)常用数集:R Q Z N N N ;;;;;*+ 2、集合的关系: 子集 相等 3、全集 交集 并集 补集 4、集合的性质: (1);,,A B B A A A A A ?=?=?=?φφ (2) ;,A B B A A A ?=?=?φ (3) );()(B A B A ??? (4);B B A A B A B A =??=??? (5));()()(),()()(B C A C B A C B C A C B A C S S S S S S ?=??=? 二、典型例题 例1. 已知集合 }33,)1(,2{22++++=a a a a A ,若A ∈1,求a 。 例2. 已知集合M ={}012|2=++∈x ax R x 中只含有一个元素,求a 的值。 例3. 已知集合 },01|{},06|{2=+==-+=ax x B x x x A 且B A ,求a 的值。 \ 例4. 已知方程02=++c bx x 有两个不相等的实根x 1, x 2. 设C ={x 1, x 2}, A ={1,3,5,7,9}, B ={1,4,7,10},若C B C C A =Φ= ,,试求b , c 的值。 例5. 设集合}121|{},52|{-≤≤+=≤≤-=m x m x B x x A , (1)若Φ=B A , 求m 的范围; (2)若A B A = , 求m 的范围。 例6. 已知A ={0,1}, B ={x|x ?A},用列举法表示集合B ,并指出集合A 与B 的关系。 三、练习题 1. 设集合M =,24},17|{=≤a x x 则( ) A. M a ∈ B. M a ? C. a = M D. a > M 初中物理学习材料 1、浮力比较题 例1、甲、乙、丙三个体积相同的实心小球,静止在液体中如图8所示,关于三个小球下面说法正确的是() A. 三个球受到的浮力关系为F甲=F乙>F丙 B. 三个球受到的浮力 关系为F甲<F乙=F丙 C. 三个球的密度关系为ρ甲<ρ乙<ρ丙 D. 三个球的密度关系为ρ甲>ρ乙>ρ丙例2、将重力相同的木块和铁块放入水中静止后,则() A、木块受的浮力大 B、铁块受的浮力大 C、木块和铁块所受浮力一样大 D、无法判断谁受的浮力大 例3、甲、乙两个完全相同的密度计放在A、B两种液体中,如图 43所示,则甲、乙密度计受浮力F甲、F乙和A、B液体密度比较 () A. F甲>F乙,ρA>ρB B. F甲=F乙,ρA=ρB C. F甲<F乙,ρA<ρB D. F甲=F乙,ρA>ρB 2.浮力变化题 一般情况下,在同种液体中,关注V排的变化情况,如果液体发生改变,一般用浮沉条件来分析。 例1.一个充气的气球下面挂一个金属块,把它们放入水中某处恰能静止,如果把金属块及气球的位置轻轻向上移一些,则金属块和气球( ) A.仍能静止 B.向下运动 C.向上运动 D.上下晃动 解释:由于气球的位置轻轻向上移,所以受到水的压强变小,导致气泡体积变大,浮力变大,超过了重力,因此选C。 例2、金鱼缸中小金鱼口中吐出的小气泡,在升至水面的过程中体积逐渐变大,这个过程中气泡所受浮力将() A. 不变 B. 变大 C. 变小 D. 无法确定 例3、潜水艇从潜行变为上浮,在浮出水面之前,所受海水的压强和浮力变化情况正确的是() A. 压强减小,浮力不变 B. 压强增大,浮力不变 C. 压强不变,浮力变大 D. 压强不变,浮力变小 例4、游泳的人由河边走向深水处的过程中,如果河底布满碎石子,则() A. 脚越来越疼,因为水对脚的压力越来越大 B、脚疼得越为越轻,因为河底对人的支持力越来越小 C、脚越来越疼,因为水对人的浮力越来越大 D、脚疼得越来越轻,因为人受到的重力越来越小 3.判断物体是否实心 例:体积是30cm3的铁球,质量是79g,它是空心的还是实心的?如果是空心的,空心部分的体积多大?(ρ=7.9g/ cm3) 分析:(1)根据密度公式变形V=m/ρ求出此时铁球的实心体积,再与铁球的实际体积(30cm3)相比较,如果相等,则是实心的,如果实心体积小于实际体 集合 一.【课标要求】 1.集合的含义与表示 (1)通过实例,了解集合的含义,体会元素与集合的“属于”关系; (2)能选择自然语言、图形语言、集合语言(列举法或描述法)描述不同的具体问题,感受集合语言的意义和作用; 2.集合间的基本关系 (1)理解集合之间包含与相等的含义,能识别给定集合的子集; (2)在具体情境中,了解全集与空集的含义; 3.集合的基本运算 (1)理解两个集合的并集与交集的含义,会求两个简单集合的并集与交集; (2)理解在给定集合中一个子集的补集的含义,会求给定子集的补集; (3)能使用Venn图表达集合的关系及运算,体会直观图示对理解抽象概念的作用二.【命题走向】 有关集合的高考试题,考查重点是集合与集合之间的关系,近年试题加强了对集合的计算化简的考查,并向无限集发展,考查抽象思维能力,在解决这些问题时,要注意利用几何的直观性,注意运用Venn图解题方法的训练,注意利用特殊值法解题,加强集合表示方法的转换和化简的训练。考试形式多以一道选择题为主。 预测高考将继续体现本章知识的工具作用,多以小题形式出现,也会渗透在解答题的表达之中,相对独立。具体 三.【要点精讲】 1.集合:某些指定的对象集在一起成为集合 a∈;若b不是集合A的元素,(1)集合中的对象称元素,若a是集合A的元素,记作A b?; 记作A (2)集合中的元素必须满足:确定性、互异性与无序性; 确定性:设A是一个给定的集合,x是某一个具体对象,则或者是A的元素,或 者不是A的元素,两种情况必有一种且只有一种成立; 互异性:一个给定集合中的元素,指属于这个集合的互不相同的个体(对象),因此,同一集合中不应重复出现同一元素; 无序性:集合中不同的元素之间没有地位差异,集合不同于元素的排列顺序无关; (3)表示一个集合可用列举法、描述法或图示法; 列举法:把集合中的元素一一列举出来,写在大括号内; 描述法:把集合中的元素的公共属性描述出来,写在大括号{}内。 具体方法:在大括号内先写上表示这个集合元素的一般符号及取值(或变化)范围,再画一条竖线,在竖线后写出这个集合中元素所具有的共同特征。 注意:列举法与描述法各有优点,应该根据具体问题确定采用哪种表示法,要注意,一般集合中元素较多或有无限个元素时,不宜采用列举法。 (4)常用数集及其记法: 非负整数集(或自然数集),记作N ; 正整数集,记作N *或N +; 整数集,记作Z ; 有理数集,记作Q ; 实数集,记作R 。 2.集合的包含关系: (1)集合A 的任何一个元素都是集合B 的元素,则称A 是B 的子集(或B 包含A ),记作A ?B (或B A ?); 集合相等:构成两个集合的元素完全一样。若A ?B 且B ?A ,则称A 等于B ,记作A =B ;若A ?B 且A ≠B ,则称A 是B 的真子集,记作A B ; (2)简单性质:1)A ?A ;2)Φ?A ;3)若A ?B ,B ?C ,则A ?C ;4)若集合A 是n 个元素的集合,则集合A 有2n 个子集(其中2n -1个真子集); 3.全集与补集: (1)包含了我们所要研究的各个集合的全部元素的集合称为全集,记作U ; (2)若S 是一个集合,A ?S ,则,S C =}|{A x S x x ?∈且称S 中子集A 的补集; (3)简单性质:1)S C (S C )=A ;2)S C S=Φ,ΦS C =S 4.交集与并集: 浮力复习知识点与经典例题 ————————————————————————————————作者:————————————————————————————————日期: 1 《浮力》复习提纲 一、浮力的定义:一切浸入液体(气体)的物体都受到液体(气体)对它竖直向上的力 叫浮力。 二、浮力方向:竖直向上,施力物体:液(气)体 三、浮力产生的原因(实质):液(气)体对物体向上的压力大于向下的压力,向上、向下的压力差 即浮力。 四、物体的浮沉条件: 1、前提条件:物体浸没在液体中,且只受浮力和重力。 2、请根据示意图完成下空。 下沉 悬浮 上浮 漂浮 F 浮 < G F 浮 = G F 浮 > G F 浮 = G ρ液<ρ物 ρ液 =ρ物 ρ液 >ρ物 ρ液 >ρ物 3、说明: ① 密度均匀的物体悬浮(或漂浮)在某液体中,若把物体切成大小不等的两块,则大块、小块都悬浮(或漂浮)。 ②一物体漂浮在密度为ρ的液体中,若露出体积为物体总体积的1/3,则物体密度为 2 3ρ 分析:F 浮 = G 则:ρ液V 排g =ρ物Vg ρ物=( V 排/V )·ρ液= 2 3ρ液 ③ 悬浮与漂浮的比较 相同: F 浮 = G 不同:悬浮ρ液 =ρ物 ;V 排=V 物 漂浮ρ液 <ρ物;V 排 溶解度曲线专题复习 溶解度是初中化学中的一个重要概念,溶解度曲线综合题是近年中考的热点题型。这类题目涵盖面广,综合性强。能较好地考查学生的观察能力、获取信息的能力及知识应用能力。是中考化学的重点,也是学生的失分点。在2011年各地中考化学试题中,出现了许多与溶解度曲线相关的试题,现归纳如下,以供参考。 一、溶解度的意义 例1 (2011·嘉兴)将a、b两种物质的饱和溶液升高温度后,发现a溶液有晶体析出,b溶液没有明显现象。再向b溶液加入少许b晶体,晶体消失。则图1中能正确表示a、b两物质溶解度曲线的是() 解析:由题意知a物质的溶解度随温度的升高而减小,而b物质的溶解度随温度的升高而增大,所以同时符合的图像只有选项C。 答案:C 点评:正确理解溶解度曲线的意义,是解答本题的关键。 二、判断或比较溶解度的大小 例2 (2011·四川省眉山市)如图2所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: (1)P点的含义是。 (2)t1℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗(填“能”或“不能”)。 (3)t2℃时,a、b、c三种物质的溶解度按由小到大的顺序排列的是___ (填物质序号)。 解析:(1)在溶解度曲线上两线相交的点表示:在该温度下两种物质的溶解度相同。(2)t1℃时a物质的溶解度为20克,即t1℃时100克水中达到饱和状态时最多能溶解a物质的质量为20克,在50克水中最多能溶解10克,所以只能形成60克溶液。(3)在t2℃线与溶解度曲线的交点越靠上的物质的溶解度越大。所以应是:cba。 答案:(1)在t1℃时,ac的溶解度相等(2)不能(3)cba 点评:本题考查了有关溶解度的一些问题,要理解溶解度的概念,清楚交点的意义。 三、判断晶体的析出 例3 (2011·河北)根据图3所示的溶解度曲线判断,下列说法正确的是() A.甲物质的溶解度大于乙物质的溶解度 B.甲物质的不饱和溶液温度升高后变成饱和溶液 C.将t2℃甲、乙两物质的饱和溶液温度降低到t1℃时都会析出晶体 ℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有相等质量的溶质 解析:A中没有温度限制,所以不能比较甲、乙溶解度;B中甲的溶解度随着温度的升高而增大,所以甲物质的不饱和溶液温度升高之后,还是不饱和溶液;C因为甲乙两物质的溶解度都随着温度的升高而增大,所以饱和溶液降低温度后都会有晶体析出;D中t2℃时两物质的溶解度相同,所以等质量的饱和溶液中含有相等质量的溶质,但是题中并没有说等质量的饱和溶液,所以错了。 答案:C 点评:该题是一个传统题,历年来考的形式基本相同。 例4 (2011·江苏省南通市)固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线,如图4所示。下列说法错误的是( ) A.物质W能溶解在水和乙醇中 ℃时,物质w在水中的溶解度为mg ℃时,物质W在水中与在乙醇中的溶解度相同 D.将t1℃时物质w的饱和水溶液升温至t2℃有晶体析出 解析:A选项中物质W能溶解在水和乙醇中是正确的;B选项中t1℃时,物质w在水中的溶解度为m g是正确的;C选项中t2℃时,物质W在水中与在乙醇中的溶解度曲线相交,说明t2℃时,物质W在水中与在乙醇中的溶解度相同是正确的;D选项根据溶解度曲线的特点,物质W随着温度的升高溶解度增大,将t1℃时物质w的饱和水溶液升温至t2℃时饱和溶液变成不饱和溶液,没有晶体析出。 答案:D 点评:本题主要考查溶解度和溶解度曲线的相关知识,本题的亮点是一种物质溶解在不同的溶剂中,解答本题要明确溶解度概念的“四要素”和溶解度曲线的意义。 四、判断饱和溶液和不饱和溶液的转化 例5 (2011·盐城)如图5为A、B、C三种固体物质(不含结晶水)的溶解度曲线。下列说法错误的是() 【半群】G非空,·为G上的二元代数运算,满足结合律。 【群】(非空,封闭,结合律,单位元,逆元)恰有一个元素1适合1·a=a·1=a,恰有一个元素a-1适合a·a-1=a-1·a=1。 【Abel群/交换群】·适合交换律。可能不只有两个元素适合x2=1 【置换】n元置换的全体作成的集合Sn对置换的乘法作成n 次对称群。 【子群】按照G中的乘法运算·,子集H仍是一个群。单位子群{1}和G称为平凡子群。 【循环群】G可以由它的某元素a生成,即G=(a)。a所有幂的集合an,n=0,±1,±2,…做成G的一个子群,由a生成的子群。若G的元数是一个质数,则G必是循环群。 n元循环群(a)中,元素ak是(a)的生成元的充要条件是(n,k)=1。共有?(n)个。【三次对称群】{I(12)(13)(23)(123)(132)} 【陪集】a,b∈G,若有h∈H,使得a =bh,则称a合同于b(右模H),a≡b(右mod H)。H有限,则H的任意右陪集aH的元数皆等于H的元数。任意两个右陪集aH和bH或者相等或者不相交。 求右陪集:H本身是一个;任取a?H而求aH又得到一个;任取b?H∪aH而求bH又一个。G=H∪aH∪bH∪… 【正规子群】G中任意g,gH=Hg。(H=gHg-1对任意g∈G都成立) Lagrange定理G为有限群,则任意子群H的元数整除群G的元数。 1有限群G的元数除以H的元数所得的商,记为(G:H),叫做H在G中的指数,H的指数也就是H的右(左)陪集的个数。 2设G为有限群,元数为n,对任意a∈G,有an=1。 3若H在G中的指数是2,则H必然是G的正规子群。证明:此时对H的左陪集aH,右陪集Ha,都是G中元去掉H的所余部分。故Ha=aH。 4G的任意多个子群的交集是G的子群。并且,G的任意多个正规子群的交集仍是G的正规子群。 5 H是G的子群。N是G的正规子群。命HN为H的元素乘N的元素所得的所有元素的集合,则HN是G的子群。 【同态映射】K是乘法系统,G到K的一个映射σ(ab)=σ(a)σ(b)。 设(G,*),(K,+)是两个群,令σ:x→e,?x∈G,其中e是K的单位元。则σ是G到K 内的映射,且对a,b∈G,有σ(a*b)=e=σ(a)+ σ(b)。即,σ是G到K的同态映射,G~σ(G)。σ(G)={e}是K的一个子群。这个同态映射是任意两个群之间都有的。 【同构映射】K是乘法系统,σ是G到σ(G)上的1-1映射。称G与σ(G)同构,G?G′。同构的群或代数系统,抽象地来看可以说毫无差别。G和G′同态,则可以说G′是G的一个缩影。 【同态核】σ是G到G′上的同态映射,核N为G中所有变成G′中1′的元素g的集合,即N=σ-1(1′)={g∈G∣σ(g)=1′}。 N是G的一个正规子群。对于Gˊ的任意元素aˊ,σ-1(aˊ)={x|x∈G ,σ(x)= aˊ}是N在G 中的一个陪集。Gˊ的元素和N在G中的陪集一一对应。 设N是G的正规子群。若A,B是N的陪集,则AB也是N的陪集。 【环】R非空,有加、乘两种运算 a+b=b+a2)a+(b+c)=(a+b)+c, 3)R中有一个元素0,适合a+0=a, 4)对于R中任意a,有-a,适合a+(-a)=0, 5)a(bc)=(ab)c, 浮力 1、浮力的定义:一切浸入液体(气体)的物体都受到液体(气体)对它竖直向上的力 叫浮力。 2、浮力方向:竖直向上,施力物体:液(气)体 3、浮力产生的原因(实质):液(气)体对物体向上的压力大于向下的压力,向上、向下的压力差 即浮力。 4、物体的浮沉条件: (1)前提条件:物体浸没在液体中,且只受浮力和重力。 (2)请根据示意图完成下空。 。 下沉 悬浮 上浮 漂浮 F 浮 < G F 浮 = G F 浮 > G F 浮 = G ρ液<ρ物 ρ液 =ρ物 ρ液 >ρ物 ρ液 >ρ物 (3)、说明: ① 密度均匀的物体悬浮(或漂浮)在某液体中,若把物体切成大小不等的两块,则大块、小块都悬浮(或漂浮)。 ②一物体漂浮在密度为ρ的液体中,若露出体积为物体总体积的1/3,则物体密度为(2/3)ρ 分析:F 浮 = G 则:ρ液V 排g =ρ物Vg ρ物=( V 排/V )·ρ液= 2 3ρ液 ③ 悬浮与漂浮的比较 相同: F 浮 = G > 不同:悬浮ρ液 =ρ物 ;V 排=V 物 漂浮ρ液 >ρ物;V 排 (2018中考说明题型示例第189页32题)1.下表是Ca(OH)2和NaOH 的溶解度随温度变化的数据。请回答下列问题: 温度/°C 0 20 40 60 80 100 溶解度/g Ca(OH)20.19 0.17 0.14 0.12 0. 09 0.08 NaOH 31 91 111 129 313 336 (1)根据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(选填“A”或“B”)。 (2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有: ①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水后再恢复到原温度;⑥加入生石灰。 其中措施正确的是(填序号)。 A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥ (3)20°C时,将191g饱和NaOH溶液蒸发掉10 g水后,再降温到20°C,可析出NaOH晶体的质量为。(4)现有20°C时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时乙溶液中溶质的质量分数(选填“>”“?”或“=”)20°C时甲溶液中溶质的质量分数。 (5)现有60°C时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。 【答案】(1)A (2)D (3)9.1g (4)?(5)降温结晶,过滤 补充选题 1.如图是A、B、C三种物质的溶解度曲线。请回答: (1)交点K的含义是。 (2)t2℃的C物质的饱和溶液变到t1℃时,是 (选填“饱和”或“不饱和”)溶液。 (3)三种物质的溶解度为B>C>A时的温度范围是 ℃。 (4)在t3℃时,将40gC物质放入50g水中,充分溶解,所得溶液溶质质量分数为。 【答案】(1)t3℃时,A、C两种物质的溶解度相等(答案补充:t3℃时,A、C两种物质的饱和溶液的溶质质量分数相等)(2)不饱和(3)t2~t3(4)37.5% 2.根据图一的甲、乙溶解度曲线和图二实验现象回答下列问题: (1)图一中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是 (填写编号)。 (2)90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是g。 (3)在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图二所示,则两溶液质量分数甲(填“>”或“<”)乙,实验时控制温度t的范围是时,均能出现这种现象。 【答案】(1)b(2) 15 (3)<小于t2℃ 3.NaCl、KNO3、Ca(OH)2三种物质的溶解度曲线如图1与图2所示。请回答: 函数的定义域 【考纲说明】 1、理解函数的定义域,掌握求函数定义域基本方法。 2、会求较简单的复合函数的定义域。 3、会讨论求解其中参数的取值范围。 【知识梳理】 (1) 定义:定义域是在一个函数关系中所有能使函数有意义的 的集合。 (2) 确定函数定义域的原则 1.当函数y=f(x)用列表法给出时,函数的定义域指的是表格中所有实数x 的集合。 2.当函数y=f(x)用图象法给出时,函数的定义域指的是图象在x 轴上的投影所覆盖的实数的集合。 3.当函数y=f(x)用解析式给出时,函数定义域指的是使解析式有意义的实数的集合。 4.当函数y=f(x)由实际问题给出时,函数定义域要使函数有意义,同时还要符合实际情况。 3、.确定定义域的依据: ①f(x)是整式(无分母),则定义域为 ; ②f(x)是分式,则定义域为 的集合; ③f(x)是偶次根式,则定义域为 的集合; ④对数式中真数 ,当指数式、对数式底中含有变量x 时,底数 ; ⑤零次幂中, ,即x 0中 ; ⑥若f(x)是由几个基本初等函数的四则运算而合成的函数,则定义域是各个函数定义域的 。 ⑦正切函数x y tan = 4、抽象函数的定义域(难点) (1)已知)(x f 的定义域,求复合函数()][x g f 的定义域 由复合函数的定义我们可知,要构成复合函数,则内层函数的值域必须包含于外层函数的定义域之中,因此可 得其方法为:若)(x f 的定义域为()b a x ,∈,求出)]([x g f 中b x g a <<)(的解x 的范围,即为)]([x g f 的定义域。 (2)已知复合函数()][x g f 的定义域,求)(x f 的定义域 方法是:若()][x g f 的定义域为()b a x ,∈,则由b x a <<确定)(x g 的范围即为)(x f 的定义域。 溶解度曲线中考试题解析 【知识点的认识】 所谓固体溶解度曲线如图所示: 就是用纵坐标表示溶解度(用字母S表示,单位为克/g),横坐标表示温度(用字母t表示,单位为℃),根据物质在不同温度时的溶解度不同,画出的物质溶解度随温度变化的曲线。固体溶解度曲线的作用可从点、线、面和交点四方面来理解。具体如下: 1.点,溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以找到。溶解度曲线上的点有三个方面的作用: (1)根据已知的温度可以查出有关物质的溶解度; (2)根据物质的溶解度也可以查出它所对应的温度; (3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和 溶液中溶质的质量分数的大小)。 2.线,溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰。 (2)根据溶解度曲线,判断或比较某一物质在不同温度下的溶解度大小。 (3)根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并且,还可以判断或比较析出晶体的质量大小(即曲线越陡,析出的晶体就越多)。 3.面,对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。 3.交点,两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。 【命题方向】 集合 一、知识点: 1、元素: a 是集合A的元素,记作a A ;若b不是集合A的 ( 1)集合中的对象称为元素,若 元素,记作 b A ; ( 2)集合中对象元素的性质:确定性、互异性、无序性; (3)集合表示方法:列举法、描述法、图示法; (4)常用数集:N; N*; N ;Z; Q;R 2、集合的关系: 子集 相等 3、全集 交集 并集 补集 4、集合的性质: (1)A A A,A,ABBA; (2)A A, A B B A; (3)( A B)(A B); (4)A B A B A ABB; (5) C S(A B) (C S A) (C S B),C S( A B) (C S A) (C S B); 二、典型例题 例1.已知集合 A { a 2, (a 1)2 ,a 23a 3} ,若1 A ,求a。 例 2. 已知集合M =x R | ax 2 2x10 中只含有一个元素,求a的值。 例3.已知集合 A { x | x2x 6 0}, B { x | ax 1 0}, 且B A ,求 a 的值。\ 例 4. 已知方程x2bx c 0 有两个不相等的实根x , x 2.设 C= {x , x 2},A={1,3, 11 5,7,9}, B={1 ,4,7,10} ,若A C,C B C ,试求 b, c 的值。 例 5.设集合A { x | 2 x 5}, B { x | m 1 x 2m 1} , (1)若A B,求 m 的范围;(2)若A B A ,求m的范围。 例 6. 已知 A ={0 ,1} , B = {x|x A} ,用列举法表示集合 B ,并指出集合 A 与 B 的关系。 三、练习题 1. 设集合 M = { x | x 17}, a 4 2,则( ) A. a M B. a M C. a = M D. a > M 2. 有 下 列 命 题 : ① { } 是 空 集 ② 若 a N, b N , 则 a b 2③ 集合 100 N , x Z} 为无限集,其中正确命 { x | x 2 2x 1 0} 有两个元素 ④ 集合 B { x | x 题的个数是( ) A. 0 B. 1 C. 2 D. 3 3. 下列集合中,表示同一集合的是( ) A. M ={ (3, 2)} , N ={ (2, 3)} B. M ={3 ,2} , N ={( 2,3)} C. M ={ ( x , y ) |x + y = 1} , N = {y|x + y = 1} D.M ={1 ,2} , N ={2,1} 4. 设集合 M { 2,3, a 2 1}, N { a 2 a 4,2a 1},若M N { 2} , 则 a 的取值集 合是( ) { 3,2, 1 } B. { -3} C. { 3, 1 } D. { - 3,2} A. 2 2 5. 设集合A = {x| 1 < x < 2} , B = {x| x < a} , 且 A B , 则实数 a 的范围是 ( ) A. a 2 B. a 2 C. a 1 D. a 1 {( x, y) | y 1} 6. x 设 x ,y ∈ R ,A = {( x ,y )|y = x} , B = , 则集合 A ,B 的关系是( ) A.A B B.B A C. A =B D.A B 7. 已知 M = {x|y = x 2- 1} , N = {y|y =x 2 -1} , 那么 M ∩ N =( ) A. Φ B. M C. N D. R 8. 已知 A = {-2,- 1,0,1} , B = {x|x = |y|,y ∈ A} ,则集合 B = _________________ 9. 若 A { x | x 2 3x 2 0}, B { x | x 2 ax a 1 0}, 且B A ,则 a 的值为 _____ 10. 若 {1,2, 3} A {1 , 2,3, 4, 5} , 则 A = ____________ 11. 已知 M = {2 , a , b} , N = {2a , 2,b 2 } ,且 M =N 表示相同的集合,求 a , b 的值 12. 已知集合 A { x | x 2 4x p 0}, B { x | x 2 x 2 0}且A B, 求实数 p 的范 围。 13. 已知 A { x | x 2 ax a 2 19 0}, B { x | x 2 5x 6 0} ,且 A , B 满足下列三 个条件:① A B ② A B B ③ Φ A B ,求实数 a 的值。 巧用溶解度曲线 在九年级化学第九单元第 2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。 利用溶解度曲线可以解决很多的问题 技巧一:溶解度曲线是一条饱和线。通过点与曲线的位置关系,判断溶液的的状态。 1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。 2、线下方的点表示该温度下该溶液为不饱和溶液。 3、线上的点表示该游弋上该溶液恰好为饱和溶液。 技巧二:将溶液升温或降温,可在图上将点平移。通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。(归纳为5个字,就低不就高) 1、某温度下将溶升温。在图象上把表示该溶液的点向右平移。 2、某温度下将溶降温。在图象上把表示该溶液的点向左平移。 技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶) 技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。 1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。(同温下饱和溶液的 质量分数最大)。 ×100%,溶解度S越大质量分数越大。(质量分数最大的 2、某温度下某饱和溶液的质量分数=S 100g+S 是该温度下的饱和溶液) 特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。(等效法) ×100% 3、线上的点及线下的点表示的溶液的质量分数=S纵 S纵+100g 技巧引入: 例:已知:40℃时氯化钾的溶解度为40g,其含义为。 (1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。 (2)在40℃时氯化钾的饱和溶液B的质量分数为。 (3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。此时溶液C中氯化钾的质量分数为。其溶液为(填“饱和”或“不饱和”)。 (4)在40℃时,向100g水中加入100g氯化钾,充分搅拌后形成溶液D,此时溶液D中氯化钾的质量分数为,溶液为(填“饱和”或“不饱和”)。 (5)在溶解度曲线中绘制表示四各溶液A,B,C,D 规律:(1)点A,B,C,D与曲线的位置关系(线上,线上方,线下方)来判断溶液的状态。 (2)线上面的点C,D与线上的点B表示的溶液在该温度下的质量分数相等。(线上面的点C,D表示的溶液的质量分数可以用B点来代替) 技巧应用: 1、某化学兴趣小组的同学在20℃时进行了如下图1所示实验,已知图2是 高一数学集合知识点归纳及典型例题 一、、知识点: 本周主要学习集合的初步知识,包括集合的有关概念、集合的表示、集合之间的关系及集合的运算等。在进行集合间的运算时要注意使用Venn图。 本章知识结构 1、集合的概念 集合是集合论中的不定义的原始概念,教材中对集合的概念进行了描述性说明:“一般地,把一些能够确定的不同的对象看成一个整体,就说这个整体是由这些对象的全体构成的集合(或集)”。理解这句话,应该把握4个关键词:对象、确定的、不同的、整体。 对象――即集合中的元素。集合是由它的元素唯一确定的。 整体――集合不是研究某一单一对象的,它关注的是这些对象的全体。确定的――集合元素的确定性――元素与集合的“从属”关系。不同的――集合元素的互异性。 2、有限集、无限集、空集的意义有限集和无限集是针对非空集合来说的。我们理解起来并不困难。 我们把不含有任何元素的集合叫做空集,记做Φ。理解它时不妨思考一下“0与Φ”及“Φ与{Φ}”的关系。 几个常用数集N、N*、N+、Z、Q、R要记牢。 3、集合的表示方法(1)列举法的表示形式比较容易掌握,并不是所有的集合都能用列举法表示,同学们需要知道能用列举法表示的三种集合: ①元素不太多的有限集,如{0,1,8} ②元素较多但呈现一定的规律的有限集,如{1,2,3,?,100} ③呈现一定规律的无限集,如 {1,2,3,?,n,?} ●注意a与{a}的区别 ●注意用列举法表示集合时,集合元素的“无序性”。 (2)特征性质描述法的关键是把所研究的集合的“特征性质”找准,然后适当地表示出来就行了。但关键点也是难点。学习时多加练习就可以了。另外,弄清“代表元素”也是非常重要的。如{x|y=x2}, {y|y =x2}, {(x,y)|y=x2}是三个不同的集合。 4、集合之间的关系 ●注意区分“从属”关系与“包含”关系 “从属”关系是元素与集合之间的关系。 “包含”关系是集合与集合之间的关系。掌握子集、真子集的概念,掌握集合相等的概念,学会正确使用“”等符号,会用Venn图描述集合之间的关系是基本要求。 ●注意辨清Φ与{Φ}两种关系。 5、集合的运算 集合运算的过程,是一个创造新的集合的过程。在这里,我们学习了三种创造新集合的方式:交集、并集和补集。 一方面,我们应该严格把握它们的运算规则。同时,我们还要掌握它们的运算性质: A?CUA?U A?B?B?AA?A?A A?????A?? A?B?A?B?A 浮力-知识点总结及练习题-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN 浮力 1、浮力的定义:一切浸入液体(气体)的物体都受到液体(气体)对它竖直向上的力 叫浮力。 2、浮力方向:竖直向上,施力物体:液(气)体 3、浮力产生的原因(实质):液(气)体对物体向上的压力大于向下的压力,向上、向下的压力差 即浮力。 4、物体的浮沉条件: (1)前提条件:物体浸没在液体中,且只受浮力和重力。 (2)请根据示意图完成下空。 下沉 悬浮 上浮 漂浮 F 浮 < G F 浮 = G F 浮 > G F 浮 = G ρ液<ρ物 ρ液 =ρ物 ρ液 >ρ物 ρ液 >ρ物 (3)、说明: ① 密度均匀的物体悬浮(或漂浮)在某液体中,若把物体切成大小不等的两块,则大块、小块都悬浮(或漂浮)。 ②一物体漂浮在密度为ρ的液体中,若露出体积为物体总体积的1/3,则物体密度为(2/3)ρ 分析:F 浮 = G 则:ρ液V 排g =ρ物Vg ρ物=( V 排/V )·ρ液= 2 3 ρ液 ③ 悬浮与漂浮的比较 相同: F 浮 = G 不同:悬浮ρ液 =ρ物 ;V 排=V 物 漂浮ρ液 >ρ物;V 排 ρ物= G ρ/ (G-F) ⑥冰或冰中含有木块、蜡块、等密度小于水的物体,冰化为水后液面不变,冰中含有铁块、石块等密大于水的物体,冰化为水后液面下降。 5、阿基米德原理: (1)、内容:浸入液体里的物体受到向上的浮力,浮力的大小等于它排开的液体受到的重力。 (2)、公式表示:F 浮 = G 排 =ρ液V 排g 从公式中可以看出:液体对物体的浮力与液体的密度和物体排开液体的体积有关,而与物体的质量、体积、重力、形状 、浸没的深度等均无关。 (3)、适用条件:液体(或气体) 6.漂浮问题“五规律”: 规律一:物体漂浮在液体中,所受的浮力等于它受的重力; 规律二:同一物体在不同液体里漂浮,所受浮力相同; 规律三:同一物体在不同液体里漂浮,在密度大的液体里浸入的体积小; 规律四:漂浮物体浸入液体的体积是它总体积的几分之几,物体密度就是液体密度的几分之几; 规律五:将漂浮物体全部浸入液体里,需加的竖直向下的外力等于液体对物体增大的浮力。 7、浮力的利用: (1)、轮船: 工作原理:要使密度大于水的材料制成能够漂浮在水面上的物体必须把它做成空心的,使它能够排开更多的水。 排水量:轮船满载时排开水的质量。单位 t 由排水量m 可计算出:排开液体的体积V 排 = m/ρ液;排开液体的重力G 排 = m g ;轮船受到的浮力F 浮 = m g 轮船和货物共重G=m g 。 (2)、潜水艇: 2018年中考复习溶解度曲线的专题 中考溶解度曲线的常见题型: 1、根据溶解度曲线找出某一温度时,某物质的溶解度; 练习:t1时A 物质的溶解度为 。 2、 利用溶解度,求饱和溶液的溶质的质量分数。 练习:t1时A 物质的饱和溶液的溶质的质量分数为 。 t3时B 物质的饱和溶液的溶质的质量分数为 。 t3时A 物质的饱和溶液的溶质的质量分数为 。 3、根据溶解度曲线找出溶解度,结合溶解度的意义进行判断和计算 练习:t1 时,25g 水中加入20g 的A 物质,充分搅拌后,是否完全溶解,是否达到饱和,溶质 g,溶剂 g,溶液 g ,溶质质量分数为 。若A 物质完全溶解还至少需要加入 g 的水。 4、说出交点的具体意义;(某温度时,某物质与另一某物质的溶解度相同) 练习:交点M 的意义为: 。 可变形为:某温度时,某物质与另一某物质的饱和溶液的溶质质量分数相同。 练习:请判断下列说法正误:t2时,A 物质与C 物质的饱和溶液溶质的质量分数相同( ) t2时,A 物质与C 物质的溶液溶质的质量分数相同( ) (1)氯化钠与氯化铵溶解度相等的温度在 ℃ 之间。 (2)由表中数据分析可知,氯化铵和氯化钠在某一温度时具有相同的溶解度x ,则x 的 取值范围是 g 。 (3) 由上表可推出氯化铵溶解度曲线的变化规律是 。 5、比较某一温度时不同物质的溶解度的大小;(注意要求是:由大至小或由小至大), 练习:t1时A 、B 、C 物质的溶解度由小至大为 。 t2时A 、B 、C 物质的溶解度由大至小为 。 t3时A 、B 、C 物质的溶解度由小至大为 。 可变形为:某一温度时,不同物质的饱和溶液的溶质质量分数大小。 练习:t1时,A 、B 、C 的饱和溶液溶质的质量分数 。 t2时,A 、B 、C 的饱和溶液溶质的质量分数 。 t3时,A 、B 、C 的饱和溶液溶质的质量分数 。 判断正误: t3时,A 、B 、C 的溶液溶质的质量分数A >B >C 。( ) 6、根据溶解度曲线说出不同物质饱和溶液与不饱和溶液的转化: 练习:A 的不饱和溶液转化饱和溶液可采用哪些方法: 。 A 的饱和溶液转化不饱和溶液可采用哪些方法: 。 C 的不饱和溶液转化饱和溶液可采用哪些方法: 。 C 的饱和溶液转化不饱和溶液可采用哪些方法: 。 7、饱和溶液经过升温或降温引起溶解度变化导致溶液质量、溶质质量、溶质质量分数的变化 (1)饱和溶液中不含末溶物质时,升温或降温的变化 练习:t1时A 的饱和溶液升高到t3,溶解度 ,溶液的中溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 ,(填变大或变小或不变);t1时C 的饱和溶液升高到t3,溶解度 ,溶液的中溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 ,(填变大或变小或不变)。 (2)饱和溶液中含末溶物质时,升温或降温的变化 练习:右图,t1时A 的饱和溶液中仍有末溶解的A ,C 的饱和 溶液中仍有末溶解的C ,均升温至t3:A 中溶解度 ,固体 溶液的中溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 ,(填变大或变小或不变);C 中溶解度 ,固体 溶液的中溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 ,(填变大或变小或不变)。 (3)比较析出结晶的多少 练习1:t3时,等质量的A 、B 、C 三种物质的饱和溶液降温到t1,其中析出晶体的是 ,没有析出晶体的是 。 练习2:t 3℃时,将A 、B 、C 三种物质的饱和溶液降温到t 1℃,所得溶液中溶质质量分数由小到大的顺序为 8、根据溶解度曲线说出不同物质的结晶方法: 蒸发溶剂结晶:适用所有溶液的结晶 冷却热饱和溶液(冷却结晶、降温结晶):只适用溶解度随温度的升高而增大较大的物质从溶液中结晶。 练习:(1)氯化钠溶液中析出氯化钠晶体 。(2)硝酸钾溶液中析出硝酸钾晶体 。 *若溶液中有两种溶质。采用什么方法结晶,这要根据所得晶体的溶解度特点决定。 例如:(1)从混有少量氯化钠的硝酸钾溶液中得到硝酸钾。采用的方法是: 蒸发浓缩→降温结晶→过滤 (2)从混有少量硝酸钾的氯化钠溶液中得到氯化钠。采用的方法是: 蒸发结晶(不能蒸干)→趁热过滤 练习:1.现有操作步骤:①溶解;②过滤;③降温结晶;④加热浓缩。若A 固体中含有少量B ,则提纯A 的操作步骤是 .(填字母序号)高一数学集合知识点归纳及典型例题
人教版八年级物理下册浮力知识点典型题解析.docx
高考集合知识点总结与典型例题
浮力复习知识点与经典例题
溶解度曲线中考试题解析
【离散数学】知识点典型例题整理
浮力-知识点总结及练习题
陕西省中考化学题型解读:溶解度及溶解度曲线(含答案)
函数定义域知识点梳理、经典例题及解析、高考题带答案
溶解度曲线中考试题解析
高一数学集合知识点归纳与典型例题
(完整版)溶解度曲线解题方法归纳
高一数学集合知识点归纳及典型例题
浮力-知识点总结及练习题
2018中考溶解度曲线的专题
