美国药典-微生物检测
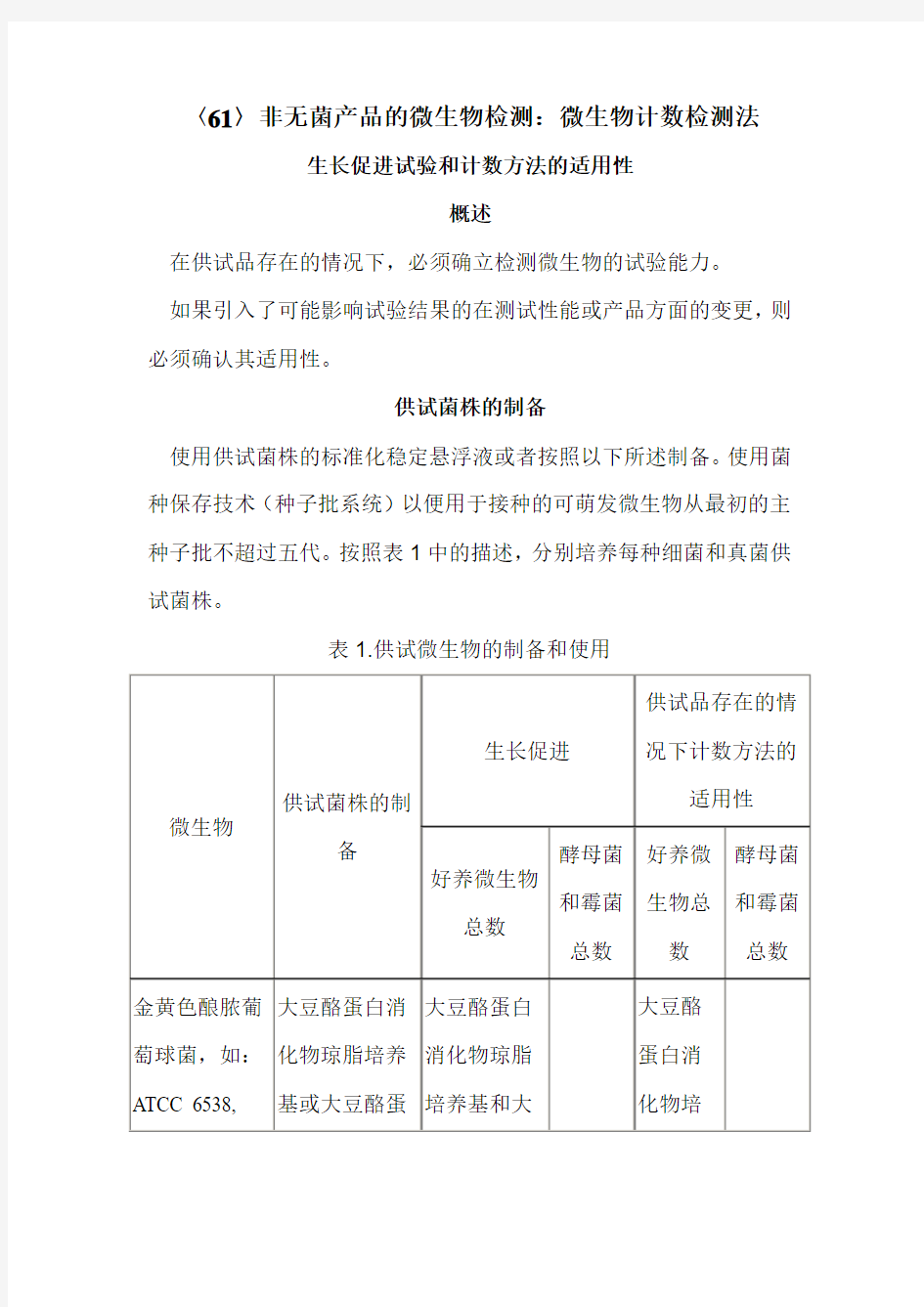

〈61〉非无菌产品的微生物检测:微生物计数检测法
生长促进试验和计数方法的适用性
概述
在供试品存在的情况下,必须确立检测微生物的试验能力。
如果引入了可能影响试验结果的在测试性能或产品方面的变更,则必须确认其适用性。
供试菌株的制备
使用供试菌株的标准化稳定悬浮液或者按照以下所述制备。使用菌种保存技术(种子批系统)以便用于接种的可萌发微生物从最初的主种子批不超过五代。按照表1中的描述,分别培养每种细菌和真菌供试菌株。
表1.供试微生物的制备和使用
用pH 7.0的氯化钠-蛋白胨缓冲溶液或pH7.2的磷酸盐缓冲液配制供试悬浮液;为使黑曲霉孢子悬浮,可将0.05%的聚山梨醇酯80加
入该缓冲液中。这些悬浮液需在2个小时之内使用,或存放在2o~8o条件下24小时内使用。作为制备并稀释黑曲霉或枯草杆菌营养细胞的新鲜悬浮液的替代方法,可制备稳定的孢子悬浮液,然后将适量的孢子悬浮液用于试验接种。稳定的孢子悬浮液可在2o~8o下保存,保存期经过时间验证。
阴性对照
为了确认试验的条件,用所选的稀释液替代供试品阴性对照。必须没有微生物的生长。
培养基的生长促进
对每一批已制备好的培养基和每一批从脱水培养基或根据描述的组分制备出来的培养基进行测试。
在部分/整个平皿内的大豆酪蛋白消化物肉汤培养基和大豆酪蛋白消化物琼脂培养基中接种少量(不超过100cfu) 表1中指定的微生物,每种微生物均使用单独一部分/整个平皿培养基。在平皿内的沙氏葡萄糖琼脂培养基中接种少量(不超过100cfu)表1中指定的微生物,每种均使用一个单独平皿的培养基。按照表1中描述的条件进行培养。对于固体培养基,所获得的生长与标准化接种体的计算值之间的差异因素不大于2。对于刚刚制备好的接种体,发生的微生物生长与用此前检验并批准过的培养基批次所得到的微生物生长相当。如果出现了与此前从上一个经过测试并通过的培养基批次获得的微生物生长相当、清晰可见的微生物生长,则液体培养基适用。
供试品计数法的适用性
样品的制备
样品制备方法取决于供试品的物理特征。如果以下描述的规程不能够被令人满意地证实,则必须开发一个适用的替代规程。
水溶性产品—溶解或稀释(通常制备1:10的稀释液)供试品,于pH 7.0的氯化钠-蛋白胨缓冲液,pH7.2的磷酸盐缓冲液或大豆酪蛋白消化物肉汤培养基中。如有必要,调整pH值为6至8。需要时,用相同的稀释剂作进一步稀释。
不溶于水的非脂肪性产品—将供试品(通常制备1:10的稀释液)悬浮于pH 7.0的氯化钠-蛋白胨缓冲液,pH7.2的磷酸盐缓冲液或大豆酪蛋白消化物肉汤培养基中。可以加入表面活性剂,如1g/L的聚山梨酯80,以帮助难以与水混合的物质悬浮。如有必要,调整pH值为6至8。需要时,用相同的稀释剂进一步稀释。
脂肪性产品—溶解于以过滤除菌的豆蔻酸异丙酯,或者将供试品与所需最少量的、经过加热的无菌聚山梨酯80或另一种非抑菌性的无菌表面活性剂进行混合,如有必要,可加热至不超过40o或者在特殊情况下不超过45o。仔细混匀,如有必要,在水浴锅里中维持该温度。加入充足数量、经过预热的所选择稀释剂,制成原产品的1:10稀释液。仔细混匀,同时维持该温度至形成乳化剂所必需的最短的时间。可以用所选择的含有适当浓度的无菌聚山梨酯80或者另一种非抑菌性的无菌表面活性剂的稀释液,来制备后续的系列10倍稀释液。
液体或固体悬浮微粒状—以无菌操作将供试品转移至一个膜过滤设
备或无菌容器中做进一步取样。使用每个待检容器中的全部内容物或规定数量的一定剂量。
贴剂——去除贴剂的防护面(“释放衬板”)并将它们放置在无菌玻璃或塑料托盘上,将有粘性的一面朝上。用适当的无菌多孔材料(如:无菌纱布)盖住粘性面,以防止贴剂粘在一起,并将10片贴剂转移到所选的含有灭活剂(如:聚山梨醇酯80和/或卵磷脂)的适量稀释剂中。振摇供试品至少30分钟。
接种和稀释
加入足量的微生物悬浮液到按上述规定制备的样品及对照品(不含检测物)中,以获得一个不多于100 cfu的接种体。接种体的悬浮液体积应当不超过被稀释供试品体积的1%。
为证明供试品有可接受的微生物回收率,必须使用已制备样品的最低可能稀释倍数来进行检测。如果由于抗菌活性或低溶解度而无法做到这一点时,必须进一步开发合适的规程。如果样品对生长的抑制不能避免,可以在中和、稀释或过滤后加入等量的微生物悬浮液。
抗菌活性的中和/去除
用制备好的样品按接种和稀释项下的描述稀释,并按供试品微生物的回收率规程培养,将从中回收的微生物数量与从对照品中回收的微生物数量进行比较。
如果生长被抑制(以大于2的因素减少),那么修改特定的计数测试规程以确保结果的有效性。规程的修改可以包括,例如:
1. 稀释剂或培养基体积的增加;
2. 将某个特定或通用的中和剂加合到稀释剂中;
3. 膜过滤;或
4. 综合以上措施
中和剂——中和剂可以用于中和抗菌剂(见表2)的活性。最好在灭菌前将它们加入到所选的稀释来论证它们的功效和无毒性。
表2.对干扰物质的常用中和剂/方法
如果没有找到合适的中和方法,则可以假定未能分离所接种有机体的原因是供试品杀灭微生物活性。这个信息帮助指出此物品不太可能被特定微生物种群污染。然而,有可能供试品只抑制这里所列出微生物中的某些,而并不抑制未包括在供试菌株之中其他微生物或者后者对其不具代表性的那些微生物。然后,用与微生物生长和具体接受标准相适应的最高稀释倍数进行试验。
供试品中微生物的回收
膜过滤—使用标准孔径不超过0.45 μm的膜过滤器。过滤器材质的类型按以下标准选择,即细菌保留效能不被待检测样品的成分所影响。对于所列出的每个微生物,单独使用一个膜过滤器。
将按照样品的制备、接种、稀释和抗菌活性的中和/去除项下描述所制备的适当数量的样品(最好相当于1克产品,在cfu数量预计较大时,可减用量)转移至膜过滤器,立即过滤,并用适量的稀释剂冲洗膜过滤器。
为确定总好氧微生物计数(TAMC),将滤膜转移至大豆酪蛋白消化物琼脂培养基的表面。为确定总酵母菌和霉菌联合计数(TYMC),将膜转移至沙氏葡萄糖琼脂培养基的表面。按表1中规定培养这些平皿,进行计数。
平板计数法—每种培养基至少进行两次平板计数法,并使用计数结果的平均值。
倾注平板法—在直径为9cm的平皿中,加入按样品的制备、接种、稀释和抗菌活性的中和/去除项下的描述所制备的样品 1 mL以及15~20 mL大豆酪蛋白消化物琼脂培养基或沙氏葡萄糖琼脂培养基加入至平皿,此两种培养基的温度均保持在不超过45o。如果使用较大的平皿,琼脂培养基的量也相应地增加。对于表1中所列出的每一个微生物至少要使用两个平皿。
按表 1 中的指示培养这些平皿。取每培养基计数的算术平均值,计算在最初的接种体中的菌落数(cfu)数量。
表面铺展法—对于直径为9cm的平皿,倾入15~20 mL、温度约为45o的大豆酪蛋白消化物琼脂培养基或沙氏葡萄糖琼脂培养基至每个平皿中,静置凝固。如果使用较大的平皿,琼脂的数量也需相应地增加。干燥平皿,例如,在层流柜或恒温箱里。对于表1中列出的每个微生物,至少使用两个平皿。将已称量好的体积不少于0.1 mL、按照样品的制备、接种、稀释和抗菌活性的中和/去除项下的规定所制备的样品,铺展在培养基的表面。按照倾注培养法项下的规定进行培养和计数。
最大可能数(MPN)法—MPN法的精密度和准确度低于膜过滤法或平板计数法。所获得的霉菌计数的结果尤其不可靠。由于这些原因,MPN法被保留用于当没有其它可行方法情况下的总好氧微生物计数。如果该方法的使用有据可可循,则按如下进行。
按样品的制备,接种和稀释,以及抗菌活性的中和/移除这些项下的描述,制备一系列至少三个连续、每级稀释10倍的产品稀释液。从每个水平的稀释液中将1克或者1毫升的三等分的试样接种到三管装有9~10毫升大豆酪蛋白消化物肉汤培养基的试管中。如有必要,加入表面活性剂,如聚山梨醇酯80或抗菌灭活剂到培养基中。因此,如果制备了三水平的稀释液,则会接种九个试管。
在30o~35o温度下培养所有的试管不超过3天。如果由于供试品的性质导致结果的读数很困难或不确定,则在相同温度下,在同样的肉汤培养基或大豆酪蛋白消化物琼脂培养基中在同样温度下放置1~2天再次培养,并且使用这些结果。从表3确定每克或每毫升供试品
中微生物的最大可能数。
表3 微生物的最大可能数值
结果和说明
当确认膜过滤法或平板计数法的适用性时,任何供试微生物的平均计数与在没有产品的情况下,从培养和稀释项下规定的对照组的数值差距必须不超过2。当确认最大可能数法的适用性时,从接种体得到的计算值必须是在从对照组取得结果的95%置信区间内。
如果上述标准不能用任何一种所叙述的方法符合检测有机体中的一种,那么使用最接近标准的方法和检测条件来检测该供试品。
供试品的测试
供试品的检测
膜过滤
使用能够将滤膜转移至培养基中的过滤设备。按生长促进测试和计数方法的适用性项下描述的、已经证明适用的方法制备样品,转移合适的量至两个膜过滤器中的每一个,并立即过滤。按照以下已经证明适用的规程清洗每个过滤器。
对于总好氧微生物计数的测定,转移滤膜中的一个至大豆酪蛋白消化物琼脂培养基的表面。对酵母菌和霉菌联合计数的测定,转移另一个滤膜至沙氏葡萄糖琼脂培养基的表面。在温度30o~35o之间培养大豆酪蛋白消化物琼脂培养基的平皿3~5天,并在温度20o~25o 之间培养沙氏葡萄糖琼脂培养基的平皿5~7天。计算每克或每毫升
供试品的菌落数(cfu)数量。
当检测贴剂时,分别将样品的制备项下描述的制备品数量的10%过滤通过两个无菌滤膜中的一个。为总好氧微生物计数将一个滤膜转移至大豆酪蛋白消化物琼脂培养基,以检测总好氧微生物计数,而将另一个滤膜转移至沙氏葡萄糖琼脂培养基,以检测总酵母菌和霉菌联合计数。
平板计数法
倾注培养法——使用已经证明适用的、在生长促进测试和计数方法的适用性项下描述的方法制备样品。对于每种培养基,为每个稀释水平准备至少两个培养平皿。在温度30o~35o之间,培养大豆酪蛋白消化物琼脂培养基的平皿3~5天,并在温度20o~25o之间,培养沙氏葡萄糖琼脂的平皿5~7天。选择总好氧微生物的数量不超过250个和总酵母和霉菌的数量不超过50的稀释平板进行计数。取每培养基计数的算术平均值,并计算每克或每毫升供试品的cfu数量。
表面铺展法——使用已经证明适用的、在生长促进测试和计数方法的适用性项下描述的方法制备供试品。为每种培养基和每个稀释水平准备至少两个培养平皿和不同程度的稀释液。对于培养和cfu数量的计算,直接按倾注培养法进行。
最大可能数法
使用已经证明适当的、在生长促进测试和计数方法的适用性项下描述的方法制备和稀释样品。在温度30o至35o之间时,培养所有试管3到5天。如有必要,则使用已经证实适合的规程再次培养。记录不
同稀释水平下显示出微生物生长的试管数。从表3中确定每克或每毫升供试品中微生物的最大可能数。
结果的说明
总好氧微生物计数(TAMC)被认为等于使用大豆酪蛋白消化物琼脂培养基所发现的cfu数量,如果在该培养基上发现真菌的菌落,则它们作为总好氧微生物计数的一部分来计数。总酵母菌和霉菌联合计数(TYMC)被认为等于使用沙氏葡萄糖琼脂培养基所发现的cfu数量,如果在该培养基上发现细菌的菌落,则它们作为总酵母菌和霉菌联合计数的一部分来计数。当细菌的生长导致总酵母菌和霉菌联合计数预计超过接受标准时,可以使用含有抗生素的沙氏葡萄糖琼脂培养基。如果通过最大可能数法进行计数,则计算出的数值就是总好氧微生物计数。
当规定微生物质量的接受标准给出时,可作如下解释:
101 cfu: 可接受的最大计数=20;
102 cfu: 可接受的最大计数=200;
103 cfu: 可接受的最大计数=2000;
等等。
推荐的溶液和培养基在非无菌产品微生物学检查:指定微生物检查<62>中描述。
〈62〉非无菌产品的微生物检测:特定微生物检测
产品的检测
胆汁耐性革兰氏阴性菌
样品的制备和预培养—按照非无菌产品生物学检测:微生物计数检查法<61>章节中的描述,将不少于1克的供试品以1:10稀释来制备样品,但是使用大豆酪蛋白消化物肉汤培养基作为所选择的稀释剂,混匀,并在20o~25o时培养一段时间,此时间段足以使细菌复苏但不足以促进微生物的繁殖(通常2个小时而不超过5小时)。
确认微生物不存在的检测—除非另有规定,否则使用按样品的制备和预培养项下规定制备的、对应的1克该产品的制备品,接种至肠道菌增菌肉汤培养基Mossel。在温度30o~35 o下培养24~48小时。再次培养紫红色胆汁葡萄糖琼脂培养基平皿上。在温度30 o~35 o下培养18~24小时。
如果没有菌落生长,则供试品符合该检测的要求。
定量检测—选择和再培养—将在样品的制备和预培养项下规定的制备品和/或分别包含0.1克,0.01克,和0.001克(或0.1毫升,0.01毫升,和0.001毫升)该供试品的稀释液,接种于适量的肠道菌增菌肉汤培养基Mossel。在温度30o~35 o下培养24~48小时。在紫红色胆汁葡萄琼脂培养基的平皿上对培养物进行再次培养。在温度30 o~35 o下培养18~24小时。
说明—菌落的生长构成了阳性结果。记录产生阳性结果的最少量供试品和产生阴性结果的最大量供试品。从表2中大概确定细菌的数量。
表 2. 结果说明
大肠杆菌
样品的制备和预培养—按非无菌产品微生物学检测:微生物计数检查法<61>章节下的描述,将不少于1克的供试品以1:10稀释来制备样品,并使用10毫升或对应1克或1毫升的数量,接种于适量(按照检查方法的适用性项下的内容来确定)的大豆酪蛋白消化物肉汤培养基,混匀,并在温度30o~35 o下培养18~24小时。
选择和再次培养—摇动容器,转移1毫升大豆酪蛋白消化物肉汤培养基至100毫升的麦康基肉汤培养基,并在温度42 o~44 o下培养24~48小时。在温度30o~35o下,于麦康基琼脂培养基的平皿上再次培养18~72小时。
说明—菌落的生长表明可能有大肠杆菌存在,这由鉴定检测确定。如果没有该菌落存在或者鉴定检测呈阴性,则样品符合该检测要求。
建议的溶液和培养基
贮备缓冲溶液—将34 g磷酸二氢钾转移到一个1000mL的容量瓶内,溶解在500mL纯净水中,用氢氧化钠调整pH值为7.2±0.2,加入纯净水至刻度并混匀。分装在容器中,灭菌。在2o~8o温度下贮存。pH7.0磷酸盐冲液—制备纯净水与贮备缓冲溶液(800:1 v/v)的混合液,并灭菌。
在高压蒸汽灭菌锅内以经过验证的周期灭菌。
调整pH值,以使在灭菌后温度为25o时,pH值7.3±0.2。在高压蒸汽灭菌器内以经过验证的周期灭菌。
调整pH 值,以使在灭菌后温度为25o 时,
pH 值7.3±0.2。在高压蒸汽灭菌器内以经过验证的周期灭菌。
调整pH 值,以使在灭菌后温度为25o 时,pH 值5.6±0.2。在高压蒸汽灭菌器内以经过验证的周期灭菌。
调整pH值,以使在灭菌后温度为25o时,pH值5.6±0.2。在高压蒸汽灭菌器内以经过验证的周期灭菌。
调整pH值,以使在灭菌后温度为25o时,pH值5.6±0.2。在高压蒸汽灭菌器内以经过验证的周期灭菌。
调整pH值,以使在灭菌后温度为25o时,pH值7.2±0.2。加热
USP 62 非无菌产品微生物限度检查(控制菌) USP38
62 MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS: TESTS FOR SPECIFIED MICROORGANISMS 非无菌产品微生物限度检查:控制菌(USP38) 1.INTRODUCTION导言 The tests described hereafter will allow determination of the absence of, or limited occurrence of, specified microorganisms that may be detected under the conditions described. 控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。 The tests are designed primarily to determine whether a substance or preparation complies with an established specification for microbiological quality. When used for such purposes, follow the instructions given below, including the number of samples to be taken, and interpret the results as stated below. 当本法用于检查非无菌制剂及其原辅料是否符合相应的微生物限度标准时,应按下列规定进行检验,,包括样品的取样量,结果的判断. Alternative microbiological procedures, including automated methods, may be used, provided that their equivalence to the Pharmacopeial method has been demonstrated. 可以使用包括自动化法在内的方法,需确认与药典方法的等同性. 2.GENERAL PROCEDURES通用规程 The preparation of samples is carried out as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61. 供试品制备,同USP<61> If the product to be examined has antimicrobial activity, this is insofar as possible removed or neutralized as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61. 若供试品有抗菌活性,应尽可能中和或去除,中和或去除的方法同USP<61> If surface-active substances are used for sample preparation, their absence of toxicity for microorganisms and their compatibility with any inactivators used must be demonstrated as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61. 若供试品制备过程中使用了表面活性剂,应确认其对微生物的无毒性以及与所用的中和剂/灭活剂的相容性,同USP<61> 3.GROWTH-PROMOTING AND INHIBITORY PROPERTIES OF THE MEDIA, SUITABILITY OF THE TEST AND NEGATIVE CONTROLS 培养基适用性检查,控制菌检查方法的适用性 确认,阴性对照 The ability of the test to detect microorganisms in the presence of the product to be tested must be established. Suitability must be confirmed if a change in testing performance or a change in the product that may affect the outcome of the test is introduced. 在有供试品存在的情况下,所建立的方法应能检测微生物。若检测程序或产品发生变化可能影响检测结果时,控制菌检查方法应重新进行适用性试验。 3.1.Preparation of Test Strains试验菌液的制备 Use standardized stable suspensions of test strains as stated below. Seed-lot culture maintenance techniques (seed- lot systems) are used so that the viable microorganisms used for inoculation are not more than five passages removed from the original master seed-lot.
常见的微生物检测方法
常见的微生物检测 方法
摘要:微生物的检测,无论在理论研究还是在生产实践中都具有重要的意义,本文分生长量测定法,微生物计数法,生理指标法和商业化快速微生物检测简要介绍了利用微生物重量,体积,大小,生理代谢物等指标的二十余种常见的检测方法,简要介绍了这些方法的原理,应用范围和优缺点。 概述: 一个微生物细胞在合适的外界条件下,不断的吸收营养物质,并按自己的代谢方式进行新陈代谢。如果同化作用的速度超过了异化作用,则其原生质的总量(重量,体积,大小)就不断增加,于是出现了个体的生长现象。如果这是一种平衡生长,即各细胞组分是按恰当的比例增长时,则达到一定程度后就会发生繁殖,从而引起个体数目的增加,这时,原有的个体已经发展成一个群体。随着群体中各个个体的进一步生长,就引起了这一群体的生长,这可从其体积、重量、密度或浓度作指标来衡量。微生物的生长不同于其它生物的生长,微生物的个体生长在科研上有一定困难,一般情况下也没有实际意义。微生物是以量取胜的,因此,微生物的生长一般指群体的扩增。微生物的生长繁殖是其在内外各种环境因素相互作用下的综合反映。因此生长繁殖情况就可作为研究各种生理生化和遗传等问题的重要指标,同
时,微生物在生产实践上的各种应用或是对致病,霉腐微生物的防治都和她们的生长抑制紧密相关。因此有必要介绍一下微生物生长情况的检测方法。既然生长意味着原生质含量的增加,因此测定的方法也都直接或间接的以次为根据,而测定繁殖则都要建立在计数这一基础上。微生物生长的衡量,能够从其重量,体积,密度,浓度,做指标来进行衡量。 生长量测定法 体积测量法:又称测菌丝浓度法。 经过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。方法是,取一定量的待测培养液(如10毫升)放在有刻度的离心管中,设定一定的离心时间(如5分钟)和转速(如5000 rpm),离心后,倒出上清夜,测出上清夜体积为v,则菌丝浓度为(10-v)/10。菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。 称干重法:
美国药典简介
美国药典简介 1. 标题和修订(Title and Revision). 9 2. 药典地位和法律认可(Official status and legal recognition)9 2.10 药典正文(Official Text) 9 2.20 药典物品(Official Articles). 9 2.30 法律认可(Legal Recognition). 10 3. 与标准的符合性(Conformance to standard). 10 3.10 标准的适用性(Applicability of standard) 10 3.10.10 制剂、原料药、辅料的标准的适用性(Applicability of Standards to Drug Products, Dru g Substances, and Excipients). 10 3.10.20 医疗器械、营养补充剂、以及其组成成分的标准的适用性(Applicability of Standards to Medical Devices, Dietary Supplements, and Their Components and Ingredients)11 3.20 一致性的标示(Indicating Conformance). 11 4. 药典各论和通则(Monographs and general chapters)12 4.10 各论(Monographs) 12 4.10.10 检测程序的适用性(Applicability of Test Procedures) 12 4.10.20 接受标准(Acceptance Criteria) 12 4.20 附录(General Chapter). 12 5. 各论组成(Monograph Components). 13 5.10 分子式(Molecular formula). 13 5.20 附加物质、赋形剂、组分(Added Substances, Excipients, and Ingredients) 13 5.20.10官方原料药中附加的物质、赋形剂、组分(Added Substances, Excipients, and Ingredien ts in Official Substances). 13 5.20.20官方制剂中的附加物质、赋形剂、组分(Added Substances, Excipients, and Ingredients in Official Products). 13 5.30 性状和溶解性(Description and Solubility). 14
食品微生物检验的内容及检测技术
食品微生物检验的内容及检测技术 食品安全检验过程的主要内容 食品微生物的检验。食物在生产过程中以及放置过程中会受到环境中微生物的损坏或影响,在部分研究中,将食品中细菌数量对食品的损坏程度作为食品安全检测的首 要内容。在食品微生物的检验过程中,我们主要对人体有害微生物进行检验,其中在食品安全检验过程中,因为食品中有多种微生物共存现象,所以在检验前,微生物检验员要把不同的菌体进行分离,这样才能更加清楚的了解各种微生物的数量及菌体的分布情况,包括生产型食品微生物,如醋酸杆菌,酵母菌等和使食物变质的微生物,如霉菌、细菌等和食源性病原微生物如溶血性大肠杆菌,肉毒杆菌等。对食品原辅料微生物的控制和产成品微生物的检验是保证食品安 全的重要途径。 针对食品致病菌的相关检验。不同的致病菌会对人们的身体健康有不同程度的危害,像我们在生活中经常吃到的大米,有些不法商家将发霉的大米加工后再次放入市场进行二次销售,虽然经加工后,在外表上和普通大米没啥两样,但这种大米中含有黄曲霉这一致病菌,据可靠信息表明,黄曲霉的危害性十分巨大,如果人们长时间吃这样的大米,出
现癌症的风险要比常人高出很多倍,由此可见,食品中致病菌的检验是保证我们能吃到放心食品十分关键的微生物检 测技术,所以我们在致病菌的检验上对不同种类的致病菌进行定量严格检验。如乳制品和肉制品的致病菌主要是黄曲霉菌和大肠杆菌,而蛋制品中则容易出现染沙门菌、大肠菌群、大肠杆菌和金黄色葡萄球菌,罐头食品容易出现肉毒梭菌、产气荚膜梭菌、蜡样芽胞杆菌。 食品微生物检验中的主要特点 对食品检测要求相对较高。在食品微生物的一系列检验中,由于食品中涉及的微生物种类较多,因此加大了食品微生物检验的难度。国家标准或行业标准对不同食品中微生物的含量特别是致病菌的含量有明确的要求。在食品的运输过程中,食品致病菌以及其他微生物对相应的食品有一定的污染,随着微生物种类的增多,检测人员需要对食品受致病菌影响的程度、食品保质期以及其他相关的标准进行测量,难度会随着微生物种类的增多而复杂。所以在微生物检验上我们对每一阶段的食品安全检测都要重视,在各个微生物的测量上,相关的检测技术要求就有所提高。 食品微生物检验效率。随着食品市场的商品流通提高,人们对食品需求不断增加,而食品安全问题却在日益严重,为了保障人们在能够及时满足食品种类和数量要求的同时,进一步促进食品安全的保障措施落实,必须加强食品安
美国微生物测试USP51_和USP61
美国微生物测试USP51 和USP61+62 介绍(2009/12/22 18:31) 美国微生物测试USP51 和USP61+62 介绍 玩具需作微生物测试的材料: 用于玩具中的化妆品、液体、糊状物、油灰(putties)、凝胶和粉末(艺术品材料,如粉笔、蜡笔、墨水等除外) 1. USP<61>微生物限量测试*1 - 测试目的: 检验材料本身受微生物污染的情况(也即微生物洁净度情况) - USP<61>包括以下六个微生物测试: (1) Total aerobic microbial Count 菌落总数(定量) (2) Mould and Yeast Count 霉菌和酵母菌数(定量) (3) Staphylococcus aureus 金黄色葡萄球菌(定性) (4) Pseudomonas aeruginosa 绿脓杆菌(定性) (5) Salmonella 沙门氏菌(定性) (6) Escherichia Coli 大肠杆菌(定性) USP61 Limit Requirement: (1)+(2) < 5000 CFU/g ( if the material was used in baby product or eye area product, the limit should be < 500 CFU/g) (3)/(4)/(5)/(6) should be “ABSENT per 10g “ 2. USP<51>防腐剂抗菌效力测试 - 测试目的 为防止的材料在保存过程中或使用过程中发生微生物*现象,须在材料中加入适量的防腐剂,而防腐剂效果如何则需通过USP《51》测试进行评价。 -USP<51>测试简述: 将标准指定编号的以下菌种接入样品,然后在第7 天,第14 天,第28 天分别检验每种菌的存活数量,存活数量越少,其防腐剂抗菌效果越好。 Staphylococcus aureus 金黄色葡萄球菌 Escherichia coli 大肠杆菌 Pseudomonas aeruginosa 绿脓杆菌 Candida albicans 白色念株菌 Aspergillus niger 黑曲霉 USP51 Limit requirement (for toy): 细菌(Staphylococcus aureus/ Escherichia coli / Pseudomonas aeruginosa) 14 天细菌减少≥2.0 LOG (99%) 28 天不再繁殖 真菌(Candida albicans /Aspergillus niger) 14 天和28 天不再繁殖 Remark: LOG REDUCTION = LOG10 (INITIAL COUNT / NO. OF MICRO-ORGANISM RECOVERED)
食品中有害微生物快速检测方法概述
(一)、概述 食用被微生物污染的食品而导致的疾病,称作食源性疾病。导致这类疾病的微生物叫食源性致病菌。随着人们居住和卫生条件的不断改善,以及抗生素的滥用,人类对病菌的抵抗能力却在不断下降,食源性疾病一直呈上升的趋势。因此,对食品中致病菌的监测和检验也就越显示其重要性,常规的检验大多依靠培养目标微生物的方法来确定食品是否受到此微生物的污染,这些方法需要一定的培养时间,少则2~3天,多至数周,才能确定。而现行有效的一些快速检测方法不仅可以大大缩短检测时间提高微生物检出率并可用于微生物计数、早期诊断、鉴定等方面,以做到快速、简便、准确。快速方法包括了微生物学、分子化学、生物化学、生物物理学、免疫学和血清学等领域。 (二)、常见、常用的快速、简便的检测微生物数量的方法如下: 1、活细胞计数的改进方法 (1)、旋转平皿计数方法 (2)、疏水性栅格滤膜法(HGMF)或等格法(isogrid method) (3)、血膜系统(Pertrifilm) (4)、酶底物技术(ColiComplete) (5)、直接外荧光滤过技术(DEFT) (6)、“即用胶”系统(SimPlate) 2、用于估计微生物数量的新方法 (1)、阻抗法 (2)、A TP生物发光技术 3、其他方法 (1)、微量量热法 (2)、接触酶测定仪 (3)、放射测定法 (三)、食品中沙门氏菌的快速筛检方法 1、沙门氏菌显色培养基法 2、免疫学方法 3、分子生物学方法 4、自动传导法 (四)、大肠杆菌O157:H7快速检测方法 大肠杆菌O157:H7肠出血性大肠杆菌的主要血清型,自1982年在美国被分离并命名以来,陆续发现本菌与轻度腹泻、溶血性尿毒综合症、出血性肠炎、婴儿猝死综合症等多种人类病症密切相关,是食源性疾病的一种重要致病菌。E.coli O157:H7属于肠杆菌科埃希氏菌属,为革兰氏阴性杆菌,有鞭毛。近年来作为食品卫生及流行病学的研究热点,E.coli O157:H7的分离和鉴定方法已取得了较大进展。利用其生化特征、免疫原性建立的方法以及现代分子生物学技术的应用,可以从多方面对E.coli O157:H7进行检测。 1、E.coli O157:H7鉴别培养基及显色培养基 2、免疫学检测方法 3、分子生物学方法 (五)、金黄色葡萄球菌的快速检测方法 金黄色葡萄球菌为革兰氏阳性球菌,呈普通串状排列无芽孢,无鞭毛,不能运动。该菌在自然界中分布广泛,如空气、水、土壤、饲料和一些物品上,是最常见的化脓性球菌之一,食品受其污染的机会很多。金黄色葡萄球菌食物中毒是其肠毒引起的,目前已确认的肠毒素至少有A,B,C1,C2,C3,D,E和F8个型。由金黄色葡萄球菌肠毒素引发的中毒爆发事件,近年来
USP1227-VALIDATION OF MICROBIAL RECOVERY FROM PHARMACOPEIAL ARTICLES美国药典微生物回收率验证
1227VALIDATION OF MICROBIAL RECOVERY FROM PHARMACOPEIAL ARTICLES This chapter provides guidelines for the validation of methods for the estimation of the number of viable microorganisms, for the detection of indicators or objectionable microorganisms, for the validation of microbiological methods used in antimicrobial effectiveness testing, and for the sterility testing of Pharmacopeial articles. It is generally understood that if a product possesses antimicrobial properties because of the presence of a specific preservative or because of its formulation, this antimicrobial property must be neutralized to recover viable microorganisms. This neutralization may be achieved by the use of a specific neutralizer, by dilution, by a combination of washing and dilution, or by any combination of these methods. The tests under Antimicrobial Effectiveness Testing 51, Sterility Tests 71, and Microbial Limit Tests 61require the validation of recovery methods. To ensure that the results of the tests are credible, neutralization of antimicrobial properties of the test solution is required before estimating the number of viable microorganisms. INFLUENTIAL FACTORS Several factors affect the measurement of a test solution's antimicrobial activity, and these must be considered in the validation design. They include the nature of the microorganisms used as challenge organisms, the preparation of the inoculum of challenge organisms, the specific conditions of the test, and the conditions of recovery. These factors also affect the validation of recovery methods for aqueous or nonaqueous products, irrespective of their antimicrobial properties; thus, all test methods should be validated with these factors in mind. The nature of the challenge microorganism exerts a strong effect upon the response to the antimicrobial agent, and so upon the neutralization required for recovery. Represented among these organisms in compendial tests are Gram-positive bacteria, Gram-negative bacteria, yeasts, and molds. Each organism to be used in the test must be included in the validation.
最新美国药典-微生物检测
〈61〉非无菌产品的微生物检测:微生物计数检测法 生长促进试验和计数方法的适用性 概述 在供试品存在的情况下,必须确立检测微生物的试验能力。 如果引入了可能影响试验结果的在测试性能或产品方面的变更,则必须确认其适用性。 供试菌株的制备 使用供试菌株的标准化稳定悬浮液或者按照以下所述制备。使用菌种保存技术(种子批系统)以便用于接种的可萌发微生物从最初的主种子批不超过五代。按照表1中的描述,分别培养每种细菌和真菌供试菌株。 表1.供试微生物的制备和使用
用pH 7.0的氯化钠-蛋白胨缓冲溶液或pH7.2的磷酸盐缓冲液配制供试悬浮液;为使黑曲霉孢子悬浮,可将0.05%的聚山梨醇酯80加入该缓冲液中。这些悬浮液需在2个小时之内使用,或存放在2o~8o 条件下24小时内使用。作为制备并稀释黑曲霉或枯草杆菌营养细胞的新鲜悬浮液的替代方法,可制备稳定的孢子悬浮液,然后将适量的孢子悬浮液用于试验接种。稳定的孢子悬浮液可在2o~8o下保存,保存期经过时间验证。 阴性对照 为了确认试验的条件,用所选的稀释液替代供试品阴性对照。必须没有微生物的生长。 培养基的生长促进 对每一批已制备好的培养基和每一批从脱水培养基或根据描述的组分制备出来的培养基进行测试。
在部分/整个平皿内的大豆酪蛋白消化物肉汤培养基和大豆酪蛋白消化物琼脂培养基中接种少量(不超过100cfu) 表1中指定的微生物,每种微生物均使用单独一部分/整个平皿培养基。在平皿内的沙氏葡萄糖琼脂培养基中接种少量(不超过100cfu)表1中指定的微生物,每种均使用一个单独平皿的培养基。按照表1中描述的条件进行培养。 对于固体培养基,所获得的生长与标准化接种体的计算值之间的差异因素不大于2。对于刚刚制备好的接种体,发生的微生物生长与用此前检验并批准过的培养基批次所得到的微生物生长相当。如果出现了与此前从上一个经过测试并通过的培养基批次获得的微生物生长相当、清晰可见的微生物生长,则液体培养基适用。 供试品计数法的适用性 样品的制备 样品制备方法取决于供试品的物理特征。如果以下描述的规程不能够被令人满意地证实,则必须开发一个适用的替代规程。 水溶性产品—溶解或稀释(通常制备1:10的稀释液)供试品,于pH 7.0的氯化钠-蛋白胨缓冲液,pH7.2的磷酸盐缓冲液或大豆酪蛋白消化物肉汤培养基中。如有必要,调整pH值为6至8。需要时,用相同的稀释剂作进一步稀释。 不溶于水的非脂肪性产品—将供试品(通常制备1:10的稀释液)悬浮于pH 7.0的氯化钠-蛋白胨缓冲液,pH7.2的磷酸盐缓冲液或大豆
《微生物检测技术》教学大纲
《微生物检测技术》教学大纲 一、基本信息 二、教学目标及任务 教学目标:通过36个学时的教学,努力使学生了解微生物检验检测中的基本技术体系,了解微生物检测技术在研究工作中的用途和新技术的发展动态,使学生在微生物检验检测方面能够提高认识,并对技术体系有一定的了解,以适应就业后在动植物检验检疫、食品品质检测等方面的微生物检验检测业务的需要,也能适应学生今后在进一步的研究和开发过程中所需要用到的研究性检测业务。 三、学时分配 四、教学内容及教学要求 绪论我国粮食生产、我国农业的发展趋势及其和微生物的关系。 重点介绍我国粮食生产的趋势和供需关系,使学生理解微生物检验检测的重要性 无难点 了解微生物检验技术的重要性
第一章微生物在自然界的分布、作用和特征 第一节微生物在自然界的分布 第二节微生物在自然界的作用 第三节微生物在自然界的特征 本章重点介绍微生物的多样性、微生物分布的普遍性和检测特定的微生物的难点 无难点 了解技术对微生物检验的重要性 第二章微生物检验技术和社会 第一节微生物检验技术和植物检疫 第二节微生物检验技术和食品安全 第三节微生物检验技术和研究 本章重点介绍微生物检验检测技术在植物检疫、食品安全、资源开发以及研究活动中的作用和意义 无难点 理解微生物检验技术对国民经济和国民生活安全的重要性,了解微生物检验技术作用范围 第三章微生物检测技术概述 第一节可培养微生物的检测 第二节VBNC的检测技术 第三节其它的微生物检测技术 针对本课程以各项技术为中心展开,缺乏系统性的特点,本章首先给各种微生物检测技术进行概述,尽量给学生提供一个整体观和一些关键技术的信息。 难点在于理解VBNC的检测 理解各种常用的微生物检验技术和方法 第四章样品的采集和处理 第一节气体的采样和处理 第二节液体的采样和处理 第三节固体的采样和处理 从实际出发,本课程设置了采样技术,对用于微生物检验检测的样品的采集进行细致的介绍。 难点在于理解各种采样设备和工具(缺乏实物) 使学生注意到采样行为对微生物的检测结果带来的误差,并培养学生在自己今后的工作中尽量减少采样造成的误差的意识。 第五章微生物检测技术 第一节可培养微生物的检测 以国标为蓝本,介绍可培养微生物的检测方法 学生实验中有一定的基础,应无难点 使学生了解微生物检测的国家标准在实际工作中的应用,使学生学会如何利用国标。 第二节VBNC的检测技术 以最新的研究或最经典的研究例子为蓝本,介绍VBNC检测的各种方法 难点在于理解检测的理论原理和实际操作之间的差距 使学生了解VBNC的检测的方法及其特征,在必要的时候能选择使用。 第六章微生物分离和培养技术 第一节微生物的分离 介绍可培养以及难培养的微生物的分离方法,着重介绍菌根菌的分离 难点在于对于微生物的分离效果的理解 希望学生能掌握基本的微生物分离方法 第二节可培养微生物的培养 1 病原物的培养 2 非病原物的培养 介绍可培养微生物的培养方法,着重介绍病原菌培养时的注意事项 难点在于对于如何传达培养病原微生物时的临场感
美国药典 USP36微生物限度检查
USP36 1117 优良微生物检测规范(中英文1/ 2) 2013-08-09 15:30:46| 分类:USP|举报|字号订阅 1117 MICROBIOLOGICAL BEST LABORATORY PRACTICES 优良微生物检测规范INTRODUCTION 介绍 Good laboratory practices in a microbiology laboratory consist of activities that depend on several principles: aseptic technique, control of media, control of test strains, operation and control of equipment, diligent recording and evaluation of data, and training of the laboratory staff. Because of the inherent risk of variability in microbiology data, reliability and reproducibility are dependent on the use of accepted methods and adherence to good laboratory practices. 优良微生物检测规范由一些活动组成,这些活动依赖于几个基本要素:无菌技术、培养基控制、检测用菌株控制、设备操作和控制、完善的记录和数据评估、化验室员工的培训。由于微生物数据具有天生的不确定性,数据的可靠性和重复性取决于是否使用被接受的方法,以及是否严格遵守化验室规范。 MEDIA PREPARATION AND QUALITY CONTROL 培养基制备和质量控制 Media Preparation 培养基制备 Culture media are the basis for most microbiological tests. Safeguarding the quality of the media is therefore critical to the success of the microbiology laboratory. Media preparation, proper storage, and quality control testing can ensure a consistent supply of high-quality media. 培养基是大多数微生物测试的基础。保证培养基的质量因而成为微生物实验室成功的关键。培养基的制备、合适的存贮和质量控制检测可以保证持续高质量培养基供应。 It is important to choose the correct media or components in making media based on the use of accepted sources or references for formulas. The manufacturer's formula and instructions for preparation routinely accompany dehydrated media and
第一篇 微生物检验基本技术
第一章细菌检验基本技术 一、形态学检查 意义:1.为后续的进一步检验提供参考依据 2.迅速了解标本中有无细菌及菌量的大致情况 3.对少数具有典型形态特征的细菌可以做出初步诊断,为临床选用抗菌 药物治疗起重要的提示作用。 分为:染色标本和不染色标本的检查 1、不染色标本的检查:用于观察细菌的动力及运动情况。常用方法有压滴法和悬滴法。 2、染色标本检查:检查的内容:对标本合格与否进行评价;了解标本有无细菌及大致菌量;根据细菌形态、染色性质等对病原菌初步识别分类,决定进一步的生化反应鉴定血清学鉴定、并为临床选择用药提供帮助。 常用染色方法有:革兰染色(常用)、抗酸染色(结核病、麻风病)、荧光染色(结核、麻风、白喉、痢疾)、负染色(墨汁负染色法用于新型隐球菌检查)、特殊染色(鞭毛染色、荚膜染色、异染颗粒(白喉))。 二、培养与分离技术(关键) 目的:鉴定细菌的种类和保存菌种,为进一步确定细菌的致病性、药物敏感性提供依据。 牛肉膏无糖,可作为肠道细菌鉴别培养基的基础成分。 流感嗜血杆菌需要X因子和V因子。 理想的凝固物质具有的特性:本身不被细菌利用;在微生物生长温度范围内保持固体状态,凝固点的温度对微生物无害;不因消毒灭菌而破坏,透明度好,黏着力强。(琼脂最合适) 半固体培养基琼脂含量 0.3%~0.5%;固体培养基1.5%~2.0%。 培养基质量检验:1、无菌试验:将灭菌后的培养基置35℃温箱培养过夜,判定是否灭菌合格。2、效果检验:按不同的培养要求,接种相应菌种(符合要求的标准菌种),观察细菌的生长、菌落形态、色素、溶血及生化反应等特征,判断培养基是否符合要求。 制备好的培养基存放于冷暗处或4℃冰箱,一般不超过七天,如果用塑料袋密封。保存期可延长,但至多两周。 专性需氧:结核分枝杆菌、霍乱弧菌 微需氧菌(5%氧气、10%二氧化碳、85%氮气):空肠弯曲菌,幽门螺杆菌兼性厌氧菌:大多数病原菌 专性厌氧菌:破伤风梭菌、脆弱拟杆菌 二氧化碳培养(5%~10%二氧化碳):淋病奈瑟菌、脑膜炎奈瑟菌、布鲁菌 菌落是单个细菌在培养基上分裂繁殖而成的肉眼可见的细菌集落。 菌苔是由众多菌落连接而成的细菌群落。 三、生物化学鉴定技术 1、碳水化合物代谢试验 2、蛋白质和氨基酸代谢试验 3、碳源利用试验 4、呼吸酶类试验 5、其他
微生物检测手段及注意事项
微生物检测手段及注意事项
微生物检测手段及注意事项 微生物的检测,无论在理论研究还是在生产实践中都具有重要的意义,本文对生长量测定法、微生物计数法、生理指标法和商业化快速微生物检测简要介绍了利用微生物重量,体积,大小,生理代谢物等指标的二十余种常用的检测方法,简要介绍了这些方法的原理,应用范围和优缺点。 一个微生物细胞在合适的外界条件下,不断的吸收营养物质,并按自己的代谢方式进行新陈代谢。如果同化作用的速度超过了异化作用,则其原生质的总量(重量,体积,大小)就不断增加,于是出现了个体的生长现象。如果这是一种平衡生长,即各细胞组分是按恰当的比例增长时,则达到一定程度后就会发生繁殖,从而引起个体数目的增加,这时,原有的个体已经发展成一个群体。随着群体中各个个体的进一步生长,就引起了这一群体的生长,这可从其体积、重量、密度或浓度作指标来衡量。微生物的生长不同于其他生物的生长,微生物的个体生长在科研上有一定困难,通常情况下也没有实际意义。微生物是以量取胜的,因此,微生物的生长通常指群体的扩增。微生物的生长繁殖是其在内外各种环境因素相互作用下的综合反映。因此生长繁殖情况就可作为研究各种生理生化和遗传等问题的重要指标,同时,微生物在生产实践上的各种应用或是对致病,霉腐微生物的防治都和他们的生长抑制紧密相关。所以有必要介绍一下微生物生长情况的检测方法。既然生长意味着原生质含量的增加,所以测定的方法也都直接或间接的以次为根据,而
测定繁殖则都要建立在计数这一基础上。微生物生长的衡量,可以从其重量,体积,密度,浓度,做指标来进行衡量。 1. 微生物计量法 1.1 体积测量法 又称测菌丝浓度法,通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。方法是,取一定量的待测培养液(如10 mL)放在有刻度的离心管中,设定一定的离心时间(如5 min)和转速(如5000 rpm),离心后,倒出上清夜,测出上清夜体积为v,则菌丝浓度为(10-v)/10。菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。 称干重法 可用离心或过滤法测定。一般干重为湿重的10~20%。在离心法中,将一定体积待测培养液倒入离心管中,设定一定的离心时间和转速,进行离心,并用清水离心洗涤1~5次,进行干燥。干燥可用烘箱在105 ℃或100 ℃下烘干,或采用红外线烘干,也可在80 ℃或40 ℃下真空干燥,干燥后称重。如用过滤法,丝状真菌可用滤纸过滤,细菌可用醋酸纤维膜等滤膜过滤,过滤后用少量水洗涤,在40 ℃下进行真空干燥。称干重发法较为烦琐,通常获取的微生物产品为菌体时,常采用这种方法,如活性干酵母(Activity Dry Yeast, ADY),一些以微生物菌体为活性物质的饲料和肥料。
(完整版)微生物检验技术复习题
二、选择题(每题只有一个正确答) 1不属于原核细胞型微生物的是 A 细菌 B 真菌 C 支原体 D 衣原体 E 立克次体 2与细菌运动有关的结构是 A 鞭毛 B 菌毛 C 纤毛 D 荚膜 E 轴丝 3.细菌的L型是指 A 细菌的休眠状态 B 细胞壁缺陷型细菌 C 非致病菌 D 不可逆性变异的细菌 E 光滑型—粗糙型菌落(S—R)变异 4.革兰染色所用试剂的顺序是 A稀释复红—碘液—酒精—结晶紫B结晶紫—酒精—碘液—稀释复红 C结晶紫—碘液—酒精—稀释复红D稀释复红—酒精—结晶紫—碘液 E 稀释复红—结晶紫—碘液—酒精 5.下列检测细菌的生化反应中,用于检测靛基质的试验是 A 甲基红试验 B 尿素酶试验 C 枸橼酸盐利用试验 D VP试验E吲哚试验 6.“菌落”是指 A 不同种细菌在培养基上生长繁殖形成的肉眼可见的细胞集团 B 细菌在培养基上生长繁殖形成的肉眼可见的细胞集团 C 一个细菌在培养基上生长繁殖形成的肉眼可见的细胞集团 D 一个细菌细胞 E 从培养基上脱落的细胞 7.观察细菌动力最常使用的培养基是 A 液体培养基 B 半固体培养基 C 血琼脂平板培养基 D 巧克力琼脂平板培养基 E 厌氧培养基 8.滤菌器不能除去 A 支原体 B 真菌 C 螺旋体 D 细菌 E 以上都不对 9. 鉴别金黄色葡萄球菌与表皮葡萄球菌最主要的区别是 A 色素 B 溶血素 C A蛋白 D 产生凝固酶 E 在厌氧条件下分解甘露醇10.A群链球菌与其它链球菌的主要鉴别试验是 A 淀粉水解试验 B 菊糖发酵试验 C Optochin敏感试验 D 杆菌肽敏感试验 E 新生霉素敏感试验11.肠杆菌科常用的培养基KIA属于 A 基础培养基 B 营养培养基 C 鉴别培养基 D 选择培养基 E 特殊培养基 12.根据生化反应和不同,将志贺菌属分为4个血清群 A O抗原 B K抗原 C H抗原 D O、H抗原 E Vi抗原 13.鉴定肠道杆菌有无致病性的重要依据是 A 是否发酵乳糖 B 是否产生H2S C 是否发酵葡萄糖 D 是否产生靛基质 E 是否有动力 14.肠杆菌中有荚膜无鞭毛,呈粘液状的为
(61)MICROBIAL LIMIT TESTS《微生物限度测定》USP31
?61? MICROBIAL LIMIT TESTS This chapter provides tests for the estimation of the number of viable aerobic microorganisms present and for freedom from designated microbial species in pharmaceutical articles of all kinds, from raw materials to the finished forms. An automated method may be substituted for the tests presented here, provided it has been properly validated as giving equivalent or better results. In preparing for and in applying the tests, observe aseptic precautions in handling the specimens. Unless otherwise directed, where the procedure specifies simply ―incubate,‖ hold the container in air that is thermostatically controlled at a temperature between 30and 35, for a period of 24 to 48 hours. The term ―growth‖ is used in a special sense herein, i.e., to designate the presence and presumed proliferation of viable microorganisms. PREPARATORY TESTING The validity of the results of the tests set forth in this chapter rests largely upon the adequacy of a demonstration that the test specimens to which they are applied do not, of themselves, inhibit the multiplication, under the test conditions, of microorganisms that may be present. Therefore, preparatory to conducting the tests on a regular basis and as circumstances require subsequently, inoculate diluted specimens of the material to be tested with separate viable cultures of Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, and Salmonella. This can be done by adding 1 mL of not less than 10-3 dilution of a 24-hour broth culture of the microorganism to the first dilution (in pH 7.2 Phosphate Buffer, Fluid Soybean–Casein Digest Medium, or Fluid Lactose Medium) of the test material and following the test procedure. Failure of the organism(s) to grow in the relevant medium invalidates that portion of the examination and necessitates a modification of the procedure by (1) an increase in the volume of diluent, the quantity of test material remaining the same, or by (2) the incorporation of a sufficient quantity
