有机物分子中原子共平面、共直线问题

如何分析有机物分子中原子共平面的问题
有机物分子中原子共平面的问题,解决方法是:由简单到复杂。首先要掌握以下几种最简单有机物的空间构型:
(1)乙烯(CH 2CH 2)分子是平面结构,2个碳原子、4个氢原子共平面;(2)乙炔(C C H H )分子是直线型结构,4个原子在同一直线上;(3)苯()分子是平面正六边形结构,6个碳原子、6个氢原子共平面;(4)甲烷(CH 4)是正四面体结
构,任意3个原子共平面;(5)甲醛(H H O
)分子是平面结构,4个原子共平面。在判断有机物分子中原子共平面情况时.要结合以上五种最简单物质的结构进行分析。
例1请分析苯乙炔(
C CH )分子中最多有多少个原子共平面? 分析:与C CH 直接相连的苯环上的碳原子相当于C C H H
分子中1个氢原子所处的位置,应与C CH 在同一条直线上;与苯环相连的
C CH 中碳原子相当于苯分子中氢原予所处的位置,应在苯环所在的平面内。由此可知C CH 所在直线上有两点在苯环的平面内,所以苯己炔分子中所有原子均在同一平面,即苯
乙炔分子中8个碳原子、6个氢原子均在同一平面内。,
例2:有机物C
CH 2CHO H
分子中至少有多少个碳原子处于同一平面上?
分析:由苯分子的空问构型可知,苯环上的6个碳原子、4个氢原子以及与苯环直接相连的两个碳原子一定共平面。由乙烯的分子结构可知,CH 2CH 中的原子在同一平面。由乙醛分子结构可知,CHO 中的原子在同一平面。由碳碳单键可以旋转,可知
C CH 2CHO H
分子中所有的原子可以共面。
例3:结构式为CH 3CH 3的烃,分子中至少有多少个碳原子处在同一平面上?
分析:由苯分子的空间结构可知,苯环上的六个碳原子以及与它直接相邻的两个碳原子共面。另外与苯环相连的另一苯环对位上的碳原子,处于两苯环旋转的轴线(两苯环之间的碳碳键可以旋转)上,也应该共面另外.与苯环相连的另一苯环对位上的碳原子,处于两苯环旋转轴线(两苯环之间的碳碳单键可以旋转)上,也应该共平面。所以,
CH 3
CH 3分子中至少有9个碳原子共平面。
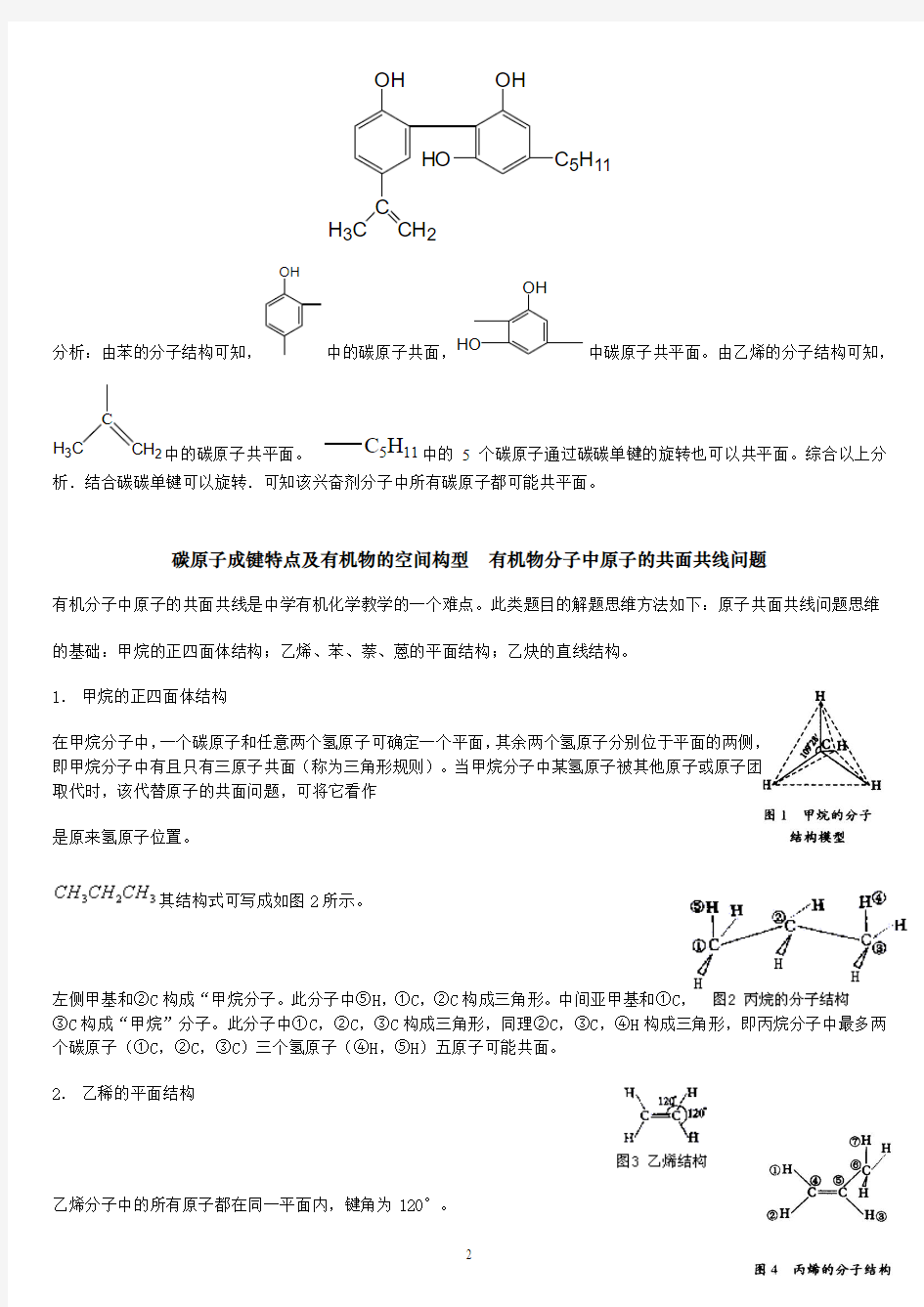
例4:我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下图所示。试求它的分子中共平面的碳原子最多有多少个?
OH
OH
HO C5H11
C
CH2
H3C
分析:由苯的分子结构可知,OH
中的碳原子共面,
OH
HO
中碳原子共平面。由乙烯的分子结构可知,
C
CH2
H3C中的碳原子共平面。C5H11中的5个碳原子通过碳碳单键的旋转也可以共平面。综合以上分析.结合碳碳单键可以旋转.可知该兴奋剂分子中所有碳原子都可能共平面。
碳原子成键特点及有机物的空间构型有机物分子中原子的共面共线问题
有机分子中原子的共面共线是中学有机化学教学的一个难点。此类题目的解题思维方法如下:原子共面共线问题思维的基础:甲烷的正四面体结构;乙烯、苯、萘、蒽的平面结构;乙炔的直线结构。
1.甲烷的正四面体结构
在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,
即甲烷分子中有且只有三原子共面(称为三角形规则)。当甲烷分子中某氢原子被其他原子或原子团
取代时,该代替原子的共面问题,可将它看作
是原来氢原子位置。
其结构式可写成如图2所示。
左侧甲基和②C构成“甲烷分子。此分子中⑤H,①C,②C构成三角形。中间亚甲基和①C,
③C构成“甲烷”分子。此分子中①C,②C,③C构成三角形,同理②C,③C,④H构成三角形,即丙烷分子中最多两个碳原子(①C,②C,③C)三个氢原子(④H,⑤H)五原子可能共面。
2.乙稀的平面结构
乙烯分子中的所有原子都在同一平面内,键角为120°。
当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
其结构式可写成如图4所示。三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。根据三角形规则[⑤C,⑥C,⑦H构成三角形]。⑦H也可能在这个平面上。至少6个原子
(6个碳原子),至多10个原子[6个碳原子和4个氢原子(每个甲基可提供一个氢原子)]共面。
3.苯的平面结构
苯分子所有原子在同一平面内,键角为120°。
当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平
面内。
甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的一个碳原子),5个氢原子(苯环上的5个
氢原子)这12个原子一定共面。此外甲基上1个氢原子(①H,②C,③C构成三角形)也可以转到
这个平面上,其余两个氢原子分布在平面两侧。故甲苯分子中最多有可能是13个原子共面。
同理可分析萘分子中10个碳原子,8个氢原子18原子共面和蒽分子中14个碳原子,10个氢原子,共24个原子共面问题。
4.乙炔的直线结构
乙炔分子中的2个碳原子和2个氢原子一定在一条直线上,键角为180°。
当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其
他原子共线。
①H ②C ③C ④C四原子共线,甲基中的三个氢原子一定不在这条直线上。
此分子中①C ②C ③C ④H四原子一定在一条直线上。故该分子共有8个原子在同一平面上。
再如:其结构简式可写成最少6个碳原子(因双键与双键之间的碳碳单键可以转动),最多10个碳原子共面。
再如:中11个碳原子,萘环上的6个氢原子共17个原子共面。亚甲基上的两个氢原子分别位于平面的两侧(①C ②C ③C构成三角形)。
巩固练习
1、大气污染物氟里昂—12的化学式是CF2Cl2,下面关于氟里昂—12的说法正确的是()
A 没有固定的熔沸点
B 分子中的碳原子是饱和的
C 属于正四面体的空间结构
D 只有一种结构
2、下列分子中,含有极性共价键且呈正四面体结构的是()
A 氨气
B 二氯甲烷
C 四氯甲烷
D 白磷
3、关于乙炔分子结构的描述错误的是()
A、叁键键长小于乙烷中C—C单键长
B、分子中所有原子都在同一平面上
C、叁键键能是乙烷中C—C单键键能的3倍
D、分子中碳氢键之间的键角约为1800
4、1999年在一些国家的某些食品中“二恶英”含量严重超标,一时间掀起了席卷欧洲的“二恶英”恐慌症。“二恶英”是二
苯基-1,4-二氧六环及其衍生物的通称,其中一种毒性最大的结构是,关于这种物质的叙述中不正确的是( )
A.该物质是一种芳香族化合物B.该物质是一种卤代烃
C.该物质是一种强烈致癌物D.该物质分子中所有原子可能处在同一平面上
5、键线式可以简明扼要的表示碳氢化合物,种键线式物质是()
A.丁烯B.丙烷C.丁烷D.丙烯
6、下列各组物质中,属于同分异构体的是()
A.O2和O3 B.CH2=CHCH2CH3和CH3CH=CHCH3
C.CH3CH2CH3和CH3(CH2)2CH3D.CH3CH2OH和CH3OCH3
7、盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错
误的是()
A.盆烯是苯的一种同分异构体
B.盆烯分子中所有的碳原子不可能在同一平面上
C.盆烯是乙烯的一种同系物
D. 盆烯在一定条件下可以发生加成反应
8、甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是
()
A.分子式为C25H20
B.分子中所有原子有可能处于同一平面
C.该化合物分子中所有原子不可能处于同一平面
D.分子中所有原子一定处于同一平面
9、观察以下有机物结构:
CH3 CH2CH3
(1) C = C
H H (2) H--C≡C--CH2CH3
(3) CH=CF2
思考:(1)最多有几个碳原子共面?(2)最多有几个碳原子共线?(3)有几个不饱和碳原子?
10、下图是某药物中间体的结构示意图:
试回答下列问题:
⑴观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示;该药物中间体分子的化学式为。
⑵请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件。
⑶解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上
图所示,试写出该化合物的结构简式:。
11、(1)在烷烃分子中的基团:中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n 1、
n2、n3、n4表示。
分子中,n1=6、n2=1、n3=2、n4=1。
试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
①烷烃分子中氢原子数n0与n1、n2、n3、n4之间的关系是n0=__ _____。
②四种碳原子数之间的关系为n1=_______ ___。
③若分子中n2=n3=n4=1,则该分子的结构简式可能为(任写一种)____ ____。
12、食盐测定某有机物元素质量组成为C:69,H:4.6,N:8.0,其余是O,相对分子质量在300-400之间,试确定该有机物的:(1)实验式;(2)相对分子质量;(3)分子式。
参考答案:
1、BD
2、C
3、C
4、B
5、A
6、BD
7、C
8、BD
9、(1)5 4 10 (2)2 3 5 (3)2 2 10
10、(1)—CH2CH3C9H12O3(2)水解酸或碱作催化剂
(3)
11、(1)3n1+2n2+n3(2)n3+2n4+2 (3)(CH3)3CCH(CH3)CH2CH3
12、350 C20H16N2O4
有机物
共线、共面类问题分析
有机化学中,判断某有机物中碳原子共线或共面问题,是一类常考的问题,处理这样的问题除了必须具备一定的化学知识外,还应注意化学与数学的结合,运用所学立体几何知识,凭借简单分子作母体模型解决相关问题.以母体模型为基准,注意基团之间的连接方式,即价键的联结方式从而做出准确判断。我们需要掌握烃类中甲烷、乙烯、乙炔、苯四种分子的空间构型,以其为母体模型并将其从结构上衍变至复杂有机物中,便能准确判断原子是否共线共面。以下分析这四种分子空间构型,及其衍变过程。
一、甲烷的空间构型----正四面体型
结构式、分子构型如图一:
其键角109度28分,很显然甲烷中一个碳原子和四个氢原子不能共面,在甲烷分子中,1个碳原子和任意2个氢原子可确定一个平面,其余的2个氢原子位于该平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则)。
以甲烷母体模型衍变为-------一氯甲烷、乙烷
当甲烷分子中某氢原子被其他原子或原子团取代时,该代替原子的共面问题,可将它看作是原来氢原子位置。若将其中一个氢原子换成一个氯原子,由于C-H键键长短于C-Cl键长则以氯原子为顶点的正三棱锥如图二(1),同样这五个原子不能共面。同理将甲烷中的一个氢原子换为甲基,则变为乙烷如图二(2)所示:
C-C单键可以自由转动以,同样这些原子不能共面。可见凡是碳原子以单键形式存在其所连四个碳原子不能共面。
二、乙烯的空间构型----平面型
结构式、分子构型如图三:
平面型结构,键角为120度,C=C 所连的四个氢原子与这两个碳原子同在一个平面上。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。需要注意的是:C=C不能转动,而C-H键可以转动。
以乙烯母体模型衍变为-------丙烯、2-丁烯
若将其中的氢原子换成氯原子,其与所有碳氢原子共面。若将一个氢原子换成甲基,即为丙烯则如图四(1):将两个氢原子换成甲基则为2-丁烯如图四(2)
显然,实线框内所有原子共面,由于C-C单键转动,实线框外的氢原子有一个可能转到纸面与框内所有原子共面, 可见凡与C=C直接相连的原子连同自身两个碳原子共面。
三、乙炔的空间构型----直线型
结构式、空间构型如图五:.
乙炔分子中的2个碳原子和2个氢原子一定在一条直线上,键角为180°。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。四个原子共直线,C≡C不能转动,而C-H键可以转动。
以乙炔母体模型衍变为-------乙烯基乙炔
.乙炔的直线形结构,若将其中的一个氢换为乙烯基,在若将其中的另外一个氢换为甲基,如图六
实线框内所有原子共面,由于C-C单键转动,虚、实线框外的氢原子有一个可能转到纸面与框内所有原子共面.与C≡C直接相连的两个碳原子和C≡C中的两个碳原子共直线。
四、苯的空间构型----平面六边型
结构简式如图七:
键角:120度
苯分子所有的原子共平面。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯环所在平面内。
以苯母体模型衍变为-------甲基苯
同样甲基取代苯环上的氢原子,即得甲苯,其构型如图八:
显然甲基上的碳原子与苯环中的原子共平面。
总而言之,有机物中出现C-R单键,则同一个碳原子上的四单键夹角接近为109度28分,而直接相连的原子不能共平面。C=C则要求保持其键角为120度,与C=C双键直接相连的四个原子,与C=C双键自身的这两个原子都共平面。C≡C其键角为180度,与C≡C直接相连的两个碳原子和C≡C中的两个碳原子共直线。
分子中原子共面问题
分子内原子共线、共面的判定,仅为一维、二维想象,但存在线面、面面的交叉,所以有一定的难度。
一、几个特殊分子的空间构型
1.常见分子的空间构型:
①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。②乙烯分子中所有原子共平面。③乙炔分子中所有原子共直线。④苯分子中所有原子共平面。⑤H—CHO分子中所有原子共平面。
(1)熟记四类空间构型
中学有机化学空间结构问题的基石是甲烷、乙烯、乙炔和苯的分子结构。
甲烷型:正四面体结构,4个C—H健不在同一平面上凡是碳原子与4个原子形成4个共价键时,空间结构都是正四面体结构以及烷烃的空间构型 5个原子中最多有3个原子共平面。
乙烯型:平面结构。六个原子均在同一平面上凡是位于乙烯结构上的六个原子共平面。
乙炔型:直线型结构。四个原子在同一条直线上凡是位于乙炔结构上的四个原子共直线。
苯型:平面正六边形结构。六个碳原子和六个氢原子共平面凡是位于苯环上的12个原子共平面。
(2)理解三键三角
三键:C—C键可以旋转,而C=C键、C≡C键不能旋转。
三角:甲烷中的C—H键之间的夹角为109°28′,乙烯和苯环中的C—H键之间的夹角为120°,乙炔中的C—H键之间的夹角为180°。
2.单键的转动思想
有机物分子中的单键,包括碳碳单键、碳氢单键、碳氧单键等可转动。
二、结构不同的基团连接后原子共面分析
1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH2=CH-C≡CH,其空间结构为,中间两个碳原子既在乙烯平面上,又在乙炔直线上,所以直线
在平面上,所有原子共平面。
2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。
如苯乙烯分子中共平面原子至少12个,最多16个。
3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于
这个平面上。如丙烯分子中,共面原子至少6个,最多7个。
4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳原子对位上的9号碳原子,记住一句歌词“对面的女孩看过来”。
烃分子中原子共线共面的确定
只要掌握好CH4、C2H4、C2H2和C6H6四种典型的有机物结构,以它们为基础,借助“C—C”可以旋转而“C=C”、“C C”不能旋转的特点,联系立体几何知识,各种与此有关的题目均可迎刃而解。
1.甲烷的正四面体结构
【规律总结】:甲烷型:正四面体结构;凡是碳原子与4个相同原子或基团相连时均形成正四面体结构,但若原子或基团不同时为四面体结构。
在甲烷分子中,1个碳原子和任意2个氢原子可确定一个平面,其余2个氢原子分别位于这个平面的两侧,即甲烷分子中有且只有3个原子共面(称为三角形规则)。当甲烷分子中某个氢原子被其他原子取代时,可将该代替原子看作是原来氢原子的位置,从而解决该原子的共面问题。
如CH3CH3的结构式可写成如下图所示:
左侧甲基和②C 构成“甲烷”分子,此分子中④H 、①C 、②C 构成三角形,同理①C 、②C 、③H 也构成了三角形,即乙烷分子中最多有2个碳原子(①C 、②C )和2个氢原子(③H 、④H )4个原子共面。
2. 乙烯的平面结构
【规律总结】乙烯型:原子共面结构;凡是位于乙烯结构上的6个原子(可以不同)共平面。
乙烯分子中所有原子都在同一平面内,键角约为120°。
乙烯分子结构
当乙烯分子中某个氢原子被其他原子取代时,代替该氢原子的原子一定在乙烯分子所在的平面内。如2323)CH (C C )CH (=的结构式可写成如下图所示:
乙烯结构的4个H 原子被甲基所代替,则该分子中6个C 原子(①C 、4个②C 、③C 、④C 、⑤C 、
⑥C )一定在同一个平面内。
3. 苯的平面结构
【规律总结】平面结构;凡是位于苯环上的原子均共面。
苯分子中所有原子都在同一平面内,键角为120°。当苯分子中的1个氢原子被其他原子取代时,代替该氢原子的原子一定在苯分子所在的平面内。
如甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的1个碳原子)和5个氢原子(苯环上的5个氢原子)这12个原子一定共面。此外,甲基上的1个氢原子(①H )和②C 、③C 构成的三角形也可以转到这个平面上,其余2个氢原子分布在平面两侧。故甲苯分子中最多可能有13个原子共面。
4. 乙炔的直线结构【规律总结】直线型分子;凡是位于乙炔结构上的4原子共直线。
乙炔分子中的2个碳原子和2个氢原子都在一条直线上,键角为180°。
当乙炔分子中的1个氢原子被其他原子取代时,代替该氢原子的原子一定和乙炔分子中的其他原子共线。如33CH C C CH -≡-。结合乙烷分子中原子共面问题的推导方法可得该分子中4个C 原子一定共线,最多可能有4个C 原子、2个H 原子共6个原子共面。
(完整版)有机物分子中原子共线、共面问题(带答案)
有机物分子中原子共线、共面问题 一.熟记五类分子空间构型 以上述几种分子的空间构型为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。 【例】 二、旋转 单键可旋转(含C-C,C-H,C-O ) 双键、三建不可 三、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子与一个平面结构共用,则直线在这个平面上。 代表物 空间构型 结构 球棍模型 结 构 特 点 C 2H 4 平面结构 6点共面 C=C 键不能旋转 C 2H 2 直线型 4点共线(面) C≡C 键不能旋转 C 6H 6 平面正六边形 12点共面 HCHO 平面 4点共面 CH 4 正四面体 任意3点(原子)共面C —C 键可以旋转
如CH 2=CH-C≡CH ,其空间结构为 ,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。 如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。 如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接: 如图所示的大分子中共平面原子至少12个, 最多19个。分析时要注意两点:①观察大 分子的结构,先找出甲烷、乙烯、乙炔和 苯分子的“影子”,再将甲烷“正四面体”、乙 烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。 强化练习: 1.描述CH 3-CH =CH -C≡C -CF 3分子结构的叙述中,正确的是( BC ) A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是( D ) A . B . C . D . 3.在 分子中,处于同一平面上的原子数最多 可能是( D ) A .12个 B .14个 C .18个 D .20个 4.在 分子中,处于同一平面上碳原子数最少是( A ) A .10个 B .8个 C .14个 D .12个 HC C —CH 3 —CH 3 CH 3 —CH — C H 3 CH 3 CH 2 C CH 3 —CH 3
有机物分子式计算(成品)
有机物分子式的确定 一、有机物组成元素的判断——燃烧法 有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,Cl→HCl。某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素 欲判定该有机物中是否含氧元素 二、实验式(最简式)和分子式的区别与联系 (1)最简式:表示化合物分子所含各元素的原子数目最简单整数比的式子。 不能确切表明分子中的个各原子的个数。 注意: ①最简式是一种表示物质组成的化学用语; ②无机物的最简式一般就是化学式; ③有机物的元素组成简单,种类繁多,具有同一最简式的物质往往不止一种; ④最简式相同的物质,所含各元素的质量分数是相同的,若相对分子质量不 同,其分子式就不同。例如,苯(C6H6)和乙炔(C2H2)的最简式相同,均为CH,故它们所含C、H元素的质量分数是相同的。 (2)分子式:表示化合物分子所含元素的原子种类及数目的式子。 注意: ①分子式是表示物质组成的化学用语; ②无机物的分子式一般就是化学式; ③由于有机物中存在同分异构现象,故分子式相同的有机物,其代表的物质 可能有多种; ④分子式=(最简式)n。,。 三、有机物相对分子质量的计算方法 1、标准状况下,M=22.4ρ(单位:克/升) 2、相对密度法:M=2D (D是氢气密度的倍数) M=29D (D是空气密度的倍数) 四、确定分子式的方法——关键是计算M (1)、实验式法: 由各元素的质量分数→求出实验式→相对分子质量→求分子式。 例1:某有机物含碳40%,氢6.67%,氧53.3%,如果0.2mol该有机物质量为6g,求它的分子式。 (2)、物质的量关系法——比值法 求:1摩尔有机物中各元素的物质的量之比,就是分子式下标的比。 例2:某混合气体由两种气态烃组成。取2.24升该混合气体完全燃烧后得到4.48升二氧化碳(在标况下)和3.6克水,则这两种气体可能是 A、CH4、C3H8 B、CH4、C3H4 C、C2H4、C3H4 D、C2H2、C2H6 E、C2H4、C2H6 例3:由两种气态烃组成的混合气体30ml,与过量氧气完全燃烧后,生成CO2 60ml,水蒸气45ml(相同条件下测得)。求原混合气的成分及体积比。 (3)、化学方程式法——利用化学方程式求分子式。(已知物质的类别) (4)、燃烧通式法——利用通式和相对分子质量求分子式。
原子共平面问题的解题技巧
有机物中原子共平面的问题 模型 (1)乙烯(CH 2CH 2)分子是平面结构,2个碳原子、4个氢原子共平面; (2)乙炔(C C H H )分子是直线型结构,4个原子在同一直线上; (3)苯( )分子是平面正六边形结构,6个碳原子、6个氢原子共平 面; (4)甲烷(C H4)是正四面体结构,任意3个原子共平面; (5)甲醛(C H H O )分子是平面结构,4个原子共平面。 典例 例1请分析苯乙炔( C CH )分子中最多有多少个原子共平面 例1 分析:与 C CH 直接相连的苯环上的碳原子相当于C C H H 分子中1个氢原子所处的位置,应与 C CH 在同一条直线上;与苯环相连的C CH 中碳原子相当于苯分子中氢 原予所处的位置,应在苯环所在的平面内.由此可知 C CH 所在直线上有两点在苯环的平面内,所以苯己炔分子中所有原子均在同一平面,即苯乙炔分子中8个碳原子、6个氢原子均在同一平面内。 例2:有机物C CH 2 CHO H 分子中至少有多少个碳原子处于同一平
面上? 例3:结构式为 CH 3 CH 3的烃,分子中至少有多少个碳原子处在 同一平面上? 例4:我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下图所示。试求它的分子中共平面的碳原子最多有多少个? OH OH HO C 5H 11C CH 2H 3C 答案 例2 分析:由苯分子的空问构型可知,苯环上的6个碳原子、4个氢原 子以及与苯环直接相连的两个碳原子一定共平面。由乙烯的分子结构可知,CH 2CH 中的原子在同一平面。由乙醛分子结构可知,CHO 中的原子在同一平面.由碳碳单键可以旋转,可知 C CH 2CHO H 分子中所有的原子可以共面。即分子中9个碳原子在 同一平面内。 例3 分析:由苯分子的空间结构可知,苯环上的六个碳原子以及与
高中化学选修5 第一章 专题与练习 有机物分子式的确定
专题与练习有机物分子式的确定 1.有机物组成元素的判断 一般来说,有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,Cl→HCl。某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。 2.实验式(最简式)和分子式的区别与联系 (1)最简式是表示化合物分子所含各元素的原子数目最简单整数比的式子。不能确切表明分子中的原子个数。 注意: ①最简式是一种表示物质组成的化学用语; ②无机物的最简式一般就是化学式; ③有机物的元素组成简单,种类繁多,具有同一最简式的物质往往不止一种; ④最简式相同的物质,所含各元素的质量分数是相同的,若相对分子质量不同,其分子式就不同。例如,苯(C6H6)和乙炔(C2H2)的最简式相同,均为CH,故它们所含C、H元素的质量分数是相同的。 (2)分子式是表示化合物分子所含元素的原子种类及数目的式子。 注意: ①分子式是表示物质组成的化学用语; ②无机物的分子式一般就是化学式; ③由于有机物中存在同分异构现象,故分子式相同的有机物,其代表的物质可能有多种; ④分子式=(最简式)n。即分子式是在实验式基础上扩大n倍,
。 3.确定分子式的方法 (1)实验式法由各元素的质量分数→求各元素的原子个数之比(实验式)→相对分子质量→求分子式。 (2)物质的量关系法由密度或其他条件→求摩尔质量→求1mol分子中所含各元素原子的物质的量→求分子式。(标况下M=dg/cm3×103·22.4L/mol) (3)化学方程式法利用化学方程式求分子式。 (4)燃烧通式法利用通式和相对分子质量求分子式。 由于x、y、z相对独立,借助通式进行计算,解出x、y、z,最后求出分子式。 [例1] 3.26g样品燃烧后,得到4.74gCO2和1.92gH2O,实验测得其相对分子质量为60,求该样品的实验式和分子式。 (1)求各元素的质量分数 (2)求样品分子中各元素原子的数目(N)之比
专题:有机物共线共面解析
分子中原子共线、共面问题 一.熟记五类分子空间构型 掌握上述几种分子的空间构型,以其为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。
二、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH 2=CH-C≡CH ,其空间结构为 ,中间两个碳原子既在乙烯平面上, 又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳原子对位上的9 1. 描述CH 3-CH =CH -C≡C -CF 3分子结构的下列叙述中,正确的是 A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.(2010年西城期末)下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是 A . B . D . 3.在分子中,处于同一平面上的原子数最多可能是 A .12个 B .14个 C .18个 D .20个 4.在分子中,处于同一平面上碳原子数最少是 A .10个 B .8个 C .14个 D .12个 HC C —CH 3 —CH 3 CH 3 —CH — CH 3 CH 3 C CH 3 —CH 3
有机化学原子共面共线判断
有机分子中原子的共面、共线 有机分子结构中由于碳原子形成不同价键,造成空间构型存在差异,成为高考命题的采分点之一,也是同学们的“难以捉摸”的点,掌握有机物分子的空间构型的基准点和判断技巧会使问题迎刃而解。 一.有机分子中原子的共面、共线基准点 1.甲烷的正四面体结构 如图1所示,在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三个原子共面(称为三角形规则)。 当甲烷分子中某个氢原于被其他原子取代时,讨论取代该氢原子的其他原子的共面问题时,可将与甲基碳原子直接相连的原子看做代替了原来的氢原子。 CH3CH2CH3的结构如图2所示,左侧甲基和②C构成“甲烷”分子,此分子中⑤H、①C、②C构成三角形。中间亚甲基和①C、③C构成“甲烷”分子,此分子中①C、②C、③C构成三角形。同理②C、③C、④H 构成三角形,即丙烷分子中最多有三个碳原子(①C、②C、③C)和两个氢原子(④H、⑤H)可能共面。 2.乙烯的平面结构 乙烯分子中的所有原子都在同一平面内,键角为120°(如图3所示)。当乙烯分子中某个氢原子被其他原子取代时,则代替该氢原子的原子一定在乙烯的平面内。 如图4所示是CH3CH=CH2的分子结构。由图可知,三个氢原子(①②③)和三个碳原子(④⑤⑥)一定共面。根据三角形规则(⑤C、⑥C、⑦H构成三角形),⑦H也可能在这个平面上。同理(CH3)2C=C(CH3)2中至少有6个原子(6个碳原子)共平面,至多有10个原子共平面:6个碳原子和4个氢原子(每个甲基可提供一个氢原子)共平面。
提示:羰基碳原子也是平面形碳原子,如甲醛即为平面型结构: 3.苯的平面结构 苯分子的所有原子在同一平面内,键角为120°,结构式为 ,当苯分子中的一个氢原子被其他原子取代时,代替该氢原子的原子一定在苯环所在平面内。如甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的1个碳原子)和苯环上的5个氢原子一定共面,此外甲基上的1个氢原子也可以转到这个平面上,其余两个氢原子分布在平面两侧。故甲苯分子中最多有13个原子共面。同理可分析萘 中10个碳原子、8个氢原子均共面,蒽分子 中14个碳原子、10个氢原子共面。 4.乙炔的直线结构 乙炔分子中的2个碳原子和2个氢原子一定在一条直线上。键角为180°,结构式为: H—C≡C— H。当乙炔分子中的一个氢原子被其他原子取代时,代替该氢原子的原子一定和乙炔分子中的其他原子共线。如
人教版高中化学考点精讲 有机物分子式和结构式的确定(附解答)
高中化学考点精讲有机物分子式和结构式的确定 复习重点 1.了解确定有机物实验式、分子式的方法,掌握有关有机物分子式确定的计算; 2.有机物分子式、结构式的确定方法 难点聚焦 一、利用有机物燃烧反应的方程式进行计算 有关化学方程式 由上可知,相同碳原子数的烯烃(环烷烃)与一元饱和醇完全燃烧时,耗氧量相同(把
:相同碳原子数的炔烃(二烯烃)与醛(酮)及饱和二元醇完全燃烧时,耗氧量相同(醛:饱和二元醇: );相同碳原子数的羧酸(酯)与三元醇完全燃烧,耗氧量相同(羧酸:→饱和三元醇:) 二、通过实验确定乙醇的结构式 由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质。在这种情况下,知道了某一物质的分子 式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式。例如:根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构: 为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验。实验装置如右下图所示。在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇。乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒。通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积。 讨论2 下面是上述实验的一组数据:
根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢? 由于0.100 mol C2H6O与适量Na完全反应可以生成1.12 L H2,则1.00 mol C2H6O与Na反应能生成11.2 L H2,即0.5 mol H2,也就是1 mol H。这就是说在1个C2H6O 分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H 中,有1个与其他5个是不同的。这一事实与(1)式不符,而与(2)式相符合。因此,可以推断乙醇的结构式应为(2)式。 问题与思考 1.确定有机物分子式一般有哪几种方法? 2.运用“最简式法”确定有机物分子式,需哪些数据? 3.如何运用“商余法”确定烃的分子式? 问题与思考(提示) 1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等 2、①有机物各元素的质量分数(或质量比) ②标准状况下的有机物蒸气的密度(或相对密度) 3、 则为烯烃,环烷烃. ②若余数=2,则为烷烃. ③若余数=-2,则为炔烃.二烯烃 ④若余数=-6,则为苯的同系物. 若分子式不合理,可减去一个C原子,加上12个H原子 有机物分子式的确定典型例题 例题精讲 一、有机物分子式的确定 【例1】实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
(完整版)有机物共线共面问题专题突破
有机化学查漏补缺专题 专题一:原子共线共面问题 一.基本空间构型 1、甲烷——正四面体型 在甲烷分子中,1个碳原子和任意2个氢原子可确定一个平面,其余的2个氢原子位于该平面的两侧。 2、乙烯——平面型 平面型结构,键角为120度,C=C 所连的四个氢原子与这两个碳原子同在一个平面上。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。需要注意的是:C=C不能转动,而C-H键可以转动。 3、乙炔——直线型 乙炔分子中的2个碳原子和2个氢原子一定在一条直线上,键角为180°。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。四个原子共直线,C≡C不能转动,而C-H键可以转动。 4、苯——平面六边型键角:120度 苯分子所有的原子共平面。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯环所在平面内。 以上4种分子中的H被其他原子(如C、O、N、Cl等)所取代,取代后分子构型基本不变。 二、旋转问题 形成共价单键的原子可以绕轴旋转,双键、叁键的原子不能绕轴旋转。 三、判断规律 1.任意两个直接相连的原子在同一直线上
2.任何满足炔烃结构的分子,若只含一个碳碳三键,与其三键相连的所有原子均在同一直线上。 3.中学学的有机物中,全部原子能够共面的有乙烯、乙炔、苯、苯乙烯、1,3-丁二烯、苯乙炔等。 四、分割法(例题1) 1.一点定面:分子中有一个碳形成4个单键,则该分子中所有原子不可能共面。 2.分割组合:若有机物中碳原子的共线、共面问题,要进行单元分割,必要时兼顾分子对称性。分割后结合键的旋转性确定共线或共面的原子个数,注意题目要求。 五.注意关键字 审题时注意“碳原子”“所有原子”“可能”“一定”“最少”“最多”“共线”“共面”。 【例题】 1、下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是()。 A.6个碳原子有可能都在一条直线上 B.6个碳原子不可能都在一条直线上 C.6个碳原子一定都在同一平面上 D.6个碳原子不可能都在同一平面上 【答案】B、C 【解析】根据(1)乙烯分子中的6个原子共平面。键角120°;(2)乙炔分子中的4个原子共直线,键角180°,可推知题给有机物的碳链骨架结构如下: 由上面的碳链骨架结构很容易看出:题给有机物分子中的6个碳原子不可能都在一条直线上,而是一定都在同一平面上。 2、某烃的结构简式为 分子中处于四面体结构中心的碳原子数为a,一定在同一平面内的碳原子数为b,一定在同一直线上的碳原子数为c,则a、b、c依次为()。 A.4、5、3 B.4、6、3 C.2、4、5 D.4、4、6 【答案】B 【解析】四面体结构为饱和烃的特点,如—CH2—CH3,共4个,共线以碳碳三键为基础,有3个,共面一双键为基础,又因为其中包含一个三键,故共有6个碳。 巩固练习: 1.某烃的结构简式如右图所示,若分子中共线碳原子数为a,可能共面的碳原子最多为b,含四面体结构碳原子数为c,则a、b、c分别是()
有机物分子式的确定-规律总结
有机物分子式的确定 一.有机物组成元素的判断 某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。 欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。 二、有机物分子式的确定 1、根据最简式和分子量确定分子式 例1:某有机物中含碳40%、氢6.7%、氧53.3%,且其分子量为90,求其分子式。 例2:某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g/L,写出该烃的分子式。 注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式。例如最简式为CH3的在机物,其分子式可表示为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。同理,最简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为分子式。例如最简式为CH4、CH3Cl、C2H6O、C4H10O3等有机物,其最简式即为分子式。 2、根据各元素原子个数确定分子式 例1:吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧,其分子量不超过300。试确定其分子式。 例2:实验测得某烃A中含碳85.7%,含氢14.3%。在标准状况下11.2L此化合物气体的质量为14g。求此烃的分子式。 3、根据通式确定分子式 烷烃CnH2n+2 烯烃或环烷烃CnH2n 炔烃或二烯烃CnH2n-2 苯及同系物CnH2n-6 用CnH2n-x(-2≤x≤6)和相对分子量可快速确定烃或分子式
如何分析有机物分子中原子共平面的问题
如何分析有机物分子中原子共平面的问题 有机物分子中原子共平面的问题,解决方法是:由简单到复杂。首先要掌握以下几种最简单有机物的空间构型:(1)乙烯(CH2=CH2)分子是平面结构,2个碳原子、4个氢原子共 平面;(2)乙炔(H—C≡C—H)分子是直线型结构,4个原子在同一直线上;(3)苯()分子是平面正六边形结构,6个碳原子、6个氢原子共平面; (4)甲烷(CH4)是正四面体结构,任意3个原子共平面;(5)甲醛分子是平面结构, 4个原子共平面。在判断有机物分子中原子共平面情况时,要结合以上五种最简单物质的结构进行分析。 例1.请分析苯乙炔)分子中最多有多少个原子共平面? 分析:与—C≡CH—直接相连的苯环上的碳原子相当于H—C≡C—H分子中1个氢原子所处的位置,应与—CCH在同一条直线上;与苯环相连的—C≡CH中碳原子相当于苯分子中氢原子所处的位置,应在苯环所在的平面内。由此可知—C≡CH所在直线上有两点在苯环的平面内,所以苯乙炔分子中所有原子均在同一平面,即苯乙炔分子中8个碳原子、6个氢原子均在同一平面内。 例2.有机物的分子中一定能共平面的原子最多有多少?可能共平面的原子最多有多少? 分析:由苯分子的空间构型可知,苯环上的6个碳原子、4个氢原子以及与苯环直接相连的两个碳原子一定共平面。由乙烯的分子结构可知,CH=CH2—中的原子在同一平面。由乙醛的分子结构可知,—CHO中的原子在同一平面。由碳碳单键可以旋转,可知 分子中所有原子都可能共平面。 例3.结构简式为的烃, 分子中至少有多少个碳原子处于同一平面上? 分析:由苯分子的空间构型可知,苯环上的6个碳原子以及与它直接相连的两个碳原子共平面。另外,与苯环相连的另一苯环对位上的碳原子,处于两苯环旋转轴线(两苯环之间 的碳碳单键可以旋转)上,也应该共平面。所以,分子中至少有9个碳
专题:有机物共线共面解析
分子中原子共线、共面问题一.熟记五类分子空间构型 代表 物 空间构 型 结构球棍模型结构特点CH4 正四面 体 任意3点(原子)共面 C—C键可以旋转 C2H4 平面结 构 6点共面 C=C键不能旋转C2H2直线型 4点共线(面) C≡C键不能旋转C6H6 平面正 六边形 12点共面 HCH O 平面4点共面 掌握上述几种分子的空间构型,以其为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。
二、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH 2=CH-C≡CH,其空间结构为 ,中间两个碳原子既在乙烯平面上, 又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳 原子对位上的9 1. 描述CH 3-CH =CH -C≡C-CF 3分子结构的下列叙述中,正确的是 A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.(2010年西城期末)下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是 A . B . C . D . 3.在 分子中,处于同一平面上的原子数最多可能是 A .12个 B .14个 C .18个 D .20个 HC C —CH 3 —CH 3 CH 3 —CH — CH 3 CH 3 CH 2 C CH 3 —CH 3
有机物分子式确定方法
一、直接求算法 直接计算出1mol气体中各元素原子的物质的量,推出分子式。步骤为:密度(或相对密度)→摩尔质量→1mol气体中各元素的原子个数→分子式。 例1、0.1L某气态烃完全燃烧,在相同条件下测得生成0.1LCO2和0.2L水蒸气且标准状况下其密度为0.717g / L,该烃的分子式是:( ) A. CH4 B. C2H4 C. C2H2 D. C3H6 解析:由M=0.717g /L*22.4 L/mol=16 g/mol,可求N(C)= 0.1 L/0.1 L=1, N(H)= 0.2 L*2/0.1 L=4,即1mol该烃中含1mol C, 1mol H,则其分子式为CH4, 二、最简式法 通过有机物中各元素的质量分数或物质的量,确定有机物的最简式(即各原子最简整数比),再由烃的相对分子质量来确定分子式。 烃的最简式的求法为:N(C):N(H)=(碳的质量分数/12):(氢的质量分数/1)=a:b(最简整数比)。 例1、某气态烃含碳85.7%,氢14.3%。标准状况下,它的密度是1.875 g /L,则此
烃的化学式是_______。 解析:由M=1.875g /L*22.4 L/mol=42g/mol, N(C):N(H)=( 85.7%/12):(14.3%/1)=1:2, 最简式为CH2,该烃的化学式可设为(CH2)n,最简式式量为14,相对分子质量为42,n=3,此烃为C3H6。 练习:某烃完全燃烧后生成8.8gCO2和4.5g水。已知该烃的蒸气对氢气的相对密度为29,则该烃的分子式为_______。答案:C4H10 注意:某些特殊组成的最简式,可直接确定其分子式。如最简式为CH4的烃中,氢原子数为四,已经饱和,其最简式就是分子式。 三、通式法 若已知烃的种类可直接设,烷烃设为CnH2n+2, 烯烃设为CnH2n,炔烃设为CnH2n-2,苯及苯的同系物设为CnH2n-6;若为不确定分子则设为CxHy. 例1、若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则( ) A. x=2,y=2 B. x=2,y=4 C. x=3,y=6 D. x=3, y=8 解析:由烃的燃烧方程式CxHy+(x+y/4)O2→xCO2+y/2H2O,依题意x+y/4=3,
原子共面问题
【化学】【化学】突破有机物分子中原子共线、共面问题有机分子结构中由于碳原子形成不同价键,造成空间构型存在差异,成为高 考命题的采分点之一,也是同学们的“难以捉摸”的点,掌握有机物分子的空间 构型的基准点和判断技巧会使问题迎刃而解。 一.有机分子中原子的共面、共线基准点 1.甲烷的正四面体结构 如图1所示,在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三个原子共面(称为三角形规则)。 当甲烷分子中某个氢原于被其他原子取代时,讨论取代该氢原子的其他原子的共面问题时,可将与甲基碳原子直接相连的原子看做代替了原来的氢原子。 CH 3CH 2 CH 3 的结构如图2所示,左侧甲基和②C构成“甲烷”分子,此分子中 ⑤H、①C、②C构成三角形。中间亚甲基和①C、③C构成“甲烷”分子,此分子中①C、②C、③C构成三角形。同理②C、③C、④H构成三角形,即丙烷分子中最多有三个碳原子(①C、②C、③C)和两个氢原子(④H、⑤H)可能共面。 2.乙烯的平面结构
乙烯分子中的所有原子都在同一平面内,键角为120°(如图3所示)。当乙烯分子中某个氢原子被其他原子取代时,则代替该氢原子的原子一定在乙烯的平面内。 如图4所示是CH 3CH=CH 2 的分子结构。 由图可知,三个氢原子(①②③)和三个碳原子(④⑤⑥)一定共面。根据三角形规 则(⑤C、⑥C、⑦H构成三角形),⑦H也可能在这个平面上。同理(CH 3) 2 C=C(CH 3 ) 2 中至少有6个原子(6个碳原子)共平面,至多有10个原子共平面:6个碳原子和4个氢原子(每个甲基可提供一个氢原子)共平面。提示:羰基碳原子也是平面形碳原子,如甲醛即为平面型结构: 3.苯的平面结构 苯分子的所有原子在同一平面内,键角为120°,结构式为 ,当苯分子中的一个氢原子被其他原子取代时,代替该氢原子的原子一定在苯环所在平面内。如甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的1个碳原子)和苯环上的5个氢原子一定共面,此外甲基上的1个氢原子也可以转到这个平面上,其余两个氢原子分布在平面两侧。故甲苯分子中最多有13个原子共面。同理可分析萘中10个碳原子、8个氢原子均共面,蒽分子中14个碳原子、lO个氢原子共面。
根据有机物的化学式计算不饱和度
根据有机物的化学式计算不饱和度 (1)若有机物的化学式为CxHy则Ω=(2x+2-y)/2 (2)若有机物为含氧化合物,因为氧为二价,C=O与C=C“等效”,所以在进行不饱和度的计算时可不考虑氧原子,如CH2=CH2、C2H4O、C2H4O2的Ω为1。氧原子“视而不见” 推导:设化学式为CxHyOz-------------CxHy-z(OH)z ,由于H、OH都是一价在与碳原子连接,故分子式等效为CxHy。 (3)若有机物为含氮化合物,设化学式为CxHyNz-------------CxHy-2z(NH2)z,由于—H、—NH2都是一价在与碳原子连接,故分子式等效为CxHy-z (4)按照该法可以推得其它有机物分子的不饱和度 (5)有机物分子中的卤素原子取代基,可视作氢原子计算Ω。如:C2H3Cl的不饱和度为1,其他基团如-NO2、-NH2、-SO3H等都视为氢原子。 (6)碳的同素异形体,可将它视作Ω=0的烃。 如C60 (7)烷烃和烷基的不饱和度Ω=0 2.非立体平面有机物分子,可以根据结构计算,Ω=双键数+叁键数×2+环数 如苯:Ω=3+0×2+1=4 即苯可看成三个双键和一个环的结构形式。 注意环数等于将环状分子剪成开链分子时,剪开碳碳键的次数。 3.立体封闭有机物分子(多面体或笼状结构)不饱和度的计算,其成环的不饱和度比面数少数1。 如立方烷面数为6,Ω=6-1=5 61 |评论 U=1+n4 +1/2*(n3-n1), n4表示4价原子数,一般是C原子,n3表示3价原子数,一般是N 原子,n1表示一价原子数,一般是H原子,2价的O不需考虑。
不饱和度,又称缺氢指数,是有机物分子不饱和程度的量化标志,通常用希腊字母Ω表示。此概念在推断有机化合物结构时很有用。从有机物结构计算不饱和度的方法:单键对不饱和度不产生影响,因此烷烃的不饱和度是0(所有原子均已饱和)。一个双键(烯烃亚胺、羰基化合物等)贡献一个不饱和度。一个叁键(炔烃、腈等)贡献两个不饱和度。一个环(如环烷烃)贡献一个不饱和度。环烯烃贡献2个不饱和度。 从有机物分子结构计算不饱和度的方法 根据有机物分子结构计算,Ω=双键数+叁键数×2+环数如苯: Ω=3+0×2+1=4 即苯可看成三个双键和一个环的结构形式。补充理解说明:单键对不饱和度不产生影响,因此烷烃的不饱和度是0(所有原子均已饱和)。一个双键(烯烃、亚胺、羰基化合物等)贡献1个不饱和度。一个叁键(炔烃、腈等)贡献2个不饱和度。一个环(如环烷烃)贡献1个不饱和度。环烯烃贡献2个不饱和度。一个苯环贡献4个不饱和度。一个碳氧双键贡献1个不饱和度。一个-NO2贡献1个不饱和度。例子:丙烯的不饱和度为1,乙炔的不饱和度为2,环己酮的不饱和度也为2。 从分子式计算不饱和度的方法 第一种方法为通用公式:Ω=1+1/2∑Ni(Vi-2) 其中,Vi 代表某元素的化合价,Ni 代表该种元素原子的数目,∑ 代表总和。这种方法适用于复杂的化合物。第二种方法为只含碳、氢、氧、氮以及单价卤素的计算公式:Ω=C+1-(H-N)/2 其中,C 代表碳原子的数目,H 代表氢和卤素原子的总数,N 代表氮原子的数目,氧和其他二价原子对不饱和度计算没有贡献,故不需要考虑氧原子数。这种方法只适用于含碳、氢、单价卤素、氮和氧的化合物。第三种方法简化为只含有碳C和氢H或者氧的化合物的计算公式:Ω =(2C+2-H)/2 其中C 和H 分别是碳原子和氢原子的数目。这种方法适用于只含碳和氢或者氧的化合物。补充理解说明:(1)若有机物为含氧化合物,因为氧为二价,C=O与C=C“等效”,所以在进行不饱和度计算时可不考虑氧原子。如CH2=CH2(乙烯)、CH3CHO(乙醛)、CH3COOH(乙酸)的不饱和度Ω为1。(2)有机物分子中的卤素原子取代基,可视作氢原子计算不饱和度Ω。如:C2H3Cl的Ω为1,其他基团如-NH2、-SO3H等都视为氢原子。(3)碳的同素异形体,可将其视作氢原子数为0的烃。如C60(足
有机化学中原子共面的知识点
分子中原子共面问题 分子内原子共线、共面的判定,仅为一维、二维想象,但存在线面、面面的交叉,所以有一定的难度。 一、几个特殊分子的空间构型 1.常见分子的空间构型: ①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。②乙烯分子中所有原子共平面。③乙炔分子中所有原子共直线。④苯分子中所有原子共平面。⑤H—CHO分子中所有原子共平面。 (1)熟记四类空间构型 中学有机化学空间结构问题的基石是甲烷、乙烯、乙炔和苯的分子结构。 甲烷型:正四面体结构,4个C—H健不在同一平面上凡是碳原子与4个原子形成4个共价键时,空间结构都是正四面体结构以及烷烃的空间构型5个原子中最多有3个原子共平面。 乙烯型:平面结构。六个原子均在同一平面上凡是位于乙烯结构上的六个原子共平面。 乙炔型:直线型结构。四个原子在同一条直线上凡是位于乙炔结构上的四个原子共直线。 苯型:平面正六边形结构。六个碳原子和六个氢原子共平面凡是位于苯环上的12个原子共平面。 (2)理解三键三角 三键:C—C键可以旋转,而C=C键、C≡C键不能旋转。
三角:甲烷中的C—H键之间的夹角为109°28′,乙烯和苯环中的C—H键之间的夹角为120°,乙炔中的C—H键之间的夹角为180°。 2.单键的转动思想 有机物分子中的单键,包括碳碳单键、碳氢单键、碳氧单键等可转动。 二、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH2=CH-C≡CH,其空间结构为 ,中间两个碳原子既在乙烯平面上,又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转 性,两个平面不一定重合,但可能重合。如苯乙烯分子中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋 转性,甲基的一个氢原子可能暂时处于这个平面上。如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳原子对位上的9号碳原子,记住一句歌词“对面的女孩看过来”。
(完整word版)有机物分子式的确定练习题
有机物分子式的确定练习题 一、选择题 1.在常温常压下,将16mL H2、CH4、C2H2的混合气体与足量的O2混合,点燃后使之完全燃烧,冷却至原状态,测得总体积比原体积减小26mL,则混合气体中CH4的体积是A.2mL B.4mL C.8mL D.无法计算 2.在一定条件下,将A、B、C三种炔烃所组成的混合气体4g在催化剂条件下与足量的H2发生加成反应,反应生成4.4g三种对应的烷烃,则所得烷烃中一定含有 A.戊烷B.乙烷C.丙烷D.丁烷 3.含碳原子数相同的某烯烃和炔烃组成的混合气体与燃烧后生成的CO2和水蒸气的体积(同温同压下测定)比为3∶6∶4,则原混合气体的成分是 A.C3H6,C3H4B.C2H4,C2H2C.C4H8,C4H6D.C5H10,C5H8 4.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等。则X的分子式是 A.C10H14B.C11H16C.C12 H18D.C13H20 5.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成l 5.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为 A.20%B.40%C.60%D.80% 6.“长征二号”火箭所用的主要燃料叫做“偏二甲肼”。已知该化合物的相对分子质量为60,其中含碳的质量分数为40%,氢的质量分数为13.33%,其余是氮元素,则“偏二甲肼”的化学式为() A.CH4N B.C2H8N2C.C3 H10N D.CN3H6 7、某单烯烃3.5g跟溴水反应,得到无色油状液体质量为11.5g,则该烃的化学式为() A、C2H4 B、C3H6 C、C4H8 D、C5H10 8、一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍。该混合物气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g。该混合气体可能是() A 乙烷和乙烯 B 乙烷和丙烯 C 甲烷和乙烯 D 甲烷和丙烯 二、填空计算题 9.1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在相同条件下测定)。0.1 mol 烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增重39g。则该烃的化学式为。10.某烃A 0.2mol在氧气中完全燃烧后,生成化合物B、C各1.2mol。试回答: ⑴42g A完全燃烧时,应消耗的氧气在标准状况下的体积为; ⑵若A能使溴水褪色,且在催化剂存在下与H2加成的产物分子中含有4个甲基,则A可能的结构简式为(任写一种) ; ⑶某有机物的分子式为C x H y O2,若x的值与A分子中的碳原子个数相同,则该分子中y 的最大值为。 11、某烃A 0.2 mol在O2中充分燃烧,生成化合物B、C各1.2 mol。试回答: (1)烃A的分子式:,B、C的分子式分别是、。(2)若一定量的烃A燃烧后生成B、C各3 mol,则有g 烃A参加了反应,燃烧时消耗了标况下O2 L。 12. 某炔烃A催化加氢后转化为最简式为“CH2”的另一种烃B,5.6g B恰好能吸收12.8g溴转化为溴代烷烃,则A烃可能是__ ____、___ ___、____ __。
化学有机物经典计算题
化学有机物经典计算题
————————————————————————————————作者:————————————————————————————————日期:
? 超大大中小 ? 有机物的知识很散,我现在在复习,平时就应该把这方面的知识归纳总结! 有关有机物燃烧的题型分类解析 一、一定物质的量有机物燃烧耗氧量的计算 有机物燃烧的试题时,其根本依据是有机物燃烧的通式: ①烃:C x H y +(x+y/4)O 2 →xCO 2 +y/2H 2 O?②烃的衍生物:C x H y O z +(x+y /4-z/2)O 2→xCO 2 +y/2H 2 O 若题中明确给出了烃或烃的衍生物的类别,上面的燃烧通式还可进一步简 化,?如烷烃的燃烧:C n H 2n+2 +(3n+1)/2 O 2 →nCO 2 +(n+1)H 2 O 【题型1】①1mol烃C x H y 完全燃烧时的耗氧量为(x+y/4)mol,即每摩碳 原子消耗1molO 2,每4摩氢原子消耗1molO 2 。?②计算1mol烃的含氧衍生 物完全燃烧的耗氧量时,可先将其中的氧原子折算为水,再将剩余C、H原子按烃 的计算方法计算,如C 2H 5 OH可看作C 2 H 4 ·H 2 O,因此其耗氧量与等物质的量的 C 2H 4 耗氧量相同。根据情况,也可将氧原子折算为CO 2 ,如HCOOH可看作 H 2·CO 2 ,故耗氧量与等物质的量的H 2 相同(折算成的H 2 O和CO 2 不消耗氧)?据 此,上面的燃烧通式也能迅速推写出来,而不必死记硬背。 例⒈充分燃烧等物质的量的下列有机物,相同条件下需要相同体积氧气的是()(A)乙烯、乙醛(B)乙酸乙酯、丙烷 (C)乙炔、苯 (D)环丙烷、丙醇 【变式练习】有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )?A、8n B、14nC、18n D、44n 【题型2】在总物质的量一定的情况下,以任意比例混合的有机物完全燃烧后有关量的讨论,解答这种题目的关键是:总物质的量一定的混合物,不论以何比 例混合,只要分子中具有相同的碳(或氢)原子,完全燃烧后产生的CO 2(或H 2 O) 的量也一定。若耗氧量一定,则要求各组分在物质的量相同时,耗氧量也相同,这应是常识性知识。
原子共平面问题的解题技巧
原子共平面问题的解 题技巧 Revised on November 25, 2020
有机物中原子共平面的问题 模型 (1)乙烯(CH 2CH 2)分子是平面结构,2个碳原子、4个氢原子共平面; (2)乙炔(C C H H )分子是直线型结构,4个原子在同一直线上; (3)苯( )分子是平面正六边形结构,6个碳原子、6个氢原子共平 面; (4)甲烷(CH 4)是正四面体结构,任意3个原子共平面; (5)甲醛(C H H O )分子是平面结构,4个原子共平面。 典例 例1请分析苯乙炔( C CH )分子中最多有多少个原子共平面 例1 分析:与 C CH 直接相连的苯环上的碳原子相当于C C H H 分子中1个氢原子所处的位置,应与 C CH 在同一条直线上;与苯环相连的C CH 中碳原子相当于苯分子中氢原予所处的位置,应在苯环所在的平面内。由此可知C CH 所在直线上有两点在苯环的平面内,所以苯己炔分子中所有原子均在同一平面,即苯乙炔分子中8个碳原子、6个氢原子均在同一平面内。 例2:有机物 C CH 2 CHO H 分子中至少有多少个碳原子处于同一平 面上
例3:结构式为 CH3 CH3的烃,分子中至少有多少个碳原子 处在同一平面上 例4:我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下图所示。试求它的分子中共平面的碳原子最多有多少个 答案 例2分析:由苯分子的空问构型可知,苯环上的6个碳原子、4个氢原子以及与苯环直接相连的两个碳原子一定共平面。由乙烯的分子结构可知,CH2CH中的原子在同一平面。由乙醛分子结构可知,CHO中的原子在同一平面。由碳碳单键可以旋 转,可知C CH2 CHO H 分子中所有的原子可以共面。即分子中9 个碳原子在同一平面内。 例3分析:由苯分子的空间结构可知,苯环上的六个碳原子以及与它直接相邻的两个碳原子共面。另外与苯环相连的另一苯环对位上的碳原子,处于两苯环旋转的轴线(两苯环之间的碳碳键可以旋转)上,也应该共面。另外,与苯环相连的另一苯环对位上的碳原子,处于两苯环旋转轴线(两苯环之间的碳碳单键可以旋转)上,也应该共平面。所以,分子中至少有9个碳原子共平面。
