爆炸极限受温度影响

爆炸极限受温度影响 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
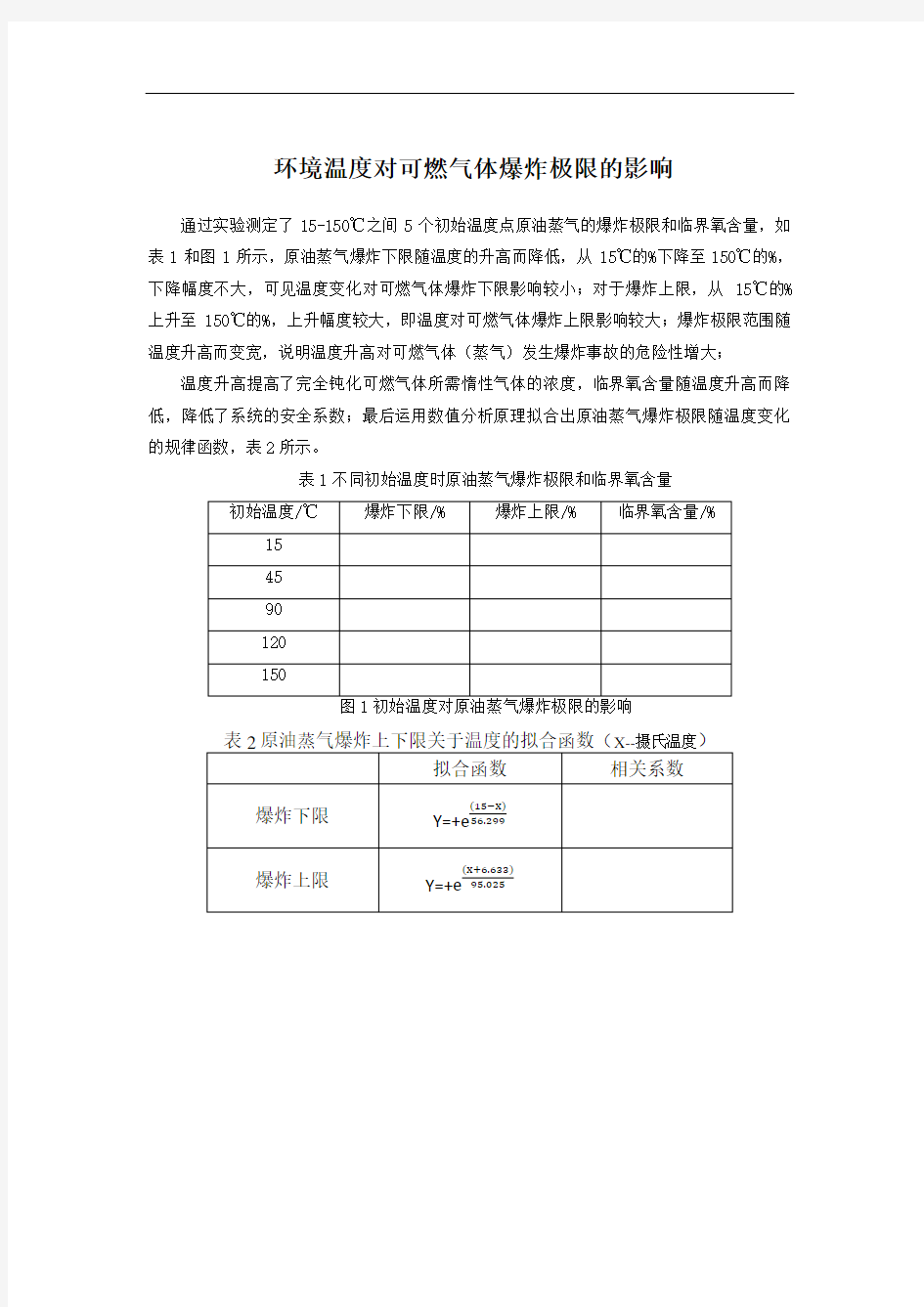
环境温度对可燃气体爆炸极限的影响
通过实验测定了15-150℃之间5个初始温度点原油蒸气的爆炸极限和临界氧含量,如表1和图1所示,原油蒸气爆炸下限随温度的升高而降低,从15℃的%下降至150℃的%,下降幅度不大,可见温度变化对可燃气体爆炸下限影响较小;对于爆炸上限,从15℃的%上升至150℃的%,上升幅度较大,即温度对可燃气体爆炸上限影响较大;爆炸极限范围随温度升高而变宽,说明温度升高对可燃气体(蒸气)发生爆炸事故的危险性增大;
温度升高提高了完全钝化可燃气体所需惰性气体的浓度,临界氧含量随温度升高而降低,降低了系统的安全系数;最后运用数值分析原理拟合出原油蒸气爆炸极限随温度变化的规律函数,表2所示。
表1不同初始温度时原油蒸气爆炸极限和临界氧含量
常见物质的爆炸极限精编版
常见物质的爆炸极限 浓度单位为空气的体积百分比。 Class IA 液体(闪点低于73°F (22.8°C);沸点低于100°F (37.8°C) 是为NFPA 704 燃烧速度4 Classes IB (闪点低于73°F (22.8°C); 沸点大于等于100°F (37.8°C)) 与IC液体(闪点大于等于73°F (22.8°C) , 但小于100°F (37.8°C)) 是为NFPA 704 燃烧速度3 Classes II (闪点大于等于100°F (37.8°C), 但小于140°F)与IIIA 液体(闪点大于等于140°F (60°C), 但小于200°F (93.3°C)) 是为NFPA 704 燃烧速度2 Class IIIB液体(闪点大于等于200°F (93.3°C) 是为NFPA 704 燃烧速度1[1-2] 物质爆炸下限(L FL/LEL) % 体积百分比 爆炸上限(U FL/UEL) % 体积百分比 NFPA分级闪点 最小点燃能量mJ 空气体积百分比 自燃 温度 乙醛 4.0 57.0 IA -39°C 0.37 175°C 乙酸(冰醋酸) 4 19.9 II 39°C to 43°C 463°C 醋酸酐II 54°C 丙酮 2.6 - 3 12.8 - 13 IB -17°C 1.15 @ 4.5% 465°C, 485°C[1] 乙腈IB 2°C 524°C 一氯乙烷7.3 19 IB 5°C 390°C 1
乙烯 2.5 82 IA -18°C 0.017 @ 8.5% (在纯氧中为0.0002 @ 40%)305°C 丙烯醛 2.8 31 IB -26°C 0.13 丙烯腈 3.0 17.0 IB 0°C 0.16 @ 9.0% 3-氯丙烯 2.9 11.1 IB -32 °C 0.77 氨气15.7 27.4 IIIB 11°C 680 651°C 砷 4.5 - 5.1[2] 78 IA 可燃气体 苯 1.2 7.8 IB -11°C 0.2 @ 4.7% 560°C 1,3-二烯丁烷 2.0 12 IA -85°C 0.13 @ 5.2% 丁烷,正丁烷 1.6 8.4 IA -60°C 0.25 @ 4.7% 420 - 500°C 乙酸正丁酯 1 - 1.7[1] 8 - 15 IB 24°C 370°C 丁醇, 1 11 IC 29°C 正丁醇 1.4[1] 11.2 IC 35°C 340°C 正丁基氯,1-氯丁烷 1.8 10.1 IB -6°C 1.24 正丁基硫醇 1.4[3] 10.2 IB 2°C 225°C 甲基丁基酮,2-己酮1[4] 8 IC 25°C 423°C 丁烯,1-丁烯 1.98[2] 9.65 IA -80°C 二氧化硫 1.0 50.0 IB -30°C 0.009 @ 7.8% 90°C 一氧化碳12[2] 75 IA -191°C 可燃气体609°C 一氧化氯IA 可燃气体 2
爆炸极限的影响因素
爆炸极限的影响因素 Revised final draft November 26, 2020
爆炸极限的影响因素 【大纲考试内容要求】: 1.了解爆炸极限的影响因素; 2.了解爆炸反应浓度的计算; 【教材内容】: 爆炸极限值不是一个物理常数,它是随实验条件的变化而变化,在判断某工艺条件下的爆炸危险性时,需根据危险物品所处的条件来考虑其爆炸极限,如在火药、起爆药、炸药烘干工房内可燃蒸气的爆炸极限与其他工房在正常温度下的极限是不一样的,在受压容器和在正常压力下的爆炸极限亦有所不同;其他因素如点火源的能量,容器的形状、大小,火焰的传播方向,惰性气体与杂质的含量等均对爆炸极限有影响。 1.温度的影响 混合爆炸气体的初始温度越高,爆炸极限范围越宽,则爆炸下限降低,上限增高,爆炸危险性增加。这是因为在温度增高的情况下,活化分子增加,分子和原子的动能也增加,使活化分子具有更大的冲击能量,爆炸反应容易进行,使原来含有过量空气(低于爆炸下限)或可燃物(高于爆炸上限)而不能使火焰蔓延的混合物浓度变成可以使火焰蔓延的浓度,从而扩大了爆炸极限范围。例如丙酮的爆炸极限受温度影响的情况见表2—1。 2.压力的影响 混合气体的初始压力对爆炸极限的影响较复杂,在~ MPa的压力下,对爆炸下限影响不大,对爆炸上限影响较大;当大于 MPa时,爆炸下限变小,爆炸上限变大,爆炸范围扩大。这是因为在高压下混合气体的分子浓度增大,反应速度加快,放热量增加,且在高气压下,热传导性差,热损失小,有利于可燃气体的燃烧或爆炸。甲烷混合气初始压力对爆炸极限的影响见表2 —2。 值得重视的是当混合物的初始压力减小时,爆炸极限范围缩小,当压力降到某一数值时,则会
影响气体混合物爆炸极限的因素
影响气体混合物爆炸极限 的因素 This manuscript was revised by the office on December 10, 2020.
影响气体混合物爆炸极限的因素 :可燃物质(、蒸气和)与空气(或)必须在一定的浓度范围内均匀混合,形成预混气,遇着火源才会发生爆炸,这个浓度范围称为,或。例如与空气混合的爆炸极限为12.5%~74%。可燃性混合物能够发生爆炸的最低浓度和最高浓度,分别称为和爆炸上限,这两者有时亦称为着火下限和着火上限。在低于爆炸下限时不爆炸也不着火;在高于爆炸上限同样不燃不爆。这是由于前者的可燃物浓度不够,过量空气的冷却作用,阻止了火焰的蔓延;而后者则是空气不足,导致火焰不能蔓延的缘故。当可燃物的浓度大致相当于反应当量浓度时,具有最大的爆炸威力(即根据完全燃烧反应方程式计算的浓度比例)。 影响气体混合物爆炸极限的因素:温度、氧含量、惰性介质、压力、容器或管道直径、着火源(点火能量) 1)温度。混合物的原始温度越高,则爆炸下限越低,上限提高,爆炸极限范围扩大,爆炸危险性增加。这是因为混合物温度升高,其分子内能增加,引起燃烧速度的加快,而且,由于分子内能的增加和燃烧速度的加快,使原来含有的过量空气(低于爆炸下限)或可燃物高于爆炸上限,而不能使火焰蔓延的混合物浓度变成为可以使火焰蔓延的浓度,从而改变了爆炸极限范围。 (2)氧含量。混合物中含氧量增加,爆炸极限范围扩大,尤其爆炸上限提高得更多。例如氢与空气混合的爆炸极限为4%~75%,而氢与纯氧混合的爆炸极限为4%~95%。 (3)惰性介质。如若在爆炸混合物中掺入不燃烧的惰性气体(如氮、二氧化碳、水蒸气、氩、氦等),随着惰性气体的百分数增加,爆炸极限范围则缩小,惰性气体的浓度提高到某一数值,亦可以使混合物变成不可爆炸。一般情况下,惰性气体对混合物爆炸上限的影响较之对下限的影响更为显着,因为惰性气体浓度加大,表示氧的浓度相对减小,而在上限中氧的浓度本来已经很小,故惰性气体稍为增加一点,即产生很大影响,而使爆炸上限剧烈下降。 (4)压力。混合物的原始压力对爆炸极限有很大影响,压力增大,爆炸极限范围也扩大,尤其是爆炸上限显着提高。值得重视的是当混合物的原始压力减小时,爆炸极限范围缩小,压力降至某一数值时,下限与上限合成一点,压力再降低,混合物即变成不可爆。爆炸极限范围缩小为零的压力称为爆炸的临界压力。临界压力的存在表明,在密闭的设备内进行减压操作,可以免除爆炸的危险。 (5)容器或管道直径。容器或管道直径越小,火焰在其中越难蔓延,混合物的爆炸极限范围则越小。当容器直径小到某一数值时,火焰不能蔓延,可消除爆炸危险,这个直径称为临界直径。如甲烷的临界直径为0.4~0.5mm,氢和乙炔为0.1~0.2mm等。 容器直径大小对爆炸极限的影响,可以用链式反应理论解释。燃烧是自由基产生的一系列链锁反应的结果,管径减小时,游离基与管壁的碰撞几率相应增大,当管径减小到一定程度时,即因碰撞造成游离基的销毁的反应速度大于游离基产生的反应速度,燃烧反应便不能继续进行。 (6)着火源。能源的性质对爆炸极限范围的影响是:能源强度越高,加热面积越大,作用时间越长,爆炸极限范围越宽。以甲烷为例,100V·A的电火花不引起曝炸, 2V·A的电火花可引起爆炸,爆炸极限为5.9%~13.6%,3V·A的电火花则爆炸极限扩大为5.85%~14.8%。 各种爆炸性混合物都有一个最低引爆能量,即点火能量,它是指能引起爆炸性混合物发生爆炸的最小火源所具有的能量,它也是混合物爆炸危险性的一项重要的性能参数。爆炸性混合物的点火能量越小,其燃爆危险性就越大。 火花的能量、热表面的面积、火源和混合物的接触时间等,对爆炸极限均有影响。此外,光对爆炸极限也有影响,如前所述,氢和氯混合,在避光黑暗处反应十分缓慢,但在强光照射下则发生剧烈反应(链锁反应)并导致爆炸。
各类粉体的爆炸极限及燃点汇总
各种粉体的爆炸极限浓度及燃点 爆炸的概念:爆炸是指物质的状态和存在形式发生突变,在瞬间释放出大量的能量,形成空气冲击波,可使周围物质受到强烈的冲击,同时伴随有声或光效应的现象。 爆炸极限的概念:爆炸极限是可燃气体、蒸气或粉尘与空气混合后,遇火会产生爆炸的最高或最低浓度。——国家标准《消防术语》 最低浓度——爆炸下限(LEL) 最高浓度——爆炸上限(UEL) 1.粉尘本身是可燃粉尘,非燃性粉尘是不会发生爆炸的,燃粉尘除前述外,还有茶叶、中药材维、硫磺粉尘等。 2.粉尘必须悬浮在空中,并与空气混合达到一定浓度粉尘能否悬浮在空中要害在于粉尘微粒,只有直径小于l0um的粉尘其扩散作用才大干重力作爪,易形成爆炸“层云”。粉尘爆炸下限一般为20~ 60g/m3,爆炸上限为2~6kg/m3。 3.火源必须具有一定能量粉尘爆炸需首先加热或熔融蒸发或热解出可燃气体,因此需较多的热量。粉尘爆炸的最小引爆能达10毫焦以上,为气体爆炸的近百倍。此外,空气中的湿度不能太大,否则也不会发生粉尘爆炸。 表1 各种粉体的爆炸极限浓度及燃点
表2 粉尘爆炸极限表补充:
凡是颗粒极微小,粒径在1至76um范围内的固体物质称为粉尘。粉尘包括易燃粉尘如:糖粉、淀粉、可可粉、硫粉、茶粉、橡胶粉等;可燃粉尘如:米粉、锯末屑、皮革屑、丝、虫胶等;难燃粉尘如:炭黑粉、木炭粉、石墨粉等。固体物质被粉碎成粉尘以后,其燃烧特性有很大的变化。原来是不燃的物质可能变成可燃物质,原来难燃的物质可能变成易燃物质。在一定条件下就有可能发生爆炸,前提是必须达到在空气中的爆炸极限浓度。粉尘爆炸前无任何征兆,起后果却都能使建筑物毁于一旦。而且能导致粉尘爆炸的情况也很多:从农副产品的加工、储存和运输到药物、食品、有机物、无机物的生产等很多过程中,粉尘爆炸的事故时有发生,其危害极大。 粉尘包括的范围很广,各种粉尘都有其自身的特性,粉尘并非随时随地都能爆炸,要发生粉尘爆炸必须具备以下几个条件: 首先,构成粉尘的物质必须是易燃或可燃的,其中包括有机粉尘和无机粉尘。有机粉尘受热后要发生分解,放出可燃性气体,并留下可以燃烧的炭。无机粉尘如金属粉尘,虽然没有耗能分解过程,升温只能促使其快速氧化,由表面向内部迅速延烧放出高热而使体系快速升温膨胀。有些金属颗粒本身能进行气、固两相燃烧。 其次是粉尘必须是悬浮在空气中,并与空气混合达到爆炸浓度极限。粉尘能否悬浮在空气中要害在于粉尘的粒径。粒径大的颗粒难以悬浮,即使由外力使它悬浮在空气中,也会很快沉积下来。粒径越小,其扩散作用大于重力作用,粉尘易于悬浮在空气中。再加上粒子四周有足够的助燃空气,很轻易达到爆炸极限浓度而燃烧或爆炸。若空气中粉尘的浓度太小,即低于爆炸浓度的下限,燃烧放热量太少,难于形成持续燃烧,也就不会发生爆炸。假如空气中粉尘的浓度太大,即高于爆炸浓度的上限,混合物中因氧气浓度太小,也不会发生燃烧或爆炸。 粉尘爆炸的另一个必要条件,就是要有足以引起粉尘爆炸的热能源。粉尘爆炸的最小点燃能量一般为10 mJ至数百mJ ,相当于气体点燃能量的百倍左右。
常见气体的爆炸极限完整版
常见气体的爆炸极限 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
常见气体的爆炸极限 气体名称化学分子式/在空气中的爆炸极限 (体积分数) / % 下限(V/V) 上限(V/V) 乙烷 C2H6 乙醇 C2H5OH 19 乙烯 C2H4 32 氢气 H2 75 硫化氢 H2S 45 甲烷 CH4 15 甲醇 CH3OH 44 丙烷 C3H8
甲苯 C6H5CH3 7 二甲苯 C6H5(CH3)2 乙炔 C2H2 100 氨气 NH3 15 苯 C6H6 8 丁烷 C4H10 一氧化碳 CO 74 丙烯 C3H6 丙酮 CH3COCH3 13 苯乙烯 C6H5CHCH2
炸,这个浓度范围称为爆炸极限(或爆炸浓度极限)。形成爆炸性混合物的最低浓度称为爆炸浓度下限,最高浓度称为爆炸浓度上限,爆炸浓度的上限、下限之间称为爆炸浓度范围。可燃性混合物有一个发生燃烧和爆炸的浓度范围,即有一个最低浓度和最高浓度,混合物中的可燃物只有在其之间才会有燃爆危险。可燃物质的爆炸极限受诸多因素的影响。如可燃气体的爆炸极限受温度、压力、氧含量、能量等影响,可燃粉尘的爆炸极限受分散度、湿度、温度和惰性粉尘等影响。可燃气体和蒸气爆炸极限是以其在混合物中所占体积的百分比(%)来表示的,表5—3中一氧化碳与空气的混合物的爆炸极限为12.5%~80%。可燃粉尘的爆炸极限是以其在混合物中所占的比重(g/m3)来表示的,例如,木粉的爆炸下限为409/m3,煤粉的爆炸下限为359/m3可燃粉尘的爆炸上限,因为浓度太高,大多数场合都难以达到,一般很少涉及。例如,糖粉的爆炸上限为135009/m3,煤粉的爆炸上限为135009/m3,一般场合不会出现。可燃性混合物处于爆炸下限和爆炸上限时,爆炸所产生的压力不大,温度不高,爆炸威力也小。当可燃物的浓度大致相当于反应当量浓度(表中的30%)时,具有最大的爆炸威力。反应当量浓度可根据燃烧反应式计算出来。可燃性混合物的爆炸极限范围越宽,其爆炸危险性越大,这是因为爆炸极限越宽则出现爆炸条件的机会越多。爆炸下限越低,少量可燃物(如可燃气体稍有泄漏)就会形成爆炸条件;爆炸上限越高,则有少量空气渗入容器,就能与容器内的可燃物混合形成爆炸条件。生产过程中,应根据各可燃物所具有爆炸极限的不同特点,采取严防跑、冒、滴、漏和严格限制外部空气渗入容器与管道内等安全措施。应当指出,可燃性混合物的浓度高于爆炸上限时,虽然不会着火和爆炸,但当它从容器里或管道里逸出,重新接触空气时却能燃烧,因此,仍有发生着火的危险。(二)爆炸反应当量浓度的计算爆炸性混合物中的可燃物质和助燃物质的浓度比例恰好能发生完全化合反应时,爆炸所析出的热量最多,产生的压力也最大,实际的
常见可燃气体爆炸极限数据表
常见可燃气体爆炸极限数据表(2016-02-26 17:56:29) 转载 分类:火灾爆炸(粉尘) 物质名称分子式下限 LEL 上限 UEL 毒性 甲烷CH4 515 乙烷C2H63 丙烷C3H8 丁烷C4H10 戊烷(液体)C5H12 己烷(液体)C6H14 庚烷(液体)CH3(CH2)5CH3 辛烷(液体)C8H181 乙烯C2H436 丙烯C3H62 丁烯C4H810 丁二烯C4H6212低毒 乙炔C2H2100 环丙烷C3H6 煤油(液体)C10-C165 城市煤气4 液化石油气112 汽油(液体)C4-C12 松节油(液体)C10H16 苯(液体)C6H6 中等 甲苯C6H5CH3低毒 氯乙烷C2H5Cl中等 氯乙烯C2H3Cl33 氯丙烯C3H5Cl中等 二氯乙烷ClCH2CH2Cl16高毒 四氯化碳CCl4 轻微麻醉三氯甲烷CHCl3中等 环氧乙烷C2H4O3100中等 甲胺CH3NH2中等 乙胺CH3CH2NH214中等 苯胺C6H5NH211高毒 二甲胺(CH3)2NH中等
乙二胺H2NCH2CH2NH2低毒 甲醇(液体)CH3OH36 乙醇(液体)C2H5OH19 正丁醇(液体)C4H9OH 甲醛HCHO773 乙醛C2H4O460 丙醛(液体)C2H5CHO17 乙酸甲酯CH3COOCH316 乙酸CH3COOH16低毒 乙酸乙酯CH3COOC2H511 丙酮C3H6O 丁酮C4H8O10 HCN剧毒 氰化氢 ( 氢氰 酸 ) 丙烯氰C3H3N28高毒 氯气Cl2 刺激 氯化氢HCl 氨气NH31625低毒 硫化氢H2S神经 二氧化硫SO2 中等 二硫化碳CS250 臭氧O3刺激 一氧化碳CO剧毒 氢H2475 乙醚(C2H5)O浓度超过303g/m3有 生命危险。
爆炸极限范围
爆炸极限的意义 可燃物质(、蒸气和)与空气(或)必须在一定的浓度范围内均匀混合,形成预混气,遇着火源才会发生爆炸,这个浓度范围称为爆炸极限,或。例如与空气混合的爆炸极限为%~80%。可燃性混合物能够发生爆炸的最低浓度和最高浓度,分别称为和爆炸上限,这两者有时亦称为着火下限和着火上限。在低于爆炸下限时不爆炸也不着火;在高于爆炸上限同样不燃不爆。这是由于前者的可燃物浓度不够,过量空气的冷却作用,阻止了火焰的蔓延;而后者则是空气不足,导致火焰不能蔓延的缘故。当可燃物的浓度大致相当于反应当量浓度时,具有最大的爆炸威力(即根据完全燃烧反应方程式计算的浓度比例)。 影响爆炸极限的因素 混合系的组分不同,爆炸极限也不同。同一混合系,由于初始温度、系统压力、惰性介质含量、混合系存在空间及器壁材质以及点火能量的大小等的都能使爆炸极限发生变化。一般规律是:混合系原始温度升高,则爆炸极限范围增大,即下限降低、上限升高。因为系统温度升高,增加,使原来不燃的混合物成为可燃、可爆系统。系统压力增大,爆炸极限范围也扩大,这是由于系统压力增高,使分子间距离更为接近,碰撞几率增高,使燃烧反应更易进行。压力降低,则爆炸极限范围缩小;当压力降至一定值时,其上限与下限重合,此时对应的压力称为混合系的。压力降至临界压力以下,系统便不成为爆炸系统(个别气体有反常现象)。混合系中所含惰性气体量增加,爆炸极限范围缩小,惰性气体浓度提高到某一数值,混合系就不能爆炸。容器、管子直径越小,则爆炸范围就越小。当管径(火焰通道)小到一定程度时,单位体积火焰所对应的固体冷却表面散出的就会大于产生的热量,火焰便会中断熄灭。火焰不能传播的最大管径称为该混合系的临界直径。点火能的强度高、热表面的面积大、点火源与混合物的接触时间不等都会使爆炸极限扩大。除上述因素外,混合系接触的封闭外壳的材质、机械杂质、光照、表面活性物质等都可能影响到爆炸极限范围。 与可燃物的危害 可燃性混合物的爆炸极限范围越宽、爆炸下限越低和爆炸上限越高时,其爆炸危险性越大。这是因为爆炸极限越宽则出现爆炸条件的机会就多;爆炸下限越低则可燃物稍有泄漏就会形成爆炸条件;爆炸上限越高则有少量空气渗入容器,就能与容器内的可燃物混合形成爆炸条件。应当指出,可燃性混合物的浓度高于爆炸上限时,虽然不会着火和爆炸,但当它从容器或管道里逸出,重新接触空气时却能燃烧,仍有发生着火的危险。 表示 爆炸极限的表示方法 气体或蒸汽爆炸极限是以可燃性物质在混合物中所占体积的百分比(%)来表示的,如氢与空气混合物的爆炸极限为4%~75%。可燃粉尘的爆炸极限是以可燃性物质在混合物中所
爆炸极限理论与计算 (1)
第五节爆炸极限理论与计算 一、爆炸极限理论 可燃气体或蒸气与空气的混合物,并不是在任何组成下都可以燃烧或爆炸,而且燃烧(或爆炸)的速率也随组成而变。实验发现,当混合物中可燃气体浓度接近化学反应式的化学计量比时,燃烧最快、最剧烈。若浓度减小或增加,火焰蔓延速率则降低。当浓度低于或高于某个极限值,火焰便不再蔓延。可燃气体或蒸气与空气的混合物能使火焰蔓延的最低浓度,称为该气体或蒸气的爆炸下限;反之,能使火焰蔓延的最高浓度则称为爆炸上限。可燃气体或蒸气与空气的混合物,若其浓度在爆炸下限以下或爆炸上限以上,便不会着火或爆炸。 爆炸极限一般用可燃气体或蒸气在混合气体中的体积百分数表示,有时也用单位体积可燃气体的质量(kg·m—3)表示。混合气体浓度在爆炸下限以下时含有过量空气,由于空气的冷却作用,活化中心的消失数大于产生数,阻止了火焰的蔓延。若浓度在爆炸上限以上,含有过量的可燃气体,助燃气体不足,火焰也不能蔓延。但此时若补充空气,仍有火灾和爆炸的危险。所以浓度在爆炸上限以上的混合气体不能认为是安全的。 燃烧和爆炸从化学反应的角度看并无本质区别。当混合气体燃烧时,燃烧波面上的化学反应可表示为 A+B→C+D+Q(4—1) 式中A、B为反应物;C、D为产物;Q为燃烧热。A、B、C、D不一定是稳定分子,也可以是原子或自由基。化学反应前后的能量变化可用图4—4表示。初始状态Ⅰ的反应物(A+B)吸收活化能正达到活化状态Ⅱ,即可进行反应生成终止状态Ⅲ的产物(C+D),并释放出能量W,W=Q+E。 图4-4 反应过程能量变化 假定反应系统在受能源激发后,燃烧波的基本反应浓度,即反应系统单位体积的反应数为n,则单位体积放出的能量为nW。如果燃烧波连续不断,放出的能量将成为新反应的活化能。设活化概率为α(α≤1),则第二批单位体积内得到活化的基本反应数为anW/E,放出的能量为。αnW2/E。后批分子与前批分子反应时放出的能量比β定义为燃烧波传播系数,为
爆炸极限的计算方法
爆炸极限的计算方法 1 根据化学理论体积分数近似计算 爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下: L下≈0.55c0 式中 0.55——常数; c0——爆炸气体完全燃烧时化学理论体积分数。若空气中氧体积分数按20.9%计,c0可用下式确定 c0=20.9/(0.209+n0) 式中 n0——可燃气体完全燃烧时所需氧分子数。 如甲烷燃烧时,其反应式为 CH4+2O2→CO2+2H2O 此时n0=2 则L下=0.55×20.9/(0.209+2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。 2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算 目前,比较认可的计算方法有两种: 2.1 莱?夏特尔定律 对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。用Pn表示一种可燃气在混合物中的体积分数,则: LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%) 混合可燃气爆炸上限: UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%) 此定律一直被证明是有效的。 2.2 理?查特里公式 理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。 Lm=100/(V1/L1+V2/L2+……+Vn/Ln) 式中Lm——混合气体爆炸极限,%; L1、L2、L3——混合气体中各组分的爆炸极限,%; V1、V2、V3——各组分在混合气体中的体积分数,%。 例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。 Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369 3 可燃粉尘 许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。 碳氢化合物一类粉尘如能完全气化燃尽,则爆炸下限可由布尔格斯-维勒关系式计算: c×Q=k
爆炸极限的影响因素
爆炸极限的影响因素 【大纲考试内容要求】: 1.了解爆炸极限的影响因素; 2.了解爆炸反应浓度的计算; 【教材内容】: 爆炸极限值不是一个物理常数,它是随实验条件的变化而变化,在判断某工艺条件下的爆炸危险性时,需根据危险物品所处的条件来考虑其爆炸极限,如在火药、起爆药、炸药烘干工房内可燃蒸气的爆炸极限与其他工房在正常温度下的极限是不一样的,在受压容器和在正常压力下的爆炸极限亦有所不同;其他因素如点火源的能量,容器的形状、大小,火焰的传播方向,惰性气体与杂质的含量等均对爆炸极限有影响。 1.温度的影响 混合爆炸气体的初始温度越高,爆炸极限范围越宽,则爆炸下限降低,上限增高,爆炸危险性增加。这是因为在温度增高的情况下,活化分子增加,分子和原子的动能也增加,使活化分子具有更大的冲击能量,爆炸反应容易进行,使原来含有过量空气(低于爆炸下限)或可燃物(高于爆炸上限)而不能使火焰蔓延的混合物浓度变成可以使火焰蔓延的浓度,从而扩大了爆炸极限范围。例如丙酮的爆炸极限受温度影响的情况见表2—1。 2.压力的影响 混合气体的初始压力对爆炸极限的影响较复杂,在~ MPa的压力下,对爆炸下限影响不大,对爆炸上限影响较大;当大于 MPa时,爆炸下限变小,爆炸上限变大,爆炸范围扩大。这是因为在高压下混合气体的分子浓度增大,反应速度加快,放热量增加,且在高气压下,热传导性差,热损失小,有利于可燃气体的燃烧或爆炸。甲烷混合气初始压力对爆炸极限的影响见表2 —2。值得重视的是当混合物的初始压力减小时,爆炸极限范围缩小,当压力降到某一数值时,则会出现下限与上限重合,这就意味着初始压力再降低时,不会使混合气体爆炸。把爆炸极限范围缩小为零的压力称为爆炸的临界压力。甲烷在3个不同的初始温度下,爆炸极限随压力下降而缩小的
爆炸极限计算资料
爆炸极限计算 爆炸反应当量浓度、爆炸下限和上限、多种可燃气体混合物的爆炸极限计算方法如下: (1)爆炸反应当量浓度。爆炸性混合物中的可燃物质和助燃物质的浓度比例,在恰好能发生完全的化合反应时,则爆炸所析出的热量最多,所产生的压力也最大。实际的反应当量浓度稍高于计算的反应当量浓度,这是因为爆炸性混合物通常含有杂质。 可燃气体或蒸气分子式一般用C αHβOγ表示,设燃烧1mol气体所必需的氧摩尔数为n,则燃烧反应式可写成: C αHβOγ+nO2→生成气体 按照标准空气中氧气浓度为20.9%,则可燃气体在空气中的化学当量浓度X(%),可用下式表示: 可燃气体在氧气中的化学当量浓度为Xo(%),可用下式表示: 也可根据完全燃烧所需的氧原子数2n的数值,从表1中直接查出可燃气体或蒸气在 空气(或氧气)中的化学当量浓度。其中。 可燃气体(蒸气)在空气中和氧气中的化学当量浓度
(2)爆炸下限和爆炸上限。各种可燃气体和燃性液体蒸气的爆炸极限,可用专门仪器测定出来,或用经验公式估算。爆炸极限的估算值与实验值一般有些出入,其原因是在计算式中只考虑到混合物的组成,而无法考虑其他一系列因素的影响,但仍不失去参考价值。 1)根据完全燃烧反应所需的氧原子数估算有机物的爆炸下限和上限,其经验公式如下。 爆炸下限公式: (体积) 爆炸上限公式: (体积) 式中 L ——可燃性混合物爆炸下限; 下 L ——可燃性混合物爆炸上限; 上 n——1mol可燃气体完全燃烧所需的氧原子数。 某些有机物爆炸上限和下限估算值与实验值比较如表2: 表2 石蜡烃的化学计量浓度及其爆炸极限计算值与实验值的比较
影响气体混合物爆炸极限的因素
影响气体混合物爆炸极限的因素 :可燃物质(、蒸气和)与空气(或)必须在一定的浓度范围内均匀混合,形成预混气,遇着火源才会发生爆炸,这个浓度范围称为,或。例如与空气混合的爆炸极限为12.5%~74%。可燃性混合物能够发生爆炸的最低浓度和最高浓度,分别称为和爆炸上限,这两者有时亦称为着火下限和着火上限。在低于爆炸下限时不爆炸也不着火;在高于爆炸上限同样不燃不爆。这是由于前者的可燃物浓度不够,过量空气的冷却作用,阻止了火焰的蔓延;而后者则是空气不足,导致火焰不能蔓延的缘故。当可燃物的浓度大致相当于反应当量浓度时,具有最大的爆炸威力(即根据完全燃烧反应方程式计算的浓度比例)。 影响气体混合物爆炸极限的因素:温度、氧含量、惰性介质、压力、容器或管道直径、着火源(点火能量) 1)温度。混合物的原始温度越高,则爆炸下限越低,上限提高,爆炸极限范围扩大,爆炸危险性增加。这是因为混合物温度升高,其分子内能增加,引起燃烧速度的加快,而且,由于分子内能的增加和燃烧速度的加快,使原来含有的过量空气(低于爆炸下限)或可燃物高于爆炸上限,而不能使火焰蔓延的混合物浓度变成为可以使火焰蔓延的浓度,从而改变了爆炸极限范围。 (2)氧含量。混合物中含氧量增加,爆炸极限范围扩大,尤其爆炸上限提高得更多。例如氢与空气混合的爆炸极限为4%~75%,而氢与纯氧混合的爆炸极限为4%~95%。 (3)惰性介质。如若在爆炸混合物中掺入不燃烧的惰性气体(如氮、二氧化碳、水蒸气、氩、氦等),随着惰性气体的百分数增加,爆炸极限范围则缩小,惰性气体的浓度提高到某一数值,亦可以使混合物变成不可爆炸。一般情况下,惰性气体对混合物爆炸上限的影响较之对下限的影响更为显着,因为惰性气体浓度加大,表示氧的浓度相对减小,而在上限中氧的浓度本来已经很小,故惰性气体稍为增加一点,即产生很大影响,而使爆炸上限剧烈下降。 (4)压力。混合物的原始压力对爆炸极限有很大影响,压力增大,爆炸极限范围也扩大,尤其是爆炸上限显着提高。值得重视的是当混合物的原始压力减小时,爆炸极限范围缩小,压力降至某一数值时,下限与上限合成一点,压力再降低,混合物即变成不可爆。爆炸极限范围缩小为零的压力称为爆炸的临界压力。临界压力的存在表明,在密闭的设备内进行减压操作,可以免除爆炸的危险。 (5)容器或管道直径。容器或管道直径越小,火焰在其中越难蔓延,混合物的爆炸极限范围则越小。当容器直径小到某一数值时,火焰不能蔓延,可消除爆炸危险,这个直径称为临界直径。如甲烷的临界直径为0.4~0.5mm,氢和乙炔为0.1~0.2mm等。容器直径大小对爆炸极限的影响,可以用链式反应理论解释。燃烧是自由基产生的一系列链锁反应的结果,管径减小时,游离基与管壁的碰撞几率相应增大,当管径减小到一定程度时,即因碰撞造成游离基的销毁的反应速度大于游离基产生的反应速度,燃烧反应便不能继续进行。 (6)着火源。能源的性质对爆炸极限范围的影响是:能源强度越高,加热面积越大,作用时间越长,爆炸极限范围越宽。以甲烷为例,100V·A的电火花不引起曝炸,2V·A的电火花可引起爆炸,爆炸极限为5.9%~13.6%,3V·A的电火花则爆炸极限扩大为5.85%~14.8%。 各种爆炸性混合物都有一个最低引爆能量,即点火能量,它是指能引起爆炸性混合物发生爆炸的最小火源所具有的能量,它也是混合物爆炸危险性的一项重要的性能参数。爆炸性混合物的点火能量越小,其燃爆危险性就越大。 火花的能量、热表面的面积、火源和混合物的接触时间等,对爆炸极限均有影响。此外,光对爆炸极限也有影响,如前所述,氢和氯混合,在避光黑暗处反应十分缓慢,但在强光照射下则发生剧烈反应(链锁反应)并导致爆炸。
影响气体混合物爆炸极限的因素
影响气体混合物爆炸极 限的因素 Document serial number【LGGKGB-LGG98YT-LGGT8CB-LGUT-
影响气体混合物爆炸极限的因素 :可燃物质(、蒸气和)与空气(或)必须在一定的浓度范围内均匀混合,形成预混气,遇着火源才会发生爆炸,这个浓度范围称为,或。例如与空气混合的爆炸极限为%~74%。可燃性混合物能够发生爆炸的最低浓度和最高浓度,分别称为和爆炸上限,这两者有时亦称为着火下限和着火上限。在低于爆炸下限时不爆炸也不着火;在高于爆炸上限同样不燃不爆。这是由于前者的可燃物浓度不够,过量空气的冷却作用,阻止了火焰的蔓延;而后者则是空气不足,导致火焰不能蔓延的缘故。当可燃物的浓度大致相当于反应当量浓度时,具有最大的爆炸威力(即根据完全燃烧反应方程式计算的浓度比例)。 影响气体混合物爆炸极限的因素:温度、氧含量、惰性介质、压力、容器或管道直径、着火源(点火能量) 1)温度。混合物的原始温度越高,则爆炸下限越低,上限提高,爆炸极限范围扩大,爆炸危险性增加。这是因为混合物温度升高,其分子内能增加,引起燃烧速度的加快,而且,由于分子内能的增加和燃烧速度的加快,使原来含有的过量空气(低于爆炸下限)或可燃物高于爆炸上限,而不能使火焰蔓延的混合物浓度变成为可以使火焰蔓延的浓度,从而改变了爆炸极限范围。 (2)氧含量。混合物中含氧量增加,爆炸极限范围扩大,尤其爆炸上限提高得更多。例如氢与空气混合的爆炸极限为4%~75%,而氢与纯氧混合的爆炸极限为4%~95%。 (3)惰性介质。如若在爆炸混合物中掺入不燃烧的惰性气体(如氮、二氧化碳、水蒸气、氩、氦等),随着惰性气体的百分数增加,爆炸极限范围则缩小,惰性气体的浓度提高到某一数值,亦可以使混合物变成不可爆炸。一般情况下,惰性气体对混合物爆炸上限的影响较之对下限的影响更为显着,因为惰性气体浓度加大,表示氧的浓度相对减小,
混合气体的爆炸极限怎么计算
爆炸极限的计算 1 根据化学理论体积分数近似计算 爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下: L下≈0.55c0 式中——常数; c0——爆炸气体完全燃烧时化学理论体积分数。若空气中氧体积分数按%计,c0可用下式确定 c0=( n0) 式中 n0——可燃气体完全燃烧时所需氧分子数。 如甲烷燃烧时,其反应式为 CH4 2O2→CO2 2H2O 此时n0=2 则L下=×( 2)=由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。 2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算 目前,比较认可的计算方法有两种: 莱?夏特尔定律 对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏表示一种可燃气在混合物中的Pn特尔定律,可以算出与空气相混合的气体的爆炸极限。用. 体积分数,则: LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%) 混合可燃气爆炸上限: UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%) 此定律一直被证明是有效的。
理?查特里公式 理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。 Lm=100/(V1/L1 V2/L2 …… Vn/Ln) 式中Lm——混合气体爆炸极限,%; L1、L2、L3——混合气体中各组分的爆炸极限,%; V1、V2、V3——各组分在混合气体中的体积分数,%。 例如:一天然气组成如下:甲烷80%(L下=%)、乙烷15%(L下=%)、丙烷4%(L下=%)、丁烷1%(L下=%)求爆炸下限。 Lm=100/(80/5 15/ 4/ 1/)= 3 可燃粉尘 许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。 碳氢化合物一类粉尘如能完全气化燃尽,则爆炸下限可由布尔格斯-维勒关系式计算: c×Q=k 式中c——爆炸下限浓度; Q——该物质每靡尔的燃烧热或每克的燃烧热; k——常数 第五节爆炸极限理论与计算 一、爆炸极限理论 可燃气体或蒸气与空气的混合物,并不是在任何组成下都可以燃烧或爆炸,而且燃烧(或爆炸)的速率也随组成而变。实验发现,当混合物中可燃气体浓度接近化学反应式的化学计量比时,燃烧最快、最剧烈。若浓度减小或增加,火焰蔓延速率则降低。当浓度低于或高于某个极限值,火焰便不再蔓延。可燃气体或蒸气与空气的混合物能使火焰蔓延的最低浓度,称为该气体或蒸气的
各常见气体爆炸极限
常见可燃性气体爆炸极限 三氯氢硅SiHCl3 1. 别名?英文名
硅氯仿、硅仿、三氯硅烷;Trichlorosilane 、Silicochloroform . 2. 用途 单晶硅原料、外延成长、硅液、硅油、化学气相淀积、硅酮化合物制造、电子气。 3. 制法 (1) 在高温下Si 和HCl 反应。 (2) 用氢还原四氯化硅(采用含铝化合物的催化剂) 。 4. 理化性质 分子量:135.43 熔点(101.325kPa) : -134C ;沸点(101.325kPa) : 31.8 C;液体密度(0 C): 13 50kg/m3;相对密度(气体,空气=1): 4.7 ;蒸气压(-16.4 C) : 13.3kPa ; (14. 5C) : 53.3kPa ;燃点:-27.8 C;自燃点:104.4 C;闪点:-14C ;爆炸下限:9.8%;毒性级别:3;易燃性级别:4;易爆性级别:2 三氯硅烷在常温常压下为具有刺激性恶臭易流动易挥发的无色透明液体。在空气中极易燃烧,在-18C以下也有着火的危险,遇明火则强烈燃烧,燃烧时发出红色火焰和白色烟,生成SiO2、HCl 和Cl2: SiHCI3 O2-SiO2 HCI CI2 ;三氯硅烷的蒸气能与空气形成浓度范围很宽的爆炸性混合气,受热时引起猛烈的爆炸。它的热稳定性比二氯硅烷好,在900C时分解产生氯化物有毒烟雾(HCl),还生成Cl2和Si。 遇潮气时发烟,与水激烈反应:2SiHCI3 3H2O—- (HSiO)2O 6HCI ; 在碱液中分解放出氢气:SiHCl3 3NaOH H2O—-Si (OH)4 3NaCl H2 ; 与氧化性物质接触时产生爆炸性反应。与乙炔、烃等碳氢化合物反应产生有机氯硅烷: SiHCl3 CH三CH一—CH2CHSiCl3、SiHCl3 CH2=CH2-->CH3CH2SiCl3 在氢化铝锂、氢化硼锂存在条件下,SiHCl3 可被还原为硅烷。容器中的液态Si HCl3 当容器受到强烈撞击时会着火。可溶解于苯、醚等。无水状态下三氯硅烷对铁和不锈钢不腐蚀,但是在有水分存在时腐蚀大部分金属。 5. 毒性 小鼠-吸入LC50 1.5?2mg/L 最高容许浓度:1mg/m3 三氯硅烷的蒸气和液体都能对眼睛和皮肤引起灼伤,吸入后刺激呼吸道粘膜引起各种症状(参见四氯化硅)。 6. 安全防护 液体用玻璃瓶或金属桶盛装,容器要存放在室外阴凉干燥通风良好之处或在易燃液体专用库内,要与氧化剂、碱类、酸类隔开,远离火种、热源,避光,库温不宜超过25 r。可用氨水探漏。 火灾时可用二氧化碳、干石粉、干砂,禁止用水及泡沫。废气可用水或碱液吸收。 三氯硅烷有水分时腐蚀性极强。可用铁、镍、铜镍合金、镍钢、低合金钢,不能用铝、铝合金。可以用聚四氟乙烯、聚三氟氯乙烯聚合体、氟橡胶、聚氯乙烯、聚乙烯、玻璃等。
什么是爆炸极限
什么是爆炸极限 (一)定义 可燃物质(可燃气体、蒸气、粉尘或纤维)与空气(氧气或氧化剂)均匀混合形成爆炸性混合物,其浓度达到一定的范围时,遇到明火或一定的引爆能量立即发生爆炸,这个浓度范围称为爆炸极限(或爆炸浓度极限)。形成爆炸性混合物的最低浓度称为爆炸浓度下限,最高浓度称为爆炸浓度上限,爆炸浓度的上限、下限之间称为爆炸浓度范围。 可燃性混合物有一个发生燃烧和爆炸的浓度范围,即有一个最低浓度和最高浓度,混合物中的可燃物只有在其之间才会有燃爆危险。 可燃物质的爆炸极限受诸多因素的影响。如可燃气体的爆炸极限受温度、压力、氧含量、能量等影响,可燃粉尘的爆炸极限受分散度、湿度、温度和惰性粉尘等影响。 可燃气体和蒸气爆炸极限是以其在混合物中所占体积的百分比(%)来表示的,表5—3中一氧化碳与空气的混合物的爆炸极限为12.5%~80%。可燃粉尘的爆炸极限是以其在混合物中所占的比重(g/m3)来表示的,例如,木粉的爆炸下限为409/m3,煤粉的爆炸下限为359/m3可燃粉尘的爆炸上限,因为浓度太高,大多数场合都难以达到,一般很少涉及。例如,糖粉的爆炸上限为135009/m3,煤粉的爆炸上限为135009/m3,一般场合不会出现。可燃性混合物处于爆炸下限和爆炸上限时,爆炸所产生的压力不大,温度不高,爆炸威力也小。当可燃物的浓度大致相当于反应当量浓度(表中的30%)时,具有最大的爆炸威力。反应当量浓度可根据燃烧反应式计算出来。 可燃性混合物的爆炸极限范围越宽,其爆炸危险性越大,这是因为爆炸极限越宽则出现爆炸条件的机会越多。爆炸下限越低,少量可燃物(如可燃气体稍有泄漏)就会形成爆炸条件;爆炸上限越高,则有少量空气渗入容器,就能与容器内的可燃物混合形成爆炸条件。生产过程中,应根据各可燃物所具有爆炸极限的不同特点,采取严防跑、冒、滴、漏和严格限制外部空气渗入容器与管道内等安全措施。应当指出,可燃性混合物的浓度高于爆炸上限时,虽然不会着火和爆炸,但当它从容器里或管道里逸出,重新接触空气时却能燃烧,因此,仍有发生着火的危险。 (二)爆炸反应当量浓度的计算 爆炸性混合物中的可燃物质和助燃物质的浓度比例恰好能发生完全化合反应时,爆炸所析出的热量最多,产生的压力也最大,实际的反应当量浓度稍高于计算的反应当量浓度。当混合物中可燃物质超过化学反应当量浓度时,空气就会不足,可燃物质就不能全部燃尽,于是混合物在爆炸时所产生的热量和压力就会随着可燃物质在混合物中浓度的增加而减小;如
可燃性混合气体爆炸特性计算
可燃性混合气体爆炸特性计算 1 绪论 可燃性混合气体的爆炸是生产生活,特别是化工生产中极为普遍的爆炸现象。气体混合物有两种:一种是单一的可燃性气体与空气混合;另一种是多种可燃性气体与空气混合。这两种气体混合物并非在任何情况下都能发生爆炸,只有在一定的爆炸浓度范围,并需要一定的能量点燃,才可能发生爆炸。由此可知,对气体混合物爆炸的爆炸极限和最小点火能的测定相当重要,对生产生活特别是化工生产也有着积极的指导意义。 可燃气体的燃烧、爆炸是最严重的灾害性事故。最近几年,我国城市天然气及煤矿瓦斯爆炸重特大事故频频发生,给国家和人民财产造成了巨大损失,直接影响着我国经济、社会的可持续发展。为了掌握防火防爆技术,了解可燃性混合气体的爆炸特性,掌握可燃性混合气体爆炸极限、最小发火能量的计算方法,以及进一步了解并掌握其危险特性,特做此课程设计。通过对爆炸极限的研究可以了解爆炸与燃烧与可燃物浓度的关系,以及最小发火能对其危险性的影响。燃烧与爆炸是非常激烈的化学反应,特别是爆炸,其反应速度非常快,反应的过程很难控制,如果不是按照人的意愿进行,只要其一发生,就会造成严重的后果。故只有认识其本质,才能从根本上解决它们产生的危害。 2 爆炸极限 2.1 爆炸极限理论 可燃物质(可燃气体、蒸气、粉尘或纤维)与空气(氧气或氧化剂)均匀混合形成爆炸性混合物,其浓度达到一定的范围时,遇到明火或一定的引爆能量便立即发生爆炸,这个浓度范围称为爆炸极限(或爆炸浓度极限)。形成爆炸性混合物的最低浓度称为爆炸浓度下限,最高浓度称为爆炸浓度上限,爆炸浓度的上限、下限之间称为爆炸浓度范围。 可燃气体或蒸气与空气的混合物,并不是在任何组成下都可以燃烧或爆炸,而且燃烧(或爆炸)的速率也随组成而变。实验发现,当混合物中可燃气体浓度
爆炸极限一般认为是物质发生爆炸必须具备的浓度或温度范围
爆炸极限一般认为是物质发生爆炸必须具备的浓度或温度范围爆炸极限一般认为是物质发生爆炸必须具备的浓度或温度范围,根据物质的不同形态和不同需要,通常将爆炸极限分为爆炸浓度极限和爆炸温度极限两种。一、爆炸浓度极限可燃气体、液体蒸气和粉尘与空气混合后,遇火源会发生爆炸的最高或最低的浓度范围,称为爆炸浓度极限,简称爆炸极限。能引起爆炸的最高浓度称爆炸上限,能引起爆炸的最低浓度称爆炸下限,上限和下限之间的间隔称爆炸范围。可燃气体、液体蒸气和粉尘与空气混合后形成的混合物遇火源不一定都能发生爆炸,只有其浓度处在爆炸极限范围内,才发生爆炸。浓度高于上限,助燃物数量太少,不会发生爆炸,也不会燃烧;浓度低于下限,可燃物的数量不够,也不会发生爆炸或燃烧。但是,若浓度高于上限的混合物离开密闭的空间或混合物遇到新鲜空气,遇火源则有发生燃烧或爆炸的危险。气体和液体的爆炸极限气体和液体的爆炸极限通常用体积百分比%表示。不同的物质由于其理化性质不同,其爆炸极限也不同;即使是同一种物质,在不同的外界条件下,其爆炸极限也不同。如在氧气中的爆炸极限要比在空气中的爆炸极限范围宽,下限会降低。部分可燃气体在空气和氧气中的爆炸极限如表1-3-1所示。表1-3-1 部分可燃气体和蒸气的爆炸极限物质名称在空气中在氧气中下限上限下限上限氢气 4.075.04.794.0乙炔 2.582.02.893.0甲烷5.015.05.460.0乙烷 3.012.453.066.0丙烷 2.19.52.355.0乙烯 2.7534.03.080.0丙烯2.011.02.153.0氨15.028.013.579.0环丙烷2.410.42.563.0一氧化碳12.574.015.594.0乙醚1.940.02.182.0丁烷1.58.51.849.0二乙烯醚1.727.01.8585.5除助燃物条件外,对于同种可燃气体,其爆炸极限还受以下几方面影响。火源能量的影响。引燃混气的火源能量越大,可燃混气的爆炸极限范围越宽,爆炸危险性越大。初始压力的影响。混气初始压力增加,爆炸范围增大,爆炸危险性增加。值得注意的是,干燥的一氧化碳和空气的混合气体,压力上升,其爆炸极限范围缩小。初温对爆炸极限的影响。混气初温越高,混气的爆炸极限范围越宽,爆炸危险性越大。惰性气体的影响。可燃混气中加入惰性气体,会使爆炸极限范围变宽,一般上限降低,下限变化比较复杂。当加入的惰性气体超过一定量以后,任何比例的混气均不能发送爆炸。可燃粉尘的爆炸极限粉尘的爆炸极限通常用单位体积中粉尘的
