艾曲波帕杂质
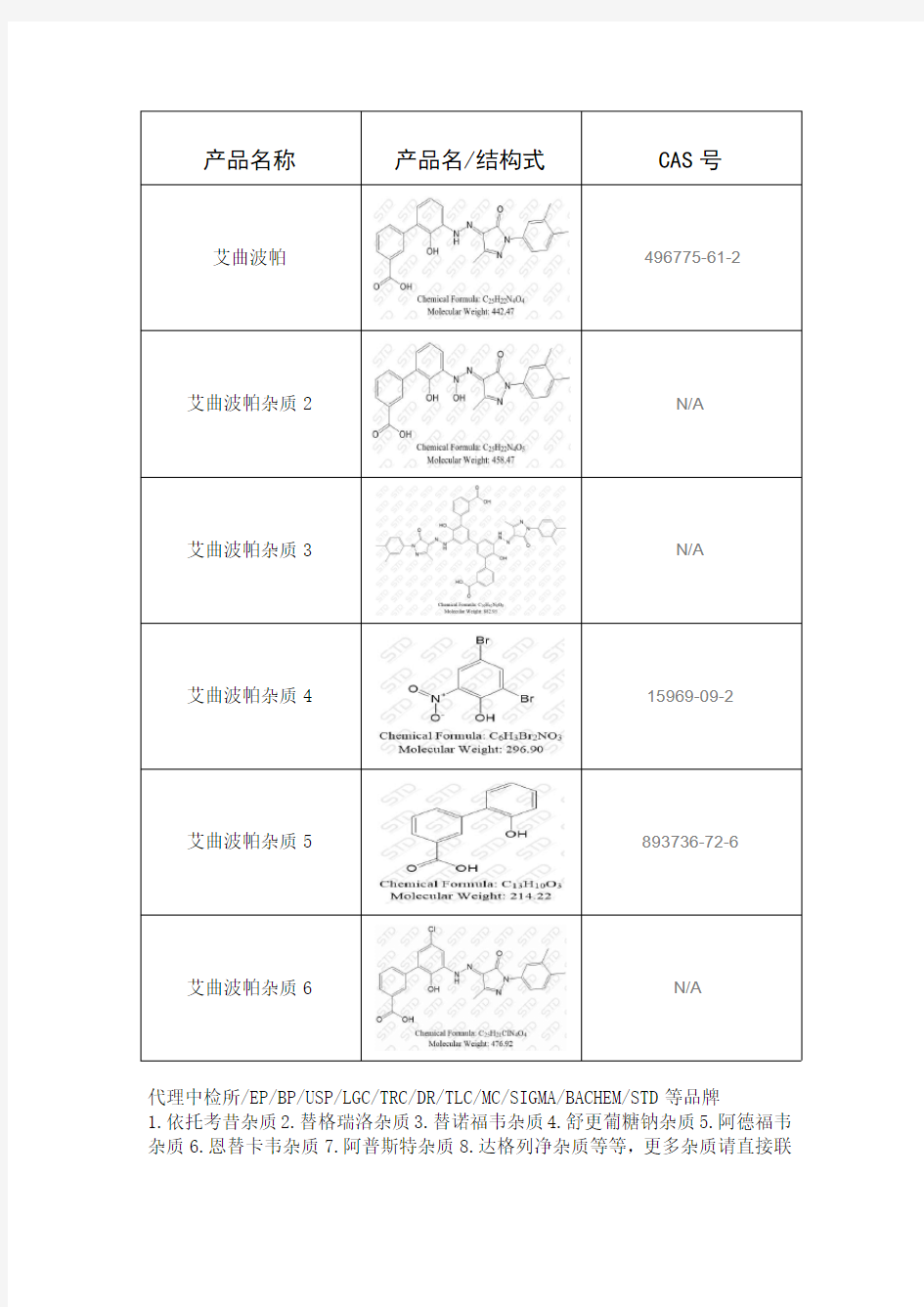

产品名称产品名/结构式CAS号
艾曲波帕496775-61-2
艾曲波帕杂质2N/A
艾曲波帕杂质3N/A
艾曲波帕杂质415969-09-2
艾曲波帕杂质5893736-72-6
艾曲波帕杂质6N/A
代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌
1.依托考昔杂质
2.替格瑞洛杂质
3.替诺福韦杂质
4.舒更葡糖钠杂质
5.阿德福韦杂质
6.恩替卡韦杂质
7.阿普斯特杂质
8.达格列净杂质等等,更多杂质请直接联
系湖北扬信医药科技有限公司。
2008年全球批准上市新药回顾与展望
2008年全球批准上市新药回顾与展望 时间:2009年03月30日14:39 2008年,全球批准上市的新分子实体(New Molecular Entity,NME)22个(见表1)和新生物药品(New Biologic)5个(见表2),共27个。其中,影响血液及造血系统药物5个,中枢神经系统药物5个,抗感染药3个,消化系统药物3个,抗癌药2个,心血管系统药物2个,遗传病治疗药2个,造影剂2个,泌尿系统药物1个,外科用药1个和眼科用药1个。 美国FDA网页上的“CDER New Molecular En tity (NME) Drug and New Biologic Approvals in Calendar Year 2008”表中列出的盐酸苯达莫司汀(bendamustine hydrochloride,商品名:Treanda )、钆塞酸钠(gadoxetate disodium,商品名:Eovist)、丁苯那嗪(tetrabenazine,商品名:Xenazine)、西罗多辛(silodosin,商品名:Rapaflo)、卢非酰胺(Rufinamide,商品名:Banzel)和培格干扰素α-2b/利巴韦林(商品名:Pegpak)分别于2003年10月默克公司在德国、2004年拜耳保健制药(Bayer HealthCare Pharmaceuticals)公司在欧洲、2004年普雷斯特维克制药(Prestwick Pharmaceuticals)公司在加拿大、一些欧洲国家和澳大利亚、2006年沃森(Watson)公司在日本、2007年6月卫材(Eisai)公司以商品名Inovelon在德国、澳大利亚和斯堪的纳维亚以及2002年5月先灵葆雅公司在加拿大获准上市,故不一一列入本文表1和2中。
2018年度深圳市卫生计生系统科研项目拟立项名单
2018 年度深圳市卫生计生系统科研项目拟立项名单
临床研究项目
项目名称 基于多模态 MRI 影像组学的脑胶质瘤临床队列诊断预测模型研究 单倍型异基因造血干细胞移植后应用高剂量环磷酰胺诱导免疫耐受的作用 联合地西他滨去甲基化治疗的化疗方案改善儿童急性髓系白血病预后的随机对照临床研究 艾曲波帕与重组人血小板生成素促进造血干细胞移植后血小板恢复的等效性随机对照临床研究 数字化外科在颅颌面畸形精准治疗中的应用研究 甲状旁腺激素预防骨质疏松椎体成形术后再骨折的临床研究 基于“远程智能腹膜透析随诊系统”的居家 CAPD 患者的临床管理效果评价:前瞻性队列研究 深圳市女童性早熟调查及邻苯二甲酸酯(PAEs)与性早熟进展关系的队列研究 miRNAs 作为肾癌预后标志物的研究 高渗盐水液体复苏对重症急性胰腺炎的前瞻性、多中心、开放、随机对照、优效性研究 颅内静脉窦血栓形成支架取栓治疗的前瞻性临床研究 基于“五脏相关”理论探讨健脾益肾方治疗慢性肾脏病 3 期的临床观察及微炎症状态机制研究 基于循环肿瘤 DNA 的 HER2 基因异常扩增检测在胃癌精准诊治中的应用研究 新式神经内镜通道内技术治疗颅内血肿的多中心临床对照研究 基于 Oddi 括约肌功能保护理念的胆总管结石多镜联合治疗方案的临床研究 基于真实世界的第三代无饥饿禁食疗法缓解或逆转 2 型糖尿病的多中心对照研究 项目承担单位 深圳市第二人民医院
中国医学科学院肿瘤医院深圳医
中山大学附属第七医院(深圳) 深圳市第二人民医院 北京大学深圳医院 深圳市南山区人民医院 深圳市中医院 深圳市儿童医院 北京大学深圳医院 北京大学深圳医院 南方医科大学深圳医院 深圳市中医院 深圳市南山区人民医院 深圳市人民医院 深圳市人民医院
中山大学附属第七医院(深圳)
1 / 16
2008年全球批准上市新药回顾与展望上
2008年全球批准上市新药回顾与展望(上) 上海医药工业研究院信息中心黄胜炎 2008年,全球批准上市的新分子实体(New Molecular Entity,NME)22 个(见表1)和新生物药品(New Biologic)5个(见表2),共27个。其中,影响血液及造血系统药物5个,中枢神经系统药物5个,抗感染药3个,消化系统药物3个,抗癌药2个,心血管系统药物2个,遗传病治疗药2个,造影剂2个,泌尿系统药物1个,外科用药1个和眼科用药1个。 美国FDA网页上的“CDER New Molecula r Entity (NME) Drug and New Biologic Approvals in Calendar Year 2008”表中列出的盐酸苯达莫司汀(bendamustine hydrochloride,商品名:Treanda )、钆塞酸钠(gadoxetate disodium,商品名:Eovist)、丁苯那嗪(tetrabenazine,商品名:Xenazine)、西罗多辛(silodosin,商品名:Rapaflo)、卢非酰胺(Rufinamide,商品名:Banzel)和培格干扰素α-2b/利巴韦林(商品名:Pegpak)分别于2003年10月默克公司在德国、2004年拜耳保健制药(Bayer HealthCare Pharmaceuticals)公司在欧洲、2004年普雷斯特维克制药(Prestwick Pharmaceuticals)公司在加拿大、一些欧洲国家和澳大利亚、2006年沃森(Watson)公司在日本、2007年6月卫材(Eisai)公司以商品名Inovelon 在德国、澳大利亚和斯堪的纳维亚以及2002年5月先灵葆雅公司在加拿大获准上市,故不一一列入本文表1和2中。 表1 2008年全球批准的NME 序列药物中文名药物英文名商品名药物类别申请者 批准日期 (最先批准国 家或地区) 1 依曲韦林etravirine Intelence 抗病毒药蒂博特克制药 (Tibotec Pharmaceutical s)1月18日(美国) 2 西他沙星水 合物sitafloxacin hydrate Gracevit 抗生素第一制药三共 (Daiichi Sankyo) 1月28日(日 本) 3 琥珀酸去甲 文拉法辛desvenlafaxin e succinate Pristiq 中枢神经 系统药 物 惠氏制药2月29日(美 国)
艾曲波帕:一种口服的血小板生成素受体激动剂-用于特发性血小板减少性紫癜的治疗教学内容
艾曲波帕:一种口服的血小板生成素受体激动剂-用于特发性血小板减少性紫癜的治 疗
艾曲波帕:一种口服的血小板生成素受体激动剂,用于特发性血小板减少性紫癜的治疗 第1页 摘要: 背景:特发性血小板减少性紫癜(ITP)是一种比较少见的后天免疫性疾病,其特点是血小板生成降低或者对血小板破坏增加,从而降低血小板数量和增加出血的风险。免疫调节剂已经被使用于治疗;然而,最近开发出一类新型血小板生成素类似物。艾曲波帕被批准用于慢性ITP患者,而传统的免疫调节剂初始治疗或脾切除术对于这类患者的治疗均失败。 目的:这篇论述的目的是总结艾曲波帕的药理学,药动学性质,有效性,和耐受性,并评价这种药物被批准的以及研究性用途。 方法:临床试验科克伦中心注册的搜索和https://www.360docs.net/doc/7611841997.html,使用实施艾曲波帕条款或SB-497115-GR。此外,还有1980年1月至2011年1月间用英文发表的,并被收录于在PubMed文献服务检索系统和Cochrane系统评价数据库的所有综述和临床前及临床研究文献。 结果:共找到153篇出版物和13个临床试验;其中14篇出版物被排除在外,因为其不是用英文发表的。Ⅲ期临床试验,114例ITP患者,随机分为两组2:1,分别给予艾曲波帕50毫克或安慰剂,给药后43天,艾曲波帕组较安慰剂组患者具有显著更大比例的响应(59%比16%,比值比[OR]为9.61;95%CI, 3.31-27.86; P< 0.0001)。第八天,艾曲波帕组的基线血小板平均百分比变化
是安慰剂组的2倍,而在整个剩余治疗周期艾曲波帕组也持续是安慰剂组几倍高。另一个III期临床试验,评估艾曲波帕的有效性和安全性对比6个月以上安慰剂。艾曲波帕组响应(定义为50-400×109血小板数/ L)的几率,比安慰剂组高8倍(95%CI:3.59-18.73; P<0.0001)。骨髓纤维化肝脏毒性是最严重的不良影响,而恶心和呕吐则是最常见的。艾曲波帕对于感染丙型肝炎,化疗,急性白血病和骨髓增生异常,引起的继发血小板减少的治疗作用也正在被评价。 结论:艾曲波帕在提高慢性ITP患者血小板数量,具有良好的耐受性和有效性。(Clin Ther. 2011;33:1560–1576) ? 2011 Elsevier HS Journals, Inc. All rights reserved. 关键词:艾曲波帕 ITP 引言: 特发性血小板减少性紫癜(ITP)是一种获得性自身免疫性疾病,其特点是由于针对巨核细胞前体或血小板的自身抗体的形成,血小板生成降低或对血小板破坏增加,这将导致血小板数量降低和出血增加的风险。ITP的发病率大约为9.5%每10万人每年,其中约一半以上发生在儿童。ITP可被分为原发性、其它潜在疾病的继发性,也可被分为急性(3个月),持续性(3-12个月)和慢性(12个月)。成人ITP患者通常具有起病隐袭,有一个长期的过程,而儿童ITP患者具有典型的突发性,通常伴随着急性感染性疾病,短暂的,且至少70%的儿童能够自发消退。虽然无任何明显起因的外周血小板数<100×109/ L即可使得到确诊,但是ITP患者通常不需要治疗,除非其血小板数低于30至 50×109/ L2,8或由于手术或分娩出血风险增加。
高效液相色谱法测定艾曲波帕片有关物质及含量
2019年第15期广东化工 第46卷总第401期https://www.360docs.net/doc/7611841997.html,·195·高效液相色谱法测定艾曲波帕片有关物质及含量 胡蝶 (安徽中医药大学第二附属医院药学部,安徽合肥230001) Determination of Related Substances and Content of Atratropine Tablets by HPLC Hu Die (Second Affiliated Hospital of Anhui University of Traditional Chinese Medicine,Hefei230001,China) Abstract:Objective To establish a high performance liquid chromatography method for the determination of related substances and contents of atratropine tablets.Methods Welch C8column was used;0.02mol/L dipotassium hydrogen phosphate buffer solution(pH adjusted to6.5with phosphoric acid)was used as mobile phase A,acetonitrile was mobile phase B;detection wavelength was210nm,column temperature:30℃;flow rate1.0mL/min.Results The concentration of ezeppa has a good linear relationship in the range of90.0~210.0μg/mL,r is0.9998,the average recovery is99.0%,and the RSD is0.5%.Conclusions The method is simple,accurate,reproducible and specific.It can be used for the detection and determination of related substances in Atratropine tablets. Keywords:atratropin;related substances;content determination;HPLC 艾曲波帕是一种口服血小板生成素受体激动剂(TPO-RA),通过诱导来自骨髓干细胞的巨核细胞刺激和分化来增加血小板的产生。该药物已经批准用于对IST反应不足的再生障碍性贫血患者治疗,也被批准用于患有慢性免疫性(特发性)血小板减少症(ITP)的成人和儿童,这些患者对其他治疗无效或耐药。此外,还可以用于治疗慢性丙型肝炎病毒(HCV)感染患者的血小板减少症。获得FDA批准用于严重再生障碍性贫血(SAA)的一线突破性治疗药物,用于暴露于辐射的低血小板计数人群。此次获批是基于同既往单药相比,重度再障患者在使用艾曲波帕联合标准IST治疗后可获得更高的CR率[1-2]。艾曲波帕是美国数十年来首个用于新诊断的SAA患者的一线方案。为有效控制艾曲波帕片的产品质量,建立了简便、准确、快速的检测有关物质及含量的方法,研究如下。 1仪器与试药 1.1仪器 岛津高效液相色谱仪:LC-20AT流动相输送泵,SPD-20A二极管检测器;LC-15C流动相输送泵(单泵),SPD-15C紫外检测器;Lcsolution液相色谱工作站;UV-1750PC和UV-1700PC可见紫外分光光度计(日本岛津);AB135-S型电子天平,梅特勒托利多公司。 1.2试药 艾曲波帕片(葛兰素史克公司,批号:R824834,规格:25mg);艾曲波帕片(葛兰素史克公司,批号:R835842,规格:25mg);艾曲波帕片(葛兰素史克公司,批号:R826839,规格:25mg);艾曲波帕对照品(斯坦德公司,批号180523,含量:99.5%);乙腈(瑞士oceanpak公司,色谱级);甲醇(瑞士oceanpak公司,色谱级);磷酸(天津光复精细化工研究所,色谱级);水为纯化水;其余试剂均为分析纯。 2方法与结果 2.1色谱条件[3-5] Welch C8(250×4.6mm,5μm),以0.02mol/L磷酸氢二钾缓冲盐溶液(用磷酸调节pH值至6.5)为流动相A,乙腈为流动相B,梯度洗脱(0~20min,80.0%A→70.0%A;20~40min,70.0% A→35.0%A;40~50min,35.0%A;50~51min,35.0%A→80.0% A);检测波长210nm;柱温:30℃;流速1.0mL/min。 2.2专属性考察 取艾曲波帕片细粉适量,约相当于艾曲波帕10mg,置50mL 量瓶中,用甲醇溶解并稀释至刻度,置紫外灯光下24小时,作为光破坏样品;取艾曲波帕片细粉适量,约相当于艾曲波帕10mg,置50mL量瓶中,置140℃高温1小时后,用甲醇溶解并稀释至刻度,作为高温破坏样品;取艾曲波帕片细粉适量,约相当于艾 曲波帕10mg,置50mL量瓶中,加2mol/L盐酸溶液2mL,避 光放置2小时,另加2mol/L氢氧化钠溶液2mL中和,用甲醇稀释至刻度,作为酸破坏样品;取艾曲波帕片细粉适量,约相当于 艾曲波帕10mg,置50mL量瓶中,加0.1mol/L氢氧化钠溶液4 mL,避光放置2小时,另加0.1mol/L盐酸溶液4mL中和,用甲醇稀释至刻度,作为碱破坏样品;取艾曲波帕片细粉适量,约相 当于艾曲波帕10mg,置50mL量瓶中,加30%过氧化氢2mL, 避光放置15分钟后,用甲醇稀释至刻度,作为氧化破坏样品;取稀释剂及酸、碱及氧化破坏空白试验溶液同比考察;分别将上述个破坏样品按上述色谱条件进行考察分析。通过对样品进行高温、酸、碱、光照、氧化破坏试验,结果显示奔跑在氧化条件下极不稳定;在其他条件下较稳定;用此色谱条件能将杂质峰和主峰完全分离,且基线平稳,峰形对称,峰纯度符合要求,经二极管阵列检测器检测,主峰均为单一峰。 2.3标准曲线 精密称取艾曲波帕对照品约10mg,置25mL量瓶中,甲醇 溶解,并稀释至刻度,摇匀,作为对照品储备液。再分别精密吸 取对照品储备液3.0、4.0、5.0、6.0、7.0mL置10mL量瓶中,加 甲醇溶液稀释至刻度,摇匀。照高效液相色谱法测定,记录色谱 图,以浓度为横坐标,以峰面积为纵坐标,进行线性回归,线性方程为Y=23571X-6896.6(r=0.9998),峰面积与浓度呈良好的线性关系。 2.4溶液稳定性 取艾曲波帕片细粉适量,约相当于艾曲波帕10mg,置50mL 量瓶中,甲醇溶解,并稀释至刻度,摇匀,分别放置0、1、2、4、6、8小时后,测定其峰面积分别为3627716、3593815、3590755、3661818、3613299、3607808,RSD为0.73%。 2.5检测限 取艾曲波帕对照品适量,用甲醇制成浓度为0.05μg/mL的溶 液,以信噪比为3∶1分别作为本品检出限,调试色谱仪,待基线 平稳后取20μL进样,并记录色谱图;从色谱图可知:本品的最 小检测限为(0.05μg/mL×20μL)1.0ng。 2.6重复性 取样品6份,分别按照含量测定方法进行测定,分别为100.22%、99.84%、99.92%、100.61%、101.01%、100.98%,计算得艾曲波帕片平均含量为100.4%,RSD为0.51%。 2.7加样回收率 取重复性试验项下的样品适量,按加样回收法分别配制80%、100%和120%三个浓度的溶液,每个浓度各配制三份样品,在9份样品中分别加入等比例的美洛昔康对照品。取上述溶液,按照含量测定方法进行测定,精密量取20μl注入液相色谱仪,记 [收稿日期]2019-07-15 [作者简介]胡蝶(1987-),女,淮南人,本科,主要研究方向为药物分析。
罗米司亭及艾曲波帕药品说明书
根据病人的病情选择: 1.确定什么原因引起的血小板减少,至少要找到疾病 的诱因。 免疫系统?骨髓造血系统?分泌(激素)? 2.若不能找到诱因,一定要使用该两种药品,先用6 周,看看效果,查血小板计数,是否继续使用,再做评估。 罗米司亭 【商品名】Nplate 【药品名称】罗米司亭/ romiplostim 【适应症】治疗脾切除和脾未切除慢性免疫性血小板减少性紫癜(ITP)成人患者的血小板生成药。 【用法用量】 (1)初始剂量1μg/kg每周1次皮下注射。 (2)因为需要减低出血的风险,通过增量1μg/kg调整每周剂量以达到和维持血小板计数50 × 109/L. (3)最大剂量不要超过每周10μg/kg。如血小板计数达>400×109/L不要给药。 (4)如在最大剂量4周后血小板计数不增加中断Nplate。 (5)在配制期间不要震荡;避光保护配制好的Nplate; 24小时给配制好的Nplate。 (6)注射容积可能非常小。使用刻度0.01 mL的注射器。 (7)遗弃单次使用小瓶中未使用部份。
【注意事项】 (1)Nplate增加骨髓网硬蛋白(reticulin)沉积的风险;临床研究未除外网硬蛋白和其它纤维沉积导致有血细胞减少的骨髓纤维化的可能性。监查外周血骨髓纤维化征象。 (2)中止Nplate可能导致血小板减少比Nplate治疗前更坏。Nplate中止后监查全血细胞计数(CBCs),包括血小板计数至少2周。 (3)过量Nplate可能增加血小板计数至产生血栓形成/栓塞并发症的水平。(4)如随Nplate初期反应后血小板计数严重减低评估患者中和抗体的形成。(5)Nplate可能增加血液学恶性病的风险,尤其是有骨髓增生异常综合征患者。(6)每周监查CBCs,包括血小板计数和外周血涂片,直至达到稳定的Nplate 剂量。其后,至少每月监查CBCs,包括血小板计数和外周血涂片。 (7)只能通过受限制的分配计划,称为Nplate NEXUS(了解和支持Nplate专家和患者网络)计划,才能获得Nplate。在Nplate NEXUS(了解专家和支持Nplate 及患者网络)计划下,只有已注册的开处方者和患者能开处方,给药和接受产品。【不良反应】 最常见不良反应(≥ 5% Nplate患者发生率相比安慰剂较高)是关节痛、眩晕、失眠、肌肉痛、四肢疼痛、腹痛、肩痛、消化不良、和感觉异常。头痛是最常报道Nplate患者发生率相比安慰剂不是≥5%较高的不良反应。 妊娠患者和哺乳母亲禁用。 【包装规格】250微克/0.5毫升/瓶5500元 500微克/1毫升/瓶11000元 【储存】12个月,2~8℃保存,不可冷冻 【批准文号】H20065432 【生产厂商】美进公司
艾曲波帕杂质结构式整理-标准品
艾曲波帕杂质 ——孟成科技(上海)有限公司 名称信息 结构式艾曲波帕杂质Eltrombopag Impurity 分子式/Molecular Formula : C25H21ClN4O5 分子量/Molecular Weight : 492.91艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C21H19NO5 分子量/Molecular Weight : 365.39 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C21H23NO9 分子量/Molecular Weight : 433.42 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C31H30N4O11 分子量/Molecular Weight : 634.59 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C25H21ClN4O4 分子量/Molecular Weight : 476.92
艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C32H28N4O4 分子量/Molecular Weight : 532.60 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C25H21N5O5 分子量/Molecular Weight : 471.47 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C28H29N5O4 分子量/Molecular Weight : 499.57 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C13H11NO3 分子量/Molecular Weight : 229.24 CAS#:376592-93-7 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C12H14N2O 分子量/Molecular Weight : 202.26 CAS#:277299-70-4
