卡尔费休水分测定全面信息

卡尔费休氏水分测定法
对样品中水分的含量测定建立在R.W.Bunsen描述的下面这个反应上:
I
2+SO
2
+2H
2
O 2HI+H
2
SO
4
Karl Fischer首先发现这个反应可以在非水环境中用来测定水分含量,反应系统中包含有过量的SO
2
,甲醇可以被选作理想的溶剂。但反应是可逆的,为了使反
应向右进行,Karl Fischer用吡啶来吸收反应生成的HI和H
2SO
4
.
Smith,Bryanz 和 Mitchell 将这个反应描述成两步:
I
2+SO
2
+H
2
O+3B
5
C
5
N → 2B
5
C
5
NH+I- + B
5
C
5
N.SO
3
B 5C
5
N.SO
3
+CH
3
OH → B
5
C
5
N H+CH
3
SO
4
-
在第一步反应中,KF试剂和水反应生成的B
5C
5
N.SO
3
不稳定,容易分解成吡啶和二
氧化硫,甲醇可以和其反应生成稳定的B
5C
5
N H+CH
3
SO
4
-。由此可见,甲醇作溶剂有
防止副反应发生的作用。在醇溶剂中,碘和水反应的化学计量数为1:1。在无醇的溶剂中,碘和水反应的化学计量数为1:2:
I 2+SO
2
+H
2
O+3 B
5
C
5
N → 2 B
5
C
5
N H+I- + B
5
C
5
N.SO
3
(不稳定)
B 5C
5
N.SO
3
+H
2
O → B
5
C
5
N H+HSO
4
-(稳定)
卡尔.费休试剂的基本成份是碘、二氧化硫、溶剂和有机碱,溶剂主要是醇
类。通常,试剂中二氧化硫、有机碱和醇类物质都是过量的,试剂中碘与水以固定的化学计量数1:1进行反应,所以我们在进行实验前应先确定滴定剂中碘的浓度,也即对滴定剂进行标定,这是本实验定量的基础。用已知浓度的卡氏试剂滴定样品中的水分,由消耗滴定剂的体积和称样量,即可求出样品的含水量。
以前,卡氏试剂中用的有机碱主要是有毒、恶臭的吡啶,但更重要的是如果我们不能确定反应到底受那些方面的影响的话,我们就无法用其来进行定量分析。后来,E.Barenrecht和J.Cverhoff对Karl Fisher反应进行了更进一步的研究后,得出了如下结论:
◎吡啶不直接参加反应,也就是说它只起调节PH值和缓冲剂的作用,可以用其它的有机碱替代。
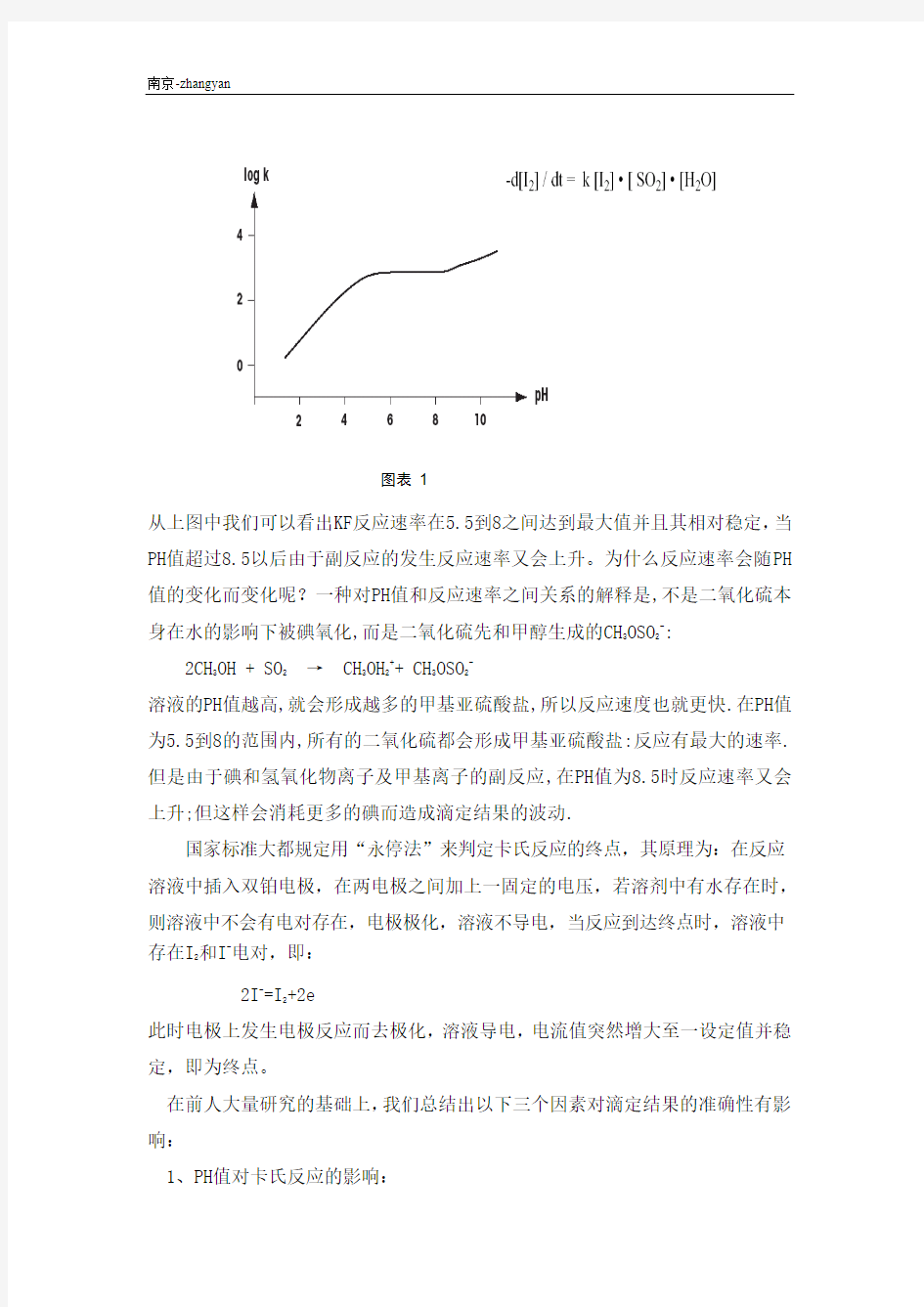
◎Karl Fisher反应的速率受反应介质的PH值影响。(如图.1)
图表1
从上图中我们可以看出KF反应速率在5.5到8之间达到最大值并且其相对稳定,当PH值超过8.5以后由于副反应的发生反应速率又会上升。为什么反应速率会随PH 值的变化而变化呢?一种对PH值和反应速率之间关系的解释是,不是二氧化硫本
身在水的影响下被碘氧化,而是二氧化硫先和甲醇生成的CH
3OSO
2
-:
2CH
3OH + SO
2
→ CH
3
OH
2
++ CH
3
OSO
2
-
溶液的PH值越高,就会形成越多的甲基亚硫酸盐,所以反应速度也就更快.在PH值为5.5到8的范围内,所有的二氧化硫都会形成甲基亚硫酸盐:反应有最大的速率.但是由于碘和氢氧化物离子及甲基离子的副反应,在PH值为8.5时反应速率又会上升;但这样会消耗更多的碘而造成滴定结果的波动.
国家标准大都规定用“永停法”来判定卡氏反应的终点,其原理为:在反应溶液中插入双铂电极,在两电极之间加上一固定的电压,若溶剂中有水存在时,则溶液中不会有电对存在,电极极化,溶液不导电,当反应到达终点时,溶液中存在I
2
和I-电对,即:
2I-=I
2
+2e
此时电极上发生电极反应而去极化,溶液导电,电流值突然增大至一设定值并稳定,即为终点。
在前人大量研究的基础上,我们总结出以下三个因素对滴定结果的准确性有影响:
1、PH值对卡氏反应的影响:
因为卡氏反应的最大速率在PH值为5.5到8之间就已经达到了,超出这个范围时又会使滴定的结果不准确,所以在实际操作中PH值应控制在5.5到8以内。对强酸性或强碱性的样品要用缓冲剂控制PH值(用咪唑做碱性缓冲剂,用水杨酸做酸性缓冲剂)。
2、溶剂对卡氏反应的影响:
反应的化学计量数(水:碘的分子摩尔比)随溶剂的不同而改变。Eberius已经证明在反应系统中甲醇的含量大于或等于20%时,其比值为:1:1,假如你需要不含甲醇的溶剂(对酮或醛),还可以选择其它的醇。
3、卡氏反应中水分的影响:
J.cVerhoff 和 E.Barenrecht观察到化学计量数也会受样品中水分的含量的影响,当含水量超过1摩尔每升时,单位质量的水消耗的滴定剂的量会增加。但这并没有什么现实意义,因为通常水在溶剂中的含量很低。
※一般情况下,KF反应的速率由以下因素决定:
·样品的含水量,当样品的含水量大时,反应速率快,反之,反应速率减慢。例如:在滴定的开始,滴定剂加入的速率快,样品中的水很快和滴定剂反应。·试剂中二氧化硫的浓度,浓度和反应速率成正比,在单组分KF试剂中,二氧化硫稍微过量,在双组分KF试剂中二氧化硫则是远远过量的,所以,样品在双组分试剂中的反应速率一般比在单组分试剂中高2到4倍。
·碘的浓度。
·溶液的PH值,前已叙及。
二、卡氏法测定水分含量的发展:
1984年E.Scholz发现了一种用咪唑取代吡啶的新的KF试剂.这种试剂不仅代替了有毒、有刺激性气味的吡啶,并且它的反应速度更快,使滴定结果更准确,因为咪唑对PH值的缓冲空间更大. E.Scholz还对试剂的化学稳定性进行了研究,发现其它试剂能够改善试剂的稳定性,如:乙醇,2-丙醇,或甲氧基乙醇,能取代甲醇。这些发现产生了以下的卡氏反应方程式:
ROH +SO
2 +RN → (RNH).SO
3
R
(RNH).SO
3R +I
2
+H
2
O → (RHN).SO
4
R +2(RNH)I
E.Scholz 同样证明了甲基亚硫酸广泛地存在于滴定中的甲醇/二氧化硫/碘溶液中。在1988年A.Seubert借助于红外光谱从KF试剂中发现了甲基亚硫酸盐,独立确认了二甲基亚硫酸盐是卡氏发应的第二产物。
最近人们假设在极性溶剂中氧化型的分子不是I
2 和RN.I
2
而是I
2
的一部分
不成比例地反应生成了I-和RNI+,然后RNI+再作为氧化型分子进行其它的反应。
现在,人们常常应用多元溶剂来溶解以前在甲醇中不易溶解的样品,从而也就扩大了卡氏法测定水分的应用范围。例如:用正癸醇:甲酰胺:甲醇=8:2:1,来溶解测定奶酪的含水量,可以使得到的s值小于0.5%。
将传统的干燥失重法与卡氏法结合起来应用,使得测量范围得到极大的拓展,测量结果也更为准确。这种结合一般是在卡氏水分测定仪上引入加热炉,利用惰性气体将样品受热散发出来的水分带入反应容器中。但这种方法仍可能使得一些样品分解而生成水或其它能和卡氏液反应的物质,使得结果不准确,这时,人们又通过研究发现,特定环境中,这些误差的发生和时间存在线形关系,从而可以通过计算对结果进行校正。
三、[KF滴定法的一些优点]:
》卡氏法测定水分(包括结晶水)含量的范围是很大的,应用范围很宽,能满足现代测量要求。
》一般情况下滴定样品所用的时间只有2到5分钟,也就是说用的时间相当的少,它满足快速的要求。
》适宜条件下测定结果的重现性好。
》卡氏滴定仪可以在换样器或工作站的控制下自动工作。
》水分测定和滴定剂标定应在同样的溶剂条件下进行,使得结果更为准确。》本法在PH值为5.5到8之间就可得到理想结果。
》酸或碱性样品在缓冲液中也能进行测定。
四、[KF试剂]:
(一)分类:
1、单组份:卡尔·费休试剂可分为无吡啶(用咪唑来取代吡啶)和含吡啶两种。浓度有1~2mg/ml H2O、3~4mg/ml H2O、5~6mg/ml H2O三种,建议使用无吡啶型卡氏液。
2、双组份:滴定剂中含有碘和甲醇;溶剂中含有二氧化硫,咪唑和甲醇。
其特点是反应速度快,两种溶液分开储存时都很稳定,通常用的有两种:》用于测量含水量在1000ppm到100%的样品,其浓度为5mg/mL。
》用于测量含水量低于1000ppm的样品,其浓度为2mg/mL。
3、混合型:卡尔·费休试剂由滴定液(A液)和溶液(B液)组成,溶液(B液)用来溶解样品,滴定液(A液)用来测定含水量,也包括含吡啶和无吡啶型两种,常用滴定浓度有5~6mg/ml H2O、2~3mg/ml H2O两种.同单组份卡尔·费休试剂使用相同(使用前1:1混合放置24小时)。滴定液浓度下降比较快,开启后应尽快使用。
(二)、KF试剂浓度变化的原因:
》滴定剂的化学稳定性很低,其中的碘和二氧化硫都是很活泼的物质,容易和其它物质发生发应。
》滴定剂一有机会就会吸收空气中的水分而使自己的浓度降低,因为其中的甲醇吸水性极强。
》因为溶剂中90%的物质为甲醇或乙醇,所以KF试剂中醇的密度对温度的变化很敏感,温度的一点升高将引起试剂浓度的急剧下降,温度生高1摄氏度,可以使浓度下降0.1%。
五、[滴定剂的标定]:
在密封的棕色瓶中滴定剂的浓度一般变化很小,对单组分卡氏液其每周变化约0.01mg/mL,对双组分卡氏液来说则更小。但由于温度的变化对卡氏液有较大的影响,并且对滴定剂的储存并不是绝对密封的,所以建议在每次滴定前都要进行标定,并且经过一定的时间后,也应进行重新标定。标定的滴定剂的结果,受滴定剂和系统两方面的影响。
1、酒石酸二钠:其是KF试剂的滴定一级标准物,在正常条件下,该物质含有15.66%的水,很稳定而且不吸水也不失水。但是酒石酸二钠在甲醇中只能缓慢溶解且溶解度很小,所以使用前应把它研成很细的粉末,在滴定前应混合2~3分钟(保证完全溶解),每40ml甲醇可溶解140mg酒石酸二钠(室温)。注意经常更换溶剂。
2、用水标准品标定:精密称定水标准品1.0到1.5克,用反称量法确定其质量,滴定至终点。所用水标准品的量一般以消耗2到5毫升卡氏液较合适。
3、用去离子水标定:用去离子水标定滴定剂浓度需要大量的练习和精确的实验操作以获得重复的精确的结果。由于使用去离子水量非常小(10μl~20μl),偶然误差较大。因此推荐酒石酸二钠或水标准来标定滴定液的浓度。
#在使用注射器标定滴定剂浓度时应注意以下几点:
》注射器不能漏水,密封性要好;
》通过把水从注射器快进挤出的方法,除掉注射器中气泡;
》不要用手紧握注射器,注射器的温度要恒定,以免进样不准确。
》调整活塞到所要刻度,使注射器与视线垂直以便读数,用减重法确定加样量;
》确定水的体积后,擦掉针头上的残余水滴,但不能用滤纸,它会把水从针头中吸出,可以用不吸水的纸巾擦拭。
》进样中,将注射器的针头插入液面以下,避免将试剂打到电极上或玻璃杯壁上。
#安全维护:
A)卡尔·费休试剂具有腐蚀性,操作时加以注意,避免试剂溅洒在仪器
表面造成腐蚀。
B)标准磨口均应涂有硅脂,并经常转动。
C)卡尔·费休试剂对人体有较大的危害性,操作应在良好的通风条件下
进行,确保安全。
D)卡尔·费休废液要排入固定密封瓶中,按有害物质处理。不可敞口放
置或任意排入下水道以防污染。
E)发现硅胶变成红色或白色,则应更换,或将变色的硅胶放在105℃烘
箱中加温,待其还原成天蓝色后放置干燥管中冷至室温后再用。
六、[样品]:
(一)、取样:当取样用于水含量测定时,你必须小心,防止样品从空气中吸取水分,这是造成误差的最普遍的原因,如果由于吸水或脱水,使得水含量随着样品测量过程不断变化,你将得不到正确的含水量。
取样应注意以下几点:
》样品必须具有代表性,即要含有整个待测物的平均含水量。
》样品的取出和处理必须迅速,以最大程度减少空气中水分对样品中水分含量的影响。
》在非极性液体(例如油)中,水分吸附在容器壁上面,或漂浮于表面或沉于底部,在取样时,必须通过摇动等方式使其充分混合。
》对于高含水量的物质,水亦容易失去,其表面含水量往往比其内部低。 》吸湿性物质,如果吸湿性物质在空气中存放时间过长,其表面含水量往往比内部的高。
》含水量极低或高吸湿性的物质,样品的处理要迅速,所用的注射器和刮刀必须绝对干燥
(二)、供试品取样量:
可根据卡尔费休氏液浓度的大小和供试品含水量来决定,一般以取样量相当于消耗费休氏试液的体积为泵头总量的30%到70%的量为宜。取样量的大小对测量结果的重现性有较大影响,如下图:
测量含水量小于1000ppm 的样品:测定痕量水分对准确度要求不高,重复实验中相对于偏差在
1~5%,是可以接受的,如果想提高痕量水(10~1000ppm ),测定的准确度,应该使用低浓度的滴定剂(1~2mg ),并可参照下表所列出取样量:
测定含水量1000ppm~100%之间的样品,以取样量的消耗费休氏液(3~4mg/ml)2~3ml为宜。
(三).、进样的方法:
◎对液体样品,如:果汁,香水等,最好用注射器进样,其操作方法如下:》用注射器吸取一定量的样品,约相当于10毫克的水。
》将注射器置烧杯中一起一起放入电子天平中,按”tart”键归零。
》将样品注入反应容器中,容器的开口要尽量小,操作要尽量快。
》将注射器重新放入天平,用减重法确定加样量的多少。如下图:
◎对固体样品,如:药片,砂糖等,建议用称量舟进样,样品要彻底粉碎,操作要快,以防止空气中水分对样品的影响,其方法如下:
》将样品适量装入称量舟,放入电子天平中,按”tart”键归零。
》将样品倒入反应容器中,注意不要将样品撒到电极上或杯壁上了。
》将称量舟重新放到电子天平上,用减重法确定加入样品的质量。
如下图:
◎ 对粘稠的样品,如:油脂,果冻,化装品等最好也使用注射器进样,但
不要加针头。其它操作同液体样品。如图:
◎ 对气体样品,可以定量地将其溶解在适宜的溶剂中,再按液体样品进行
测定。也可以直接进行测量,但必须用流量计记录加样量,如下图:
七、溶剂:
有一些样品不溶于甲醇,要测定这些样品的含水量,就需要选择其它溶剂或配合使用多种溶剂。例如:
流量计
气体样品
气流控制阀
对不同溶解性的固体,要依不同样品的极性和溶解性选择溶剂,例如:
八、[ 滴定方法:] (一)、直接容量滴定法:
测量范围:按取样量的大小可以测量1毫克到100%范围内的含水量。 根据滴定容器大小的不同,可以在其中加入20到200毫升的甲醇。甲醇是含有水分的,所以我们要先用KF 试剂进行预滴定,让其达到一个稳定的值。然后再用这种“干燥”了的甲醇做工作介质和溶剂。将样品加入到“干燥”了的甲醇中,其滴定方法和预滴定的方法一样。样品的含水量可以通过KF 试剂的消耗量计算得到。当第一个样品滴定完之后,第二个样品可以直接加进去,反应杯中的溶液可以反复应用。当然,被测的样品相互之间不能发生反应。 算样品含量的公式为:
VKF(mL)*Titer[mg/mL]*100 样品重量(mg)
说明:VKF :卡氏液的消耗体积
Titer :滴定度
(二)、间接容量滴定法(回滴定法):
测量范围:按取样量的大小可以测量1毫克到100%范围内的含水量。
当用直接滴定法反应太慢时,我们用回滴定法。这种方法是在样品中加入过量的KF试剂,经过一个比较短的时间后,我们用含水量为5mg/mL的甲醇溶液回滴。但是,这种方法也有其不足处。第一,它需要更多的设备和更多的试剂,并且每种试剂都需要进行标定。比较此种方法的优缺点,我们可以总结出:除非必须使用,一般我们不选用它
九、[副反应]:
》活泼羰基化合物与甲醇作用可产生缩醛或缩酮和水,干扰水份测定。
\ ╱OCH3
C=O+2CH3OH →H2O + ==C
/ ╲OCH3
对于这类样品的测定,既使使用特殊的卡氏液,副反应仍会发生。建议不要使用大的进样量进行测定,并且每做完一个样品后要更换溶剂。
》甲醇,二氧化硫,有机碱和水可以发生加成反应:
CH3OH+SO2+NR+H2O → HC(OH)SO3HNR
所以,加入样品后,我们要尽快启动滴定,在此副反应发生之前就把样品滴定完全。
》有机酸与甲醇易起酯化反应。建议快速滴定并使用等量无水甲醇与吡啶为溶剂。
》I2能与易于被氧化的样品反应。如:抗坏血酸、过氧化物等,建议使用加热炉进行测定。用双组分KF试剂进行滴定,并在KF溶剂中加如过量的SO2,这样氧化反应在滴定前就已经反应完全,不会对水分测量造成影响。
》当甲醇不足时,化学计量数会发生改变。
》用双组分KF 试剂在零下40摄氏度进行滴定能够阻碍副反应的发生。 》如果所发生的副反应的化学计量数是一定的,则其造成的误差可在结果计算中排除。
十、[进样时的一些问题]:
》操作时间应尽量短,反应容器开口应尽量小。 》空白实验可以增加重现性。
》对液体样品,最好用注射器取样和进样。
》沸点低的样品也要用注射器取样,不立即进样时,针头还要用橡皮套密封。 》粉末样品最好选用称量舟取样和进样.
》糊状或粘稠的样品宜选用不装针头的注射器取样和进样.
》一般粘稠的样品不易取样,我们可以用螺旋形的金属丝取样,在烧杯中称量后,将金属丝一并放进反应容器中,再称烧杯,即可得到取样量.注意,金属丝的重量应预先称定.
》气体样品,可以先用固体或液体吸收后,再进行测量;也可以将气体直接通入反应容器.
》松散或有泡沫的样品应该和干燥的氮气或甲醇一起注入反应容器中.
十一、[滴定时的要点]:
》良好的混合是快速,准确完成实验的关键,混合一般受以下几方面的影响: ·搅拌速度:最合适的搅拌速度是在刚好可以看到一个小旋涡时。假如搅拌速度太慢,本次滴定可能很慢或造成滴定过量。如果有气泡产生,说明搅拌速度过快。如图2:
·滴定剂加入的位置。滴定剂应该加入到溶液流动最快的地方,
并且离电极应
尽量的远,如果离的太近的话,电极有可能一直能检测到还没反应的碘而使滴定剂加入的很慢。如图
3
·反应杯的形状:圆锥形的反应杯和短小的搅拌子可以有利于搅拌的效果。 》经过干燥的器具必须在干燥器中冷却至室温再用。
》滴定参数中最大加液量和最小加液量对滴定的过程有很大影响:
最大加液量设定的太高或太低都会使滴定时间变长,尽管最大加液量很高,但滴入的碘不能立即反应完全,因而滴定将时常被打断,滴定时间延长。 》假如滴定仪长时间不用,在里面的溶剂中加入一些卡氏液。
》假如样品的测量时间超过了5分钟,那么就应该考虑做空白实验。系统的漂移值一般在10微升以内。
十二、[滴定中易出现的问题与可能原因和解决途径]: 如下表:
附录:
一、K F试剂的配制:
下面介绍的是含吡啶KF试剂的配制:
1、试剂的配制时对试剂的要求很高,特别是水分应严格控制在0.1%以下。
因此试剂必须预先出除去水分。
》碘:将升华碘于硫酸干燥器中干燥48小时。
》二氧化硫:可用钢瓶二氧化硫,通过硫酸洗气瓶后,直接应用。或用硫酸或亚硫酸钠(或亚硫酸氢钠)制取。
》无水吡啶:取吡啶200mL,加苯40mL,混合后,在水浴上蒸馏,收集115—116摄氏度的馏出物,密封,储存备用。
》无水甲醇:于2000毫升的圆底烧瓶中,加甲醇约200毫升,表面光洁的镁条15克和二氯化汞0.4克(或碘片0.5可作为脱水反应的催化剂),在沙浴上回流至金属镁转变为白色絮状的甲醇镁,再加入1000毫升,甲醇,继续回流至镁条全部溶解,然后进行蒸馏,收集64—65摄氏度的馏出物,密封,储存备用。(其含水量应在0.05%以下)。
回流及蒸馏时使用的仪器应预先干燥,与大气相通的部分应以硅胶干燥管相连。
2、滴定剂的配制:
取无水吡啶133毫升,碘42.33克置磨口玻璃瓶中振荡至碘完全溶解,加无水甲醇333毫升,称定重量,将烧瓶置冰浴中冷却,通入经硫酸脱水的二氧
化硫,至重量增至32克,摇匀,即得。
该储备液应置棕色瓶中,于暗处放置24小时后标定。通常是将滴定剂配成1毫升相当于3到6毫克水的溶液,但溶液不稳定,随时间的增长浓度逐渐降低,其原因是碘、二氧化硫、甲醇、吡啶四组分易发生副反应,当浓度降至2.5毫克每毫升以下,使滴定终点变化不敏锐。为克服此问题,采用甲液和乙液分开配置的方法(甲液:63克碘,加366毫升无水甲醇,振荡至碘溶解即得;乙掖:100毫升无水吡啶,通二氧化硫至重量增至32克即得。使用时甲液做滴定剂,乙液做溶剂)
卡尔费休水分测定的原理介绍
卡尔-费休库仑法水分测定仪测试原理 一、引言 测定物质中水分含量的方法很多,现对常用的几种方法就其经济性、准确性做简单的对比分析。 1干燥法优点:仪器价格低廉。缺点:精度差;仅能测定至10-3级;在干燥蒸馏过程中挥发性物质亦被蒸发,不能测定物质中水分含量的真值,试验时间过长。 2光谱、色谱法优点:可以测至10-6级。缺点:仪器价格昂贵;环境要求高;准备时间长(几个小时);不利于产品的过程控制。 3卡氏容量法优点:测试品种多,相对于卡氏库仑法有些特殊物质在特定试剂条件下可以测定(如酮类、醛类)。缺点:在最佳状态下仅能测至10-4级;耗材(试剂)大;测定时间偏长。 4卡氏库仑法优点:仪器价格中等;耗材少;可以测定至10-6级;时间短,一般物质在掌握好进样量的前提下使用淄博华坤电子仪器有限公司DT-30系列全自动(以下简称华坤仪器)60秒内即可完成测定,是过程控制和仲裁判定的最佳方法。缺点:有些具有副反应的物质如酮类、醛类不能测定。 对于多数物质而言,选择卡氏库仑法仪器做为质量控制测定水分含量是一种即经济又准确的方法。 二、卡氏库仑法仪器原理 1.1935年卡尔-费休(KarlFischer)首先提出了利用容量分析测定水分的方法,这种方法即是GB6283《化工产品中水分含量的测定》中的目测法。目测法只能测定无色液体物质的水分。后来,又发展为电量法。随着科技的发展,继而又将库仑计与容量法结合起来推出库仑法。这种方法即是GB7600《运行中变压器油水分含量测定法(库仑法)》中的测试方法。现在的分类目测法和电量法统称为容量法。卡氏方法分为卡氏容量法和卡氏库仑法两大方法。两种方法都被许多国家定为标准分析方法,用来校正其他分析方法和测量仪器。 2.卡氏库仑法测定水分是一种电化学方法。其原理是仪器的电解池中的卡氏试剂达到平衡时注入含水的样品,水参与碘、的氧化还原反应,在吡啶和甲醇存在的情况下,生成氢碘酸吡啶和甲基硫酸吡啶,消耗了的碘在阳极电解产生,从而使氧化还原反应不断进行,直至水分全部耗尽为止,依据法拉第电解定律,电解产生碘是同电解时耗用的电量成正比例关系的,其反应如下: H2O+I2+SO2+3C5H5N 2C5H5N HI+C5H5N SO3 C5H5N SO3+CH3OH C5H5N HSO4CH3
卡尔费休水分测定原理与测定方法
卡尔费休水分测定原理 与测定方法 文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]
卡尔费休水分测定原理与测定方法 卡尔·费休是水分测定方法中最为专业和准确的方法,经过多年的改进,提高了准确度,扩大了测量范围,已被列为多种物质水分测定的标准方法。 费休法属碘量法,其基本原理是利用碘氧化二氧化硫时,需要-定量的水参加反应: 12十S02十2H2O=2HI十H2SO4 (1) 上述反应是可逆的。为了使反应向正方向移动并定量进行,须加入碱性物质。实验证明,吡啶是最适宜的试剂,同时吡啶还具有可与碘和二氧化硫结合以降低二者蒸气压的作用。因此,试剂必须加进甲醇或另一种含活泼OH基的溶剂,使硫酸酐吡啶转变成稳定的甲基硫酸氢吡啶。 试剂的理论摩尔比为碘:二氧化硫:吡啶,甲醇=1:1:3:1。 测定技术费休试剂的配制和标定通常,配制费休试剂时只有碘应严格依照化学计量,其它组分则是过量的,一般采用的摩尔比为碘:二氧化硫:吡啶:甲醇=1:3:10:50。配制费休试剂所用各物质必须严格控制其含水量,一般不得超过0.1%,若进行微量分析时,不应超过数个ppm。
配制步骤取无水吡啶133mL与碘42。33g,置入具塞棕色试剂瓶中,振摇至碘全部溶解后,加入无水甲醇333ml。难确称量试剂瓶重,通入经浓硫酸脱水的二氧化硫气体至试剂瓶增重32g,将瓶塞塞牢、摇匀,于暗处放置48h后标定。依此配制的费休试剂的滴定度约为含水3-5g/mL。当使用专用试剂瓶时,可在通二氧化硫至增重32g时,把液面的位置作一标记,以后每次配制,只需取一定量的各物质置入试剂瓶中,通入二氧化硫气体,使试剂溶液掖面升高至标记处即可,这样可省去费时的称重操作。为使费休试剂稳定,有另一种配制方法,即先配成二组溶浓,在使用前混合。一组为碘和甲醇溶液I;另一组为二氧化硫和吡啶溶液II。 溶液I:取碘63p,置入试剂瓶中,加366mL无水甲醉,括至碘全部溶解。 溶液II:取100mL无水吡啶,置入试剂瓶小,准确称量,然后通入干燥的二氧化硫气体,使其增重32g。 新配制的费体试剂很不稳定,随放置时间增加,浓度逐渐降低。在前二、三日内,淌定皮有显着下降,以后降低援慢,一周以后,滴定度每日约减少1%,之后则变化更趋缓慢。滴定度开始迅速下降的原因主要是试剂中各组分所含残存水分的作用,随后滴定度缓慢下降的原因则是副反应的影响。
卡尔费休氏水分测定法
1.前言 卡尔·费休水分测定法是以甲醇为介质以卡氏液为滴定液进行样品水分测量的一种方法。此方法操作简单,准确度高,广泛应用于医药、石油、化工、农药、染料、粮食等领域。尤其适用于遇热易被破坏的样品。 一般情况下,产品中水分的含量异常会严重地影响产品的质量和使用效果。例如:药品、日用品、食品中所含水分过高会影响其稳定性、理化性状、及使用效果和保质期,化学试剂中所含水分过多会影响其化学特性等。因此,对产品中的水分进行检查并控制其限度非常重要。以前,人们普遍应用加热干燥法,此种方法不但繁琐、费时,而且系统误差较大不能满足现代化生产中对产品检验的需要。 1935年,Karl Fischer发现了一种用滴定法测定含水量从1ppm到100%的样品的方法。该方法测定水分含量的用途广泛、结果准确可靠、重复性好,能够最大限度的保证分析结果的准确性。而且该方法滴定时间短,一般情况下测定一个样品仅需2到5分钟,适应现代化生产中快速检测的要求。因而卡尔·费休氏水分测定法得到了各界的一致认可,现在已成为国际上通用的经典水分测定法。 2.基本原理 卡尔·费休水分测定法是一种非水溶液中的氧化还原滴定法,其滴定的基本原理是碘氧化二氧化硫时需要一定量的
水参与反应,化学反应方程式如下: I2+SO2+2H2O → 2HI+H2SO4 (2-1) I2+SO2+H2O+3RN+R1OH → 2RNHI+RNSO4R1 (2-2) 卡氏试剂中含有分子碘而呈深褐色,当含有水的试剂或样品加入后,由于化学反应,生成甲基硫酸化合物(RNSO4R1)而使溶液变成黄色,由此可用目测法判断终点,即由浅黄色变成橙色.但是目测法误差教大而且在测定有颜色的物质时会遇到麻烦。国家标准大都规定用“永停法”来判定卡氏反应的终点,其原理为:在反应溶液中插入双铂电极,在两电极之间加上一固定的电压,若溶剂中有水存在时,则溶液中不会有电对存在,溶液不导电,当反应到达终点时,溶液中存在I2和I-电对,即: 2I-= I2+2e (2-3) 因此,溶液的导电性会突然增大,在设有外加电压的双铂电极之间的电流值突然增大,并且稳定在我们事先设定一个阈值上面,即可判断到了滴定终点,机器便会自动停止滴定,从而通过消耗KF试剂的体积计算出样品的含水量。 3.溶剂的选择 3.1常用溶剂 由于此法是测量样品中水分含量,因此需要使用一种非水物质作为溶剂,使样品溶解。通常情况下,甲醇是比较理想的溶剂。此反应是可逆反应,为了使反应向右进行,反应
卡尔费休水分测定仪自校规程
卡尔费休水分测定仪校准规程 一编制目的 在仪器设备两次检定之间,进行期间核查,验证设备是否保持校准时的状态,确保检验结果的准确性和有效性。 二检查项目 外观、仪器示值重复性、仪器示值误差等3 项。 三检定条件 1环境条件 环境温度:10℃~30℃ 相对湿度:≤80% 无尘,无腐蚀性气体,无影像测量的强烈震动、电磁干扰 2 标准物质 2.1 水-甲醇标准物质(水含量1mg/g) 2.2 蒸馏水 四检定依据 卡尔费休库仑法水分测定仪说明书及国家计量检定规程JJG1044-2008 五检定方法 1仪器外观 1.1名牌完整,标明仪器名称、型号、生产厂家、序列号、出产日期等。 1.2一起不应有影响正常工作的机械外伤。 1.3各紧固件均应紧固、工作正常。 1.4一起的电解池系统应密封良好,电极、干燥管、磨塞拆装顺利。 2 仪器示值误差检定 选取10、100、1000、5000四个点的左右进行测定,为了减小测量误差,不同的点采用不同的标准物质和微量进样器。测量时首先采用所需微量进样器抽取标准物质(或蒸馏水)至所需刻度,在分析天平上称量进样针的质量W1然后进样,进样器针头必须进入到电解液
面一下,全部注入试样后拔出,擦干进样器粘的电解液称量进样针质量W2,分别对不同含水量的标准物质测量三次,检定点的测量值与标准值之差的平均值即为仪器的示值误差。不同的检定点采用不同的微量进样器: 示值误差计算公式: 式中:Δx-----示值误差,μg; xi------检定点的测量值,μg; xs------检定点的标准值,μg。 3 仪器示值重复性检定 当仪器稳定后,用10μl微量进样器注入10μl水-甲醇标准物质。连续进样6次,记录测量值,定量重复性以含水量测量结果的相对标准偏差RSD表示: 六评定标准 所测得仪器的示值误差不超过±(5%检定点)μg;100μg点的测量值的相对偏差不大于3%;外观正常。 七核查周期 在仪器设备两次检定之间,一般每隔六个月核查一次。
卡尔·费休水分测定原理与技术
卡尔·费休水分测定原理与技术 卡尔·费休法简称费休法,是1935年卡尔·费休(KarlFjscher)提出的测定水分的容量分拆方法。费休法是测定物质水分的各类化学方法中,对水最为专一、最为准确的方法。虽属经典方法但经过近年改进,提高了准确度,扩大了测量范围,已被列为许多物质中水分测定的标准方法。 费休法属碘量法,其基本原理是利用碘氧化二氧化硫时,需要—定量的水参加反应: 12十S02十2H2O=2HI十H2SO4 (1)上述反应是可逆的。为了使反应向正方向移动并定量进行,须加入碱性物质。实验证明,吡啶是最适宜的试剂,同时吡啶还具有可与碘和二氧化硫结合以降低二者蒸气压的作用。因此,试剂必须加进甲醇或另一种含活泼OH基的溶剂,使硫酸酐吡啶转变成稳定的甲基硫酸氢吡啶。试剂的理论摩尔比为碘:二氧化硫:吡啶,甲醇=1:1:3:1。测定技术 费休试剂的配制和标定通常,配制费休试剂时只有碘应严格依照化学计量,其它组分则是过量的,一般采用的摩尔比为碘:二氧化硫:吡啶:甲醇=1:3:10:50。配制费休试剂所用各物质必须严格控制其含水量,一般不得超过0.1%,若进行微量分析时,不应超过数个ppm。配制步骤 取无水吡啶133mL与碘42.33g,置入具塞棕色试剂瓶中,振摇至碘全部溶解后,加入无水甲醇333ml。难确称量试剂瓶重,通入经浓硫酸脱水的二氧化硫气体至试剂瓶增重32g,将瓶塞塞牢、摇匀,于暗处放置48h后标定。依此配制的费休试剂的滴定度约为含水3—5g/mL。 当使用专用试剂瓶时,可在通二氧化硫至增重32g时,把液面的位置作一标记,以后每次配制,只需取一定量的各物质置入试剂瓶中,通入二氧化硫气体,使试剂溶液掖面升高至标记处即可,这样可省去费时的称重操作。为使费休试剂稳定,有另一种配制方法,即先配成二组溶浓,在使用前混合。一组为碘和甲醇溶液I;另一组为二氧化硫和吡啶溶液II。溶液I:取碘63p,置入试剂瓶中,加366mL无水甲醉,括至碘全部溶解。溶液II:取100mL无水吡啶,置入试剂瓶小,准确称量,然后通入干燥的二氧化硫气体,使其增重32g。新配制的费体试剂很不稳定,随放置时间增加,浓度逐渐降低。在前二、三日内,淌定皮有显著下降,以后降低援慢,一周以后,滴定度每日约减少1%,之后则变化更趋缓慢。滴定度开始迅速下降的原因主要是试剂中各组分所含残存水分的作用,随后滴定度缓慢下降的原因则是副反应的影响。因此,费你试剂配制以后,应放置一用以上,用前标定。 费休试剂的标定方法一般有纯水标定、含水甲酵标准溶液标定和稳定的结晶水合物标定三种。 (1) 纯水标定法 取数个干燥具塞滴定瓶,加入25mL无水甲醇,用费休试剂滴定至终点。这时滴定瓶内呈无水状态,随即用注射取样器迅速注入已准确称量的纯水30.00mg,在剧烈搅拌下,以费休试剂滴定至终点,求得每毫升费体试剂相当于水的质量M^. (2)含水甲醇标准溶液标定法(i)含水甲醇标准溶液的配制含水中醇标准溶液是用无水甲醉加入 定还的燕螺水配成的。无水甲醇应经过金届镁粉二次处理,然后蒸馏,把蒸出的甲醇立即用来配制。 取充分干燥的500mL存虽瓶,在瓶中加入无水甲醇400mL,用注射器(或小滴瓶)减员法准确称设蒸馏水0.2500,注入容量瓶中,迅速塞牢瓶塞,振荡均匀后,用元水甲醇稀释至刻度。即使经过多次处理的甲醇,也难免含有微量水分,因此必须对此值予以校正。
卡尔费休水分测定仪使用方法
卡尔费休水分测定仪使用方法 目前在化工、制药等行业中,对原材料和部分成品中的游离水或结晶水的检测普遍采用卡尔费休水份测定仪。在检测了众多进口的、国产的各类型仪器以及各行业检测人员中,就卡尔-费休水分测定仪使用中存在的有关问题提出交流。 1、卡尔费休水份测定仪安全防护目前在化工、制药等行业中,对原材料和部分成品中的游离水或结晶水的检测普遍采用卡尔费休水份测定仪。在检测了众多进口的、国产的各类型仪器以及各行业检测人员中,就卡尔-费休水分测定仪使用中存在的有关问题提出交流。 1、卡尔费休水份测定仪安全防护 卡尔-费休试剂主要由碘、二氧化硫、吡啶和甲醇组成的溶液。其中的二氧化硫与吡啶挥发性极强,对人体的危害很大,操作时应在良好的通风条件下进行。尤其是在换试剂时,要注意排风,以防止有害气体吸人体内。并戴上防护眼镜与乳胶手套,避免有害试剂溅洒眼睛和手上,一旦发生试剂溅洒眼睛和手上要立即用流动水冲洗,严重者即送医院治疗。 但实际情况是有些操作人员对该试剂的危害性认识不足,在无任何防护措施的条件下,将试剂随意倒进倒出,满屋异味而浑然不顾,自我
保护意识问题有待加强。 2、卡尔费休水份测定仪试剂的应用 卡尔-费休试剂对新鲜度要求很高,购买卡尔-费休试剂要注意生产日期,要根据使用量即买即用。并要避光保存,才能延长保存期。 目前有不含吡啶的卡尔-费休试剂问世,解决了含吡啶试剂有刺鼻异味的问题,但是测定中发现含吡啶的卡尔-费休试剂终点的突变较明显,试剂到终点时的颜色是微棕黄色,根据经验凭肉眼能预测到终点即将到来,而不含吡啶的卡尔-费休试剂终点的突变不明显,试剂到终点时的颜色是深棕色。 两者的选择可根据试样的含水量以及对样品检测准确度要求的不同而定。对含水量低、检测准确度要求高的样品建议选用含吡啶的卡尔-费休试剂。反之则用不含吡啶的卡尔-费休试剂。 无水甲醇作为样品的溶解剂,适用范围很广。一般的有机化合物、饱和或不饱和的碳氢化合物以及一般的无机化合物、酸性氧化物、部分有机和无机的盐都能适用。但是部分酮和醛类样品不能用甲醇反应。如发现反应不能中断,无终点,反应连续进行时,应该考虑到是否有副反应这个问题。当产生副反应时,其实只需要几分钟的反应,却一
费休氏水分测定法
费休氏水分测定法 1 简述 费休氏水分测定法是利用碘在吡啶和甲醇溶液中氧化二氧化硫时需要定量的水参加反应的原理来测定样品中的水分含量,本法可适用任何可溶解于费休氏试液但不与费休氏试液起化学反应的药品的水分测定,故对遇热易破坏的样品仍能用本法测定。 基本反应为I2+SO2+H2O→2HI+SO3 上述反应是可逆的,但有吡啶存在时,无水吡啶能定量地吸收HI和SO3,生成氢碘酸吡啶和亚硫酸吡啶。 C5H5N·I2+C5H5N·SO2+C5H5N+H2O →2C5H5N·HI+C5H5N·SO3亚硫酸吡啶亦不稳定,能与水发生副反应,消耗一部分水,因而干扰测定。 C5H5N·SO3+H2O → C5H5NHSO4H 加入无水甲醇可使亚硫酸吡啶转变成稳定的甲基硫酸氢吡啶,避免了上述副反应的发生。 C5H5N·SO3+CH3OH → C5H5NHSO4CH3 滴定的总反应为C5H5N·I2+C5H5N·SO2+C5H5N+CH3OH+H2O →2C5H5N·HI+ C5H5NHSO4CH3 (1) 由上式可知,吡啶与甲醇不仅作为溶剂,而且参与滴定反应,此外,吡啶还可以与二氧化硫结合降低其蒸气压,使其在溶液中保持比较稳定的浓度。1.1 容量滴定法 根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理;由滴定溶液颜色变化(由淡黄色变为红棕色)或用永停滴定法指示终点;利用纯水首先标定出每1ml费休氏试液相当于水的重量(mg);再根据样品与费休氏试液的反应计算出样品中的水分含量。 1.2 库仑滴定法 与容量滴定法相同,库仑滴定法也是根据碘和二氧化硫在吡啶(有些型号仪器改用无臭味的有机胺代替吡啶)和甲醇溶液中能与水起定量反应的原理来进行测定的。
卡尔费休水分测定原理与测定方法 (2)
卡尔费休水分测定原理与测定方法 卡尔·费休是水分测定方法中最为专业和准确的方法,经过多年的改进,提高了准确度,扩大了测量范围,已被列为多种物质水分测定的标准方法。 费休法属碘量法,其基本原理是利用碘氧化二氧化硫时,需要-定量的水参加反应:12十S02十2H2O=2HI十H2SO4(1) 上述反应是可逆的。为了使反应向正方向移动并定量进行,须加入碱性物质。实验证明,吡啶是最适宜的试剂,同时吡啶还具有可与碘和二氧化硫结合以降低二者蒸气压的作用。因此,试剂必须加进甲醇或另一种含活泼OH基的溶剂,使硫酸酐吡啶转变成稳定的甲基硫酸氢吡啶。 试剂的理论摩尔比为碘:二氧化硫:吡啶,甲醇=1:1:3:1。 测定技术费休试剂的配制和标定通常,配制费休试剂时只有碘应严格依照化学计量,其它组分则是过量的,一般采用的摩尔比为碘:二氧化硫:吡啶:甲醇=1:3:10:50。配制费休试剂所用各物质必须严格控制其含水量,一般不得超过0.1%,若进行微量分析时,不应超过数个ppm。 配制步骤取无水吡啶133mL与碘42。33g,置入具塞棕色试剂瓶中,振摇至碘全部溶解后,加入无水甲醇333ml。难确称量试剂瓶重,通入经浓硫酸脱水的二氧化硫气体至试剂瓶增重32g,将瓶塞塞牢、摇匀,于暗处放置48h后标定。依此配制的费休试剂的滴定度约为含水3-5g/mL。当使用专用试剂瓶时,可在通二氧化硫至增重32g时,把液面的位置作一标记,以后每次配制,只需取一定量的各物质置入试剂瓶中,通入二氧化硫气体,使试剂溶液掖面升高至标记处即可,这样可省去费时的称重操作。为使费休试剂稳定,有另一种配制方法,即先配成二组溶浓,在使用前混合。一组为碘和甲醇溶液I;另一组为二氧化硫和吡啶溶液II。 溶液I:取碘63p,置入试剂瓶中,加366mL无水甲醉,括至碘全部溶解。 溶液II:取100mL无水吡啶,置入试剂瓶小,准确称量,然后通入干燥的二氧化硫气体,使其增重32g。 新配制的费体试剂很不稳定,随放置时间增加,浓度逐渐降低。在前二、三日内,淌定皮有显着下降,以后降低援慢,一周以后,滴定度每日约减少1%,之后则变化更趋缓慢。滴定度开始迅速下降的原因主要是试剂中各组分所含残存水分的作用,随后滴定度缓慢下降的原因则是副反应的影响。 因此,费你试剂配制以后,应放置一用以上,用前标定。 费休试剂的标定方法一般有纯水标定、含水甲酵标准溶液标定和稳定的结晶水合物标定三种。
卡尔费休水分测定仪性能确认
KARL FISHER APPARATUS AND ITS PERFORMANCE VERIFICATION R ICK J AIRAM, R OBERT M ETCALFE, P H.D., AND Y U-H ONG T SE, P H.D. GlaxoSmithKline Canada, Inc. 14.1 INTRODUCTION The Karl Fisher titration is one of the most common and most sensitive methods used in the analytical laboratory. The titrimetric determination of water is based on the quantitative reaction of water with an anhydrous solution of sulfur dioxide and iodine in the presence of a buffer that reacts with hydrogen ions. This titration is a two-stage process: SO2 + MeOH + RN→(RNH)SO3Me (14.1) (RNH)SO3Me + I2 + H2O + 2RN→(RNH)SO4Me + 2(RNH)I (14.2) where RN is a base, typically pyridine or imidazole. Reaction (14.1) reaches equilibrium and produces methylsulfite as the reaction intermediate. Reaction (14.2) the redox process, is very rapid. From equation (14.2) the direct relation between water and iodine consumption can be seen, which enables the amount of water to be determined. Complete esterification of the sulfur dioxide with the alcohol, and the ability of the base to neutralize the methyl sulfurous acid, are the key requirements for the reaction above to be stoichiometric. Analytical Method Validation and Instrument Performance Verification, Edited by Chung Chow Chan, Herman Lam, Y. C. Lee, and Xue-Ming Zhang ISBN 0-471-25953-5 Copyright 2004 John Wiley & Sons, Inc. 221 222 KARL FISHER APPARATUS AND ITS PERFORMANCE VERIFICATION Pyridine was used in the beginning of the development of the method. The reaction was slow and the endpoint unstable because of weak basicity of pyridine. The pyridine system buffers at about pH 4. A stronger base, imidazole, has been used to replace pyridine since it gives a faster response and has the advantages of lower toxicity and decreased odor. The optimal pH range for the SO2 imidazole buffer is at pH 6. It is important that the pH of the Karl Fisher reaction be maintained within the range 5 to 7. Outside this recommended pH range, the endpoint may not be reached. There are two types of Karl Fisher titrations: volumetric and coulometric. Volumetric titration is used to determine relatively large amounts of water (1 to 100 μg) and can be performed using the single- or two-component system. Most commercially available titrators make use of the one-component titrant, which can be purchased in two strengths; 2 mg of water per milliliter of titrant and the 5 mg of water per milliliter of titrant. The choice of concentration is
KF型卡尔费休氏水分测定仪操作规程精编版
K F型卡尔费休氏水分测定仪操作规程 公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-
一.目的 为规范KF-1型卡尔费休氏水分测定仪操作程序和方法,特制订本操作规程。二.适用范围 适用于化验室KF-1型卡尔费休氏水分测定仪的使用。 三.责任 化验员有责任按本操作规程正确操作,以提供准确的实验数据。 四.内容 4.1操作程序 4.1.1 后,接通电源,指示灯亮。 4.1.2滴定溶剂甲醇中的水分 μA ,然后将校正开关拨到测定档。 费休液滴定,滴定至电流计产生较大的偏转(38μA)并保持1min不变为终点(不需记录卡尔费休液体积)。此时呈无水状态,再按下法标定卡尔.费休试剂。 费休液达到滴定管满刻度。 μl(约10mg)蒸馏水通过加料口注入反应瓶中(切忌将水溅到反应瓶壁上)。 费休液滴定,当滴定至指针偏转较大时,此时应小心滴定,并注意观察指针,当指针产生最大的偏转(38μA)并保持1min不变,即可认为达到滴定终点。
费休液体积(ml);按照上述方法测定两次,计算两次消耗卡尔费休液体积(ml)的平均值A,计算每ml卡尔费休液相当于水的毫克数: 用双链球加压使卡尔.费休达到滴定管满刻度。 用注射器取5ml样品后进行称量G1,然后注射于反应瓶中(切忌不要滴到瓶壁上),开始进行滴定。记下样品所消耗卡尔费休液体积(ml)A;称注射器的重量G2;则样品重量为G(mg)=(G1-G2)。并按下式计算: 式中: A-样品所消耗的卡尔费休液体积(ml) F-每ml卡尔费休液相当于水的毫克数(mg); G-样品重量(mg)。 每个试样测试两次,以两次测试结果的平均值作为试验结果。 4.2维修保养 4.2.1 卡尔费休试剂具有腐蚀性,操作时应加以注意,避免试液溅洒仪器表面造成腐蚀。 4.2.2 标准磨口均应涂有硅酯,并经常转动。 4.2.3 卡尔费休试剂对人体有不同程度的危害性,操作时应在良好通风条件下进行,确保安全。 4.2.4 卡尔费休废液要排入固定密封瓶中,按有害物处理。不可敞口放置或任意排入下水道以防污染环境。
卡尔费休氏水分测定法在药品检验中的应用
卡尔·费休氏水分测定法在药品检验中的应用 随着科学研究的发展和生产技术的进步,水分的定量分析已被列为药品检验的基本项目之一,作为药品一项重要的质量指标。一般情况下,药品中水分的含量异常会严重地影响药品的质量和疗效。特别是抗生素类药品中所含水分过高会严重影响其稳定性、理化性状、及有效期和使用效果, 甚至于服用这些药品会严重危害广大人民群众的身体健康和生命安全。因此,对药品的水分进行检查并严格控制其限度非常重要。 以前,人们普遍采用加热干燥法(即干燥失重法)检查药品中的水分,此种方法不但繁琐、费时、系统误差大,而且遇热不稳定的药品不能适用于此方法,故不能满足现代药品检验的需要。1935年,Karl Fischer发现了一种用滴定法测定含水量从1ppm到100%的样品的方法(卡尔·费休氏水分测定法)。该法以甲醇为介质,以卡尔费休液为滴定液进行样品水分测定的一种方法。此方法测定水分含量的用途广泛、操作简单、准确度高、重复性好,能够最大限度的保证分析结果的准确性。而且该方法滴定时间短,一般情况下测定一个样品仅需2到6分钟,尤其适用于遇热易被破坏的药品。中国、英国、美国、日本四国药典均收载了卡尔·费休氏水分测定法(容量滴定法和库仑滴定法),现在已成为国际上通用的经典水分测定法。 一基本原理 卡尔·费休氏水分测定法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的一种非水溶液中氧化还原滴定法,其滴定的基本原理是仪器的电解池中的卡尔费休试剂达到平衡时注入含水的样品,水参与碘、二氧化硫的氧化还原反应,在吡啶和甲醇存在的情况下,生成氢碘酸吡啶和甲基硫酸吡啶,消耗了的碘在阳极电解产生,从而使氧化还原反应不断进行,直至水分全部耗尽为止,依据法拉第电解定律,电解产生碘是同电解时耗用的电量成正比例关系的,其化学反应方程式如下: ①H2O+I2+SO2+3C5H5N→2C5H5N·HI+C5H5N·SO3(不稳定) ②C5H5N·SO3+CH3OH→C5H5N·HSO4CH3(稳定) 卡尔费休试剂中含有分子碘而呈深褐色,当含有水的试剂或样品加入后,由于化学反应,生成甲基硫酸吡啶(C5H5N·HSO4CH3)而使溶液变成黄色,可用目测法判断终点(即由浅黄色变成橙色)。或用“永停滴定法”来指示卡氏反应的终点,其原理为:在反应溶液中插入双铂电极,在两电极之间加上一固定的电压,若溶剂中有水存在时,则溶液中不会有电对存在,溶液不导电;当反应到达终点时,溶液中存在I2和I-电对,在电解过程中,电极反应如下: 阳极: 2I--2e→I2 阴极: ① I2+2e→2I- ② 2H++2e→H2 因此,溶液的导电性会突然增大,在设有外加电压的双铂电极之间的电流值突然增大,并且稳定在我们事先设定一个阈值上面,即可判断到了滴定终点,仪器便会自动停止滴定,从而通过消耗卡尔费休试剂的体积计算出样品的含水量。按照上述原理科研人员研制了卡尔·费休氏水分测定仪,近年来在国内市场中较活跃的进口卡尔·费休氏水分测定仪有法国雷氏、瑞士万通、德国梅特勒-托利多、德国SCHOTT、日本京都电子;国产卡尔·费休氏水分测定仪主要有海淀潮声、北京先驱威锋等。目测法和永停滴定法两种方法均被《中国药典》(2005年版)收载。但是目测法误差较大而且在测定有颜色的物质时会遇到麻烦,故该法不宜使用。卡尔·费休氏水分测定仪操作简便、灵敏度高、再现性好,并能连续测定,自动
卡尔费休水分测定仪期间核查规程
第 1 页 共 2 页 名称:旋光仪期间核查规程 实施日期 一 编制目的 在仪器设备两次检定之间,进行期间核查,验证设备是否保持校准时的状态,确保检验结果的准确性和有效性。 二 检查项目 外观、仪器示值重复性、仪器示值误差等 3 项。 三 检定条件 1环境条件 环境温度:10℃~30℃ 相对湿度:≤80% 无尘,无腐蚀性气体,无影像测量的强烈震动、电磁干扰 2 标准物质 2.1 水-甲醇标准物质(水含量1mg/g ) 2.2 蒸馏水 四 检定依据 卡尔费休库仑法水分测定仪说明书及国家计量检定规程JJG1044-2008 五 检定方法 1仪器外观 1.1名牌完整,标明仪器名称、型号、生产厂家、序列号、出产日期等。 1.2一起不应有影响正常工作的机械外伤。 1.3各紧固件均应紧固、工作正常。 1.4一起的电解池系统应密封良好,电极、干燥管、磨塞拆装顺利。 2 仪器示值误差检定 选取10、100、1000、5000四个点的左右进行测定,为了减小测量误差,不同的点采用不同的标准物质和微量进样器。测量时首先采用所需微量进样器抽取标准物质(或蒸馏水)至所需刻度,在分析天平上称量进样针的质量W 1然后进样,进样器针头必须进入到电解液面一下,全部注入试样后拔出,擦干进样器粘的电解液称量进样针质量W 2,分别对不同含水量的标准物质测量三次,检定点的测量值与标准值之差的平均值即为仪器的示值误差。 不同的检定点采用不同的微量进样器: 含水量检定点 标准物质 采用的微量进样器 (10-1000)μg 1mg/g 水-甲醇 10μl 、100μl 、1ml (1000-5000)μg 蒸馏水 10μl 示值误差计算公式: ∑=-=?3 1 )(31i s i x x x
卡尔-费休水分测定操作规程(最终版)20151209-上传
目的:建立915 KF Ti-Touch 卡尔-费休水分仪的使用、维护、保养标准操作规程,规范水分测定法操作,保证检验的质量。 范围:本规程规定了万通915 KF Ti-Touch 卡氏水分测定仪的使用方法及操作要求,适用于费休氏法(第一法)测定样品的水分。 职责:质量研究部负责本文件的起草和实施。 检验依据:《中国药典》2015年版四部通则0832。 内容: 1、技术参数 1.1 测量分辨率:0.1 mV / 0.1μA ; 1.2 测量精确度:±0.2 mV; 1.3 滴定管加液误差(10mL ):± 20μL (0.2 %,优于ISO/ EN/ DIN 的标准要求0.3%); 1.4水分测量范围:10ppm 到100%; 1.5滴定管加液分辨率:1/10000或1/20000(可选); 1.6对话语言: 中文,英语,德语,西班牙语,法语; 1.7 温度探头:Pt1000或NTC ; 2、操作方法 2.1滴定前准备 2.1.1确认卡尔.费休氏试液和无水甲醇充足,仪器连接完好后,打开电源开关。 2.1.2必要时排空滴定杯,在滴定杯中加入溶剂,直至甲醇基本浸没电极铂金柱。 2.2滴定液标定 2.2.1待仪器自检结束后,点击界面上BD ,仪器会自动平衡。 文件名称:卡尔-费休水分测定法操作规程 文件编码 SOP-QR-001-00 起 草 人 日 期 颁发部门 质量研究 部 审 核 人 日 期 生效日期 批 准 人 日 期 颁发数量 2份 分发部门 质量部经理(1份)、分析室(1份)
2.2.2待界面显示平衡正常后(即漂移值≤5μL/min),将标准水样抽入注射器中(约1ml),确保注射器中没有气泡。用天平精密称量已装满标准水的注射器,点击开始,仪器将停止平衡,会显示要求10秒钟内加入标准水样。 2.2.3迅速将标准水样通过隔垫注入滴定杯中。注意在注入标准水样的过程中,将注射器的针头浸入溶液中(或用差量法),输入称量值,滴定结束后会显示滴定液浓度。 2.2.4平行标定三次,仪器会自行求平均值,以平均值为滴定液浓度进行供试品水分测定。要求三次标定所得值相对偏差不得过1.0%。 2.3供试品测定 2.3.1标定结束后,点击界面上YP , 仪器会自动平衡。 2.3.2待仪器显示平衡正常后(即漂移值≤5μL/min),精密称取供试品适量(含水量约为0.5?5mg) , 点击开始,仪器将停止平衡,会显示要求10秒钟内加入供试品。 2.3.2迅速将供试品转移至滴定杯中,用差量法称得加入供试品的质量。滴定结束后,记录数据。 2.3.3平行测定三次,要求三次测定所得值相对偏差不得过0.5%。 2.4仪器使用后清洗 检测结束后,把滴定瓶中废液排出,再吸甲醇清洗,清洗完成清掉废液收集瓶中的废液。 3、维护与保养 3.1进行水分测定时,确保室内温湿度在使用范围内,湿度≤50%。 3.2 每次使用前检查所有管路的密封性,不允许使用台面有积水或者水迹。 3.3 干燥瓶应根据需要及时更换(硅胶蓝色变淡时请更换硅胶)。 3.4 仪器表面滴落溶剂请及时用吸水纸吸干,有残留痕迹请用合适的溶剂清洗干净并吸干。 3.5长期不使用(3个月)情况下建议每个月进行一次开机,使用甲醇作为滴定液检查其密封性,同样进行用无水甲醇滴定无水甲醇(溶剂)空白滴定,检查其电气与机械部分是否正常,不建议使用卡尔-费休试液检查。注意检查完后清理完残留仪器内所有溶剂包括废液瓶。密封性不正常可选择更换密封件,再检查其密封性。密封性维护后不能正常工作,送回厂方维修。 3.6 长期不使用(3个月)情况下,按以上4项目检查一遍,才进行正常的滴定。 发现终点电位提前或者滞后(反应液溶液未变深或者溶液颜色很深的时候还一直滴定情况下)可能原因如下: 3.6.1 铂电极可能已被污染物覆盖,用无水乙醇超声清洗10分钟后,再用去离子水超声清洗10分钟后,再用去铬酸洗液清洗,再用去离子水清洗干净,用无水甲醇清洗干净残留电极的水后方使用电极
水份卡尔费休测试
卡尔·费休法简称费休法,是1935年卡尔·费休(Karl Fischer)提出的测定水分的容量分拆方法。费休法是测定物质水分的各类化学方法中,对水最为专一、最为准确的方法。虽属经典方法但经过近年改进,提高了准确度,扩大了测量范围,已被列为许多物质中水分测定的标准方法。 费休法有滴定法与库仑电量法两种方法。适用于许多无机化合物和有机化合物中含水量的测定。是世界公认的测定物质水分含量的经典方法。可快速测定液体.固体.气体中的水分含量,是最专一、最准确的化学方法,为世界通用的行业标准分析方法。广泛应用在石油、化工、电力、医药、农药行业及院校科研等单位。 利用卡尔费休法测定物质中水分是一种重要而灵敏的化学分析方法,但除 了有一个非常好的测定仪器外,必须对测定的物质中有无干扰物质存在, 根据物质中水分的含量确定适当的进样量,克服各种影响测定精度的因素,细心操作,才能得到好的测定结果。1935年卡尔-费休(KarlFischer)首先提出了利用容量分析测定水分的方法,这种方法即是GB6283《化工产品中水分含量的测定》中的目测法。目测法只能测定无色液体物质的水分。后来,又发展为电量法。随着科技的发展,继而又将库仑计与容量法结合起来推出库仑法。这种方法即是GB7600《运行中变压器油水分含量测定法(库仑法)》中的测试方法。现在的分类目测法和电量法统称为容量法。卡氏方法分为卡氏容量法和卡氏库仑法两大方法。两种方法都被许多国家定为标准分析方法,用来校正其他分析方法和测量仪器。 卡氏库仑法测定水分是一种电化学方法。其原理是仪器的电解池中的卡氏试剂达到平衡时注入含水的样品,水参与碘、二氧化硫的氧化还原反应,在吡啶和甲醇存在的情况下,生成氢碘酸吡啶和甲基硫酸吡啶,消耗了的碘在阳极电解产生,从而使氧化还原反应不断进行,直至水分全部耗尽为止,依据法拉第电解定律,电解产生碘是同电解时耗用的电量成正比例关系的。其反应如下: H2O+I2+SO2+3C5H5N→2C5H5N·HI+C5H5N·SO3 C5H5N·SO3+CH3OH→C5H5N·HSO4CH3 在电解过程中,电极反应如下:
卡尔-费休法 水分测定注意事项
卡尔-费休滴定法可适用于多种有机和无机物中含水的测定。由于各种化合物性质的差异, 可分为能直接进行测定和不能直接进行测定两类。可以直接测定的主要有机和无机化合物如下面所示。 表1 无干扰的有机和无机化合物 化合物种类举例 1.无机化合物 (1).有机酸盐Na(CH3 )SO4 ,Ba(OOCCH3 )2 ,K2 C2 O4 ,VO2 (OOCCH3 )2 ,Na2 C2 H4 O6 (2).无机酸盐NH4 PO4 ,CaCl2 ,NaHSO4 ,Na2 SO4 ,KF,NH4 NO3 ,MgSO4 , Na2 SO4 ,KSCN,FeSO4 ,Al2 (SO4 )3 ·KSO4 ,CaHPO4 , NaI,CaCO3 ,FeF3 ,VO2 (NO3 )2 (3).酸式氧化物SiO2 ,Al2 O3 (4).无机酸和酸酐SO2 ,HI,HF,HNO3 ,HCN,H2 SO4 ,HSO3 ,NH2 2.有机化合物 (1).酸羧酸,羧基酸,氨基酸,磺酸 (2).醇一元醇,多元醇,酚 (3).酯羧酸酯,正酸酯,氨基甲酸酯内酯,无机酸酯 (4).稳定的羟基化合物糖,甲醛,二苯基乙二酮,二苯乙醇酮,二氯乙醛 (5).缩醛,醚缩甲醛,二乙醚 (6).烃饱和与不饱合脂族和芳香族化合物 (7).酸酐和酰卤乙酸酐,苯甲酰氯 (8).卤化物卤代烷
(9).过氧化合物过氧化氢,二烷基过氧化物 (10).含氮化合物胺, 胺,腈 (11) .含硫化合物硫化物,硫氰酸盐,硫醚,磺原酸盐,二硫化氨基甲酸脂不能直接测定的主要有机和无机化合物如下面所示。 表2 有干扰的有机和无机化合物 化合物种类干扰性质 1.无机化合物 (1).金属氢氧化物及氧化物与费休试剂定量反应 (2).碳酸盐及酸式碳酸盐同上 (3).醋酸铅,碱式氨反应不完全 (4).硼酸及氧化物与碘反应 (5).铬酸及重铬酸非定量反应(6).钴氨络合物同上 (7).铜的氯化物及硫酸盐被HI定量还原 (8).氯化铁与费休试剂定量反应 (9).硫化氢及硫化钠反应不确定 (10).羟胺与费休试剂部分反应 (11).磷钼酸反应不完全 (12).甲基硅烷醇(R3 SiOH) 与费休试剂定量反应 (13).硫代硫酸盐同上 (14).二氯化锡同上 (15).二氯化氧锆反应不完全 2.有机化合物
卡尔费休水分测定仪期间核查规程
一编制目的 在仪器设备两次检定之间,进行期间核查,验证设备是否保持校准时的状态,确保检验结果的准确性和有效性。 二检查项目 外观、仪器示值重复性、仪器示值误差等3项。 三检定条件 1环境条件 环境温度:10℃~30℃ 相对湿度:≤80% 无尘,无腐蚀性气体,无影像测量的强烈震动、电磁干扰 2标准物质 2.1水-甲醇标准物质(水含量1mg/g) 2.2蒸馏水 四检定依据 卡尔费休库仑法水分测定仪说明书及国家计量检定规程JJG1044-2008 五检定方法 1仪器外观 1.1名牌完整,标明仪器名称、型号、生产厂家、序列号、出产日期等。 1.2一起不应有影响正常工作的机械外伤。 1.3各紧固件均应紧固、工作正常。 1.4一起的电解池系统应密封良好,电极、干燥管、磨塞拆装顺利。 2仪器示值误差检定 选取10、100、1000、5000四个点的左右进行测定,为了减小测量误差,不同的点采用不同的标准物质和微量进样器。测量时首先采用所需微量进样器抽取标准物质(或蒸馏水)至所需刻度,在分析天平上称量进样针的质量W1然后进样,进样器针
头必须进入到电解液面一下,全部注入试样后拔出,擦干进样器粘的电解液称量进样针质量W2,分别对不同含水量的标准物质测量三次,检定点的测量值与标准值之差的平均值即为仪器的示值误差。 不同的检定点采用不同的微量进样器: 示值误差计算公式: 式中:Δx-----示值误差,μg; x------检定点的测量值,μg; i x------检定点的标准值,μg。 s 3仪器示值重复性检定 当仪器稳定后,用10μl微量进样器注入10μl水-甲醇标准物质。连续进样6次,记录测量值,定量重复性以含水量测量结果的相对标准偏差RSD表示: 式中:RSD—相对标准偏差,%; n—测量次数; x—第i次测量值。 i 六评定标准 所测得仪器的示值误差不超过±(5%检定点)μg;100μg点的测量值的相对偏差不大于3%;外观正常。 七核查周期 在仪器设备两次检定之间,一般每隔六个月核查一次。
卡尔费休水分测定全面信息
卡尔费休氏水分测定法 对样品中水分的含量测定建立在R.W.Bunsen描述的下面这个反应上: I 2+SO 2 +2H 2 O 2HI+H 2 SO 4 Karl Fischer首先发现这个反应可以在非水环境中用来测定水分含量,反应系统中包含有过量的SO 2 ,甲醇可以被选作理想的溶剂。但反应是可逆的,为了使反 应向右进行,Karl Fischer用吡啶来吸收反应生成的HI和H 2SO 4 . Smith,Bryanz 和 Mitchell 将这个反应描述成两步: I 2+SO 2 +H 2 O+3B 5 C 5 N → 2B 5 C 5 NH+I- + B 5 C 5 N.SO 3 B 5C 5 N.SO 3 +CH 3 OH → B 5 C 5 N H+CH 3 SO 4 - 在第一步反应中,KF试剂和水反应生成的B 5C 5 N.SO 3 不稳定,容易分解成吡啶和二 氧化硫,甲醇可以和其反应生成稳定的B 5C 5 N H+CH 3 SO 4 -。由此可见,甲醇作溶剂有 防止副反应发生的作用。在醇溶剂中,碘和水反应的化学计量数为1:1。在无醇的溶剂中,碘和水反应的化学计量数为1:2: I 2+SO 2 +H 2 O+3 B 5 C 5 N → 2 B 5 C 5 N H+I- + B 5 C 5 N.SO 3 (不稳定) B 5C 5 N.SO 3 +H 2 O → B 5 C 5 N H+HSO 4 -(稳定) 卡尔.费休试剂的基本成份是碘、二氧化硫、溶剂和有机碱,溶剂主要是醇 类。通常,试剂中二氧化硫、有机碱和醇类物质都是过量的,试剂中碘与水以固定的化学计量数1:1进行反应,所以我们在进行实验前应先确定滴定剂中碘的浓度,也即对滴定剂进行标定,这是本实验定量的基础。用已知浓度的卡氏试剂滴定样品中的水分,由消耗滴定剂的体积和称样量,即可求出样品的含水量。 以前,卡氏试剂中用的有机碱主要是有毒、恶臭的吡啶,但更重要的是如果我们不能确定反应到底受那些方面的影响的话,我们就无法用其来进行定量分析。后来,E.Barenrecht和J.Cverhoff对Karl Fisher反应进行了更进一步的研究后,得出了如下结论: ◎吡啶不直接参加反应,也就是说它只起调节PH值和缓冲剂的作用,可以用其它的有机碱替代。 ◎Karl Fisher反应的速率受反应介质的PH值影响。(如图.1)
