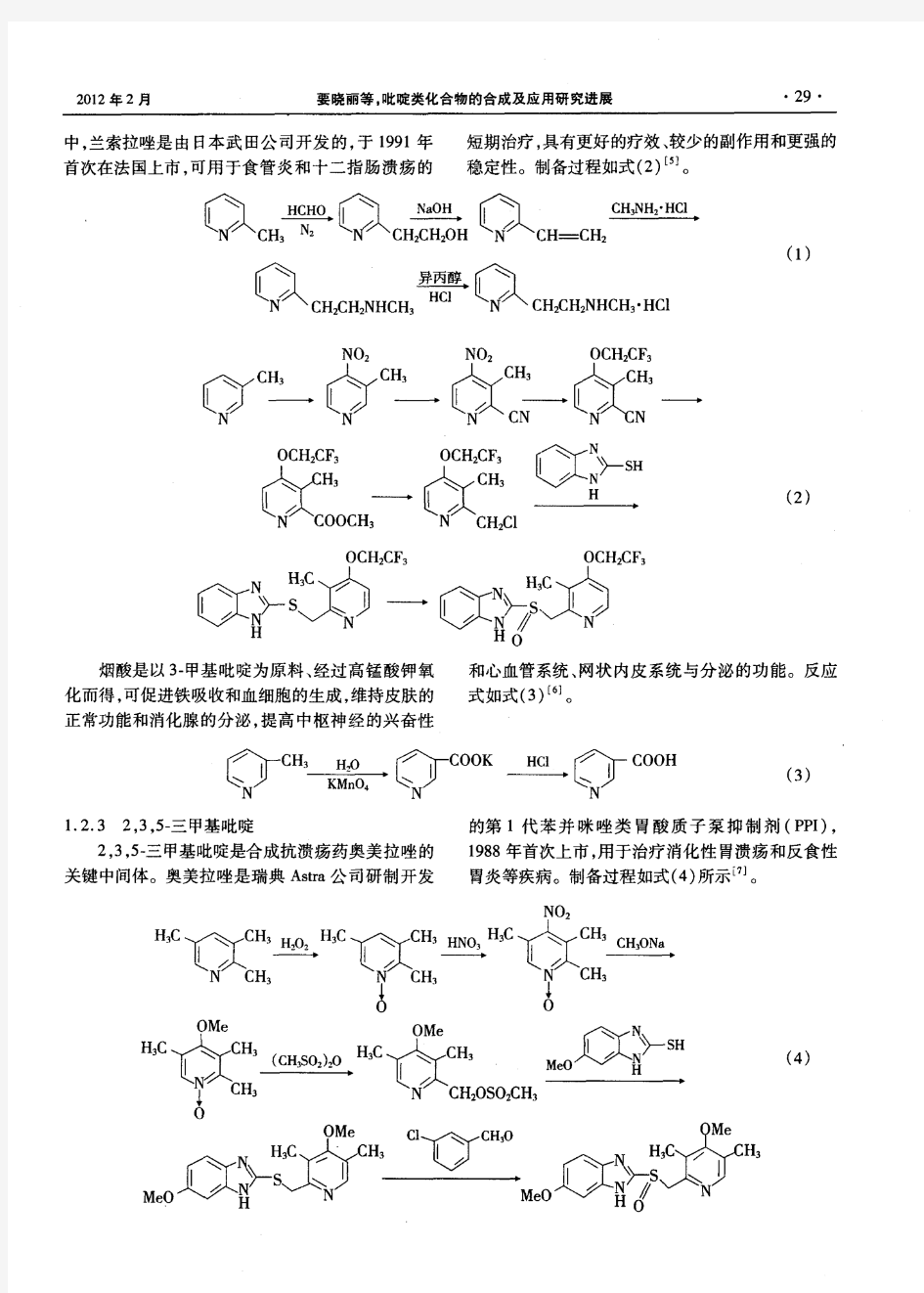
吡啶类化合物的合成及应用研究进展

二氢吡啶类降压药比较
临床上常用的钙离子拮抗剂有三类: 苯烷胺类(如维拉帕米) 二氢吡啶类(如一代硝苯地平;二代缓释硝苯地平、非洛地平;三代拉西地平、氨氯地平) 地尔硫卓类(如地尔硫卓) 钙离子拮抗剂适用人群: 1老年性单纯收缩压增高,首选长效钙离子拮抗剂,如苯磺酸氨氯地平,苯磺酸左旋氨氯地平,硝苯地平控释片,拉西地平,非洛地平等。单用效果不理想,可加服利尿剂(吲哒帕胺,氢氯噻嗪等),或联用长效ACEI类(依那普利,培哚普利等),或联用ARE类(厄贝沙坦,替米沙坦等)。 用药原理:长效制剂,降压作用温和,持久。确保24小时血压平稳,尽量避免血压波动,预防心血管事件的发生。 2、高血压合并稳定性心绞痛 用药提示:该药能舒张冠脉特别是已痉挛收缩的狭窄冠脉,故能增加缺血区流量,可治心绞痛。 二氢吡啶类(以“地平”结尾),这类钙拮抗药发展较快,在作用和药代动力学方面都有所改进,主要有以下几种: 1、硝苯地平。该药能舒张冠脉特别是已痉挛收缩的狭窄冠脉,故能 增加缺血区流量,可治心绞痛。也能舒张外周小动脉,降低血压,治疗轻、
中度高血压,还能治疗急性腹泻。
硝苯地平制剂规格/用法用量 片剂:5mg,sig:10m—30mg tid 缓释制剂:10mg20mg sig:10m—20mg bid 控释制剂:30mg sig:30mg qd 温馨提示:普通片剂为短效制剂,不良反应发生率较高,有明显的“峰谷”现象。 缓释制剂为等比释药,“峰谷”现象较弱,为中长效制剂。 控释制剂为等量释药,无“峰谷”现象,为长效制剂,每日服药一次即可。缓释制剂的服药时间为一天两次,分别是晨起和下午17: 00。(对 应人体血压的两个高峰时段:9:00和19:00) 避免晚间服用,以免夜间血压过低。 【不良反应】发生率达20% 一般较轻,主要是低血压,降压过快引起反射性心律加快,面色潮红,脚踝水肿(可用利尿药吲哒帕胺或氢氯噻嗪对抗)。长期用药约有5%患者出现头痛。少数患者偶见心肌缺血症状加重,可能是严重冠脉阻塞、心率加快、血压过低所致。 2、氨氯地平(amlodipine)舒张冠脉及外周血管,用于治疗中、轻度高血压作用缓慢持久,降低血压10%-18%无反射性心动过速。治疗稳定型心绞痛效果明显。它的消除t i/2较久,达35?45小时,日服一次即可。
全球吡啶类化合物的市场现状及前景分析
全球吡啶类化合物的市场现状及前景分析 一、综述 吡啶类化合物是一类含有氮原子的杂环芳烃,除了吡啶本身之外,吡啶类化合物包括:甲基吡啶(picolines皮考林),二甲基吡啶(卢剔啶lutidines)和三甲基吡啶(可力丁collidines)。吡啶类化合物最大的应用市场是农用化学品(主要为除草剂)和烟酰胺/烟酸。 20世纪50年代初开始吡啶的化学合成之前,煤焦油中分离是吡啶的唯一来源。如今,世界上几乎所有的吡啶都是化学合成的。本次论坛只讨论合成吡啶。 合成吡啶所用的原料有甲醛、乙醛和氨,催化剂是普通的沸石催化剂,反应温度也不高300~500℃。从表面是看,吡啶的合成应该是一件很容易的事,实际上将乙醛和甲醛环起来再在环上加上一个杂原子氮是一项技术含量很高的合成工艺。世界上能够掌握这项技术的公司为数不多,10年前有美国、日本、德国和瑞士等几家公司。目前又增加了中国台湾、中国大陆和印度等几家公司。 二、全球吡啶及其衍生物的供需情况 本报告讨论的吡啶及其衍生物主要包括吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶和2-甲基-5-乙基吡啶(MEP)。表1列出了2007年全球吡啶及其衍生物的供需情况。 表1 2007年全球吡啶及其衍生物的供需情况t a. 包括2-甲基-5-乙基吡啶(MEP)和少量的二甲基吡啶(卢剔啶)和三甲基吡啶(可力丁);
b. 包括印度尼西亚、马来西亚、新加坡和泰国。 来源:CEH 估计。 三、全球吡啶及其衍生物的消费情况 2007年全球吡啶的消费量为11.8万t/a。产能利用率为66%,这是因为吡啶产能的增速已经超过了全球的需求。在2003-2007年间,世界吡啶产能的平均增长率为8.7%,超过了全球消费的平均增长率3.5%。2003~2007年底,大约有4.5万t/a产能增加,主要都分布在中国、印度和美国。大部分亚洲产能增加都用于百草枯和烟酸/烟酰胺的强劲需求。而2003-2007 年亚洲新增吡啶需求被美国和西欧需求的降低给平衡掉了。表2列出了世界吡啶的消费情况。 表2 世界吡啶的消费情况t/% a. 包括2-甲基-5-乙基吡啶(MEP) 来源:CEH 估计。 2007年和2012年全球吡啶产品的消费情况分别如图1和图2所示。 图1 2007年全球吡啶产品的消费情况
稀土金属配合物发光性能研究进展及应用
稀土金屬配合物發光性能研究進展及應用 摘要:稀土金屬配合物因鑭系離子獨特的電子結構而成為一類具有特殊性能的發光材料,有著重要的理論意義及應用價值。本文簡要介紹了 稀土與配體間的能量傳遞機制,並綜述了稀土金屬配合物發光及其應用研究的新進展。 關鍵字:配合物;能量傳遞;發光;應用;稀土 稀土元素的顯著特點是大多數稀土離子含有 能級相近且未充滿的4f電子,並且4f電子處於原 子結構的內層,受到5s25p6電子對外場的遮罩,因 此其配位場效應較小。這種特殊的電子構型,使其 不僅在光、電、磁等方面具有獨特的性質,而且具 有豐富的電子能級和長壽命的激發態,它們的能 級躍遷達20萬餘次,可以產生多種多樣的輻射, 構成廣泛的發光和鐳射材料,被譽為新材料的寶 庫[1’2】。我國稀土資源豐富,約占世界已探明儲量 的80%以上,居世界之首。而且礦物種類最多,稀 土組分最全,深入開展稀土化合物的應用研究對 於我國把稀土資源優勢轉化為經濟技術優勢起著 十分重要的作用。 由於稀土離子本身的獨特結構和性質,使其
與適當有機配體配合後,所發出的螢光兼有稀土離子發光強度高、顏色純正和有機化合物所需激發能量低、螢光效率高等優點。近年來,人們對稀土配合物的發光性能研究表現出濃厚的興趣,大量有關稀土發光現象的研究在不同領域內展 開[3卅。本文從光致發光稀土配合物的發光機制、稀土配合物的配體等幾方面,對其發光性質的研究及應用做一綜合性闡述。 1 稀土配合物的發光機制 由於稀土離子的f-f躍遷屬於禁戒躍遷,因此 在可見和紫外區域表現出很弱的吸收,單一稀士離子的發光相對較弱。但當稀土離子與有機配體配合得到稀土配合物時,由於有機配體在紫外區常常有較大的吸收,並通過有效的分子內能量傳遞過程將其激發態的能量傳遞給稀土離子的發射能級,從而極大地提高了稀土離子的特徵發射,即所謂的天線(antenna)效應。 Crosby等[7’8]對稀土配合物發光進行大量研究之後,解釋了其發光機制,證實這些配合物的螢光發射是配體激發態的電子能級與金屬離子4f能級間的分子內能量傳遞產生的,並不是稀土離子直接激發引起的。具體發光過程為:配合物分子內的
吡啶
吡啶 汉语拼音:bǐdìng 英文名称:pyridine 中文名称2:氮(杂)苯 CAS No.:110-86-1 分子式:C5H5N 分子量:79.10 吡啶是含有一个氮杂原子的六元杂环化合物。可以看做苯分子中的一个(CH)被N取代的化合物,故又称氮苯。 吡啶及其同系物存在于骨焦油、煤焦油、煤气、页岩油、石油中。 [编辑本段]物理性质 外观与性状:无色或微黄色液体,有恶臭。 熔点(℃):-41.6 沸点(℃):115.3 相对密度(水=1):0.9827 折射率:1.5067(25℃) 相对蒸气密度(空气=1):2.73 饱和蒸气压(kPa): 1.33/13.2℃ 闪点(℃):17 引燃温度(℃):482 爆炸上限%(V/V):12.4 爆炸下限%(V/V): 1.7 溶解性:溶于水、醇、醚等多数有机溶剂。 与水形成共沸混合物,沸点92~93℃。(工业上利用这个性质来纯化吡啶。) [编辑本段]化学性质 吡啶及其衍生物比苯稳定,其反应性与硝基苯类似。典型的芳香族亲电取代反应发生在3、5位上,但反应性比苯低,一般不易发生硝化、卤化、磺化等反应。吡啶是一个弱的三级胺,在乙醇溶液内能与多种酸(如苦味酸或高氯酸等)形成不溶于水的盐。工业上使用的吡啶,约含1%的2-甲基吡啶,因此可以利用成盐性质的差别,把它和它的同系物分离。吡啶还能与多种金属离子形成结晶形的络合物。吡啶比苯容易还原,如在金属钠和乙醇的作用下还原成六氢吡啶(或称哌啶)。吡啶与过氧化氢反应,易被氧化成N-氧化吡啶。 [编辑本段]用途 除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品(包括药品、消毒剂、染料、食品调味料、粘合剂、炸药等)的起始物。 吡啶还可以用做催化剂,但用量不可过多,否则影响产品质量。 [编辑本段]来源(合成方法) 吡啶可从天然煤焦油中获得,也可由乙醛和氨制得。吡啶及其衍生物也可通过多种方法合成,其中应用最广的是汉奇吡啶合成法,这是用两分子的β-羰基化合物,如乙酰乙酸乙酯与一分子乙醛缩合,产物再与一分子的乙酰乙酸乙酯和氨缩合形成二氢吡啶化合物,然后用氧化剂(如亚硝酸)脱氢,再水解失羧即得吡啶衍生物。 也可用乙炔、氨和甲醇在500℃通过催化剂制备。 [编辑本段]衍生物 吡啶的许多衍生物是重要的药物,有些是维生素或酶的重要组成部分。吡啶的衍生物异烟肼是一种抗结核病药,2-甲基-5-乙烯基吡啶是合成橡胶的原料。 中文名称:吡啶 [编辑本段]危险信息及使用注意事项(MSDS) 燃爆危险:本品易燃,具强刺激性。 危险特性:其蒸气与空气可形成爆炸性混合物,遇明火、高热极易燃烧爆炸。与氧化剂接触猛烈反应。高温时分解,释出剧毒的氮氧化物气体。与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等剧烈反应,有爆炸危险。流速过快,容易产生和积聚静电。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。若遇高热,容器内压增大,有开裂和爆炸的危险。燃烧(分解)产物:一氧化碳、二氧化碳、氧化氮。 吡啶的危害:
吡啶的合成方法
吡啶的合成方法 1.hantzsch合成 用两分子β-酮酸酯,一分子醛基及氨作原料经多分子环化成吡啶 例如 One-Pot Synthesis of 1,4-Dihydropyridines via a Phenylboronic Acid Catalyzed Hantzsch Three-Component Reaction Efficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous Micelles A. Kumar, R. A. Maurya, Synlett, 2008, 883-885. A. Debache, R. Boulcina, A. Belfaitah, S. Rhouati, B. Carboni, Synlett, 2008, 509-512. Yb(OTf)3 catalyzed an efficient, operationally simple and environmentally benign Hantzsch reaction via a four-component coupling reaction of aldehydes, dimedone, ethyl acetoacetate and ammonium acetate at ambient temperature to yield polyhydroquinoline derivatives in excellent yield. L.-M. Wang, J. Sheng, L. Zhang, J.-W. Han, Z.-Y. Fan, H. Tian, C.-T. Qian, Tetrahedron, 2005, 61, 1539-1543.
含吡啶环高能化合物的分子设计和理论研究
含吡啶环高能化合物的分子设计和理论研究运用量子化学密度泛函理论(DFT)等方法,对设计的系列含吡啶环分子(如硝胺类、桥连双吡啶类、吡啶并含氮杂环类等)的分子结构、电子结构、晶体结构、爆轰性能等进行了较系统的计算研究,以了解其基本性能,筛选品优化合物,为实验合成提供参考。主要内容如下:1.基于硝胺基团的高能特性和毗啶的钝感性,设计了系列含吡啶环的硝胺炸药,并对其进行了理论研究。采用PM3半经验方法和DFT方法计算了生成焓(HOF),采用等电子密度面求体积法及其静电势校正法 计算晶体密度(p)。在此基础上应用Kamlet-Jacobs(K-J)方程求得爆速(D)和爆 压(P)。 发现有些化合物具有较高密度(约1.9g/cm3)和优良的爆轰性能(D高于 9km/s,P约为39GPa),为潜在的高能量密度化合物(HEDC)。根据自然键轨道(NBO)、键解离能(BDE)和撞击感度(h50)分析了化合物的稳定性和热解机理,发现在热分解过程中N-N02键是最可能的引发键。溶剂效应能影响化合物的稳定性。最后总结了吡啶硝胺类化合物的分子设计规律。 2.根据含吡啶环炸药TNPyO(2,4,6-三硝基吡啶氮氧化物)和PYX(2,6-二苦 胺基-3,5-二硝基吡啶)的结构设计了它们的-NO2、-NH2、-N3、-NHNO2、-ONO2、-CH2C(NO2)3和-NF2衍生物,应用DFT进行了理论研究。通过等键反应计算了气态生成焓并进而预测了固态生成焓;应用分子力学(MM)方法计算了ρ;由K-J 方程估算爆热(Q)、D和P,讨论了取代基团对HOF、ρ、Q、D和P的影响;由前线轨道能量、键级、BDE和h50评价感度,并探讨了可能的热解引发机理。综合 考虑爆轰性能与稳定性两方面因素,大多数TNPyO衍生物以及部分PYX衍生物为潜在的HEDC,值得进一步研究。3.对具有不同连接基团(-H-、-O-、-NH-、-CH2、-N=N-、-N=N(O)-、-CH=N-、-CH=CH--NH-NH-和-NH-CH2-NH-)和取代基(-NH2、NO2-NF2)的系列双吡啶进行了计算研究。 设计等键反应计算气态生成焓,进而应用Politzer方法预测固态生成焓。讨论了不同连接基团对生成焓的影响规律。比较三种密度预测方法(体积法、Politzer静电势校正法以及MM预测分子堆积方法)的结果,发现分子堆积法所得晶体密度更可靠。以-O-、-NH-或-CH2-连接的双吡啶化合物的爆轰性能与直接相连的双吡啶相比没有明显提高。
氮氧化物排放量计算
锅炉燃烧氮氧化物排放量 燃料燃烧生成的氮氧化物量可用下式核算: GNOx=1.63B(β·n+10-6Vy·CNOx) 式中:GNOx ~燃料燃烧生成的氮氧化物(以NO2计)量(kg); B ~煤或重油消耗量(kg); β~燃烧氮向燃料型NO的转变率(%),与燃料含氮量n有关。普通燃烧条件下,燃煤层燃炉为25~50%(n≥0.4%),燃油锅炉为32~40%,煤粉炉取20~25%; n ~燃料中氮的含量(%); Vy ~燃料生成的烟气量(Nm3/kg); CNOx~温度型NO浓度(mg/Nm3),通常取70ppm,即93.8mg/Nm3。第一种方法: 《环境统计手册》-方品贤中的计算方法(第99和100页)和国家环保总局《关于排污费征收核定有关工作的通知》(环发[2003]64号)中氮氧化物的计算方法上述方法是一致的,假设了燃烧1kg煤产生10m3烟气。 GNOx=1.63×B×(N×β+0.000938)
GNOx—氮氧化物排放量,kg; B–消耗的燃煤(油)量,kg; N–燃料中的含氮量,%;《环境保护实用数据手册》-胡名操和《环境统计手册》-方品贤统计数据一致。取0.85%。 β—燃料中氮的转化率,%。取70% 计算燃烧1t煤产生氮氧化物量为
18.64kg。 第二种方法:根据N守恒,计算公式为:G=B×N/14×a×46 其中:G—预测年二氧化氮排放量; N—煤的氮含量(%),取0.85%; a—氮氧化物转化为二氧化氮的效率(%),取70%。 B—燃煤量。 计算燃烧1t煤氮氧化物产生量为19.55 kg。 第三种方法: 按照《环境保护实用数据手册》-胡名操中相关统计数据,工业锅炉燃烧1t煤产生的氮氧化物为
多氨基多硝基吡啶氮氧化物及其配方的性能研究
多氨基多硝基吡啶氮氧化物及其配方的性能研究多氨基多硝基吡啶氮氧化物的代表化合物2,6-二氨基-3,5-二硝基吡啶氮 氧化物(ANPyO)和2,4,6-三氨基-3,5-二硝基吡啶氮氧化物(INPyO)是一类新型 的含能材料,具有感度低,成本低,稳定性好,耐热性好以及较高的爆炸性能,是潜在的高能钝感炸药候选物,在含能材料领域具有广阔的应用前景。本论文分别以三氟乙酸(CF3COOH)、二甲基亚砜(DMSO)和N,N-二甲基甲酰胺(DMF)为溶剂,采用重结晶法精制ANPyO或TNPyO,对精制后样品性能进行比较分析。结果表明:分 别用CF3COOH重结晶的ANPyO和TNPyO平均粒径最小,比表面积分别为 0.454m2·g-1和2.760m2·g-1;10℃·min-1温升速率时,热分解峰值温度分别 为370.69°C和355.9℃,表观活化能分别为279.63kJ·mol-1和303.15kJ·mol-1;机械感度最低。CF3COOH是最佳的重结晶溶剂。 结晶工艺条件对ANPyO的晶型和感度也有明显的影响。采用溶液-水悬浮- 蒸馏法,分别以氟橡胶F2311和丁腈橡胶(NBR)包覆ANPyO和TNPyO,利用傅里叶 变换红外光谱(FTIR)、扫描电子显微镜(SEM)、差示扫描量热法(DSC)、热重分析法(TG)和感度试验表征包覆前后ANPyO和TNPyO的结构和性能。试验结果表明:分别用F2311和NBR包覆后的ANPyO和TNPyO热分解峰值温度降低,分解热提高,分解深度减小;包覆后颗粒变大,红外光谱中N-H特征峰和氮杂原子的特征峰均发生偏移;机械感度均降低。包覆能改善ANPyO和TNPyO的能量和机械感度性能,其中以F2311包覆的ANPyO和TNPyO性能更优。 根据ANPyO和TNPyO及其配方分别在不同升温速率下TG的分析结果,分析讨论了它们的热分解过程,用非线性等转化率积分法和Ozawa法计算了它们的热分解活化能、指前因子等动力学参数和机理函数。ANPyO和TNPyO及其配方的热分解机理均属于n=1的随机成核和随后生长。采用绝热加速量热仪对ANPyO和TNPyO及其配方进行绝热分析。利用速率常数法计算了它们绝热分解的活化能和指前因子等动力学参数。 依据绝热分解过程的温度、压力、温升速率随时间的变化以及计算结果对它们的热安全性进行评价。采用热重-微商热重分析(TG-DTG)、热重与质谱联用(TG-MS)和原位热裂解快速扫描傅里叶变换红外等技术研究了ANPyO的热分解全过程,并通过跟踪测试热分解过程中气相和凝聚相产物及其变化情况提出了
吡啶的生产工艺与技术路线的选择
吡啶的生产工艺与技术路线的选择 在吡啶类化合物中,最早被发现的是2-甲基吡啶。1946年,英国Anderson 自煤焦油中分离得到;1951年Anderson从骨油中分离得到吡啶并做了鉴定。 但煤焦油中分离吡啶量有限,产量少,组分复杂,随着世界能源结构发展,以油代煤的变化,从煤焦油中分离提取吡啶的方法已不适应大批量工业化生产,逐步被化学合成法淘汰。 2.1 焦油法生产粗轻吡啶 吡啶以往主要从煤焦油中提取,我国部分焦化厂以氨气中和法从饱和器母液中生产粗轻吡啶,见下图:..…. 2.2 化学合成法生产吡啶 吡啶以往主要从煤焦油中提取,现在主要由化学合成法获取。 化学合成的生产工艺是一步合成,分步分离、精制。 化学合成法生产吡啶,产品不仅仅是单一的吡啶,而是一个混合物,其组成依技术、反应条件及添加剂有所不同。..…. 2.2.1 醛(酮)-氨法合成烷基吡啶 此法自20世纪50年代工业化以来,因原料价廉易得、可以根据市场需求调整合成路线、生产多种产品而一直是热门的研究课题。..…. 我国红太阳集团有限公司吡啶合成工艺技术考虑下游产品发展及吡啶衍生物在国内市场的需求情况,工艺采用乙醛+甲醛--氨合成工艺技术,以吡啶和3-甲基吡啶为主要产品。..….
2.2.2 醛(酮)-烯腈法合成烷基吡啶 该法主要以不饱和烃为原料生产烷基吡啶,乙烯和乙腈在(Me4N2CoB10H12)2 催化剂作用下,可得2-甲基吡啶,产率18%。..…. 2.3 吡啶生产方法研究及相关专利 我国在吡啶及下游产品开发方面也取得一些新的成果。 东南大学从事吡啶的合成技术研究,1996年获得成功的一项新工艺投产后,为我国开发二类新药奥兰啦唑提供原料,..….2009年09月08日沙隆达集团公司 申请了“一种合成吡啶与甲基吡啶的方法及装置”专利,见下表: 表2.5 一种合成吡啶与甲基吡啶的方法及装置专利表 申请专利号200910063901 专利申请日2009/09/08 名称一种合成吡啶与甲基吡啶的方法及装置 申请(专利权)沙隆达集团公司 地址湖北省荆州市北京东路93号 发明(设计)人殷宏;王正国;薛光才;艾秋红;马安兵;向维德;李新年;杨浩斌;刘孝平;廖艳;张诗忠 摘要 本发明涉及一种中间体的制备方法,具体地说是一种合成吡啶与甲基吡啶的方法及装置。它是以氨、甲醛、乙醛为原料,在催化剂的作用下,原料气经气体分布板后,首先进入流化床反应器,从流化床反应器出来的气体,经扩大段后不经旋风分离器直接进入固定床反应器中反应得到吡啶。本发明具有催化剂可连续补充,反应周期长,吡啶收率高的优点。 主权项 一种合成吡啶与甲基吡啶的方法,它是以氨、甲醛、乙醛为原料,在催化剂的作用下,原料气经气体分布板后,首先进入流化床反应器,从流化床反应器出来的气体,经扩大段后不经旋风分离器直接进入固定床反应器中反应得到吡啶。 详细内容参见六鉴网(https://www.360docs.net/doc/817803038.html,)发布《吡啶技术与市场调研报告》。
吡啶类化合物的应用举例
吡啶类化合物的应用举例 吡啶类化合物作为化学工业,特别是精细化工的重要原料,应用范围很广,涉及医药中间体、医药制品、农药、农药中间体、饲料和饲料原料及其它多项领域。以下举例几种比较常见的吡啶类化合物。 3-甲基吡啶 3-甲基吡啶是最重要、也是应用最为广泛的吡啶衍生物产品。3-甲基吡啶既是合成吡啶类香料的重要中间体,又是制备吡啶类农药的重要中间体,同时,也是合成抗糙皮病的维生素、烟酸、烟酰胺等的原料,亦可作溶剂、酒精变性剂、染料和树脂中间体,用来生产橡胶硫化促进剂、防水剂和胶片感光剂添加物等。 3 -甲基吡啶的合成方法在工业化合成法出现以前,3-甲基吡啶主要从煤焦油中获得。以煤焦油中的粗吡啶先脱渣得水吡啶,然后在填料塔内常压蒸馏,并用纯苯与水共沸蒸馏脱水,截取138℃~145℃馏分,可得纯度约95%的3 -甲基吡啶。由于焦化副产物中吡啶组分多、分离困难,产品产率不高,提取装置复杂,现已基本被合成法所替代。 以丙烯醛和氨为原料这是古老的制备3 -甲基吡啶的方法,早在1970 年John 等申请了专利,Helmut Beschke等采用由氧化铝、硝酸镁、氟化氢铵制备的催化剂,此催化剂中铝、镁、氟的原子比例是1000: 50:100,采用流化床反应器,反应过程中通入氮气作为稀释剂,对3 -甲基吡啶的催化选择性较高,收率达到48.5%,同时副产24.8%的吡啶。也有专利报道此方法合成3 -甲基吡啶收率可达66%。 乙醛与氨催化合成3-甲基吡啶时, 得到主要含3-甲基吡啶和4-甲基吡啶的混合物, 两者比例约为3:1.由于它们沸点接近, 性质相似, 用普通精馏法或其它分离方法如结晶、溶剂萃取等, 很难使二者得到经济有效的分离.采用对甲基苯磺酸为萃取剂可以明显提高萃取效率。 2 , 3一二氯吡啶: 2 , 3一二氯吡啶是重要的精细化工中间体泛应用于医药与农药研究领域"它是新型杀虫剂氯虫苯甲酞胺与H G w 86 的关键中间体. 2 , 3 , 6一三氯吡啶还原法3 是2 , 3一二氯吡啶较早的一种合成方法, 以3一氯吡啶为起始原料合成2 , 3一二氯吡啶的文献报道较多, 主要有两条路线: 以乙酞次氟酸为试剂, 3一氯吡啶生成具有N 一F 键的一对共振体, 然后脱去H F 、二氯甲烷氯化, 选择性的生成2 ,3一二氯吡啶, 收率80 % 。该法由于吡啶3 位活性不够强, 亲电取代不易进行, 原料3一氯吡啶价格较高, 不宜工业化开发。 以2一氯一3一氨基吡啶为起始原料合成2 , 3一二氯吡啶的方法其实是上面方法的一部分, 区别在于起始原料的不同"该合成法主要包括两步反应: 2-氯一3一氨基吡啶首先进行重氮化反应, 然后发生Sandmeyer 氯代反应得到2 , 3一二氯吡啶。反应试剂便宜易得, 适宜于工业化生产" 4一二甲氨基吡啶: 用吡啶催化轻基化合物与酸配的反应, 是一种温和而可靠的酞化反应, 但是, 对于空间位阻较大的醇类的反应, 则酞化难于进行, 产率较低。1967 年,Litvinenk。和Kirichenk。在间氯苯胺的苯甲酞化的动力学研究中发现, 用4一二甲氨基吡啶(简称DMAP ) 代替吡啶时, 反应速率大大增加。 D M A P 的酞化催化作用之所以胜于吡啶和三乙胺等, 这是因为D M A P 亲核性极强,并且在非极性溶剂中与亲核试剂形成浓度很高的N 一酞基一4 二甲氨基吡啶盐。同时, 此盐分
吡啶(MSDS)
危险化学品安全技术性能数据(MSDS) 标识中文名:吡啶英文名:Pyridine 分子式:C2H6S2相对分子质量: CAS号:110-86-1危险性类别:易燃液体化学类别: 组成与性状主要成分:含量99.5%外观与形状: 主要用途:用于制造维生素、磺胺类药、杀虫剂及塑料等。 健康 危害 健康危害:吸入有毒,口服会中毒。呼吸道刺激、皮肤刺激、严重眼刺激。 急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗。如有不适感,就医。 眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15分钟。如有不适感,就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。呼吸、心跳停止,立即进行心肺复苏术。就医。 食入:饮足量温水,催吐、洗胃、导泻。就医。 急性和迟发效应,主要症状:有强烈刺激性;能麻醉中枢神经系统。对眼及上呼吸道有刺激作用。高浓度吸入后,轻者有欣快或窒息感,继之出现抑郁、肌无力、呕吐;重者意识丧失、大小便失禁、强直性痉挛、血压下降。误服可致死。慢性影响:长期吸入出现头晕、头痛、失眠、步态不稳及消化道功能紊乱。可发生肝肾损害。可致多发性神经病。对皮肤有刺激性,可引起皮炎,有时有光感性皮炎。 爆炸特性与消防燃烧性:易燃,其蒸气与空气混合,能形 成爆炸性混合物。 闪点(℃):20 爆炸下限(V%):1.8爆炸上限(V%):12.4 引燃温度(℃):482最大爆炸压力(Mpa):无意义 最小点火能(Mj):无意义 危险特性:其蒸气与空气可形成爆炸性混合物,遇明火、高热极易燃烧爆炸。与氧化剂接触猛烈反应。高温时分解,释出剧毒的氮氧化物气体。与硫酸、硝酸、铬酸、发烟硫酸、氯磺酸、顺丁烯二酸酐、高氯酸银等剧烈反应,有爆炸危险。流速过快,容易产生和积聚静电。蒸气比空气重,沿地面扩散并易积存于低洼处,遇火源会着火回燃。若遇高热,容器内压增大,有开裂和爆炸的危险。
吡啶的合成方法
吡啶的合成方法 合成 用两分子β-酮酸酯,一分子醛基及氨作原料经多分子环化成吡啶 例如 One-Pot Synthesis of 1,4-Dihydropyridines via a Phenylboronic Acid Catalyzed Hantzsch Three-Component Reaction Efficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous Micelles A. Kumar, R. A. Maurya, Synlett, 2008, 883-885. A. Debache, R. Boulcina, A. Belfaitah, S. Rhouati, B. Carboni, Synlett, 2008, 509-512. Yb(OTf)3 catalyzed an efficient, operationally simple and environmentally benign Hantzsch reaction via a four-component coupling reaction of aldehydes, dimedone, ethyl acetoacetate and ammonium acetate at ambient temperature to yield polyhydroquinoline derivatives in excellent yield. . Wang, J. Sheng, L. Zhang, . Han, . Fan, H. Tian, . Qian, Tetrahedron, 2005, 61, 1539-1543.
氮氧化物的计算方法
氮氧化物的计算方法 燃烧产生的氮氧化物根实际燃烧条件关系密切,所以要准确估算是非常困难的。如果条件允许,尽量类比具备可比性同类型项目实测数据;在无实测情况下最好查阅相关书籍或相关研究成果计算方式,根据相关条件选择相近情况公式的计算结果准确率稍高,而且符合导则要求可找到依据出处;切记别拍脑袋。以下几种方法供大家参考。 传统方法 第一种方法: 《环境统计手册》-方品贤中的计算方法(第99和100页)和国家环保总局《关于排污费征收核定有关工作的通知》(环发[2003]64号)中氮氧化物的计算方法上述方法是一 产生10m3烟气。致的,假设了燃烧1kg煤 GNOx=1.63×B×(N×β+0.000938) 氮氧化物排放量,kg; GNOx— B–消耗的燃煤(油)量,kg; N–燃料中的含氮量,%;《环境保护实用数据手册》-胡名操和《环境统计手册》-方品贤统计数据一致。取0.85%。 β—燃料中氮的转化率,%。取70% 计算燃烧1t煤产生氮氧化物量为18.64kg。 第二种方法:根据N守恒,计算公式为:G,B×N/14×a×46 其中:G—预测年二氧化氮排放量; N—煤的氮含量(,),取0.85,; a—氮氧化物转化为二氧化氮的效率(%),取70%。
B—燃煤量。 计算燃烧1t煤氮氧化物产生量为19.55 kg。 第三种方法: 按照《环境保护实用数据手册》-胡名操中相关统计数据,工业锅炉燃烧1t煤产生的氮氧化物为9.08kg(第65页,表2-51);用烟煤作燃料,选锅炉铺撇式加煤产生的氮氧化物为7.5kg(第66页,表2-53);用无烟煤作燃料的锅炉燃烧,选可移动炉蓖产生的氮氧化物产生量为5kg(第67页,表2-57);美国典型的燃烧烟煤小型工业锅炉的氮氧化物7.5kg(第68页,表2-60)。 第四种计算方法: 采用《产排污系数手册》第十册:按燃烧1t煤来计算: 烟煤-层燃炉:2.94kg;285.7mg/m3;(第240页) 锅炉燃烧氮氧化物排放量 燃料燃烧生成的氮氧化物量可用下式核算: GNOx,1.63B(β?n+10,6Vy?CNOx) 式中:GNOx ~燃料燃烧生成的氮氧化物(以NO2计)量(kg); ); B ~煤或重油消耗量(kg β ~燃烧氮向燃料型NO的转变率(%),与燃料含氮量n有关。普通燃烧条件下,燃煤层燃炉为25~50%(n?0.4%),燃油锅炉为32~40%,煤粉炉取20~25%; n ~燃料中氮的含量(%); Vy ~燃料生成的烟气量(Nm3,kg); CNOx ~温度型NO浓度(mg,Nm3),通常取70ppm,即93.8mg,Nm3。 固定污染源监测质量保证与质量控制技术规范,试行,,HJ/T 373-2007, 中核定氮氧化物排放量 5.3.5 核定氮氧化物排放量
二氢吡啶类药物
一、掌握二氢吡啶类药物的基本结构及主要理化性质;结构、性质与分析方法间的 关系,铈量法测定该类药物含量的原理、方法及注意事项。 二、熟悉二氢吡啶类药物的化学鉴别反应及有关物质检查的方法。 三、了解本类药物的其他鉴别试验及含量测定方法,及体内分析中样品的处理方法。 结构 ?苯基-1,4-二氢吡啶的母核 ?1,4-二氢吡啶环和NH基是必需基团,若二氢吡啶环氧化或还原,就会失去活性; ?2,6位多为低级烷基,至少一侧为低级烷基时有利于增加活性; ?3,5位酯基为必要基团,酯基中烷氧基不同时活性不同; 4位为苯环取代,苯环邻位或间位有吸电子基团时活性增强; 典型药物 1硝苯地平Nifedipine 2.尼群地平Nitrendipine
3.苯磺酸氨氯地平Amlodipine Besylate 4.非洛地平Felodipine 4. 5.拉西地平Lacidipine
6.伊拉地平Isradipine 7.尼伐地平Nilvadipine 8.盐酸尼卡地平Nicardipine Hydrochloride 二、主要理化性质
1.二氢吡啶环的还原性 二氢吡啶类药物分子中有二氢吡啶环,具有还原性。 可用氧化还原反应鉴别或氧化还原滴定法进行含量测定。 2.硝基的氧化性 苯环上大多有硝基,硝基具有氧化性,可被还原为芳伯氨基,进一步用重氮化-偶合反应鉴别。 3.二氢吡啶环氨基质子的解离性 与碱作用时,二氢吡啶环1,4-位氢均可发生解离,形成p-π共轭而发生颜色变化,利用该类反应可鉴别本类药物 4.稳定性 光不稳定性:二氢吡啶类化合物遇光极不稳定,易发生光化学歧化作用,因此二氢吡啶类药物的分析应该避光操作,同时应检查引入的特殊杂质。 5.旋光性v 二氢吡啶环的C4位多为手性碳原子,具有旋光性,但是临床药物大多为消旋体。 6.吸收光谱特性 含苯环,在紫外光区有吸收, 具特征红外吸收IR
吡啶类化合物的现状与发展
吡啶类化合物的现状与发展 ?时间:2008-12-19 14:09:00 ?来源:中国化工信息网 吡啶(Pyridine)是苯环上含有一个氮原子取代后所形成的六元杂环化合物,通常将吡啶及其衍生物统称为吡啶碱类,主要包括吡啶、2-甲基吡啶(2-MP)、3-甲基吡啶(3-MP)、4-甲基吡啶(4-MP)和2-甲基-5-乙基吡啶(MEP)。 吡啶类化合物主要用于生产除草剂百草枯(Paraquat)和敌草快(Diquat)、烟酸(Nicotinic acid)/烟酰胺(Niacinamide)及医药和农药的中间体,应用非常广泛,深加工前景相当广阔。 1、吡啶类化合物的生产方法 在吡啶类化合物中,最早被发现的是2-甲基吡啶(2-MP),1946年英国Anderson自煤焦油中分离得到,1951年Anderson从骨油中分离得到吡啶并作了鉴定,但煤焦油分离吡啶量有限,产量少,组分复杂,随着世界能源结构发生以油代煤的变化,这种分离提取方法已不适应大批量工业化生产,逐步淘汰,而由化学合成法取代。工业方法生产吡啶类化合物主要对催化剂进行不断改进,产率已由20世纪50年代的40-50%提高到了80%左右。此外,又出现了以酮、醇、烯烃、炔烃等为原料催化合成吡啶类化合物的方法,但工艺尚不成熟且产率较低。当今,世界上95%的吡啶类化合物仍然是以醛和氨作为原料,经催化合成而得。 1.1化学合成法 化学合成法是目前世界上应用最为广泛的工艺路线,绝大多数合成路线得到的是吡啶类混合物,很难得到单一产物。合成反应的最终产物随着反应条件、实验技术和催化剂的变化而变化。以羰基化合物和氨为原料的合成反应,通常采用固定床或流化床的多相催化法生产。此合成路线的反应原料价廉易得,仅需改变反应原料或原料比就能在同一装置中生产出各种吡啶化合物,有较好的经济效益和社会效益,此路线为国外工业生产采用,见表1。 表1 不同反应物所生成的吡啶化合物
4-取代氨基吡啶的合成研究[设计、开题、综述]
BI YE SHE JI (20 届) 4-取代氨基吡啶的合成研究 所在学院 专业班级化学工程与工艺 学生姓名学号 指导教师职称 完成日期年月
摘要:4-氨基吡啶属氮杂环类化合物,它是一种用于制备药物、染料等产品的重要化工原料。本文研究以2-溴吡啶为起始原料,先与间氯过氧苯甲酸氧化生成2-溴吡啶氮氧化物,接着利用混酸硝化生成2-溴-4-硝基吡啶氮氧化物,最后经Raney/Ni催化加氢还原得目标产物2-溴-4-氨基吡啶,总收率61.23%并对其结构进行了熔点和核磁氢谱表征。 关键词:2-溴-4-氨基吡啶;合成
Abstract: 4-aminopyridine compounds are kind of heterocyclic,which were used to prepare the drugs, dyes and other products as raw materials. In this paper, 2-bromo-4-aminopyridine was synthesized from 2-bomop yridine as starting material, firstly oxidated by m-chloroperoxybenzoic acid to generate 2-bromopyridine N-oxide, then nitration with mixed acid to attain 2-bromo-3-nitropyridine N-oxide, finally reduction with Raney/Ni and H2to attain the target product, the total yield was 61.23%. In ad dition, its structures has been determined by melt point and 1HNMR data. Keywords:2-bromo-4-aminopyridine;Synthesis
化学合成部专业知识培训测试题 (1-4)-071129
化学合成部专业知识培训试题 姓名:项目组:得分: 第一部分:Beilstein 查询(30 分) 1.1在检索的主界面上Allow一栏,前面五个选择后代表什么(5 分)? 1.2 1.2 看以下的检索设定,回答问题(5 分): a) 以下的检索中小图虚线代表什么意思?b) 芳环的四个Cx代表什么? c) 检索主界面的Search field两栏,LAH, >90%各代表什么?
1.3 按要求在虚框中填入检索信息(7 分) 硝基苯表方法N 吡啶氮氧化物表示方法 N R 普通芳香环:R 芳香杂环: R 任意官能团:R 卤原子通式: R 任意取代的杂原子: 1.4 在一个分子中有一个仲羟基和一个伯羟基我们需要选定一个方法将硅的保护基放在仲羟基上而不 是常规的伯羟基上,请写出检索的设定方法(5 分): 1.5 一般OTBS 比N-Boc 对酸更敏感,如何通过设定检索方法找到可以脱N-Boc 但同时保留OTBS 基 团(7 分): 1.6 由于很多杂环的单双键可以移动,一般我们如何设定以防漏检?以如下的分子画出设定方法(3 分)。 N N H N O NH 2N OH N H N NH 2 还原 OH 附加: 1.7 在检索设定一览如何利用快捷键将双键改为单键 (2 分)
第二部分:酰胺的合成(40 分) 2.1 使用碳二亚胺类缩合剂一般需要加入酰化催化剂或活化剂,如4-N,N-二甲基吡啶(DMAP )、1-羟 基苯并三氮唑(HOBt)等等,其主要原因是什么,写出DMAP 作为催化剂的过渡态(8 分). R N O R 2 N C O R Cx N Cx 1 活化剂: DMAP, HOBt + H N R 2 R 2.2 以HATU 的缩合反应为例,说明其反应机理(8 分)。 N N N N O HO R O R N H O R 1+ NH 2 R 1N N NH 2 R 1 2.3 请列举出十种以上胺的酰化方法(10 分)
氮氧化物的计算方法
燃烧产生的氮氧化物根实际燃烧条件关系密切,所以要准确估算是非常困难的。如果条件允许,尽量类比具备可比性同类型项目实测数据;在无实测情况下最好查阅相关书籍或相关研究成果计算方式,根据相关条件选择相近情况公式的计算结果准确率稍高,而且符合导则要求可找到依据出处;切记别拍脑袋。以下几种方法供大家参考。 传统方法 第一种方法: 《环境统计手册》-方品贤中的计算方法(第99和100页)和国家环保总局《关于排污费征收核定有关工作的通知》(环发[2003]64号)中氮氧化物的计算方法上述方法是一致的,假设了燃烧1kg煤产生10m3烟气。 GNOx=1.63×B×(N×β+0.000938) GNOx—氮氧化物排放量,kg; B–消耗的燃煤(油)量,kg; N–燃料中的含氮量,%;《环境保护实用数据手册》-胡名操和《环境统计手册》-方品贤统计数据一致。取0.85%。 β—燃料中氮的转化率,%。取70% 计算燃烧1t煤产生氮氧化物量为18.64kg。 第二种方法:根据N守恒,计算公式为:G=B×N/14×a×46 其中:G—预测年二氧化氮排放量; N—煤的氮含量(%),取0.85%; a—氮氧化物转化为二氧化氮的效率(%),取70%。 B—燃煤量。 计算燃烧1t煤氮氧化物产生量为19.55 kg。 第三种方法: 按照《环境保护实用数据手册》-胡名操中相关统计数据,工业锅炉燃烧1t煤产生的氮氧化物为9.08kg(第65页,表2-51);用烟煤作燃料,选锅炉铺撇式加煤产生的氮氧化物为7.5kg(第66页,表2-53);用无烟煤作燃料的锅炉燃烧,选可移动炉蓖产生的氮氧化物产生量为5kg(第67页,表2-57);美国典型的燃烧烟煤小型工业锅炉的氮氧化物7.5kg(第68页,表2-60)。 第四种计算方法: 采用《产排污系数手册》第十册:按燃烧1t煤来计算: 烟煤-层燃炉:2.94kg;285.7mg/m3;(第240页)
氮氧化物排放量计算
燃料燃烧生成的氮氧化物量可用下式核算: GNOx=(β·n+10-6Vy·CNOx) 式中:GNOx ~燃料燃烧生成的氮氧化物(以NO2计)量(kg); B ~煤或重油消耗量(kg); β~燃烧氮向燃料型NO的转变率(%),与燃料含氮量n有关。普通燃烧条件下,燃煤层燃炉为25~50%(n≥%),燃油锅炉为32~40%,煤粉炉取20~25%; n ~燃料中氮的含量(%); Vy ~燃料生成的烟气量(Nm3/kg); CNOx ~温度型NO浓度(mg/Nm3),通常取70ppm,即/Nm3。 第一种方法: 《环境统计手册》-方品贤中的计算方法(第99和100页)和国家环保总局《关于排污费征收核定有关工作的通知》(环发[2003]64号)中氮氧化物的计算方法上述方法是一致的,假设了燃烧1kg煤产生10m3烟气。 GNOx=×B×(N×β+) GNOx—氮氧化物排放量,kg;
B–消耗的燃煤(油)量,kg; N–燃料中的含氮量,%;《环境保护实用数据手册》-胡名操和《环境统计手册》-方品贤统计数据一致。取%。 β—燃料中氮的转化率,%。取70% 计算燃烧1t煤产生氮氧化物量为18.64kg。 第二种方法:根据N守恒,计算公式为:G=B×N/14×a×46 其中:G—预测年二氧化氮排放量; N—煤的氮含量(%),取%; a—氮氧化物转化为二氧化氮的效率(%),取70%。 B—燃煤量。 计算燃烧1t煤氮氧化物产生量为19.55 kg。 第三种方法: 按照《环境保护实用数据手册》-胡名操中相关统计数据,工业锅炉
燃烧1t煤产生的氮氧化物为9.08kg(第65页,表2-51);用烟煤作燃料,选锅炉铺撇式加煤产生的氮氧化物为7.5kg(第66页,表2-53);用无烟煤作燃料的锅炉燃烧,选可移动炉蓖产生的氮氧化物产生量为5kg(第67页,表2-57);美国典型的燃烧烟煤小型工业锅炉的氮氧化物7.5kg(第68页,表2-60)。 第四种计算方法: 采用《产排污系数手册》第十册:按燃烧1t煤来计算: 烟煤-层燃炉:2.94kg;m3;(第240页) 个人认为可参考:固定污染源监测质量保证与质量控制技术规范(试行)(HJ/T 373-2007)中 5.3.5 核定氮氧化物排放量 核定氮氧化物排放量时,可现场测算氮氧化物排放量,与实测氮氧化物浓度对比,若两 者相差大于±50%,应立即现场复核,查找原因。 燃料燃烧过程中氮氧化物排放量可参考公式(8)计算。 氮氧化物排放量(千克)=燃料消耗量(吨)×排放系数(千克/吨)(8) 计算燃烧过程中氮氧化物排放量时,可参考表5 系数。 生产工艺过程产生的氮氧化物排放量可按公式(9)计算。 生产工艺过程中氮氧化物排放量(千克)=工业产品年产量(吨)×排放
