第三节 腺病毒

第三节腺病毒
腺病毒(Adenovirus)是一群分布十分广泛的DNA病毒。能引起人类呼吸道、胃肠道、泌尿系及眼的疾病。少数对动物有致癌作用。
一、生物学性状
腺病毒颗粒直径60~90nm,没有囊膜,20面体立体对称,衣壳由252个克微粒组成,其中240个壳微粒是六邻体(Hexon),具有组特异性α抗原。位于20面体顶端的12个克微粒是五邻体(Penton)。每个五邻体由基底和伸出表面的一根末端有顶球的纤维组成。基底具有毒素样活性,能引起细胞病变,并使细胞从生长处脱落,具有同组共有的β抗原。纤维与病毒凝集大白鼠或恒河猴红细胞的活性有关,是型特异性γ抗原所在。核酸为以股线状DNA,分子量20~
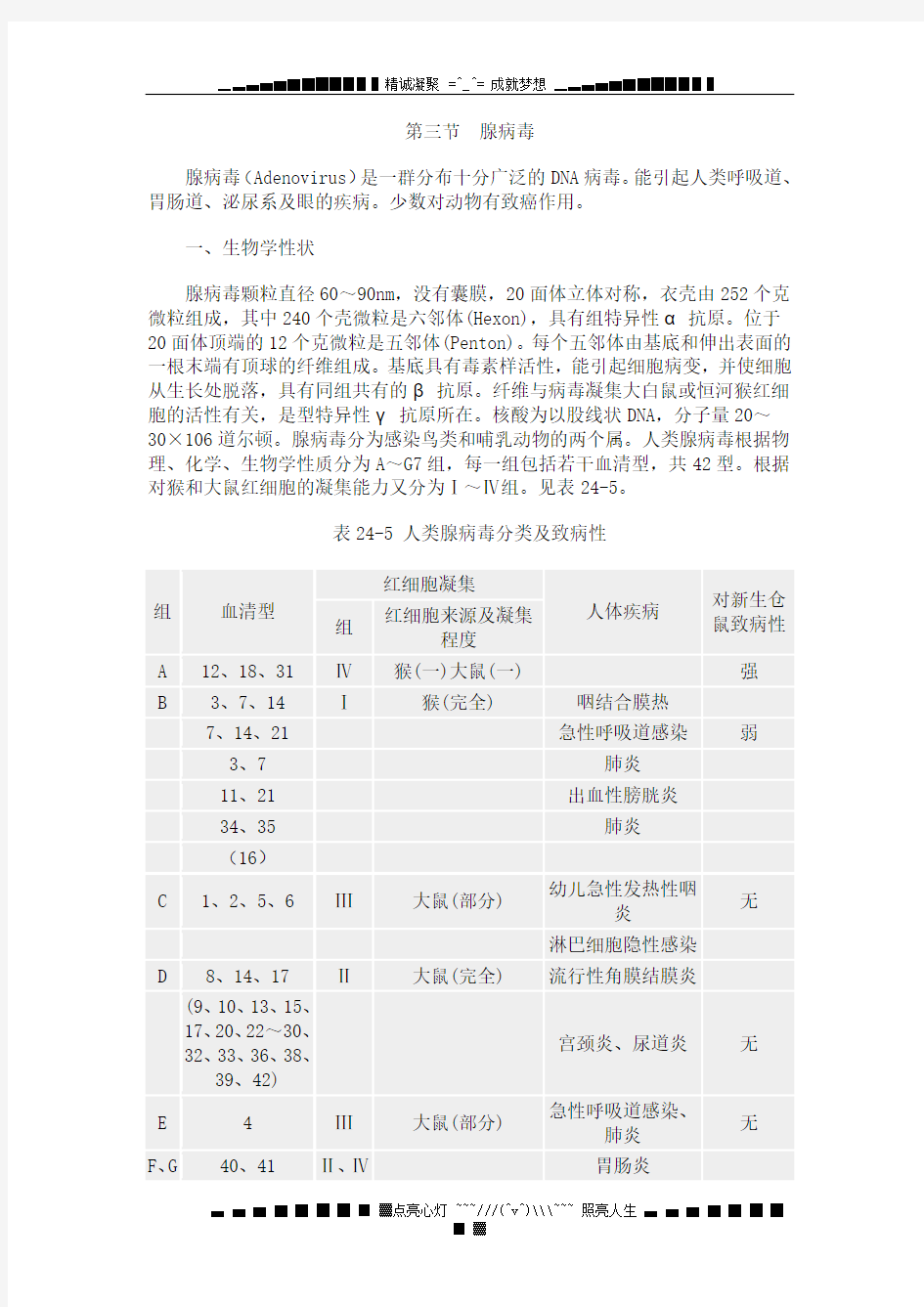
30×106道尔顿。腺病毒分为感染鸟类和哺乳动物的两个属。人类腺病毒根据物理、化学、生物学性质分为A~G7组,每一组包括若干血清型,共42型。根据对猴和大鼠红细胞的凝集能力又分为Ⅰ~Ⅳ组。见表24-5。
表24-5 人类腺病毒分类及致病性
*括弧中型别的一般不致病
人类腺病毒不能在鸡胚中增殖,上皮样人细胞系HeLa细胞和人胚原代细胞培养最敏感,能引起细胞肿胀、变圆、聚集成葡萄串状的典型细胞病变。腺病毒对酸碱度及温度的耐受范围较宽,36℃7天病毒感染力无明显下降。对脂溶剂和酶类均抵抗作用,但56℃30分钟可将其灭活。
二、致病性与免疫性
人腺病毒中部分型别有致病性,最常的是1~7型。幼儿急性上呼吸道感染约5%由腺病毒引起,成人感染很少发生于呼吸道。腺病毒致病情况见表24-5。传播以粪一口为主途径,也可通过呼吸道或污染物品传播。病毒在咽、结膜尤其是小肠上皮细胞内增殖,偶尔波及其他脏器,隐性感染常见。疾病一般为自限性,感染后可获得长期持续的型特异性免疫力,中和抗体损伤作用重要。A、B组病毒在某些新生动物可诱发肿瘤,对人未发现致癌作用。
三、微生物学检查
(一)病毒分离
自急性期病人咽、直肠、结膜等处采取标本,迅速接种敏感细胞,根据特征性细胞突变及抗原性鉴定病毒。
(二)血清学检查
取急性期和恢复期血清进行补体结合试验,抗体升高4倍或以上,可判断为近期感染。中和试验和血凝抑制试验可定型别。
四、防治原则
因存在许多健康带毒者,隔离病人对防止腺病毒传播几乎无效。第4型减毒活疫苗在美国军队中度用效果良好。疫苗就保证无致癌危险。因此,研制高纯度的亚单位疫苗是今后的主要任务。
腺病毒中文操作手册
腺病毒载体操作手册中文版 腺病毒重组系统 AdEasyTM操作手册 目录 第一章简介 1 第二章应用重组腺病毒的优点 2 第三章 AdEasyTM 技术 3 3.1 技术概况 3 3.2 AdEasyTM系统中产生重组腺病毒的时程 3 第四章主要流程 4 4.1 将基因克隆入AdEasyTM转移载体4 4.1.1 克隆的一般原则 4 4.1.2 构建重组AdEasyTM转移载体 5 4.2 细菌内AdEasyTM重组子的产生 5 4.2.1 共转化的一般原则 5 4.2.2 共转化方法 5 4.2.3 预期结果 5 4.3 AdEasyTM重组质粒的筛选和扩增6 4.4 AdEasyTM重组子转染QBI-293A 细胞 6 4.4.1 细胞铺板 6 4.4.2 磷酸钙转化技术 7 第五章常用技术 8 5.1 QBI-293A细胞培养 8 5.1.1 QBI-293A细胞的初始培养8 5.1.2 QBI-293A细胞的维持培养和增殖 8 5.1.3 QBI-293A细胞的冻存 8 5.2 QBI-293A细胞的转染和病毒空斑的产生 9 5.2.1 感染QBI-293A细胞 9 5.2.2 病毒空斑形成 9 5.2.3 琼脂糖覆盖被感染细胞 9 5.3 MOI测定 10 5.4 腺病毒感染力测定 10
5.4.1 X-Gal染色 11 5.5 重组腺病毒的筛选和纯化 11 5.5.1 挑选最佳重组腺病毒:表达和基因输送 11 5.5.2 病毒空斑挑选和小量扩增12 5.5.3 Western杂交 13 5.5.4 Southern杂交和点杂交 13 5.5.5 病毒裂解产物PCR 14 5.5.6 免疫测定 14 5.5.7 功能测定 14 5.6 病毒颗粒在QBI-293A细胞中的大量扩增 15 5.7 两次氯化铯密度梯度离心纯化重组腺病毒 16 5.7.1 不连续密度梯度离心 17 5.7.2 连续密度梯度离心 17 5.7.3 病毒溶液去盐和浓集 17 5.8 病毒滴度测定 18 5.8.1 O.D.260 nm (VP/ml) 19 5.8.2 空斑测定法 20 5.8.3 50%组织培养感染剂量法 20 第六章疑难解答 22 6.1 QBI-293A细胞培养 22 6.2 感染力测定 22 6.3 转移载体克隆 23 6.4 在BJ5183细胞中共转化和重组24 6.5 转染QBI-293A细胞 25 6.6 筛选和测定 25 6.7 在QBI-293A细胞中表达 26 6.8 重组腺病毒的扩增 26 6.9 纯化 26 6.10 病毒滴度测定 27 缩写英文全称中文全称 Ad Adenovirus 腺病毒 Ad5 Adenovirus serotype 5 血清5型腺病毒 AdV Adenoviral Vector 腺病毒载体Amp Ampicillin 氨苄青霉素 β-Gal β-Galactosidase β-半乳糖苷酶 bp Base Pair 碱基对
腺病毒详解
腺病毒是一种无包膜的双链DNA病毒,基因组长约25-45kb,理论上可编码22-40个基因。衣壳(capsid)呈规则的20面体结构,直径约80-110nm。衣壳含有240个六联体(hexon)、12个五联体(penton)及12根纤毛(fiber),除此之外还有其他一些小蛋白,如VI、VIII、IX、IIIa和IVa2等。六联体是形成病毒衣壳20个三角形面的主要蛋白,12个顶端是5个五联体亚单位和3个纤毛蛋白构成的复合物,12根纤毛以五联体蛋白为基底由衣壳表面伸出,纤毛顶端形成头节区(knob)。五联体和纤毛的头节区可与细胞表面的病毒受体结合,在病毒感染细胞过程中起着非常重要的作用。 腺病毒含13%DNA和87%的蛋白质,病毒体分子量约为175×106。病毒基因组为线状双链DNA,大约含35kb~36kb,腺病毒12、18 和31型的DNA组成中,G+C mol%最低(48%~49%),属于对动物具有高致癌性基因型。腺病毒1、2、4、5、8等型的G+C mol%较高(61%),致癌性反而低或无。这是一种用于人腺病毒分离株的分组的标准,根据其基因同源性将人腺病毒分为A~F等6组。 腺病毒的基因组以线性的双链DNA形式存在,由蛋白VII和一种称为mu的小蛋白紧密地环绕在其周围,起到类组蛋白样的作用。另一种蛋白V将这种DNA-蛋白复合物连接起来,并通过蛋白VI与病毒衣壳连接在一起。在两条链的5′端各以共价键结合着一个被称为DNA 末端蛋白(pTP)复合物(DNA-TPC)的特化的结构,与腺病毒复制密切相关。腺病毒基因组的两端各有一段100bp的反向末端重复序列(ITR),是复制的起始位点。在左端ITR的3′侧有一段长约300bp的包装信号(ψ)介导腺病毒基因组包装入病毒衣壳。对腺病毒而言,只有包括两端的ITR和包装信号(ψ)的约0.5kb的序列是顺式作用元件,也就是说必须由腺病毒载体自身携带,而其他的30余种蛋白都可以通过辅助病毒(或细胞)反式补足。 病毒蛋白约11种(TP和PⅠ~PⅩ),其中有4种蛋白(病毒多肽PⅤ、PⅦ,末端蛋白TP、酶蛋白PⅩ)与病毒基因构成病毒核心,多肽PⅦ是主要的核心蛋白,如同组蛋白一样包裹病毒基因DNA。构成病毒衣壳的蛋白质约7种。多肽PⅡ是病毒衣壳中最丰富和最主要成分,六邻体是由3个PⅡ分子紧密相连组成。多肽PⅥ、PⅧ在六邻体与病毒核心之间形成连接桥,并与多肽PⅨ一起稳定着六邻体分子的晶格排列。5个分子多肽PⅢ相连构成五邻体的基座蛋白,PⅢa为五邻体的周围蛋白,也参与衣壳的组成,五邻体通过PⅤ与病毒核心相连。多肽PⅣ主要构成病毒三聚体纤突,纤突与病毒血凝活性相关,因血凝素(纤突)具有型特异性,常用血凝抑制试验(HI)对临床分离株进行分型。 分类及自上个世纪50年代发现并成功分离腺病毒以来,已陆续发现了100余个血清型,其中人腺病毒有49种,分为A、B、C、D、E 和F六个亚群(subgroup)。基因治疗常用的人的2型及5型腺病毒在血清学分类上均属C亚群,在DNA序列上有95%的同源性。二者的增殖能力非常强,滴度通常可以达到109pfu (plaque forming unit)/ml,其在单个细胞中的基因组拷贝数可达104(约占细胞总DNA的10%)。病毒颗粒比较稳定,通过CsCl梯度离心可以达到1010~1011pfu/ml,满足动物实验的要求。
禽腺病毒感染
禽腺病毒感染 禽腺病毒感染:是由禽腺病毒引起的一种亚临床性传染病,多数为长期潜伏带毒,引起症状不明显的潜伏感染,少数可致病。 禽腺病毒可以分为三群: 第Ⅰ群:包括传统的腺病毒和从鸡、火鸡、鹅和其它禽类获得的腺病毒分离物,它们具有一种共同的抗原群; 第Ⅱ群:包括火鸡出血性肠炎病毒、雉鸡(zhi俗称野鸡)大理石脾和鸡大脾病病毒(有人认为,鸡大肝大脾病的病源为:鸡戊型肝炎病毒,是戊肝病毒科戊肝 病毒属的一个成员),这些病毒共有一种与Ⅰ群病毒不同的抗原群; 第Ⅲ群:是与产蛋下降综合征(EDS—76)有关的一些病毒和从鸭获得的相似病毒,它们只是部分含有Ⅰ群病毒的共同抗原 在此,主要介绍“鸡包涵体肝炎”: 《鸡包涵体肝炎》 一、流行病学: 鸡包涵体肝炎:是由鸡腺病毒引起的鸡的一种急性传染病。 也有人称之鸡(Ⅰ群)腺病毒感染。 其主要特征是:病鸡在发生肝炎的同时,伴有出血性变化和再生不良性贫血。 种鸡发生感染时,本身可能无任何临诊症状,但所产种蛋的孵 化率下降,孵化的雏鸡死亡率显著增高。 试验感染证明,出生雏鸡可感染发病,并且雏鸡的日龄越小易感性越强。但在自然条件下,则以3—15周龄的鸡发生较多,成年鸡也可感染,但一般没有可见的临诊症状。 该病的病原体为禽腺病毒科Ⅰ群禽腺病毒属中的“鸡腺病毒”。 目前,分离到的Ⅰ群禽腺病毒共12个血清型,各型之间大多具有较一致的抗原关系。 目前认为鸡腺病毒2型、3型、4型、5型、8型等血清型是鸡包涵体肝炎的主要病原体。 病毒可以通过病鸡的粪便排出,健康鸡直接与病鸡接触或接触病鸡的粪便而感染,并且可以经蛋传染给下一代。
二、临床症状与剖检病变: 病鸡表现:精神沉郁,食欲减退或不食,翅膀下垂,羽毛蓬乱,双脚麻痹,排灰白色或粉灰色水样粪便等,临死前有的发出鸣叫声,并出现角弓反张 等神经症状。 鸡群一旦感染本病,大部分鸡在7—10天内相继发病,发病3—5天死 亡达到高峰,持续3—5天后突然停息。病程10—16天,死亡率一般 为10%左右,经蛋传递时,雏鸡的死亡率克高达40%。 剖检症状:1、皮下、胸肌和腿部肌肉有明显的出血; 2、尸体表现贫血、黄疸; 3、肝脏肿大,边缘钝圆,质地脆弱,呈黄褐色,肝被膜下有较大面积 淤血和出血灶,出血点或出现斑常呈线状或芒状,在出血点之间有 灰黄色坏死灶,使肝脏外观呈斑驳状; 4、脾脏肿大,常见有灰白色斑点; 5、肾脏肿大、苍白,表面有出血点,肾小管有尿酸盐沉积; 6、长骨骨髓呈黄白色,有的呈灰白色胶冻状。 7、组织病理学的特征性变化是肝细胞发生广泛性的脂肪变性和坏死, 细胞核内有嗜酸性包涵体。 三、临床诊断: 根据本病流行特点、临床症状、病例剖检变化可初步诊断;但要作出确切诊断必须进行实验室检测。 四、鉴别诊断: 诊断时应注意与“传染性法氏囊病”、“脂肪肝综合征”、“弯杆菌性肝炎”等相 区别: 1、传染性法氏囊病:同样有严重的肌肉出血和其他类似的症状; 但法氏囊具有肿胀或萎缩或有胶冻样水肿的特征性病变;腺 胃与肌胃交界处有新鲜的出血带; 2、脂肪肝综合征:虽然表现有突然死亡,营养良好,肝脏肿大,被膜下也有出血 点等,但多是由于饲喂高能量饲料引起的代谢性疾病,多为零 星发生,无传染性。
腺病毒质量检定方法
一、无菌检查 (2) (一)薄膜过滤法 (3) (二)直接接种法 (3) 二、支原体检查 (4) 第一法细胞培养法 (4) 第二法指示细胞培养法(DNA染色法) (5) 三、细胞内、外源病毒因子检查 (7) 1 细胞形态观察及红细胞吸附试验(简称血吸附试验) (7) 2 不同细胞传代培养法检测病毒因子 (7) 3 接种动物和鸡胚法检测病毒因子 (8) 4 逆转录病毒及其他内源性病毒或病毒核酸的检测 (8) 1)逆转录酶活性测定 (8) 2)透射电镜检查 (11) 3)感染性试验 (11) 5 特殊外源病毒因子的检测 (11) 四、致瘤性检查 (11) 五、感染效率和病毒的产量等的测定 (12) 六、细胞鉴别(染色体检查) (12) 七、病毒敏感性检查 (13) 八、细胞功能检查 (13) 九、重组腺病毒滴度的测定 (14) 十、病毒比滴度(比活性IU)测定 (16) 十一、E1A区、E2B区、AA V及插入基因的检测 (16) 一)E1A区的检测 (16) 二)E2B区的检测 (17) 三)AA V的检测 (18) 四)插入基因的检测 (18) 十二、病毒外源因子检查 (19) 十三、内毒素测定 (19) 供试品溶液的制备 (19) 确定最大有效稀释倍数(MVD) (20) 方法1 凝胶法 (20) 鲎试剂灵敏度复核试验 (21) 干扰试验 (21) 检查法 (23) 十四效力试验插入基因表达活性测定,插入基因的生物学活性测定 (24) 十五复制型病毒(RCA)检测A549细胞检测法 (24) 十六腺相关病毒的检测采用PCR法 (26) 十七残留量测定应根据生产工艺及成品的添加成份,对有潜在危险性的成份进行残留量检测: (27) 1残余宿主DNA含量测定 (27) 2残余牛血清白蛋白含量测定 (27) 3残余核酸酶含量测定 (28) 十八重组病毒制品的稳定性试验 (28)
腺病毒中文操作手册
腺病毒载体操作手册中文版腺病毒重组系统 AdEasyTM操作手册 目录 第一章简介1 第二章应用重组腺病毒的优点2 第三章AdEasyTM技术3 3.1技术概况3 3.2AdEasyTM系统中产生重组腺病毒的时程3 第四章主要流程4 4.1将基因克隆入AdEasyTM转移载体4 4.1.1 缩写英文全称中文全称 AdAdenovirus腺病毒 Ad5Adenovirusserotype5血清5型腺病毒AdVAdenoviralVector腺病毒载体 AmpAmpicillin氨苄青霉素 β-Galβ-Galactosidaseβ-半乳糖苷酶 bpBasePair碱基对 BSABovineSerumAlbumin小牛血清白蛋白cDNAComplementaryDNA互补DNA cccDNAClosedCircularCoiledDNA闭环螺旋DNA CPECytopathicEffect细胞病理效应CsClCesiumChloride氯化铯 DMEMDulbecco’sModifiedEagleMediumDMEM培养基DMSODimethylSulfoxide二甲基亚砜DTTDithiothreitol二硫苏糖醇EDTAEthyleneDiamineTetraaceticAcid乙二胺四乙酸EtBrEthidiumBromide溴化乙锭FBSFetalBovineSerum胎牛血清 HrHour小时 ITRInvertedTerminalRepeat反向末端重复KanKanamycin卡那霉素 kbKilobases千碱基对 KDaKiloDaltons千道尔顿LBLuria-Bertani(broth)LB培养基MCSMultipleCloningSite多克隆位点 MinMinute分钟 MOIMultiplicityofInfection(Virus/Cell)感染复数mRNAMessengerRNA信使RNA MWCOMOIecularWeightCut-off PAGEPolyAcrylamideGelElectrophoresis聚丙烯凝胶电泳PBSPhosphateBufferedSaline磷酸盐缓冲液PFUPlaqueFormingUnit空斑形成单位 piPostInfection感染后RCAReplicationCompetentAdenovirus增殖性腺病毒RITRRightInvertedTerminalRepeat右侧反向末端重复SDSSodiumDodecylSulfate十二烷基硫酸钠TBETrisBorate/EDTA三羟甲基氨基甲烷硼酸盐/乙二胺四乙酸 TCID50TissueCultureInfectiousDose5050%组织培养感染剂量 TCPTotalCellularProtein细胞总蛋白 TETris/EDTATE溶液 wtWildType野生型 X-Gal5-bromo-4-chloro-3-indolyl-D-Galactopyranoside5-溴-4-氯-3-吲哚-β-D-半乳糖苷 第一章简介 当今基因输送技术的发展日趋复杂,一些治疗药物(生长激素、干扰素、抗病毒和抗癌复合物)和诊断性蛋白(单克隆抗体)的设计、发展与合成需要更高效的基因输送工具。人类基因组计划和正不断发展的基因治疗同样急需发展快速有效和治疗性的分析工具。为解决这一问题,基因输送技术(通常使用病毒载体如增殖缺陷的腺病毒)通过基因工程不断发展,致力于生产基因表型药物。重组腺病毒提供了一类在基因转移系统发展中有极大潜力的新的生物治疗剂。 1953年对普通感冒病因的探索和研究导致了腺病毒的发现。迄今为止已发现了40多种不同血清型和93种不同种类的腺病毒,它们通常感染眼、呼吸道或胃肠上皮(Fields等,1996)。1977年,FrankGraham博士建立了一种细胞株,可在无辅助病毒的情况下产生重组腺病毒(Graham等,1977)。此后,腺病毒载体作为极具潜力的哺乳动物基因转移载体而得到广
腺病毒中文操作手册
腺病毒中文操作手 册
腺病毒载体操作手册中文版腺病毒重组系统 AdEasyTM操作手册 目录 第一章简介 1 第二章应用重组腺病毒的优点 2 第三章AdEasyTM 技术 3 3.1 技术概况 3 3.2 AdEasyTM系统中产生重组腺病毒的时程 3 第四章主要流程 4 4.1 将基因克隆入AdEasyTM转移载体 4 4.1.1 克隆的一般原则 4 4.1.2 构建重组AdEasyTM转移载体5 4.2 细菌内AdEasyTM重组子的产生5 4.2.1 共转化的一般原则 5 4.2.2 共转化方法 5 4.2.3 预期结果 5 4.3 AdEasyTM重组质粒的筛选和扩增 6 4.4 AdEasyTM重组子转染QBI-293A 细胞 6 4.4.1 细胞铺板 6 4.4.2 磷酸钙转化技术7 第五章常见技术8 5.1 QBI-293A细胞培养8 5.1.1 QBI-293A细胞的初始培养8 5.1.2 QBI-293A细胞的维持培养和增殖8 5.1.3 QBI-293A细胞的冻存8 5.2 QBI-293A细胞的转染和病毒空斑的产生9 5.2.1 感染QBI-293A细胞9 5.2.2 病毒空斑形成9 5.2.3 琼脂糖覆盖被感染细胞9 5.3 MOI测定10 5.4 腺病毒感染力测定10
5.4.1 X-Gal染色11 5.5 重组腺病毒的筛选和纯化11 5.5.1 挑选最佳重组腺病毒:表示和基因输送11 5.5.2 病毒空斑挑选和小量扩增12 5.5.3 Western杂交13 5.5.4 Southern杂交和点杂交13 5.5.5 病毒裂解产物PCR 14 5.5.6 免疫测定14 5.5.7 功能测定14 5.6 病毒颗粒在QBI-293A细胞中的大量扩增15 5.7 两次氯化铯密度梯度离心纯化重组腺病毒16 5.7.1 不连续密度梯度离心17 5.7.2 连续密度梯度离心17 5.7.3 病毒溶液去盐和浓集17 5.8 病毒滴度测定18 5.8.1 O.D.260 nm (VP/ml) 19 5.8.2 空斑测定法20 5.8.3 50%组织培养感染剂量法20 第六章疑难解答22 6.1 QBI-293A细胞培养22 6.2 感染力测定22 6.3 转移载体克隆23 6.4 在BJ5183细胞中共转化和重组24 6.5 转染QBI-293A细胞25 6.6 筛选和测定25 6.7 在QBI-293A细胞中表示26 6.8 重组腺病毒的扩增26 6.9 纯化26 6.10 病毒滴度测定 27 缩写英文全称中文全称 Ad Adenovirus 腺病毒Ad5 Adenovirus serotype 5 血清5型腺病毒AdV Adenoviral Vector 腺病毒载体Amp Ampicillin 氨苄青霉素β-Gal β-Galactosidase β-半乳糖苷酶bp Base Pair 碱基对BSA Bovine Serum Albumin 小牛血清
重组腺病毒常见问题解答(FAQs)解析
重组腺病毒常见问题解答(FAQs) ?Q1. 使用重组腺病毒需要的生物安全级别? ?Q2. 怎么确定我所用的细胞模型可以感染腺病毒? ?Q3. 感染细胞时腺病毒的最佳浓度? ?Q4. 感染腺病毒时所需要的培养基的量? ?Q5. VP,PFU,IFU的区别?哪一个能更好地反映所使用的有活性的病毒的量? ?Q6. 病毒的滴度是如何测定的? ?Q7. 对于体外实验(细胞实验)CsCl纯化或层析柱纯化有必要么? ?Q8. 重组腺病毒的推荐存储条件是什么? ?Q9. 腺病毒表达系统承载外源基因的容量? ?Q10. 腺病毒有多种血清型,哪一种是基因传递中最普遍使用的? ?Q11. 什么是RCAs? ?Q12. 目前存在的许多病毒载体系统,包括:腺病毒、逆转录病毒和慢病毒,针对我的实验应该使用哪个系统? Q1.使用重组腺病毒需要的生物安全级别? 答:我们所提供的重组腺病毒是E1/E3区缺失的复制缺陷型病毒。根据NIH官方的参考信息,重组腺病毒的生物安全等级被确定为II级,您只需要BL-II级实验设施,值得注意的是,大多数实验室都具备BL-II级的实验设施。野生型腺病毒可复制,能引起感冒和很强的免疫反应,通常不会引起很严重的疾病。要想获得更多生物安全信息,请参考网站https://www.360docs.net/doc/8f4126317.html, 返回Q2.怎么确定我所用的细胞模型可以感染腺病毒? 答:腺病毒有很广泛的宿主范围。它可以感染人类或者其他哺乳动物细胞系或原代细胞,包括可分裂的和不可分裂的细胞。只有少数细胞系不被感染。一些淋巴细胞系对腺病毒有更强的抵抗性,因此需要大量的病毒来感染细胞。为了客户的
方便,我们提供含有报告基因的病毒,如Ad-CMV-B-gal 和Ad-CMV-GFP从而方便的进行您的预实验。 返回 Q3.感染细胞时腺病毒的最佳浓度? 答:要得到最佳的实验结果,确定腺病毒的最佳用量是非常重要的。如果用量不足,那么不能达到100%的感染效率,如果用量太高,会对细胞有毒害作用或者其他不可预测的效应。我们应该尽量用最小浓度的病毒来达到100%的基因传递效率。这个最佳的浓度因不同的细胞类型而有显著差异。为了确定你的细胞系的最适病毒用量,可以用带报告基因的腺病毒做预实验,如AdCMV-B-gal 或者AdCMV-GFP。用不同稀释倍数的报告基因病毒感染细胞,在感染1-2天后检测感染效率。可以通过B-gal染色或者通过在荧光显微镜下观察细胞的GFP的表达情况来确定可达到100%感染效率但又不会引起细胞表型变化病毒浓度范围。 我们已经针对多种细胞系做了预实验,加入已混合病毒的培养基,6-8小时或者过夜。对于大多数细胞系来说病毒浓度在2 x 105 - 1 x 106 IFU/PFU (infectious unit)/ml培养基都能得到10%的感染效率而且不会有副作用。我们推荐在您实验系统中用报告基因病毒重新摸索一下最适培养基用量。 返回 Q4.感染腺病毒时所需要的培养基的量? 答:作为参考,我们推荐您按照如下的量加培养基(已混入病毒): 10cm培养皿:8-10ml/孔6孔板:1ml/孔12孔板:0.5ml/孔24孔板:0.2ml/孔 返回 Q5. VP,PFU,IFU的区别?哪一个能更好地反映所使用的有活性的病毒的量? 答:VP(Viral particles) 反映病毒颗粒的总数(包括活病毒和死病毒),由于在病毒制备过程中,每次活/死病毒比率都不同,VP并不能反映有活性的病毒的数量。 PFU(plaque formation unit)代表可感染的或者活病毒的数量。能反映实验中所需要的病毒的量。 IFU(infectious unit)相当于PFU 大多数情况下所制备的病毒,VP/PFU比值在20:1到50:1范围。 应用VP(viral particles)做单位会与实际应用的活病毒的数量有很大出入。用IFU或者PFU做单位会得到比较一致的结果。 返回
腺病毒常见问题与解答
腺病毒常见问题与解答 1、腺病毒载体对目的基因的长度是否有要求? 有要求。对E1和E3双缺失的腺病毒载体,比如AdMax的Kit C、Kit D等,其总包装的 外源片断要求小于8 kb。而对于只有E1缺失或E3缺失的载体,比如Kit A、Kit B等,外源片断要求小于5 kb。注意,外源片断指包括启动子、外源基因和poly A等在内的整个插入片断。 2、我的试验需要多少总量的腺病毒载体? 腺病毒介导外源基因的基因治疗研究一般分为体外培养细胞试验(体外试验)和动物试验(体内试验)两部分,不同的实验设计所需要的病毒量也不尽相同。根据经验,完成一个完 整的肿瘤治疗实验需要腺病毒的病毒量总量约为3×1012 VP左右. 3、如何提高腺病毒的活性? 提高腺病毒的活性,关键应该是在病毒包装过程和扩增过程。纯化过程只是去掉有缺陷的病毒和细胞碎片等容易引起机体免疫反应的过程,如果扩增的病毒滴度高,那么纯化后就会更高的。 4、克隆到转移载体的基因中的5’和3’UTR(未翻译区)的额外的碱基会影响蛋白表达吗? UTR尽可能短一些,特别是在5’要避免在mRNA里形成二级结构。在起始密码子ATG 前面可以加一小段(6-9bp)的碱基序列可以增强目的基因的表达,比如Kozak序列(GCCGCCACCATG)。 5、如何判断腺病毒载体是否能高效感染某种细胞? 参照文献报道是很简单的办法,也可以用带报告基因的腺病毒先行预实验。 Ad5能高效感染绝大多数人类、小鼠等的体细胞(包括分裂和非分裂细胞),比如肝、肌肉、神经组织等。但对血液系统来源细胞和某些肿瘤细胞,比如乳腺癌、白血病细胞等,感染效率较低。 6、腺病毒载体在体外实验(in vitro)中应注意哪些问题? 1)由于细胞表面受体的差异,腺病毒载体在不同的细胞中转导效率不同。可根据文献报道或用带报告基因的腺病毒载体判断病毒用量。 2)在细胞处于对数生长期时感染病毒效果较好。避免在消化细胞后立刻感染病毒,因为此时细胞膜上的病毒受体往往受到了暂时的破坏。培养过夜后再感染病毒,效果较好。 3)选择适当的转导MOI(病毒感染单位数/细胞数),可以在MOI为0.1~1000范围内进行试验( 10倍比稀释)。 4)感染病毒时细胞培养液的体积尽量小一些,以完全覆盖细胞为准。如24孔板可用200ul,6孔板1ml。 5)感染时间为90分钟,每15分钟轻轻晃动培养液一次,以混匀。 6)选择适当表达检测时间,一般感染病毒24h后就能检测到目的基因的表达,48小时表达达到较高水平。 7、用于体内试验的腺病毒,是否要求纯化? 是的,病毒纯化是很必要的。因为细胞裂解液包含有缺损颗粒、大量的腺病毒fiber和penton蛋白(细胞毒素)、培养基、血清以及细胞碎片。这些杂质如果被注入动物体内,会
腺病毒肺炎有哪些表现及如何诊断
腺病毒肺炎有哪些表现及如何诊断? 【临床表现】 病灶性或融合性坏死性肺浸润和支气管炎为本病主要病变。肺炎实化可占据一叶的全部,以左肺下叶最多见。肺切面上从实化区可挤压出黄白色坏死物构成的管型样物,实化以外的肺组织多有明显的气肿。镜检所见病变,以支气管炎及支气管周围炎为中心,炎症常进展成坏死,渗出物充满整个管腔,支气管周围的肺泡腔内也常有渗出物,大都为淋巴、单核细胞、浆液、纤维素,有时伴有出血,而中性白细胞则很少,肺泡壁也常见坏死。炎症区域的边缘可见支气管或肺泡上皮增生,在增生而肿大的上皮细胞核内常可见核内包涵体,其大小近似正常红细胞,境界清晰,染色偏嗜酸性或嗜两色性,其周围有一透明圈;核膜清楚,在核膜内面有少量的染色质堆积;但胞浆内无包涵体,也无多核巨细胞形成,因此,在形态学上可与麻疹病毒肺炎及肺型巨细胞包涵体病区别。此外,全身各脏器如中枢神经系统及心脏均有间质性炎症与小血管壁细胞增生反应。 根据1959~1963年北京245例经病毒学证实的3、7型婴幼儿腺病毒肺炎的分析,其临床特点可概述如下。 1、症状
(1)起病:潜伏期3~8天。一般急骤发热,往往自第1~2日起即发生39℃以上的高热,至第3~4日多呈稽留或不规则的高热; 3/5以上的病病例最高体温超过40℃。 (2)呼吸系统症状:大多数病儿自起病时即有咳嗽,往往表现为频咳或轻度阵咳,同时可见咽部充血,但鼻卡他症状较不明显。呼吸困难及发绀多数开始于第3~6日,逐渐加重;重症病例出现鼻翼扇动、三凹征、喘憋(具有喘息和憋气的梗阻性呼吸困难)及口唇指甲青紫。叩诊易得浊音;浊音部位伴有呼吸音减低,有时可听到管性呼吸音。医学教育`网搜集整理初期听诊大都先有呼吸音粗或干罗音,湿啰音于发病第3~4日后出现,日渐加多,并经常有肺气肿征象。重症病儿可有胸膜反应或胸腔积液(多见于第2周),无继发感染者渗出液为草黄色,不混浊;有继发感染时则为混浊液,其白细胞数多 超过10×109/L. (3)神经系统症状:一般于发病3~4天以后出现嗜睡、萎靡等,有时烦躁与萎靡相交替。在严重病例中晚期出现半昏迷及惊厥。部分病儿头向后仰,颈部强直。除中毒性脑病外,尚有一部腺病毒所致的 脑炎,故有时需作腰穿鉴别。 (4)循环系统症状:面色苍白较为常见,重者面色发灰。心律增快,轻症一般不超过每分钟160次,重症多在160~180次,有时达200次以上。心电图一般表现为窦性心动过速,重症病例有右心负荷增加和T波、ST段的改变及低电压,个别有1~2度房室传导阻滞,
病毒滴度测定
病毒滴度测定 有很多名词都用来描述病毒溶液的滴度。 1. VP(病毒颗粒)或OPV(光学颗粒单位) 2. GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似) 3. PFU(空斑形成单位) 4. TCID50(50%组织培养感染剂量) 不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。 1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。 2. GTU则测定感染后能表达报告基因的细胞数量。这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。如果重组腺病毒含有报告基因如GFP 或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。 3. PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。 4. TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。 所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。最近,出现了两种测定病毒滴度的改良方法。一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。这两个实验室所得到的结果更为稳定,并证实以前的方法低估了病毒保存液中感染性病毒颗粒的数量。迄今为止,尚无一种方法被控制机构认定为测定滴度的标准方法。 对于同一管病毒保存液,不同的方法所得到的结果往往相差100倍以上,典型的数据见表6。所有结果都只是大概的,目前最有效的生物学方法(离心法感染)能检测到1个感染性颗粒/2个颗粒。下一部分,我们将详细描述3种不同的测定病毒滴度的方法。选择滴定方法要考虑的关键因素包括可重复性、稳定性、敏感性、易用性和耗时。无论选择那种方法,稀释和滴定过程必须重复操作以得到精确结果。一般来说,用TCID50方法得到的病毒保存液的滴度应为: 106~107 第一代细胞经冻融后 108~109 100倍数量的细胞经过冻融后 1010~1011 用氯化铯方法纯化后 表6:各滴度测定方法特性 方法类型时间可重复性滴度* 评注 VP 物理学方法 2小时好 5×1012 GTU 生物学方法 2天可变 2×1011
自噬监测——LC3双标腺病毒(完整版)
自噬双标腺病毒(mRFP-GFP-LC3)使用指南 1 自噬双标腺病毒(mRFP-GFP-LC3)使用指南 背景: 自噬是细胞内的一种“自食(Self-eating )”的现象,凋亡是“自 杀(Self-killing )”的现象,二者共用相同的刺激因素和调节蛋白, 但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指 膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包 裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与 溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳 态和细胞器的更新。目前文献对自噬过程进行观察和检测常用的策略 和手段有:通过western blot 检测LC3的剪切;通过电镜观测自噬体 的形成;在荧光显微镜下采用GFP (-RFP )-LC3等融合蛋白来示踪自 噬体形成以及降解。近几年对自噬流的研究日趋增多,针对于此我们 汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬(流) 的mRFP-GFP-LC3腺病毒,mRFP 用于标记及追踪LC3,GFP 的减弱可指 示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP 荧光蛋白对 酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检 测到红色荧光。这种串联的荧光蛋白表达载体系统直观清晰的指示了 细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利 器。
mRFP-GFP-LC3腺病毒的操作 收到病毒后的处理 (一)、腺病毒的储存 1、腺病毒采用冰袋运输。 (1)、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进 行分装; (2)、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱 保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。 2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病 毒滴度10%)。建议不要在-20℃下长期保存。如果病毒储存时间 超过6个月,应该重新测定病毒滴度。 3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小 包装病毒产品(购买时请提出)。 (二)、腺病毒的稀释需要稀释病毒时,将病毒取出后置于冰上融解,使用培养目的细胞 用PBS 或培养基稀释到所需浓度后混匀分装后4℃保存,并尽快用于 实验(尽量一周内用完),动物实验建议使用注射用平衡液来稀释, 并尽快用完。 感染目的细胞 2
腺病毒包装操作手册
汉恒重组腺病毒操作手册 目录 腺病毒安全使用和注意事项 腺病毒储存与稀释的注意事项 一、整体实验流程 二、实验材料 三、腺病毒包装和浓缩 四、重组腺病毒滴度(PFU)的测定 五、重组腺病毒感染目的细胞 六、重组腺病毒用于动物实验 附1:汉恒生物腺病毒载体 附2:腺病毒感染细胞最佳MOI的摸索(表达荧光的病毒)附3:汉恒生物常见三种病毒感染目的细胞比较
腺病毒安全使用和注意事项 ?腺病毒安全使用注意事项(*非常重要!!!*) 1)腺病毒相关实验请在生物安全柜(BL-2级别)内操作。 2)操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。 3)操作病毒时需要特别小心病毒溅出。如果操作时超净工作台有病毒污染,请立即用 70%乙醇加1%的SDS溶液擦拭干净。 4)接触过病毒的枪头、离心管、培养板及培养瓶请用84消毒液浸泡后统一处理。 5)如实验过程中需要离心,应使用密封性好的离心管,必要时请用封口膜封口后离心。 6)病毒相关的废弃物需要特殊收集,统一经高温灭菌后处理。 7)实验完毕后请用香皂清洗双手。 ?腺病毒储存与稀释的注意事项 1)腺病毒的储存 收到病毒液后若在短期内使用,可将病毒放置于4℃保存(一周内使用完最佳);如需长期保存请分装后放置于-80 ℃。 注:
a.反复冻融会降低病毒滴度(每次冻融会使病毒滴度降低10%~50%),因此在病毒使用过程中 尽量避免反复冻融。汉恒生物对病毒已进行分装(200 μl/tube),收到后请直接放置-80℃冰箱保存即可。 b.若病毒储存时间超过6个月,汉恒生物建议在使用前重新测定病毒滴度(参见附表2-慢病毒滴 度测定方法)。 2)腺病毒的稀释 需要稀释病毒时,请将病毒取出置于冰浴融解后,使用PBS或培养目的细胞用的无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后置于4℃保存(一周内使用完最佳)。 重组腺病毒是一种复制缺陷的腺病毒载体系统,在基因治疗、基础生命科学研究等领域被广泛应用。重组腺病毒具有以下几个显著优点:感染范围广,几乎可以感染所有的细胞系、原代细胞和部分组织;感染效率高达100%,可全面超越其他病毒载体工具和脂质体转染;对外源基因容载能力大(可以高达8Kb);不整合基因组;滴度高,操作方便。因此,重组腺病毒是一种最具有潜力的基因递送工具。 目前常用的腺病毒载体基于人腺病毒5型(Ad5),其基因组是36Kb长的线性双链DNA。腺病毒可通过自身的纤维(fiber)和细胞表面的受体结合被内吞进入细胞,然后从内吞体(endosome)转移到细胞质和细胞核内,借助细胞的转录和翻译机器启动病毒的复制组装。一个完整的病毒生活周期会引发细胞死亡从而释放出病毒粒子。 目前最常用的腺病毒包装体系有AdEasy和AdMAX两种,其共同特点是目的基因首先克隆到穿梭载体,然后再重组到腺病毒的大骨架上。这两个系统均具有腺病毒早期转录复制基因E1和E3的缺陷(ΔE1, ΔE3),其中E3基因对病毒产生并非必需。因此,腺病毒包装
1.1.6+腺病毒感染
疾病名:腺病毒感染 英文名:adenovirus infections 缩写: 别名: 疾病代码: ICD :B97.0 概述:可引起人、猿、马、猪、羊、狗等感染。实验发现可引起动物致癌;未证实其可致人类肿瘤,但可引起人类多种感染性疾病。 流行病学:病毒由病人及隐性感染者通过粪便及呼吸道分泌物排出,可经气溶胶、密切接触及粪-口途径传播眼、鼻、口黏膜为入侵途径。感染者半数无症状,儿童的呼吸道疾病约5%~10%由腺病毒引起。 病因:目前发现腺病毒有6个亚型(A~F)和47个不同的血清型(按中和试验分型)。已知约20余种亚型可感染人类。病毒为直径70~80nm 的20面体衣壳,内核含双股DNA。对热和酸不稳定。由于不含脂质,对胆盐等脂质溶解剂抵抗力强,故能在肠道中存活。不同亚型可引起不同感染,见表1。 发病机制:呼吸道病毒侵入人的呼吸道表面的纤毛上皮细胞后,在其内复制和扩散并直接引起受染细胞损伤,造成局部病变或产生全身毒血症状。某些病毒感染的组织损伤可能由机体免疫反应所介导,如呼吸道合胞病毒对呼吸道纤毛上皮细胞的直接破坏最轻,但能引起婴幼儿严重呼吸道疾病;最易罹患的年龄正是母传C D D C D D C D D C D D
抗体水平最高的阶段;接种疫苗后反而使自然感染者的病情加重等均提示其发病可能与免疫反应有关。呼吸道病毒感染的病理改变有鼻、咽、喉黏膜充血、水肿、渗出与单核细胞浸润,部分细胞可发生变性、坏死、脱落。上皮细胞胞质或胞核内可查见包涵体。病变程度与病毒种类、型别和感染部位有关。轻者数天后上皮细胞可再生而恢复正常。如病变累及细支气管,可发生上皮细胞坏死、剥脱,细支气管壁有广泛单核细胞浸润,纤维蛋白、细胞碎片和黏稠的黏液可堵塞管腔而致肺不张、肺气肿。病毒性肺炎最初表现为纤毛进行性减少,上皮细胞空泡形成,继之上皮细胞变性,肺泡实质性坏死、萎陷,肺泡壁也可见坏死和增厚,间质水肿和单核细胞、淋巴细胞浸润。并发细菌性感染时,可见黏膜充血,中性粒细胞浸润和黏液脓性分泌物,严重者可发生肺脓肿、败血症及多个器官的化脓性变化。 临床表现:潜伏期4~5天。 1.儿童中最常见的临床表现 (1)呼吸道感染:鼻炎为婴儿腺病毒感染最常见的症状。这个年龄组中偶可引起暴发性支气管炎和肺炎,部分病儿发生百日咳综合征。 (2)咽结膜炎热(pharyngo-conjunctival fever,APC fever):腺病毒3、7型引起为多,夏季可发生小流行,与游泳池水传播有关。发病急,发热38℃以上,出现咽炎、鼻炎、眼结膜炎及颈淋巴结炎。球结膜及睑结膜可见颗粒状突起、红肿,常为单侧,双侧者常为一侧较重。症状延续1~2周,无后遗症。一般不伴支气 管炎及肺炎。 (3)出血性膀胱炎(hemorrhagic cystitis):大多由腺病毒11、21型引起,男孩多见,无明显季节性。可有血尿、尿频、尿急及排尿困难、肉眼血尿,约3~7天,镜下血尿可持续2周左右。 (4)其他:婴儿腹泻、心包炎、慢性间质性纤维化、风疹样疾病及先天性畸形曾发现与腺病毒感染有关。有报道器官移植及免疫缺陷者腺病毒感染后,除引起呼吸道、泌尿道感染,还可致脑炎等中枢神经系统感染。 2.成人常见的临床表现 (1)呼吸道感染:常见为非典型肺炎的表现,可有发热、咳嗽、咽痛、流涕、肺部啰音。X 线胸片示间质性肺炎改变,多为单侧,下肺野较多见,可发生少量胸膜渗出。病程常自限性(约1~2周),罕见继发细菌感染或致死病例。 C D D C D D C D D C D D
腺病毒包装、扩增、纯化、滴度测定及感染
腺病毒包装、扩增、纯化、滴度测定及感染 一、包装 1.包装细胞 详情见AD-293 Cells.pdf,AdEasy? Adenoviral Vector System.pdf(P31-P32)2.细胞转染 方法一、 详情见Adeno-X Expression System 1 User Manual.pdf(P28-P29) C0508磷酸钙法细胞转染试剂盒.pdf 3.病毒收集 详情见AdEasy? Adenoviral Vector System.pdf(P34) 二、扩增 详情见Adeno-X Expression System 1 User Manual.pdf(P29-P30) 三、纯化 (i) 病毒上清(接一、包装3.病毒收集). (ii) Add 51 ml of a 50% PEG 6000 solution. (iii) Add 21.7 ml of a 4 M NaCl stock solution. (iv) Add 23.3 ml of PBS. This will result in a final volume of 300 ml. The final PEG 6000 concentration will be 8.5% and the final NaCl concentration will be B0.3 M. (v) Distribute the sample as 150-ml aliquots in two 250-ml polypropylene wide-mouthed bottles. (vi) Store the bottles at 4 1C for 1.5 h. Mix contents every 20–30 min. (vii) Centrifuge bottles at 7,000g for 10 min at 4 1C using a Beckman fixed-angel JLA-10.500 rotor. (viii) After centrifugation, a white pellet should be visible. (ix) Carefully decant the supernatant and add 1.2 ml of 50 mM Tris-HCl, pH 7.4, per
腺病毒的包装和感染PDF
腺病毒的包装,纯化和感染 技术背景:Adeasy系统利用了腺病毒具有的高感染能力,可高度浓缩等优点,并破坏了腺病毒基因组中的早期基因E1,使之成为较为安全、高效的病毒载体。利用带有E1基因的293细胞作为包装细胞,通过倍比扩增,富集病毒颗粒,并通过CsCl梯度离心,透析进行分离纯化。对绝大多数的细胞株可以达到近乎100%的感染效率。但需要指出的是Adeasy同样具有所有病毒载体或转染试剂都不可避免的细胞毒性问题。 所需试剂: ●293细胞; ●重组好的腺病毒质粒; ●Pac I限制性内切酶; ●质粒回收相关试剂; ●细胞培养、转染相关试剂; ●TBS:10mM Tris,0.9%NaCl,pH8.1; ●40%CsCl:28.45g CsCl溶于42.7ml的TBS中,4度保存; ●15%CsCl:9.085g CsCl溶于47.69ml的TBS中,4度保存; ●Beckman离心管:14*89mm,SW41转头; ●Polybrene(sigma),10mg/ml; ●透析袋:Spectrum Co.(成卷供应,带少量甘油,硫化物与重金属), MW=8000~14400; ●灭菌甘油。 操作流程: 1.293细胞(E1-transformed human embryonic kidney cells在转染前24小时接种 于1或2个60mm培养盘中,使之在转染时细胞汇合率为50-70%; 2.在转染前,用Pac I处理目的质粒(一般一个60mm细胞盘需要6μg DNA)。 处理后质粒用乙醇沉淀并重悬于20μl无菌水中; 3.用PEI或其他转染试剂将6μg Pac I处理过的质粒转染细胞;
