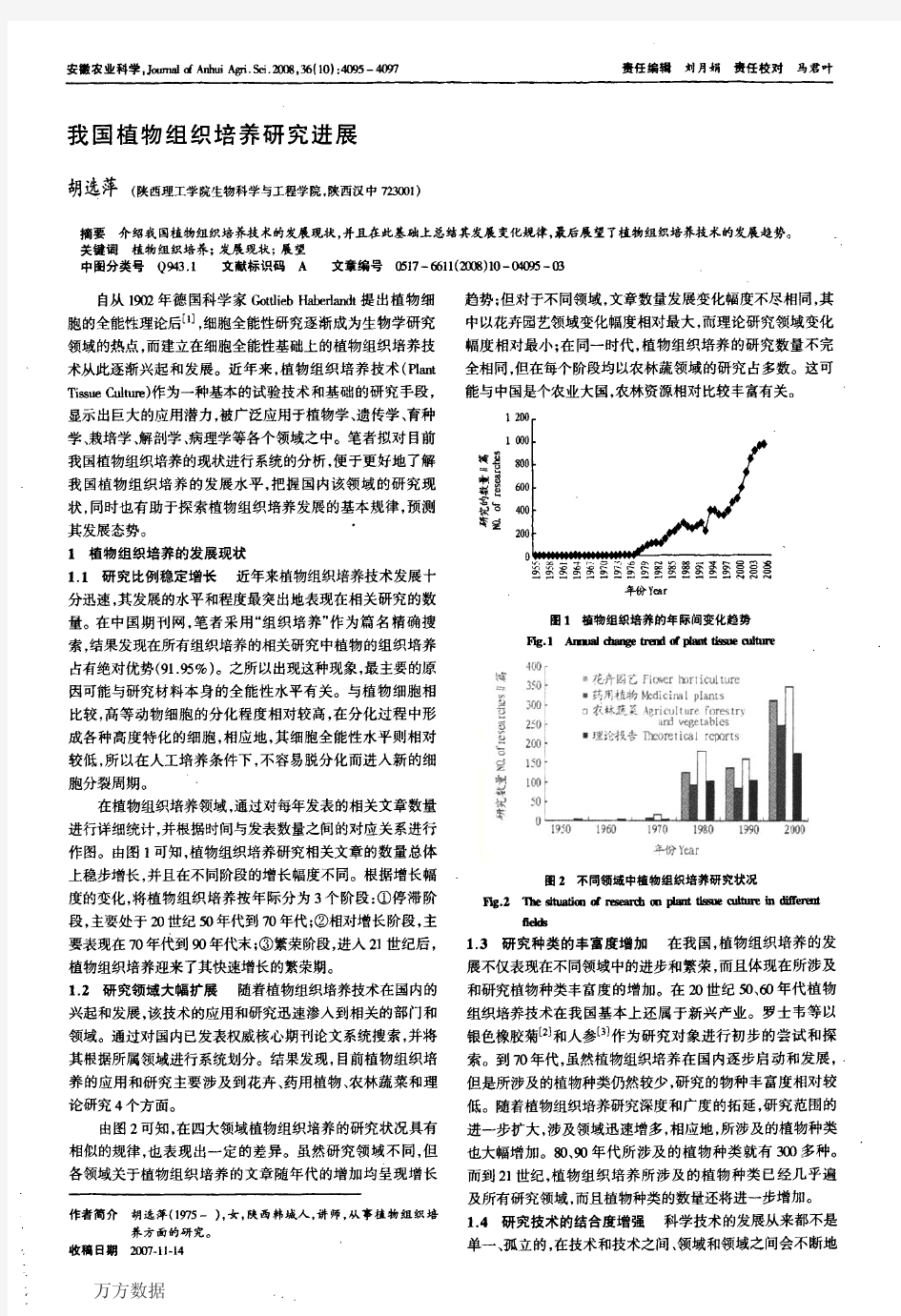
我国植物组织培养研究进展

植物组织培养报告
植物组织培养报告内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
大蒜茎尖的组织培养 谢婷婷江宋青万嫣文吕凌宇一、实验目的 掌握植物组织培养的相关理论知识及操作方法; 通过自行设计并完成实验,提高动手能力和思维能力; 利用植物细胞的全能性,使大蒜茎尖经过脱分化作用形成愈伤组织,再分化为有结构的组织和器官,最终增殖培育出大量品质优良的大蒜试管苗。二、实验原理 植物组织培养是利用植物细胞的全能性原理。植物组织培养是在无菌环境下,将离体的植物器官、组织以至单个细胞,在人工配置的培养基上培养,使其能够继续生长,甚至分化发育成一完整植株的过程。植物的组织在培养条件下,原来已经分化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。这一过程称为“脱分化”。已经脱分化的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称“再分化”。 三、实验材料、试剂和器材 1 供试材料 以购于府前菜场的大蒜为实验材料,实验在丽水学院生态学院组培实验室进行。 2 仪器与设备 超净工作台、培养事、电子天平、烧杯、容量瓶、玻璃棒、量筒、移液
管。 3 试剂 70%酒精、95%酒精、0.1%升汞、蔗糖、琼脂条、6-BA(1.5 mg/L;2.0 mg/L)、2,4-D(2.0 mg/L)、NAA(1.0 mg/L;)、IBA(2.0 mg/L)、10倍的大量元素、100倍的微量元素、100倍的铁盐、100倍的有机物。 四、实验步骤 1.培养基的配制及灭菌 诱导培养基:MS+6-BA 2.0 mg/L+2,4-D 2.0 mg/L 出芽培养基:MS+6-BA 1.5 mg/L+NAA 1.0 mg/L 生根培养基:MS+IBA 2.0 mg/L (1)将MS母液(10倍的大量元素、100倍的微量元素、100倍的铁盐、100倍的有机物)按顺序排列、检查是否失效。 (2)在装有3/4蒸馏水的容器中加入0.7%琼脂和3%蔗糖,加热溶化。(3)依次吸取适量各种母液移到容器中。 (4)用蒸馏水定容到相应体积。 (5)调节pH值(用0.1M的NaOH或HCl调节)至5.8-6.0。 (6)向培养基中加入适量激素。 (7)将配制好的培养基进行分装(20-30ml/瓶)。 (8)用两层称量纸包扎瓶口,并用橡皮筋扎牢,然后在高压灭菌锅中121 ℃下灭菌 20 min 。取出三角烧瓶放在台子上,冷却后备用。接种操作所需的一切用具(烧杯、培养皿、灭菌水等),需同时灭菌。 (9)将灭菌后的培养基于常温下放置一星期,观察有无污染。
植物组织培养的基本步骤
植物组织培养的基本步骤 成熟细胞离体——(脱分化)——分生细胞——(分裂)——愈伤组织——(再分化)——形态建成————完整植株。 培养基的主要成分 【水分】 【无机盐】1.大量元素:N,P,K,Ca,Mg,S(由相关的无机盐提供) 2.微量元素:Fe,B,Cu,Mn,Mn,Zn,Co 【有机营养成分】1.糖类 2.维生素 3.氨基酸 4.肌醇 5.天然有机物【植物生长调节剂】1.生长素 2.细胞分裂素 3.其他生长调节剂 【凝固剂】琼脂 【其他物质】1.活性炭 2.抗生素 3.抗氧化物质 4.硝酸银 培养基和组织培养用具的灭菌方式 【培养基,无菌水】高压蒸汽灭菌,0.105MPa灭菌15~30分钟 【移栽基质】曝晒,甲醛熏蒸或高压蒸汽灭菌0.14MMPa灭菌1~2h 【接种室,缓冲室】紫外线灯照射30min,或气雾消毒剂 【超净工作台】紫外线灯30min,之后打开风机过滤除菌 【外植体】不同的化学消毒剂浸泡消毒 【接种工具】70%乙醇浸泡或擦拭,之后用火焰灼烧灭菌 【培养室】3%来苏尔喷雾,或甲醛,气雾消毒熏蒸 【皮肤】先用肥皂洗手,接种前用70%乙醇擦拭 【瓶口,管口】70%乙醇擦拭,用火焰封口
【培养瓶表面】70%乙醇擦拭 【台面,桌面】70%乙醇擦拭或喷雾消毒 植物外植体的灭菌方式 【茎尖,茎段,叶片】1. 用70%乙醇浸泡30秒,再用无菌水冲洗1次。 2.用2%次氯酸钠浸泡15min或0.1%升汞浸泡5~10min。 3.若材料有绒毛,最好在消毒液中加入几滴吐温。 4.消毒时要不断震荡,使植物材料与消毒剂充分接触。 5.最后用无菌水冲洗3~5次。 【果实】1.用乙醇迅速漂洗一下,再用无菌水冲。 2.用2%次氯酸钠浸泡10min,用无菌水冲洗2~3次。 【种子】用10%次氯酸钠浸泡20~30min,或0.1%升汞消毒5~10min,然后再用无菌水冲洗3~5次。 【花蕾】1.用70%乙醇浸泡10~15秒,无菌水冲洗一次。 2.在漂白粉中浸泡10min,用无菌水冲洗2~3次。 【根及地下部器官】用0.1%升汞浸泡5~10min 或用次氯酸钠浸泡10~15min,再用无菌水冲洗3~5次。 【消毒后的外植体应及时按照无菌操作技术接种在适宜的培养基上】
植物组织培养技术
植物组织培养技术 植物组织培养是指将植物体的一部分接种在合成培养基上,使其按照预定目标生 长发育成新植株。近年来,花卉组织培养及快繁脱毒技术越来越多地应用于花卉种苗 繁殖生产中。 一、组织培养在花卉产业中的应用 1.快速、大量繁殖优良品种组织培养技术已成为种苗生产的主要技术之一。经组织 培养,可增加繁殖系数,加快繁殖速度,可生产出种性纯、品质好、产花量高的生产 性用苗。在花卉育种过程中,不断的杂交、选种极大地扩展了花卉的花形与颜色,使 得花卉在各方面都越来越接近人们的需求。但在同时,也造成了花卉基因类型的高度 异质化———子代不易有均一表现。而组培苗是在母株器官、组织或细胞的基础上发展起来的,可以保持母株的全部特性(花形、花色、株形、开花习性、抗逆性等), 因而可以根据需要来选择集多种优良性状于一体的植株加以分生,从而得到大量与母 株一模一样的植株。 2.培育脱毒苗木采用组织培养技术,利用植株的分生组织不易感染病毒的原理,可 以对花卉植株的分生组织进行组织培养来繁殖苗木,防止亲代植株的病害传递给子代,从而达到脱毒的目的。 病毒病对长期应用营养繁殖(分株、扦插等)的观赏植物及其生产的危害相当严重。由于观赏植物多采用营养繁殖,如嫁接、分株、压条等方法繁殖时,病毒(及类 病毒)则通过营养体及刀具、土壤传递给后代,大大加速了病毒病的传播与积累,导 致病毒病的危害越来越严重。据统计,观赏植物的病毒已多达100多种,并且逐年有 新增病毒的报道。观赏植物因病毒病大大影响其观赏价值,表现在康乃馨、菊花、百合、风信子等的鳞茎、球茎与宿根类花卉及兰科植物等严重退化,花少且小,花朵畸形、变色,大大影响观赏价值,严重者甚至导致某些品种的灭绝,严重制约观赏植物 生产的发展,这也是我国切花品种跨不出国门的原因之一。组培快繁技术已应用到蝴蝶兰的栽培中非洲菊也可以通过组培快繁技术进行繁殖 植物组织培养脱毒的原理主要是利用茎尖分生组织不带毒或少带毒。感病植株体内的病毒分布不均匀,其数量随植株部位和年龄而异,越靠近茎尖顶端的区域,病毒 的浓度也越低。分生区域无维管束,病毒只能通过胞间连丝传递,赶不上细胞不断分 裂和活跃的生长速度,因此生长点含有病毒的数量极少,几乎检测不出病毒。因此, 茎尖培养时,切取茎尖的大小对脱毒效果有很大影响,茎尖越小效果越佳,但太小时 不易成活,过大则不能保证完全除去病毒。不同种类的植物和不同种类的病毒在茎尖
植物组培培养基的成分
植物组培培养基的成分 培养基是人工配制的,满足不同材料生长,繁殖或积累代谢产物的营养物质。在离体培养条件下,不同种类植物对营养的要求不同,甚至同一种植物不同部位的组织以及不同培养阶段对营养要求也不相同。筛选合适的培养基是植物组织培养极其重要的内容,是决定成败的关键因素之一。 大多数植物组织培养基的主要成分是无机营养物质(大量营养元素和微量营养元素)、碳源、有机添加物、植物生长调节剂和凝胶剂。一些组织可以生长在简单的培养基上,这些培养基只含无机盐和可利用的碳源(蔗糖),但大多数组织必须在培养基中添加维生素、氨基酸和生长物质,而且经常还将一些复合的营养物质加入到培养基中,这种由“化学定义”的化合物组成的培养基称为“合成”培养基。 人们已设计了许多培养基用于特殊组织和器官的培养。 怀特培养基是最早的植物组织培养基之一,最初作为根培养的培养基。为了诱导培养组织器官发生和再生植株,广泛使用含有大量无机盐成分的MS(Murashige和Skoog,1962)和LS(Linsmaier 和Skoog,1965)培养基。原本为细胞悬液或愈伤组织培养而设计的B5培养基,经过改良后,被证实有利于原生质体培养。同时,B5培养基也被用于诱导原生质体再生植株。尽管Nitshch(1969)为花药培养设计的培养基仍然使用频繁,但另一个称为N6的培养基,专门用于禾谷类花药培养和其他组织培养。类似的,N6培养基越来越多地
用于大豆、红三叶草和其他豆科植物的培养。该培养基营养成分促进胚性细胞和原生质体再生细胞快速生长。使用这些培养基成功的原因很可能是营养元素的比例和浓度基本上满足不同培养体系中细胞或组织生长和分化的最适需要。 植物组织培养基中无机和有机成分的浓度用质量浓度(mg/L 或ppm,但现在习惯用mg/L)或物质的量浓度(mol/L)表示。按照国际植物生理学协会的推荐,应该用mol/L表示大量营养元素和有机营养成分浓度,用μmol/L表示微量营养元素、激素、维生素和有机成分浓度。用物质的量浓度的优点是,每一种化合物每一摩尔的分子数是常数,所以按照特定培养基配方配制培养基时,无论无机盐化合物的水分子数为多少,原物质的量浓度都可以使用。但是,用质量浓度来表示浓度的话,就不能不考虑无机盐化合物的水分子数目了。 1、水分 水分是植物体的主要组成部分,也是一切代谢过程的介质和溶媒,在植物生命活动过程中不可缺少。配制培养基母液时要用蒸馏水或纯水,以保持母液及培养基成分的精确性,防止储藏过程中发霉变质。研究培养基配方时尽量用蒸馏水,以防成分的变化引起不良效果。而在大规模工厂化生产时,为了降低生产成本,常用自来水代替蒸馏水。如自来水中含有大量的钙、镁、氯和其他离子,最好将自来水煮沸,经过冷却沉淀后再使用。
植物组织培养实验报告
植物组织培养实验报告 摘要:以大豆子叶为外植体,在MS培养基上附加不同浓度、不同种类的植物激素,以研究不同激素组合和不同浓度对大豆子叶愈伤诱导率的影响,并练习无菌操作。实验结果显示第2组即MS+6-BA(2.0mg/L)+NAA(1.0mg/L)和第 3 组即MS+KT(0.5mg/L)+2,4-D(1.0mg/L) 培养基中愈伤组织诱导率较高,为较佳的愈伤组织诱导组合。 关键词:大豆;植物组织培养;无菌操作;愈伤组织 1.材料与方法 1.1实验材料:大豆子叶 1.2实验试剂与仪器 (1)试剂:75%酒精、MS干粉、蔗糖、琼脂、植物生长调节剂(NAA、2,4-D、KT、6-BA)、无菌水、升汞、NaOH溶液 (2)仪器:超菌净工作台、圆纸片、培养皿、封口膜、称量纸、千分之一天平、不锈钢杯子、移液枪、试管、高压灭菌锅、注射器、酒精灯、镊子、手术刀、搁置架、烧杯、电炉。 1.3实验方法 1.3.1培养基的配制与灭菌 1.3.1.1 配制培养基的准备阶段 (1)准备80个培养试管及封口膜,2个小培养皿、1个大培养皿,用洗衣粉、自来水洗净,再用蒸馏水把每个培养试管、润洗一下。带晾干后将试管编号1-80;(2)在称量纸上用百分之一天平分别称取1.5g 琼脂4份,7.5g 蔗糖4份,在烧杯里用千分之一天平上称取1.185g MS干粉4份(烧杯不要清洗);
(3)剪小圆纸片40,均分在两个小培养皿小能从中自由取出为宜;剪大圆纸片10,均分在两个大培养皿中。然后分别用报纸包好。 (4)把接种工具手术刀、镊子、剪刀等用报纸包好。 1.3.1.2 配制培养基 (1)在装有MS干粉的烧杯中按下表加入植物生长调节剂 实验所用的所有激素浓度均为0.5mg/mL 激素的加样量(ml) 编号培养基配置 6-BA NAA KT 2,4-D 1 MS+6-BA(1.0mg/L)+NAA(0.5mg/L) 0.5 0.25 2 MS+6-BA(2.0mg/L)+NAA(1.0mg/L) 1.0 0.5 3 MS+KT(0.5mg/L)+2,4-D(1.0mg/L) 0.25 0.5 4 MS+KT(1.0mg/L)+2,4-D(2.0mg/L) 0. 5 1.0 (2)用量筒量取250ml(稍多)蒸馏水,取一个不锈钢杯子加入150ml蒸馏水和称量好的琼脂,在电炉子加热沸腾2min,再加入混合好的MS培养基1号和蔗糖,混合沸腾2min,用剩余的蒸馏水定容至250ml; (3)当温度降到60℃左右时,将溶液pH 调至5.8,一般加4滴NaOH溶液即可;(4)取编号1-20的培养试管,用大量注射器以每瓶12.5ml 左右培养基分装在培养试管中,用封口膜封口,4支一捆捆扎好。 (5)用相同的方法配置2-4号培养基,并分装、捆扎。 1.3.1.3高压湿热灭菌 (1)将包好的接种工具,包好的培养皿,以及分装好的试管一起放到高温灭菌
植物组织培养研究进展
植物组织培养研究进展 摘要 植物组织培养技术作为一种科研手段,发展异常迅猛。从组织培养的原理、培养过程中遇到的问题以及前景和展望这3方面综述了我国近几年植物组织培养的新研究。 关键词: 组织培养;存在问题;措施;发展 20 世纪后半叶,植物组织培养发展十分迅速,利用组织培养,不仅可以生产大量的优良无性系,并可获得人类需要的多种代谢物质;细胞融合可打破种属间的界限,克服远缘杂交不亲和性障碍,在植物新品种的培育和种性的改良中有着巨大的潜力;还可获得单倍体、三倍体及其它多倍体、非整倍体;组织培养的植物细胞也成为在细胞水平上分析研究的理想材料[1]。因此,植物组织培养广泛应用于植物科学的各个分支,如植物学、植物生理学、遗传学、育种学、栽培学、胚胎学、解剖学、病理学等,并广泛应用在农业、林业、医药业等多种行业,产生了巨大的经济效益和社会效益,被认为是一项很有潜力的高新技术。 1组织培养的基本原理 1.1植物组织培养的概念 植物组织培养技术是指在无菌条件下,将离体的植物器官(如根尖、茎尖、叶、花、未成熟的果实、种子等)、组织(如形成层、花药组织、胚乳、皮层等)、细胞(如体细胞、生殖细胞等)、胚胎(如成熟和未成熟的胚)、原生质体培养在人工配制的培养基上,给予适宜的培养条件,诱发产生愈伤组织或潜伏芽等,或长成完整的植株的技术[2]。 1.2植物组织培养的依据 植物组织培养的依据是植物细胞“全能性”及植物的“再生作用”。1902年,德国著名植物学家GHaberlanclt根据细胞学理论[3],大胆地提出了高等植物的器官和组织可以不断分割,直到单个细胞,即植物体细胞在适当的条件下具有不断分裂和繁殖,发育成完整植株的潜力的观点。1943年,美国人White在烟草愈伤组织培养中, 偶然发现形成一个芽, 证实了GHaberlanclt的论点[4]。在许多科学家的努力下,植物组织培养技术得到了迅速发展,其理论和方法趋于完善和成熟,并广泛应用产生了巨大的经济效益和社会效益。 1.3培养基的选择 组织培养的基础培养基有MT、MS、SH、White等[5]。由于不同植物所需要的生长条件有所不同,会对培养基做一些不同的处理,一般采用较多的是MS。组织培养采用固体培养基的较多,但只有在植物周围的营养物和激素被吸收,如果其他残留的培养基也能被利用,对工厂化生产的成本减少方面有很大的帮助。董雁等[6]利用回收转换后废弃的继代培养基,加入原继代培养基30 %浓度母液的培养基,培养效果与原继代培养基的基本相同,说明继代培养基再利用是可行的,这为规模化组培育苗开辟了新的途径。杜勤[7]等在无外源激素条件下,研究液体和固体培养基对黄瓜子叶培养器官分化的影响,结果用液体培养基直接诱导花芽率更高,分化高峰期出现的时间也更早,说明液体培养基对外植体的生长更有利,只是固体培养基更易操作而被较广泛应用。 2植物组织培养过程中存在的问题 2.1 污染问题 组织培养过程中的污染包括内因污染和外因污染。内因污染指由于外植体的表面或者内部带菌而引起的污染;外因污染则是主要由环境污染和操作不当引起,是指在接种或培养过程中病菌入侵,例如培养基、接种工具和接种室消毒不严格以及操作不规范等[8]。 针对植物组织培养中污染产生的原因,应从以下2个方而着手来控制污染。一是控制外植体自身带菌,外植体的表而带菌可以经过一系列的杀菌处理来减少;而外植体的内部带菌是不
植物组织培养实验报告
植物组织培养实验报告 一实验目的 让植物组织经过脱分化作用,形成愈伤组织,经过再分化作用,愈伤组织又能重新分化为有结构的组织和器官,最终形成完整的植株。 二实验原理 植物组织培养是把植物的器官,组织以至单个细胞,应用无菌操作使其在人工条件下,能够继续生长,甚至分化发育成一完整植株的过程。植物的组织在培养条件下,原来已经分化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。这一过程称为“脱分化作用”,已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称“再分化作用”。植物激素在此过程中起着重要的作用,吲哚乙酸(IAA )和 6 –苄基氨基腺嘌呤(6 – BA )的比例,决定了根和芽的分化。 三实验器材 (一)试剂 乙醇、IAA 或 2 ,4 – D 、HgCl 2 (或次氯酸钠)、6- 苄基氨基腺嘌呤(6-BA ) MS 培养基 (二)仪器设备 培养室,高压灭菌锅,水浴锅,解剖刀,三角烧瓶(100mL ),烧杯,量筒,培养皿,超净工作台,分析天平,长镊子,剪刀,橡皮筋等 三实验步骤 1. 配制培养基 (1 )愈伤组织诱导培养基:MS 培养基(蔗糖含量为10 g/L ,2,4 – D 含量为 2 mg/L ,琼脂10 g/L )。 (2 )试验培养基:在MS 培养基中按表33 – 1 加入IAA 和6–BA 。 吲哚乙酸先用少量0.1 mol/L NaOH 溶解,6- 苄基氨基腺嘌呤先用少量0.1 mol/L HCl 溶解,然后用蒸馏水稀释,再加入培养基中。 2. 培养基灭菌 将配好的培养基加入琼脂加热溶解,调至pH 5.8 ,趁热分装于100 mL 三角烧瓶中,每瓶约20 mL 。待培养基冷却凝固后,用两层称量纸包扎瓶口,并用橡皮筋扎牢,然后在高压灭菌锅中121 ℃( 1 kg/cm 2 )下灭菌20 min 。取出三角烧瓶放在台子上,
植物组织培养的研究进展和发展趋势
植物组织培养的研究进展和发展趋势 (甘肃农业大学生命科学技术学院植物生物技术,甘肃兰州730070) 摘要:植物组织培养是根据植物细胞具有全能性的原理而发展起来的一门生物技术。本文简要概述了植物组织培养的概念及研究进展,较全面的综述了植物组织培养新技术以及在快繁脱毒、育种、种质资源保存、次生代谢物提取、基因转化等方面的研究现状,最后展望了植物组织培养的发展趋势。 关键词:组织培养;研究进展;发展趋势 Research Progress in Plant Tissue Culture and trends (College of life science and technology of plant biotechnology of Gansu Agricultural University,gansulanzhou 730070) Abstract: Plant tissue culture plant cells are totipotent under the principle and developed a biotechnology. This article provides a brief overview of the concepts and plant tissue culture research, a more comprehensive overview of plant tissue culture propagation of new technologies as well as in detoxification, breeding, germplasm conservation, extraction of secondary metabolites, and other aspects of gene transfer research status , Finally, the future trends in plant tissue culture. Key words: organizational culture; research status; trends 引言 植物组织培养是20世纪之初,以植物细胞全能性为理论基础发展起来的一门新兴技术,是指在无菌条件下,将离体的植物器官、组织、细胞以及原生质体,在人工配制的环境里培养成完整的植株,也称离体培养或植物克隆。自1902年德国科学家Haberlandt提出植物细胞具有全能性理论, 到1934 年美国White 等用番茄根进行离体培养证实这一观点以来,植物离体培养技术在基础理论和应用研究,已广泛应用到植物生理学、病理学、药学、遗传学、育种以及生物化学 等各个研究领域, 成为生物学科中的重要研究技术和手段之一[1]。近年来,随着 科学技术的不断发展,植物组织培养新方法和新技术不断涌现,研究重点也由器官、细胞水平向分子、基因方向转移。21世纪,生物技术是最有生命力的一门学科,而植物组织培养作为一种基本的试验技术和基础的研究手段,被认为具有巨大的潜力,现就植物组织培养技术研究进展做一简单综述。 1在植物育种上的应用 植物组织培养技术对培养有粮作物品种开辟了全新的途径。目前,国内外已
植物组织培养全过程
蝴蝶兰植物组织培养全过程 一实验目的: 1 掌握植物细胞组织培养的原理和方法; 2了解植物组织培养的方法; 3 学习植物组织培养的原理; 4 了解不同浓度BA对蝴蝶兰生根的影响; 5了解炼苗的作用; 6掌握训化的方法步骤; 7观察蝴蝶兰组织培养到种植的全过程,并注意其中出现的问题。 二实验原理: 蝴蝶兰为兰科蝴蝶兰属植物,因花型奇特、色彩艳丽、花期长久而享有“洋兰皇后”的美誉。蝴蝶兰原产于缅甸、菲律宾、台湾、马来西亚、印度尼西亚等热带亚洲地区,具有极高的观赏和经济价值,是国际上最具商业价值的四大观赏热带兰之一。蝴蝶兰属单茎性气生兰,再生能力弱,很难进行分株繁殖,且种子无胚乳,自然条件下难以萌发,增殖系数低,难以满足日益增长的市场需求。应用植物组织培养技术进行蝴蝶兰快速繁殖可以缩短繁育周期,获得大量成株,并可以保持优良性状,维护种质资源,是蝴蝶兰快速繁殖的有效途径。在以蝴蝶兰根尖、茎尖、叶片和花梗芽为外植体诱导原球茎时,由于根尖的诱导率低,摘取茎尖会损失母株等原因,因此在蝴蝶兰组织培养中根和茎都不是诱导原球茎的理想材料。而蝴蝶兰叶片和花梗芽作为外植体诱导圆球茎时,其诱导率较高、对母株伤害不大,是较为理想的外植体材料。 三材料与用具: 蝴蝶兰的茎尖、1/ 2MS +BA2. 5 mg/L + NAA0. 2 mg/L花梗腋芽诱导培养基、1/ 2 MS + BA3. 5 mg/L + KT1. 0 mg/L + NAA0. 5 mg/L + 椰乳10 %增殖培养基、母液、量筒、烧杯、玻璃棒、移液管、无菌水、高压灭菌器、容量瓶、pH试纸、75%酒精、2%次氯酸钠、镊子、解剖刀、超净工作台、95%酒精、穴盘等。 四方法与步骤 (1)母液的配制 根据需要的母液量配制母液,配好后要贴好标签,以防弄错。标签上要注明是什么母液和母液的稀释倍数。将配好的母液进行储藏,要用的时候可以方便使用。 配制培养液时应注意:
植物组织培养MS培养基配方
植物组织培养MS培养基配方 (一)母液配制与保存 配制培养基时,如果每次配制都要按着杨成分表依次称量,既费时,又增加了多次称量误差。为了提高配制培养基的工作效率,一般将常用的基本培养基配制成10~200倍,甚至1000倍的浓缩贮备液,即母液。母液贮存于冰箱中,使用时,将它们按一定的比例进行稀释混合,可多次使用,并在配制较多数量的培养基时,降低工作强度,也提高试验的精度。 基本培养基的母液有四种:大量元素(浓缩20倍),微量元素(浓缩100倍),铁盐(浓缩200倍),除蔗糖之外的有机物质(浓缩100倍) 1大量元素 配制大量元素母液时要分别称量,分别溶解,在定容时按表1中的序号依次加入容量瓶中,以防出现沉淀。倒入磨口试剂瓶中,贴好标签和做好记录后,可常温保存或放入冰箱内保存。 表1大量元素母液(配1L20倍的母液) 序号成分配方浓度/(mg.L-1)称取量/mg 配1mL培养基吸取 量/mL 1 硝酸铵NH4NO3 1650 33000 50 2 硝酸钾KNO 3 1900 38000 3 磷酸二氢钾KH2PO 4 170 3400 4 七水合硫酸镁MgSO4.7H2O 370 7400 5 氯化钙无水CaCl2 440 6644 2微量元素母液 在配制微量元素母液时,也应分别称量和分别溶解,定溶时不分先后次序,可随意加入溶量瓶中定容(表2),一般不会出现沉淀现象。倒入磨口试剂瓶中,贴好标签和做好记录后,可常温保存或放入冰箱内保有存。 表2微量元素母液(配制1L100倍母液) 成分配方浓度/(mg.L-1) 称取量/mg 配制1L培养基吸取 量/mL 碘化钾KI 0.83 83 10 硫酸锰MnSO4.H2O 22.3 2230 硼酸H3BO3 6.2 620 硫酸锌ZnSO4.7H2O 8.6 860 钼酸钠Na2MoO4.2H2O 0.25 25 硫酸铜CuSO4.5H2O 0.025 2.5 氯化钴CoCl2.6H2O 0.025 2.5 3铁盐母液 由于铁盐无机化合物不易被植物吸收利用,只有基螯合物才能被植物吸收利用,因此需要单独配成螯合物母液表3)。 配制方法:称取5.56g硫酸亚铁和7.46g乙二胺乙酸二钠,分别用450ml的去离子水溶解,分别适当加热不停搅拌,分别溶解后将硫酸亚铁溶液缓缓加入到乙二胺四乙酸二钠溶液中,将两种溶液混合在一起,最后用去离子水定溶于1000mL,倒入棕色贮液瓶中,贴好标签和做好记录后放入冰箱内保存。
康乃馨植物组织培养(1)
《植物组培快繁技术》 康乃馨植物组织培养 实 验 设 计 小组成员:陈梅20141641044 郑莉20141641002 雷雨田20141641043
康乃馨植物组织培养 一、实验目的 掌握植物离体快速繁育原理、方法和完整过程。 二、实验原理 香石竹(学名Dianthuscaryophyllus)又名康乃馨,花色艳丽,开花时间长,装饰效果好,是世界上最畅销的切花之一,具有较高经济价值。由于病毒病侵害,常使植株矮化,花朵变小,花色产生斑点,退色甚至不开花,影响切花产 量和质量。通过茎尖分生组织培养,能够获得“无病毒”的健康植株,对于引 进的少而新的脱毒种苗,再进行一次茎尖培养,进一步降低基础苗中的病毒含量,并通过组织培养的方法快速繁殖,在短期内,就可以获得大量的脱毒试管苗,使引入材料迅速在生产上推广应用,取得明显的经济效益。 三、实验仪器与材料 仪器:超净工作台、酒精灯、电炉、烧杯、玻璃棒、镊子、解剖刀、接种盘、 纱布、记号笔、标签纸 试剂:75%乙醇、0.1%升汞、无菌水、MS培养基、IAA0.1mg/L、BA0.5mg/L、pH5.8-6.0、蔗糖、琼脂 材料:康乃馨带芽外植体材料 四、实验步骤 (一)培养基的配方 1、康乃馨的生芽培养基 MS+IAA(0.1mg/L)+BA(2.0mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L) pH5.8-6.0,配制300ml,用培养瓶分装10~15瓶。另外需要制备无菌水10瓶,培养瓶每人3~4瓶。纱布、碟子若干,后二者分别用报纸包好一同灭菌。
2、康乃馨的继代培养基 MS+BA(0.3mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L),pH5.8-6.0,配制300ml,用培养瓶分装10-15瓶。另外需要制备无菌水10瓶,培养瓶每人3-4瓶。纱布、碟子若干后二者分别用报纸包好一同灭菌。 3、康乃馨的生根培养基 MS+生根培养基为1/2MS+NAA(0.075mg/L)+蔗糖(30g/L)+琼脂(8g/L), pH5.8-6.0,配制0.3L,用培养瓶分装10-15瓶。另外,需要制备无菌水10瓶,每人3-4培养瓶、纱布、碟子若干后二者分别用报纸包好一同灭菌。 (二)康乃馨的生芽培养 1、无菌操作准备 将培养基、无菌水、及各种接种用具放入超净工作台,开紫外灯照射消毒20-30min,开送风开关,关紫外灯,通风10min后,打开照明日光灯。洗手、换鞋,换实验服,戴口罩,进入接种室,开启超净工作台。用纱布吸取75%酒精擦手、擦拭超净台、擦拭培养基和无菌水瓶,点燃酒精灯,镊子、解剖刀、剪刀等接种工具放入灭菌锅灭菌,待冷却后使用。 2、外植体消毒 选取康乃馨叶腋间生出的侧芽为外殖体,用自来水冲洗半小时,将材料上的泥土和灰尘及杂质冲洗干净,用解剖刀切取所需组织放入大烧杯中,用75%的酒精浸泡消毒30s,用无菌水冲洗3次,再将材料移入0.1%升汞溶液浸泡10分钟,然后在超净台内用无菌水冲洗6次。材料消毒完成。 3、外植体的制备 将消毒好的材料用无菌滤纸吸去多余的水份,然后在无菌超净工作台上的接种盘内,借助解剖刀剥离茎尖,剥取茎尖大小通常在0.3mm左右。以上操作均
植物组织培养的培养基
植物组织培养的培养基中,需要添加糖类作为碳源物质,因此糖类是影响植物组织培养成功与否的关键之一。高中生物教材中明确指出,植物组织培养的培养基中添加的糖类是蔗糖。那么为什么不添加葡萄糖呢?很多资料上解释为蔗糖较葡萄糖便宜,易被植物细胞吸收。其实并非如此。之所以以蔗糖作为碳源,主要有三个方面的原因: (1)同样作为碳源为植物细胞提供能量来源,蔗糖较葡萄糖能更好地调节培养基内的渗透压。配制相同质量分数的培养基,蔗糖形成的渗透压要明显低于葡萄糖,因此若采用葡萄糖作为碳源,易使植物细胞脱水而生长不良。同时,植物细胞吸收蔗糖的速率要明显慢于吸收葡萄糖的速率,所以蔗糖形成的渗透压可相对长期的保持稳定。 (2)植物组织培养过程中,要时刻注意防止培养基受到微生物的污染。微生物生长所需的碳源最常用的是葡萄糖,一般很少利用蔗糖。因此,采用蔗糖作为培养基的碳源,可一定程度上减少微生物的污染。 (3)诱导作用。在培养基成分中,增加生长素的浓度,导致木质部形成,增加蔗糖浓度则导致韧皮部形成。当生长素水平恒定时,2%蔗糖使分化出的全部是木质部,4%蔗糖使分化出的几乎全部是韧皮部,3%蔗糖则可以分化出两者。所以,生长素和蔗糖浓度决定愈伤组织中维管束的类型与数量。因此,在植物组培中要选用蔗糖而不选用葡萄糖。 通过细胞膜内外的液体的浓度差来调节 当细胞膜内的浓度小于细胞膜外的时候蔗糖救能进入细胞中了 植物细胞培养中最常用的培养基的碳源是蔗糖,已知葡萄糖和果糖也能使某些植物生长得很好。植物细胞可以分解蔗糖,蔗糖是由一分子果糖和一分子葡萄糖组成的,蔗糖是可以直接进入细胞的,蔗糖跨质膜从质外体进入细胞是由载体介导并需要消耗能量的质子-蔗糖共运输机制进行的,另外,植物能够利用的某些其他形式的碳源有麦芽糖、半乳糖、甘露糖和乳糖等。葡萄糖更不稳定,培养基需添加葡萄糖一般都在灭菌后再兑换。实在要添加葡萄糖那么灭菌温度一般控制在108~110左右,120度灭出来的就有一定程度的碳化了。所以用蔗糖更简单 动物细胞只能吸收葡萄糖,二糖蔗糖是无法吸收的。 以蔗糖为植物培养基碳源有两个原因: 1.抑制杂菌生长.细菌等不能直接以蔗糖为碳源,故可起抑制其生长的作用 2.蔗糖被植物细胞利用机理目还无定论.主要有以下两个学说(1)植物细胞先以次级主动运输的方式在细胞内外形成质子梯度,然后蔗糖就会利用这个梯度被吸收进细胞. (2).植物的细胞壁中含有能分解蔗糖的相关酶,蔗糖先在细胞膜外被分解为单糖,然后这些单糖再以主动运输的方式进入细胞,从而被细胞利用.
植物组织培养研究性学习报告
植物组织培养研究性学习报告 署名:徐峰刘忠和张小艾王晓瑜 内容摘要:本课题主要介绍植物组织培养的基本原理、方法和操作,以实用为 目的,使我们在了解基本原理的基础上,重点掌握实际操作技术 关键词 :植物组织培养概念植物组织培养原理组织培养培养基配制植物组织培养过程 前言:植物组织培养是二十世纪发展起来的新技术,近三十多年来由于组织培养 基础理论研究的深入,发展极为迅速,发表的文献浩如烟海,几乎以植物为研究对象的各个分支学科都在广泛进行组织培养。目前,植物组织培养已成为现代植物基因工程不可或缺的技术,并在科研与生产实践中起着越来越重要的作用。 正文: 1 植物组织培养的基本概念 植物组织培养是在无菌条件下,将离体的植物器官(根尖、茎尖等)、组织(形成层、花药组织等)、细胞(体细胞、生殖细胞等)、胚胎(成熟或未成熟的胚)、原生质体等在人工配制的培养基上培养,给予适宜的培养条件,诱发其产生愈伤组织或潜伏芽或长成完整的植株的技术。 2原理 植物组织培养的依据是植物细胞的“全能性”及植物的“再生作用”。1902年,德国著名植物学家 G.Haberlandt根据细胞学理论提出了一个观点,“高等植物的器官和组织可以不断分割,直至单个细胞,即植物体细胞,体细胞在适当的条件下具有不断分裂、繁殖并发育成完整植株的潜力”。1943年,美国人White在烟草愈伤组织中偶然发现形成一个芽,证实了G.Haberlandt 的论点。 不同植物所需要的生长条件不同,所用的培养基也有所不同。较常用的基础培养基有MT、MS、 SH、N6、White等。在组织培养中,愈伤组织和胚状体能否形成是培育出新植株的关键。通过在基础培养基里添加一定浓度的外源激素,可以诱导出愈伤组织、胚状体、不定芽、根等器官,最终获得再生植株或次生物质。 用于植物组织培养的材料称为外植体,其主要形式有器官、胚胎、单细胞、原生质体等。根据外植体的不同,所需要的培养基种类、培养条件、外源激素的种类及比例等均不同。植物组织培养中,影响培养力的因素是多方面的,诱导愈伤组织成败的关键在于培养条件,植物激素是诱导愈伤组织和绿苗分化的关键因素。 最常用的诱导愈伤组织的生长素是IAA、NAA和2,4一D,所需浓度为O.01~ 10 mg/L。最常用的细胞分裂素是KT和ABA,使用浓度为O.1~10 mg/L。 KT的主要作用是促进细胞分裂和愈伤组织分化。ABA对植物体细胞胚的发生
实验一 植物组织培养基母液配制的若干关键环节
实验一、植物组织培养基母液配制的若干关键环节目的与要求: 熟悉MS培养基的组成,掌握贮备液的配制方法. 植物组织培养(plant tissue culture)是指植物的任何器官、组织或细胞,在人工预知的控制条件下,放在含有营养物质和植物生长调节物质等组成的培养基中,使其生长、分化形成完整植株的过程.植物组织培养具有取材少,培养材料经济;人为控制培养条件,不受自然条件影响;生长周期短,繁殖率高;管理方便,利于自动化控制等特点.因而被广泛应用于各种植物的快速繁殖之中. 为了避免每次配制培养基都要对几十种化学药品进行称量,应该将培养基中的各种成分,按原量10倍、100倍或1000倍称量,配成浓缩液,这种浓缩液叫做母液。这样,每次配制培养基时,取其总量的1/10、1/100、1/1000,加以稀释,即成培养液。现将培养液中各类物质制备母液的方法说明如下。 以MS培养基为例,其母液的配制包括大量元素、微量元素、铁盐、维生素、氨基酸、植物生长调节物质和有机附加物等种类.(见表1) 表1 MS培养基母液的配制 成分规定用量 /mg.L-1 扩大倍 数 称取量/ mg 母液定溶 体积/ml 配1LMS培 养基吸取量 /ml 大量元素 KNO3 NH4NO3 MgSO4·7H2O KH2PO4 CaCl2·2H2O 微量元数 MnSO4·4H2O ZnSO4·7H2O 1900 1650 370 170 440 22.3 8.6 20 20 20 20 20 1000 1000 38000 33000 7400 3400 8800 22300 8600 1000 1000 1000 1000 1000 1000 1000 50 50 50 50 50 1 1
月季的植物组织培养开题报告
月季的植物组织培养开题报告 一、实验目的意义 通过月季的植物组织培养实验,对植物组织培养技术进行初步了解,认识植物组织培养的重要性和发展潜能,并了解月季的特征及生长习性,锻炼自己独立做实验、独立思考的能力。 二、实验材料和方法 1.实验材料:月季(取材自天津师范大学主校区明理楼旁边) 2.实验步骤 ①称取6.5g~12g琼脂,先用蒸馏水置1000ml搪瓷杯浸泡2小时后充分洗去杂质。弃去浸 液用无离子水再洗1~2次,并加入500ml无离子水在电炉上溶化。边搅拌边溶化,直至完全溶化备用。 ②另取蔗糖30g于上述溶液中搅拌完全溶解备用。 ③另按MS培养基用量量取无机大量微量元素及有机成分的母液于一烧杯中,并完全倒入 ②液中搅拌溶解混匀备用。 ④按目的要求用取样器加入各种激素并搅拌混匀,加稀碱或稀释酸调pH值应比目的要求 的pH值稍高0.1~0.2。定溶1000ml。 ⑤趁热大于60℃分装于培养瓶中,应边搅拌边分装液体,根据要求的量分装。一般液体的 厚度掌握在1cm左右为宜。分装时不得将液体粘落至瓶口上。 ⑥将培养瓶封口塞棉塞、包牛皮纸系线绳。 ⑦另取Ф5cm的滤纸若干,置Ф9cm的培养皿中并用牛皮纸包好准备灭菌。 ⑧另取无离子水若干不得超过瓶内总体积的70%,加棉塞包牛皮纸,灭菌制备无菌水。另 取清毒瓶包好备用。 ⑵灭菌 ①检查有无漏电漏水现象,加无离子水的3升,将要灭菌的物品平稳地放置高压锅套桶 内。 ②盖上锅盖水平拧好螺栓,打开放气阀,接通电源加热,待放气阀处水汽充分溢出时盖 上放气阀,待压力升至0.05Mpa时打开放气阀放气至压力回到零位时盖上放气阀升压。 ③待压力达0.12~0.15Mpa时,开始计时,使调压器自220V回调170~180V左右维持 30分钟断电。 ④待压力回降至零位时,打开锅盖错开一缝隙使热蒸汽迅速溢出烘干包纸和瓶塞。 ⑤趁热取出被灭菌之物,将培养瓶置平稳处使培养瓶中的培养基凝固。23小时后查有无 细菌,48小时后查有无霉菌,如有杂菌应及时处理,无杂菌备用。 ⑶接种 ①取材:将采集的月季茎段冲洗干净,分装到烧杯中,放入超净工作台;先用70%酒精浸 没并轻摇15s进行欲消毒;倒出酒精,加入0.1%二氯化汞浸没;倒净二氯化汞。用无菌水冲洗3次,将废液倒弃备用。 ②解下培养瓶上包头纸的线绳,并将培养瓶整齐地排列在接种台的左侧,然后用70%的酒 精棉球从内向外擦接种台面。 ③在酒精灯下用用镊子在消毒瓶内取出材料置于培养皿内的无菌滤纸上吸干水分,右手持 镊子左手拿灭过菌的解剖刀迅速地将茎段切成剪成每段2~3cm至少有1个侧芽,用镊子将外植体迅速地在酒精上接入培养瓶内。 ④在酒精灯火焰上转动瓶口和棉塞进行灼热灭菌,迅速塞好棉塞、包好包头纸,系好线绳,
国内外植物组织培养技术的差距
国内外植物组织培养技术的差距 姓名:*** 学号:********* 指导教师:*** 专业班级:生物工程2009级1班 完成日期:2012-06-05
摘要 植物组织培养技术是农业生物技术中最早实现产业化并取得显著经济效益和社会效益的领域,在理论研究和生产实践中具有广泛的应用价值。通过对国内外植物组培的发展概况以及技术差距的分析,指出了我国植物组织培养技术的发展现状、目前存在的主要问题和应采取的措施,并对植物组织培养技术的发展作了展望。 关键词:组织培养概况差距展望 Abstract The plant tissue culture technology is agricultural biotechnology as the first realized industrialization and get a remarkable economic and social benefits of the field, in the theoretical research and production practice has wide application value. Through the domestic and international plant tissue and the development situation of the technology gap analysis, and pointed out the plant tissue culture technology's development present situation, the existing problems and the measures should be taken, and the development of plant tissue culture technology are discussed. Key words:Tissue culture situation gap looking
植物组织培养技术
楚雄师范学院化学与生命科学系 生物技术专业《植物组织培养技术》课程教学大纲 一、课程基本信息 课程代码:031106014 课程中文名称:植物组织培养技术 课程英文名称:Plant Tissue Culture Technology 课程性质:专业选修课 使用专业:生物技术专业、葡萄与葡萄酒工程专业 开课学期:第7学期 总学时:36+27 总学分:3 预修课程:植物学、植物生理学 课程简介 植物组织培养技术是将植物的离体材料(器官、组织、细胞、原生质体等)无菌培养,使其生长、分化,进而再生完整植株的无性繁殖技术,是实践性较强的专业课之一。本课程在介绍了组织培养的含义、特点及其意义;组织培养的概念、类型、特点;组织培养技术的基本原理及操作规范;组织培养的发展简史、发展趋势及其应用。通过本课程的学习,使学生掌握组培实验室、家庭组培室、组培育苗工厂的组成、设计原则与设计要求;熟练掌握各种培养基的特点与应用;熟练掌握茎尖、茎段、叶及花器官培养消毒灭菌、接种及培养的技术;理解种质资源离体保存的意义,掌握种质资源离体保存常用方法;掌握一些常见植物的组培脱毒与快繁技术的应用。 教材建议 《植物组织培养原理与技术》,李胜、李唯主编,化学工业出版社,2008年。 参考书 《植物细胞组织培养》,刘庆昌编著,北京:中国农业大学出版社,2002年,标准书号:7-81066-529-4。 《植物组织培养(第三版)》,潘瑞炽编著,广州:广东高等教育出版社,2003年,标准书号:7-5361-2501-1。 《植物组织培养教程》,李浚明编著,北京:中国农业大学出版社,1996年,标准书号:7-81066-466-2。
组培常见问题
植物组培过程中污染产生的原因及防治措施 一、污染的原因 污染是指在培养过程中,培养基或培养材料上滋生真菌、细菌等微生物,使培养材料不能正常生长和发育的现象。组织培养中污染是经常发生的,常见的污染病原是细菌和真菌两大类。细菌污染常在接种1-2d后表现,培养基表面出现黏液状菌斑。真菌污染一般在接种后3d以后才表现,主要症状时培养基上出现绒毛状菌丝,然后形成不同颜色的孢子层。 造成污染的原因也很多,主要有 (1) 培养基及各种使用器具灭菌不彻底 (2) 外植体消毒不彻底 (3) 接种时不严格无菌操作 (4) 接种和培养环境不清洁 (5) 培养容器原因,包括盖子和封口膜等。 二、材料带菌或培养基灭菌不彻底会造成成批接种材料被细菌污染,操作人员不严格遵守无菌操作规程也是造成细菌污染的重要原因。培养环境不清洁、超净工作台的过滤装置失效、培养容器的口径过大以及封口膜破损等主要引起真菌污染。2 污染的预防措施 2.1灭菌要彻底 在组培生产中,各种培养基以及接种过程中使用的各种器具都要严格灭菌。首先是培养基的灭菌,耐高温的培养基需要在121-123℃条件下灭菌20-30min。若出现灭菌时间不足或温度不够,培养一段时间后就会在培养基表面产生细菌性的污染。一些不耐高温的物质,可采取细菌过滤器除去其中的微生物。其次,接种用的器具除了经过高温霉菌外,在接种的过程中,每使用1次后,都要蘸酒精在酒精灯火焰上灼烧灭菌,特别是在不慎接触到污染物时,极易由于器具引起污染。第三,对于被污染的培养瓶和器皿要单独浸泡,单独清洗,有条件的灭菌后再清洗。 2.2环境消毒 不清洁的环境也会使培养的污染率明显增加,尤其是在夏季,高温高湿条件下污染率更高。接种和培养环境要保持清洁,定期进行熏蒸或喷雾消毒。高锰酸钾和甲醛熏蒸效果好,但对人体有一定的伤害,一般每年熏蒸2-3次。平时读接种室和培养室可采用紫外线照射消毒或喷2%来苏尔消毒。臭氧消毒机对环境消毒效果较好,而且使用灵活方便,对人体的伤害也相对较小。 2.3严格无菌操作 在接种时要严格无菌操作,避免人为因素造成污染。为了使超净工作台有效工作,防止操作区域本身带菌,要定期读一过滤器进行清洗和更换。对内部的过滤器,不必经常更换,但每隔一定时间要检测操作区的带菌量,如果发现过滤器失败,则要整块更换。此外还需要测定操作区的风速,通过调压旋钮使操作区的风速达到无菌操作需要的20-30m/min。 植物组培过程中培养物的玻璃化及其防治方法 当植物材料不断地进行离体繁殖时,有些培养物的嫩茎、叶片往往会呈半透明水渍状,苗体趋于透明,其茎、叶表面无蜡质,这种现象通常称为玻璃化。玻璃化为组培苗的生理失调症,它的出现会使组培苗生长缓慢、繁殖系数有所下降,玻璃化的嫩茎不宜诱导生根。 1 导致玻璃化的主要因素: ① 材料差异,在不同的种类、品种间,组培苗的玻璃化程度有所差异。
