地球化学期末考试总结

第一章绪论
1.地球化学的定义:地球化学是研究地球及子系统(含部分宇宙体)的化学组成、化学作用和化学演化的科学(涂光炽)。
2.地球化学研究的基本问题
第一: 元素(同位素)在地球及各子系统中的组成(量)
第二: 元素的共生组合和存在形式(质)
第三: 研究元素的迁移(动)
第四: 研究元素(同位素)的行为
第五: 元素的地球化学演化
第二章自然体系中元素的共生结合规律
1.元素地球化学亲和性的定义:在自然体系中元素形成阳离子的能力和所显示出的有选择地与某种阴离子结合的特性称为元素的地球化学亲和性。
2.亲氧元素、亲硫元素与亲铁元素的特点
(1)亲氧元素:能与氧以离子键形式结合的金属(半金属)元素称为亲氧元素。
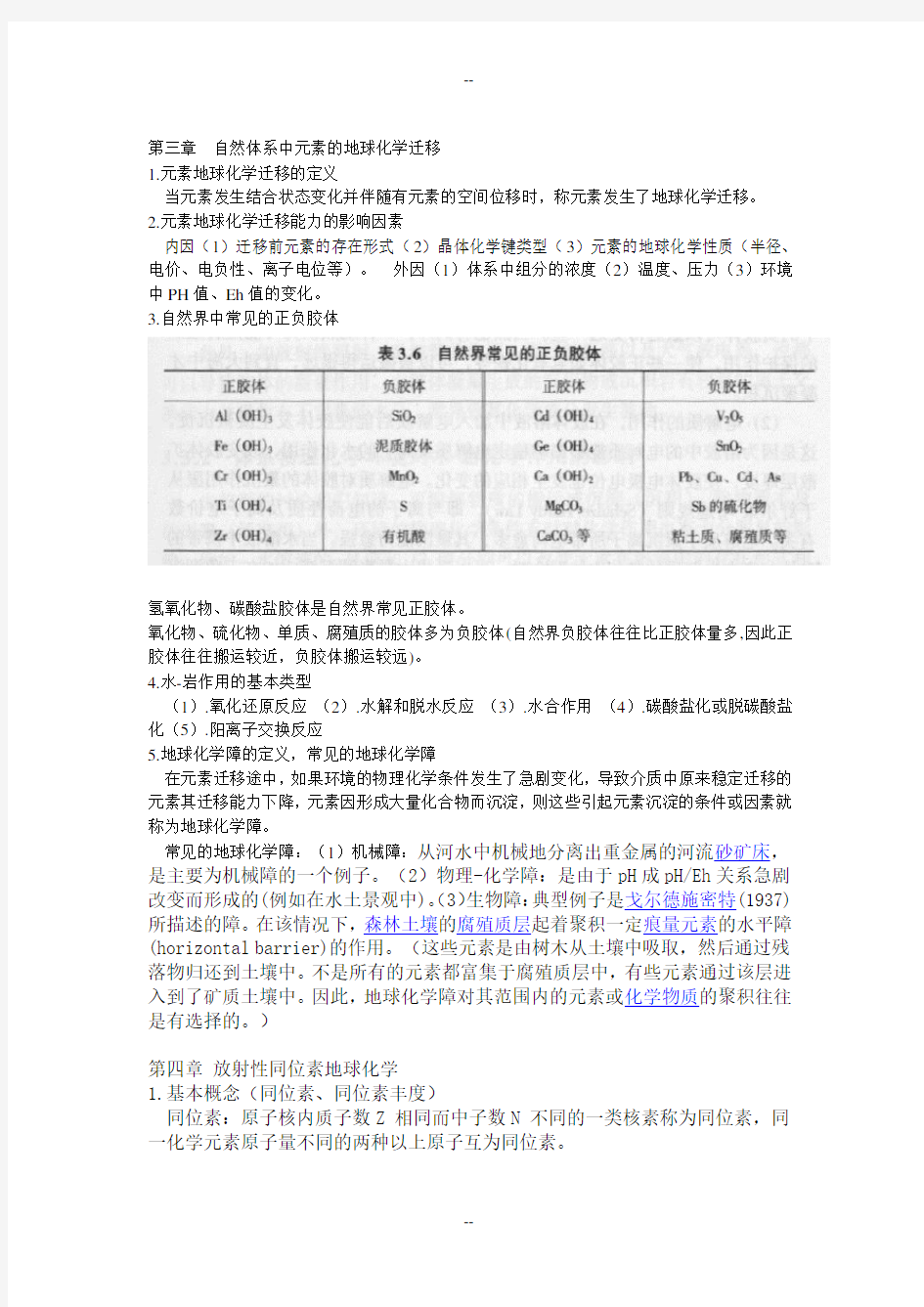
特点:惰性气体结构;电负性小;离子键为主;生成热>FeO;主要集中在岩石圈。(2)亲硫元素:能与硫结合形成高度共价键的金属(半金属)元素称为亲硫元素特点:铜型离子;电负性较大;共价键为主;生成热 (3)亲铁元素:元素在自然界以金属状态产出的一种倾向。铁具有这种倾向,在自然界中,特别是O,S丰度低的情况下,一些元素往往以自然金属状态存在,常常与铁共生,称之为亲铁元素。 特点:原子(注意不是指离子)具有d亚层充满或接近充满,接近18-18+2的外电子层结构(惰性金属型构型),电负性中等,第一电离能较高(原子中电子不易被剥夺,也难以夺取外来电子)。 常形成金属键晶体(单质或金属互化物) 其氧化物和硫化物的生成热都较小 位于原子容积曲线的最低部分 主要集中于铁-镍核,地壳较少 亲铁元素具有多亲合性,也可亲氧、亲硫,Fe是典型代表。 3.元素的地球化学化学分类(戈式分类) 亲氧(亲石)、亲硫(亲铜)、亲铁、亲气元素。 4.类质同象的定义 某些物质在一定的外界条件下结晶时,晶体中的部分构造位置随机地被介质中的其他质点(原子、离子、配离子、分子)所占据,结果只引起晶格常数的微小改变,晶体的构造类型、化学键类型等保持不变,这一现象称为“类质同象”。 5.Goldschimdt 定律 定律一:两个离子,如果他们具有相同的电价和离子半径,则易于交换,并以与他们在整个体系中相同的比例进入固熔体。 定律二:两个离子,如果他们具有相同的电价,和相似的离子半径,则较小的离子倾向于进入固体相。 定律三:两个离子,如果他们具有相似的离子半径,但是电价不同,那么,电价高的离子倾向于进入固体相。 第三章自然体系中元素的地球化学迁移 1.元素地球化学迁移的定义 当元素发生结合状态变化并伴随有元素的空间位移时,称元素发生了地球化学迁移。 2.元素地球化学迁移能力的影响因素 内因(1)迁移前元素的存在形式(2)晶体化学键类型(3)元素的地球化学性质(半径、电价、电负性、离子电位等)。外因(1)体系中组分的浓度(2)温度、压力(3)环境中PH值、Eh值的变化。 3.自然界中常见的正负胶体 氢氧化物、碳酸盐胶体是自然界常见正胶体。 氧化物、硫化物、单质、腐殖质的胶体多为负胶体(自然界负胶体往往比正胶体量多,因此正胶体往往搬运较近,负胶体搬运较远)。 4.水-岩作用的基本类型 (1).氧化还原反应(2).水解和脱水反应(3).水合作用(4).碳酸盐化或脱碳酸盐化(5).阳离子交换反应 5.地球化学障的定义,常见的地球化学障 在元素迁移途中,如果环境的物理化学条件发生了急剧变化,导致介质中原来稳定迁移的元素其迁移能力下降,元素因形成大量化合物而沉淀,则这些引起元素沉淀的条件或因素就称为地球化学障。 常见的地球化学障:(1)机械障:从河水中机械地分离出重金属的河流砂矿床,是主要为机械障的一个例子。(2)物理-化学障:是由于pH成pH/Eh关系急剧改变而形成的(例如在水土景观中)。(3)生物障:典型例子是戈尔德施密特(1937)所描述的障。在该情况下,森林土壤的腐殖质层起着聚积一定痕量元素的水平障(horizontal barrier)的作用。(这些元素是由树木从土壤中吸取,然后通过残落物归还到土壤中。不是所有的元素都富集于腐殖质层中,有些元素通过该层进入到了矿质土壤中。因此,地球化学障对其范围内的元素或化学物质的聚积往往是有选择的。) 第四章放射性同位素地球化学 1.基本概念(同位素、同位素丰度) 同位素:原子核内质子数Z 相同而中子数N 不同的一类核素称为同位素,同一化学元素原子量不同的两种以上原子互为同位素。 同位素丰度:(1)绝对丰度:某一同位素在所有各种稳定同位素总量中的相对份额。常以该同位素与1H(取1H =1012)或28Si(28Si=106)的比值表示。(2)相对丰度(原子丰度):同一元素各同位素的相对含量(以原子百分数计)。 2.同位素定年的基本原理 设衰变产物的子体原子数为D* )1(*0-=-=t e N N N D λ 3.几种同位素定年方法(銣-锶、钐-钕、铀-铅) 母体:放射性核素 子体:母体衰变的产物 (1)铷-锶(Rb-Sr)测年及同位素地球化学 Rb -Sr 同位素测年原理: Rb 有2个同位素: 72.17% 27.83% Sr 有4个同位素: 82.53% 0.56% 9.87% 7.04% 岩浆岩Rb-Sr 等时线定年 基本假设: 岩浆的整个冷却过程中Sr 同位素是均一的,即从岩浆中形成的所有矿物或岩石具有相同的锶同位素初始比值; 岩浆结晶的时间相对较短,所有的矿物或岩石具有基本相同的年龄; 形成以后保持封闭,未受蚀变、变质等外来影响; 截 距: 斜 率: 年 龄: 85 37Rb 87 37 Rb 88 38Sr 8438 Sr 8638 Sr 87 38 Sr 87873738 Rb Sr Q βν- → +++0(1) t D D N e λ=+-87 8787λt 0Sr=Sr +Rb(e -1) 87 860Sr Sr b ??= ? ? ?1 t m e λ=-()1 ln 1t m λ =+ a.Rb-Sr等时线法主要适用于测定基性、中性和中酸性岩浆岩的形成年龄。 b.变质作用过程中,若矿物Rb-Sr同位素体系开放,但全岩的同位素封闭,则全岩等时线年龄给出原岩的年龄,而矿物等时线年龄给出了最后一次变质事件的年龄。 c.变质作用过程中,若全岩Rb-Sr同位素系统被改造,等时线年龄往往不能提供变质岩原岩形成年龄的信息,只代表变质事件的年龄或无意义的年龄信息。 d.Rb-Sr等时线法很少用于沉积岩年龄测定,如采用该方法,必须对矿物进行详细的研究,且对制样的要求也非常严格。 (2)Sm-Nd 计时方程: Sm、Nd的等时线年龄 Y=a+bX 该直线称为等时线斜率:b=eλt-1 截距:a=(143Nd/144Nd)初始 要获得可靠的Sm-Nd 等时年龄,要满足下列条件:(1)所研究的样品具有同时性和同源性; (2)样品形成后,保持Sm、Nd的封闭体系(3)所测样品有较明显的Sm/Nd比值差异 4. 銣-锶等时线定年需满足的条件 1)一套岩石系列的不同岩石,由于岩浆结晶分异作用造成不同岩石的Rb/Sr比值有差异; 2)结晶分异作用经历的时间较短,各岩石形成Rb-Sr封闭体系的时间大致相同。 3)由于同源岩石具有相同的87Sr/86Sr初始同位素比值; 4)自结晶以来,每个样品都符合定年的基本条件—呈封闭体系。 第五章稳定同位素地球化学 1.基本概念稳定同位素、同位素效应、同位素分馏系数、δ值、同位素富集系数(包括它们之间的相关换算) 稳定同位素:原子核稳定,其本身不会自发进行放射性衰变或核裂变的同位素。同位素效应(Isotope effect):质量数不同的同位素及其化合物在物理和化学性质上的差异,称为同位素效应。 同位素分馏:由于同位素效应所造成的同位素以不同比例在不同物质或不同相之间的分配称为同位素分馏。 同位素分馏系数:定义为在平衡条件下,经过同位素分馏之后二种物质(或组分)中某元素的相应同位素比值之商。 δ值(δvalue):样品的同位素比值相对于标准样品同位素比值的千分偏差。δ(‰)= [(R样–R标)/ R标]X1000 = [(R样/R标)- 1]X1000 δ> 0 (正值)表明样品相对标准富集重同位素 δ< 0(负值)表明样品相对标准亏损重同位素 δ= 0 表明样品与标准同位素比值相同 同位素分馏值(富集系数):在同位素平衡的前提下,两种不同化合物的同类同位素组成δ值的差,称为同位素分馏值△,也被成为富集系数。△A-B=δA-δB 同位素富集系数与同位素分馏系数的关系:αA-B = (10-3δ A +1)/(10-3δ B +1) 103ln αA-B ≈δA - δB = ΔA-B 2.氢、氧、碳、硫同位素的常用标准 H、O同位素标准:氢有1H、2H(D)两个稳定同位素,同位素比值常用2H/1H 表示;氧有16O、17O和18O三个稳定同位素,同位素比值常用18O/16O表示。自然界H、O元素的天然产物H2O普遍存在,故二者常采用同一标准样。 C同位素标准:碳有12C、13C两个稳定同位素,其同位素比值国际标准是:美国南卡罗莱纳州白垩系皮狄组地层中的美洲拟箭石,用作碳同位素标准。 S同位素标准:硫有32S、33S、34S、36S四种稳定同位素。同位素比值通常用34S/32S表示,标准是:?CDT—Canyon Diablo Troilite。CDT是美国亚利桑那州迪亚布洛峡谷中铁陨石中的陨硫铁,用作硫同位素标准。其34S/32S=4500.45×10-5,δ34S=0。 任一样品对于不同标准之间δ值的关系可进行换算,设X,A,B分别为待测样和二个标准 已知δX-B,δB-A分别为样品对标准B和标准B对标准A的δ值。δX-A=δX-B+δB-A+δX-B·δB-A×10-3 3.同位素地质温度计的原理及应用(相关计算) δ值δ(‰)= [(R样/R标) - 1] X 1000 同位素分馏系数α与δ值的关系:103lnαA-B ≈δA- δB= ΔA-B 即lnαA-B与A, B两种物质的δ值之差相关。 同位素平衡分馏系数与温度的关系:α=103ln a/T2+ b/T + c其中a、b、c分别为常数。 1)在一般低温下,a/T2可以忽略,简化:103lnα= b/T + c 2)在高温下,b/T可以忽略,简化:103lnα= a/T2 + c 4.大气降水的氢、氧同位素组成特点;什么是“雨水线”。(“四个效应”) 大气降水来源于海洋表面的蒸发。大气降水的氢、氧同位素组成变化较大:δD:+50‰~-500‰,δ18O:+10‰~-55 ‰。 四个效应:1)纬度效应---纬度增加大气降水的δD和δ18O值都减少。 2)大陆效应---越向内陆,大气降水的δD和δ18O值越降低。 3)海拔高度效应---海拔高度增加,大气降水δD和δ18O值降低。 4)季节效应---冬季相对夏季,大气降水亏损重同位素。 雨水线: 全球雨水H, O同位素组成的一个重要特征是δD值与δ18O值间有明显的线性关系(Craig,1961),该关系式如下:δD = 8δ18O + 10(注意:1)雨水线不过原点(海水值);2)干旱和热带地区雨水线的斜率小于8。) 第六章微量元素地球化学 1.基本概念(能斯特分配定律、相容元素、不相容元素。) 能斯特分配定律:在一定的温度和压力条件下,元素在共存相间的分配达到平衡时,其活度比是一常数。 不相容元素:K或D<<<1,其特点是在岩浆过程中倾向于富集在熔体相中。 相容元素:K或D >>>1,其特点是在岩浆过程中倾向于富集在结晶相 (K为分配系数;D为总体分配系数。) 2.影响分配系数的主要因素: (1)离子半径(2).体系的组分(3).温度(4).压力(5).氧逸度。 3.岩浆过程中相容元素与不相容元素的变化特征。 0.01 0.1 1 10 100 0.2 0.4 0.6 0.8 1 100 10 1 0.1 0.01 00.20.40.60.81 a.平衡部分熔融过程微量元素变化的主要特征 不相容元素在溶体中富集:分配系数越小,富集程度越高;部分熔融程度越低,富集程度越高。 不相容元素在残留体中亏损:分配系数越小,亏损程度越高; 相容元素在溶体中的含量低于源岩:分配系数越大,亏损程度越高。 b.分离结晶过程中微量元素变化的主要特征 相容元素在分离结晶作用的早期在残余岩浆中迅速降低,在分离结晶作用的晚期在残余岩浆中几无。 不相容元素在分离结晶作用的早期在残余岩浆中浓度略升,在晚期,浓度骤升。 4.REE元素的组成及分类,PGE元素有哪些,LILE, HFSE的代表元素举例。 (1)REE的组成:57La 58Ce 59Pr* 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm 70Yb 71Lu 39Y 镧铈镨钕钜钐铕钆铽镝钬 铒铥镱镥钇 (2)REE的分类:a.两分法---轻稀土(LREE)La~Eu;重稀土(HREE)Gd~Lu+Y B.三分法---轻稀土(LREE)La~Nd; 中稀土(MREE)Sm~Ho; 重稀土(HREE)Er~Lu+Y。 (3)PGE元素有哪些:铂族金属,又称铂族元素。包括铂(Pt)、钯(Pd)、锇(Os)、铱(Ir)、钌(Ru)、铑(Rh)六种金属元素,在元素周期表中属第5,6周期。 5.什么是增田-科里尔图解:稀土元素的球粒陨石标准化图解,横坐标为原子序数,纵坐标为标准化后的稀土元素丰度,纵坐标为对数坐标。 6.制作稀土元素丰度模式图时,为什么需要将元素的含量进行标准化?最常用的参照标准是什么? 1、消除奇偶效应。 2、分异,分馏。参照标准是球粒陨石。 7. 8.REE配分图的分类 大学学期末班级工作总结 拖了老师好久的班级总结,终于在今天下午赶出来了。加上倩姐的建议、修改,终于成形发给老师了,总算完成了一件事。放在这里让师一的27位笨笨回味下这学期,顺便点评点评,对这份总结的不到位之处也请多包涵啊,顺便提点对下学期的建议吧,谢谢啦。 本学期班级里各方面正常运行。学风总体不错;工作方面无论是班内还是班外大家都表现突出;活动方面,大家积极配合,确保活动的顺利开展;生活方面,大家已经由刚开始的不习惯到现在的自如应对大学生活。 学习方面,刚开始大家很不适应大学的学习,没有老师不停的叮嘱预习复习,没有上课满满的板书,没有每周每月按时的考试,我们都有点不适应。班主任蒋老师还专门给我们安排了一场新老生学习经验交流会,在师兄师姐学习经验的传授下,我们渐渐上了轨道。懂得了大学的学习更多的是靠自习,老师只是起着引导的作用。具体展开说,精读这一科是上课方式转变最大,最需要大家慢慢适应且适应得不错的一科。刚开始很不习惯全英式的上课方式,后来经过老师的讲解,一些讲座的开展,我们也慢慢地适应了。开口讲英语、小组合作的学习方式,我们慢慢地将之习以为常并从中有所收获;泛读课上同学们积极踊跃配合老师,上课积极发言;语法课上大家学得很投入,课前课后也有许多同学问问 题,学习很主动;听力课上由于之前的英语视听水平参差不齐,同学们出现了很明显的分层现象,有些同学听力能力较高,有些相对则较弱,尽管如此,同学们还是很努力地去适应这种听力环境,并取得了进步;语音语调课上以及口语课上,大家也积极配合老师,在这一学期的学习中,大家慢慢地纠正自己的发音,口语普遍取得了很大的进步。考勤方面,虽然中间有段时间大家做得不是很够,有点懒散的迹象,但经过助班和班委们讨论后出台了一个方案,每个班干部轮流一天的考勤,包括早读、上课。实施了几个星期之后,效果很显著,大家自觉了许多。早读很少人迟到了,上课也准时了许多,考勤方面井然有序地展开。期末的学习氛围更是浓厚,大家经常泡图书馆,在宿舍也常讨论一些学习问题。相信经过大家的努力,期末考试顺利通过,都能考到满意的成绩。 工作方面,大家表现突出。在班里,班委们尽心尽职,除了做好自己的本分工作外,平时也积极帮忙其他班委干活,有问题有疑惑大家一起协商讨论。有了班委们的齐心协力,我们班的各项工作才得以顺利地开展。在班外,我们班有院学生会干事8名,团总支干事4名,礼仪小姐三名,司仪队两名,话剧队一名,合唱队一名,辩论队3名,排球队一名,羽毛球队一名,学校广播站英语播音员一名,英协干事一名,勤工俭学干事一名,CU街舞社队员一名,乒乓球秘书部干事 高中(人教版)《有机化学基础》必记知识点 目录 一、必记重要的物理性质 二、必记重要的反应 三、必记各类烃的代表物的结构、特性 四、必记烃的衍生物的重要类别和各类衍生物的重要化学性质 五、必记有机物的鉴别 六、必记混合物的分离或提纯(除杂) 七、必记有机物的结构 八、必记重要的有机反应及类型 九、必记重要的有机反应及类型 十、必记一些典型有机反应的比较 十一、必记常见反应的反应条件 十二、必记几个难记的化学式 十三、必记烃的来源--石油的加工 十四、必记有机物的衍生转化——转化网络图一(写方程) 十五、煤的加工 十六、必记有机实验问题 十七、必记高分子化合物知识 16必记《有机化学基础》知识点 一、必记重要的物理性质 难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 苯酚在冷水中溶解度小(浑浊),热水中溶解度大(澄清);某些淀粉、蛋白质溶于水形成胶体溶液。 1、含碳不是有机物的为: CO、CO2、 CO32-、HCO3-、H2CO3、CN-、HCN、SCN-、HSCN、SiC、C单质、金属碳化物等。2.有机物的密度 (1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂) (2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯 3.有机物的状态[常温常压(1个大气压、20℃左右)] 常见气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类:一氯甲烷、氟里昂(CCl2F2)、氯乙烯、甲醛、氯乙烷、一溴甲烷、四氟乙烯、甲醚、甲乙醚、环氧乙烷。 4.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示: ☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体; ☆部分被空气中氧气所氧化变质的苯酚为粉红色; ☆2,4,6—三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂); ☆苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液; ☆淀粉溶液(胶)遇碘(I2)变蓝色溶液; ☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。 5.有机物的气味 许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味: ☆甲烷:无味;乙烯:稍有甜味(植物生长的调节剂) ☆液态烯烃:汽油的气味;乙炔:无味 ☆苯及其同系物:特殊气味,有一定的毒性,尽量少吸入。 ☆C4以下的一元醇:有酒味的流动液体;乙醇:特殊香味 ☆乙二醇、丙三醇(甘油):甜味(无色黏稠液体) ☆苯酚:特殊气味;乙醛:刺激性气味;乙酸:强烈刺激性气味(酸味) ☆低级酯:芳香气味;丙酮:令人愉快的气味 6、研究有机物的方法 质谱法确定相对分子量;红外光谱确定化学键和官能团;核磁共振氢谱确定H的种类及其个数比。 二、必记重要的反应 1.能使溴水(Br2/H2O)褪色的物质 《地球化学》复习题 一、各章重点 PPT第0章重点: 地球化学发展简史(尤其是引领地球化学发展的关键学者的学术观点) 地球化学的发展趋势,包括学科生长点,及理论突破点。 PPT第1章重点: 地球化学分带的依据,各个分带地球化学特征以及相互之间的差异性; 元素和核素在地壳中分布的计量单位,元素在地壳中的分布特征,元素在主要岩石类型中的分布; 元素在地球其它圈层,如水圈(尤其是海水)、大气圈、生物圈中的分布特征。 元素在地球演化的各大地质时期中的成矿特点。 PPT第2章重点: 元素结合规律 类质同像 过渡元素的结合规律 了解戈尔德施密特的元素地球化学分类方法和按照元素的地球化学亲合性分类方法。 PPT第3章重点: 元素在水溶液中存在状态和迁移的主控因素; 主要造岩元素在岩浆结晶分异过程中的演化 岩浆作用中微量元素的定量模型 PPT第4章重点: 掌握讲解的每一种放射性同位素定年方法的原理及适用范围 稳定同位素在地球各个储库中的分布特征,影响稳定同位素分馏的主要控制反应。 PPT第5章重点: 太阳系元素分布特征,陨石分类体系及依据。 二、练习题 ---------------------------------------------------------------------------------- 1. 概述地球化学学科的特点。 2. 简要说明地球化学研究的基本问题。 3. 简述地球化学学科的研究思路和研究方法。 4. 地球化学与化学、地球科学其它学科在研究目标和研究方法方面的异同。----------------------------------------------------------------------------------------- 勘查地球化学心得体会--兼浅谈广东化探找金矿 王立强 广东省地质局七一九地质大队地质勘查所 1前言 目前,化探找金逐步被人们重视,在地质找矿中的效果也逐渐明显,成为寻找各种类型金矿床比较快速、经济、有效的重要手段。在区域普查中,通过查明区域地球化学异常,可迅速指出找矿远景区;在详查及勘探阶段,通过岩石地球化学异常的研究,可直接发现金矿床或矿体,更好地发挥化探在地质找矿工作中的作用。但是金在地壳内部的本底含量极低,即使是金矿体中的金含量一般亦仅为n×10-6~10n×10-6,仅凭肉眼无法将之直接区分出来,因此以对样品(水系沉积物、土壤、岩石等>进行定量分析为主要工作手段的化探方法,在当今金矿勘查中发挥了极其重要的作用。 中国地球化学的发展主要是借鉴了前苏联和西方的研究思路,前苏联的勘察地球化学主要依靠对土壤进行金属测量,但采样点布置较稀疏,而西方国家主要采用水系沉积物测量,但是主要用于研究,两者优缺点都有。80年代以来,金分析技术目臻成熟,当时Au分析的检出限低于或等于0.3×10-6,准确度、精密度在一定程度上能满足区域化探的要求,因而全国区域化探找金空前繁荣,特别是谢学锦先生提出的“区域化探全国扫面计划”建议,将我国的勘察地球化学推进到快速发展的崭新阶段。随着时代发展,金分析技术逐步进步,中国勘察地球化学也得到了长足的进步,三十年以来已完成1:500万和1:1 000万比例尺的39种元素或氧化物的全国地球化学图,使中国拥有了最引人瞩目的全国规模地球化学数据库,使中国化探走在了世界前列。而广东化探找金始于1974年,主要为以1:20万水系沉积物测量为主要工作方法的区域化探扫面,不过因为受金分析技术的影响,当时找金主要从金的伴生元素如As、Cu、Pb等入手,其难度不言而喻,但广东各地质单位的前辈在这种艰难条件下提交了大 高校期末考试工作总结范文 ----WORD文档,下载后可编辑修改---- 下面是小编收集整理的范本,欢迎您借鉴参考阅读和下载,侵删。您的努力学习是为了更美好的未来! 高校期末考试工作总结范文篇一根据黑电大发文件规定,?我校及所属四县电大20XX-20XX学年度第二学期期末考试于20XX年7月8日至7月13日进行,现已圆满结束。这次考试为期6天,本次共计3595人次参加了168个学科考试。在校领导的高度重视和指导下,在全体教职员工和各系、处、科、室的鼎力合作下,克服了“考生多、考场少、考试时间紧”等实际困难,使这次考试获得了圆满的成功,给下学期工作创造了良好的开端。 纵观这次考试,有以下几个特点: 1、领导高度重视,全体教职工配合默契 考试是学校工作中的一件大事,是检查教学质量的一个重要手段之一,而抓好考风考纪则是提高教学质量的一个重要途径。本学期开学伊始,校领导就提出要严肃考风考纪,端正学习风气,并由教务处制定了《监考教师奖惩条例》。各科室将这指示精神积极落实在日常工作中,狠抓教学管理,加强晚自习检查,这为严肃考风考纪奠定了良好的基础。20XX年6月底,由各个教研室组织分别在各班召开了学生考前动员大会,20XX年7月6日又召开了考务工作会议,会议由副校长邵文梅主持,,教务处主任陈英宣读了本次考试文件,刘鹏斌校长做了重要讲话,重申要严格考风考纪,并对肇源、肇州、林甸、杜蒙电大提出了新的要求。由于领导的高度重视,为考试工作创造了良好的开端。 考试期间,校领导亲自挂帅,刘鹏斌任主考,邵文梅任副主考。几位领导深入考场检查指导,邵校长连续6天亲自坐镇指挥,及时处理考试过程中遇到的问题,刘校长、孙校长在百忙之中抽出时间亲临考场检查巡视,在他们的带动下,全体监考人员和工作人员热情高涨,相互协调,紧密配合,不拖不靠,各司其职,使得这次考试进行得非常顺利。 2、加前考前教育,树立良好的学风 由于“端正学习风气,严肃考风考纪”的精神得到了贯彻落实,又召开了考前动员大会,使得考前教育工作做得非常充分。由于动员会,培训监考人等工作 一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。 二、重要的反应 1.能使溴水(Br2/H2O)褪色的物质 (1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物 ②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯 (2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O ②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+ 2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质 1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应) 2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物 与NaOH反应的有机物:常温下,易与—COOH的有机物反应加热时,能与卤代烃、酯反应(取代反应) 与Na2CO3反应的有机物:含有—COOH的有机物反应生成羧酸钠,并放出CO2气体; 与NaHCO3反应的有机物:含有—COOH的有机物反应生成羧酸钠并放出等物质的量的CO2气体。 4.既能与强酸,又能与强碱反应的物质 (1)氨基酸,如甘氨酸等 H2NCH2COOH + HCl → HOOCCH2NH3Cl H2NCH2COOH + NaOH → H2NCH2COONa + H2O (2)蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应。 5.银镜反应的有机物 (1)发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等) (2)银氨溶液[Ag(NH3)2OH](多伦试剂)的配制: 向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。 (3)反应条件:碱性、水浴加热 .......酸性条件下,则有Ag(NH3)2+ + OH- + 3H+ == Ag+ + 2NH4+ + H2O而被破坏。 (4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出 (5)有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == Ag(NH3)2OH + 2H2O 银镜反应的一般通式:RCHO + 2Ag(NH3)2OH 2 A g↓+ RCOONH4 + 3NH3 + H2O 【记忆诀窍】:1—水(盐)、2—银、3—氨 甲醛(相当于两个醛基):HCHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O 乙二醛:OHC-CHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2C2O4 + 6NH3 + 2H2O 甲酸:HCOOH + 2 Ag(NH3)2OH 2 A g↓+ (NH4)2CO3 + 2NH3 + H2O 葡萄糖:(过量)CH2OH(CHOH)4CHO +2Ag(NH3)2OH2A g↓+CH2OH(CHOH)4COONH4+3NH3 + H2O (6)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~4Ag(NH)2OH~4 Ag 6.与新制Cu(OH)2悬浊液(斐林试剂)的反应 (1)有机物:羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖)、甘油等多羟基化合物。 (2)斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液(即斐林试剂)。 (3)反应条件:碱过量、加热煮沸 ........ (4)实验现象: ①若有机物只有官能团醛基(—CHO),则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有(砖)红色沉淀生成;②若有机物为多羟基 醛(如葡萄糖),则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有(砖)红色沉淀生成; (5)有关反应方程式:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4 RCHO + 2Cu(OH)2RCOOH + Cu2O↓+ 2H2O HCHO + 4Cu(OH)2CO2 + 2Cu2O↓+ 5H2O OHC-CHO + 4Cu(OH)2HOOC-COOH + 2Cu2O↓+ 4H2O HCOOH + 2Cu(OH)2CO2 + Cu2O↓+ 3H2O CH2OH(CHOH)4CHO + 2Cu(OH)2CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O (6)定量关系:—COOH~? Cu(OH)2~? Cu2+(酸使不溶性的碱溶解) —CHO~2Cu(OH)2~Cu2O HCHO~4Cu(OH)2~2Cu2O 7.能发生水解反应的有机物是:卤代烃、酯、糖类(单糖除外)、肽类(包括蛋白质)。 HX + NaOH == NaX + H2O (H)RCOOH + NaOH == (H)RCOONa + H2O RCOOH + NaOH == RCOONa + H2O 或 8.能跟FeCl3溶液发生显色反应的是:酚类化合物。 9.能跟I2发生显色反应的是:淀粉。 10.能跟浓硝酸发生颜色反应的是:含苯环的天然蛋白质。 三、各类烃的代表物的结构、特性 类别烷烃烯烃炔烃苯及同系物 通式C n H2n+2(n≥1) C n H2n(n≥2) C n H2n-2(n≥2) C n H2n-6(n≥6) 第5章生态系统及其稳定性 【考纲知识梳理】 一、生态系统的概念及范围 1、概念:生物群落与它的无机环境相互作用而形成的统一整体,叫生态系统。 2、范围:有大有小,其中生物圈是地球上最大的生态系统,它是地球上的全部生物及其无机环境的总和。 二、生态系统的组成成分 成分构成作用(主要生理过程)营养方 式 地位 非生物成分非生物的物 质和能量 光、热、水、土,气为生物提供物质和能量 生物成分生产者 绿色植物、光合细 菌、化能合成细菌 将无机物转变成有机 (光合作用化能合成用) 自养型 生态系统的 基石 消费者 动物、寄生微生物、 根瘤菌 消费有机物(呼吸作用) 异养型 生态系统最 活跃的成分分解者腐生微生物、蛔虫分解动植物遗体(呼吸作用) 生态系统的 关键成分 三、生态系统的营养结构 1、食物链:生态系统中各生物之间由于食物关系而形成的一种联系。 2、食物网:在一个生态系统中,许多食物链彼此相互交错连接形成的复杂的营养结构。 3、食物链和食物网是生态系统的营养结构,是生态系统物质循环和能量流 动的渠道。 二、食物链和食物网的分析 1、每条食物链的起点总是生产者,如课本中的阳光不能纳入食物链,食物链终点是不能被其他生物所捕食的动物,即最高营养级,食物链中间不能做任何停顿,否则不能算作完整的食物链。 2、食物网中同一环节上所有生物的总和称为一个营养级,如书中第二营养级的生物有食草昆虫、鼠。 3、同一种生物在不同食物链中可以占有不同的营养级。 4、在食物网中,两种生物之间的种间关系有可能出现不同的类型,如书中青蛙和蜘蛛的关系既是捕食又是竞争关系。 5、食物网中,某种生物因某种原因而大量减少时,对另外一种生物的影响,沿不同食物链分析的结果不同时应以中间环节少为依据。 6、食物网的复杂程度主要取决于有食物联系的生物种类,而非取决于生物的数量。 第2节生态系统的能量流动 【考纲知识梳理】 一、能量流动的概念和过程 1、概念:生态系统中能量的输入、传递、转化和散失的过程。 2、能量流动的过程: (1)输入 ①源头:太阳能。 ②总值:生产者所固定的太阳能。 (2)传递 ①途径:食物链和食物网。 大学生培养工作总结 大学生培养工作总结 转眼间我已经进入了大三,在二年多的学习生活中,有酸甜苦辣,有欢笑和泪水,有成功和挫折!有人总结,在任何一个学校,平庸的大学生是相似的,不平庸的大学生各有各的辉煌,我们不能满足于平庸,应该以更好的方式开始新一天,而不是千篇一律的在每个上午醒来。大学,是我们由幼稚走向成熟的地方,在此,我们应认真学习专业知识,拓展自己的知识面,培养自己的能力,那么,我在这里谈一谈关于我在大学里的学习经验和心得体会。 大学的课程比起高中来说相较于轻松,大学里的学习主要是靠自觉,除了掌握老师课堂上讲的内容,还要利用课余时间阅读其他相关的书,查找资料,在提高自己专业知识水平的基础上,有目的地丰富各方面的知识。如果说高中时的学习是幼儿学路由老师领着,那么大学就是大人式的学习,我们接过学习的接力棒成为了领跑者,在这一场比赛中,可以跨栏可以抢道可以跳跃,而绝对不能在起跑线上等待老师牵着你跑。只有自主自助自信的学习,才能取得好成绩,正如一个好的足球运动员,他不能只听教练的意见,而应该自己进行思考,因为毕竟,在场上铲球,抢断,过人,射门的都是你自己。 至于学习方法,我相信没有最好,只有更好,要找到适合 于自己的学习方法,就像现在考研一样,选择适合于自己的辅导书才是最好的辅导书。我不是很聪明,但我知道“笨鸟先飞”,我应该属于那种兢兢业业型,每次都早去上课,不逃课,上课认真听讲,下课按时完成作业。关于学习,我觉得兴趣与目是最重要的,比如数学、计算机和比较重要的科目我上课就比较专心一点,而且在课外时间还会去阅读一些相关资料,而对于其他无关紧要的课程只是上课听一下,做到主次分明。在此我做以简单归纳:做好准备,提前预习,这样在课堂上能够比较顺利的跟上老师的节奏,取得更好的听课效果;认真听讲,做好记录,随堂记录笔记有助于集中注意听课,并且在期末备考的时候,可以有所侧重,减少盲目性;定期复习,注意交流,要避免因时间过久而遗忘所造成的重复性工作,掌握好复习的间隔;还有要多与同学交流,探讨解答问题的方法,和对不同问题的意见,将更有助于拓宽思路。 关于各科的课程学习我在这里谈一下数学、英语和计算机的学习。数学学习,数学是一门比较重视基础的学科,一定要把概念、公式弄清楚,一定要稳扎稳打,这样才能以不变应万变。英语学习,我英语基础不是太好,但现在考研必须重新学习,英语是大学中的必修课程,大一、大二两年一定要把英语基础打好,打牢,打实,这绝对马虎不得。因为大学要求过英语四级,还关系到能否得到学位证以及就业等诸 高中化学有机化学知识点总结 1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。 2.需用温度计的实验有: (1)、实验室制乙烯(170℃)(2)、蒸馏(3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃)(5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。 3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。 4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。 5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物 (2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物 (4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等) 6.能使溴水褪色的物质有: (1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化) (6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。) 7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。 8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。 9.能发生水解反应的物质有 卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。 10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素 11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。 高二生物必修《生态系统及其稳定性》知识点总结生态系统及其稳定性知识点总结由学习频道为大家提供的范文,仅供参考! 一、生态系统的结构 1.生态系统定义:由生物群落与它的无机环境相互作用而形成的统一整体,最大的生 态系统是生物圈(是指地球上的全部生物及其无机环境的总和)。 2.生态系统的结构包括生态系统的成分和营养结构(食物链和食物网) 3.生态系统的成分包括(1)非生物的物质和能量(无机环境);(2)生产者:自养生物, 主要是绿色植物;(3)消费者:异养生物,绝大多数动物,(营腐生的动物是分解者);(4)分 解者:异养生物,能将动植物尸体或粪便为食的生物(细菌、真菌、腐生生物)。注意:植 物并非都是生产者,如菟丝子是寄生植物,它是消费者;动物也并非都是消费者,如蚯蚓 是分解者;细菌也并非都是分解者,硝化细菌是生产者,寄生细菌是消费者。 4.食物链中只有生产者和消费者,其起点是生产者植物;第一营养级是生产者;初级消 费者是植食性动物。 5.食物网:许多食物链彼此相互交错连接成的复杂营养结构,就是食物网。 二、生态系统的能量流动 1、定义:生态系统中能量的输入、传递、转化和散失的过程。 a、能量来源:太阳能。输入:通过生产者的光合作用,将光能转化成为化学能。输 入生态系统总能量是生产者固定的太阳能总量。 b、传递途径:沿食物链、食物网, c、散失:通过呼吸作用以热能形式散失的。 行政管理干部的安全教育,主要内容包括:安全生产方针、政策和法律、法规;基本 的安全技术知识;本职的安全生产责任等。 d、过程:能量来源 (上一营养级),能量去向(呼吸作用、未利用、分解者分解作用、传给下一营养级)。 非石油输出国:出以色列为发达国家外,其他各国都是生产力水平较低的发展中国家。国民经济多以农牧业为主。各国利用地理位置优势,在运输和加工原油、提供劳务和商品上,深的石油之利。阿富汗是经济最落后的国家。 e、特点:单向流动、逐级递减(能量金字塔中底层为第一营养级,生产者能量最多 ),能量在相邻两个营养级间的传递效率:10%~20%(不可以提高也不可以降低) 第一章绪论 1.地球化学的定义:地球化学是研究地球及子系统(含部分宇宙体)的化学组成、化学作用和化学演化的科学(涂光炽)。 2.地球化学研究的基本问题 第一: 元素(同位素)在地球及各子系统中的组成(量) 第二: 元素的共生组合和存在形式(质) 第三: 研究元素的迁移(动) 第四: 研究元素(同位素)的行为 第五: 元素的地球化学演化 第二章自然体系中元素的共生结合规律 1.元素地球化学亲和性的定义:在自然体系中元素形成阳离子的能力和所显示出的有选择地与某种阴离子结合的特性称为元素的地球化学亲和性。 2.亲氧元素、亲硫元素与亲铁元素的特点 (1)亲氧元素:能与氧以离子键形式结合的金属(半金属)元素称为亲氧元素。 特点:惰性气体结构;电负性小;离子键为主;生成热>FeO;主要集中在岩石圈。(2)亲硫元素:能与硫结合形成高度共价键的金属(半金属)元素称为亲硫元素特点:铜型离子;电负性较大;共价键为主;生成热 大学教师期末个人工作总结 大学教师作为一个专业性很强的特殊的社会群体,以传播和研究高深学问为己任。作为研究者,其根本特性在于拥有精深的专业知识;作为教育者,其根本特性在于不仅要具备高深的专业知识,还应具备从事本专业所需要的教学知识。今天WTT小雅给大家整理了大学教师期末个人工作总结,希望对大家有所帮助。 大学教师期末个人工作总结范文一 在教学、科研及教书育人方面的工作总结如下: (一):教学方面 课堂教学方面,本年度共承担3门本科专业课程和1门研究生课程的课堂教学工作。在实践教学方面,承担冶金工程专业课程设计、生产实习以及毕业论文等实践环节的教学工作。教学过程中注重学生分析解决实际问题能力的培养,关注学生全方面发展。 全年教学工作量饱满,教学认真,效果良好,荣获优秀教学质量奖三等奖。 (二):教研方面 第一负责人,主持完成校级教改项目一项,新申请并获批校级教改项目一项和院教改项目一项,发表教学研究论文1篇。 (三):科研方面 课题:参加国家863、国家自然基金等省部级以上项目3项。 论文:发表论文5篇,其中1篇为国外SCI论文,另4篇EI 收录。 会议:参加国外召开的国际会议和国内会议各一次,发表论文3篇。 (四):教书育人方面 为响应创新型社会对人才创新能力培养的需要,利用业余时间积极鼓励和指导学生参加课外科研活动,指导学生完成科研立项4项(全部结题),申报并指导学生开展校级创新项目1项。 以上是20XX年度工作的总结,谢谢各位同事在工作中给予的大力支持和帮助,在新的一年里,将更加努力一如既往的做好各项工作。 大学教师期末个人工作总结范文二 现就将一年以来工作情况总结如下: 一、认真学习,提高思想认识,树立新的理念 1、坚持每周的政治学习和业务学习,紧紧围绕学习新课程,构建新课程,尝试新教法的目标,不断更新教学观念。注重把学习新课程标准与构建新理念有机的结合起来。通过学习新的《课程标准》,认识到新课程改革既是挑战,又是机遇。将理论联系到实际教学工作中,解放思想,更新观念,丰富知识,提高能力,以全新的素质结构接受新一轮课程改革浪潮的“洗礼”;。 2、通过学习新的《课程标准》,使自己逐步领会到“一切为了孩子的发展”;的教学理念。树立了学生主体观,贯彻了民主教 高中有机化学基础知识点归纳小结 一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。 二、重要的反应 1.能使溴水(Br2/H2O)褪色的物质 (1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物 ②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。 ③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色 ④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯 (2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O ②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+ 2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质 1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应) 2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物 与NaOH反应的有机物:常温下,易与含有酚羟基 ...、—COOH的有机物反应 加热时,能与卤代烃、酯反应(取代反应) 与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3; 含有—COOH的有机物反应生成羧酸钠,并放出CO2气体; 含有—SO3H的有机物反应生成磺酸钠并放出CO2气体。 与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体。4.既能与强酸,又能与强碱反应的物质 (1)2Al + 6H+ == 2 Al3+ + 3H2↑2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑ (2)Al2O3 + 6H+ == 2 Al3+ + 3H2O Al2O3 + 2OH-== 2 AlO2- + H2O (3)Al(OH)3 + 3H+ == Al3+ + 3H2O Al(OH)3 + OH-== AlO2- + 2H2O (4)弱酸的酸式盐,如NaHCO3、NaHS等等 NaHCO3 + HCl == NaCl + CO2↑ + H2O NaHCO3 + NaOH == Na2CO3 + H2O NaHS + HCl == NaCl + H2S↑NaHS + NaOH == Na2S + H2O (5)弱酸弱碱盐,如CH3COONH4、(NH4)2S等等 2CH3COONH4 + H2SO4 == (NH4)2SO4 + 2CH3COOH CH3COONH4 + NaOH == CH3COONa + NH3↑+ H2O (NH4)2S + H2SO4 == (NH4)2SO4 + H2S↑ (NH4)2S +2NaOH == Na2S + 2NH3↑+ 2H2O (6)氨基酸,如甘氨酸等 H2NCH2COOH + HCl → HOOCCH2NH3Cl H2NCH2COOH + NaOH → H2NCH2COONa + H2O 应用地球化学考试重点 绪论 1、应用地球化学:运用地球化学基本理论和方法技术,解决人类生存的自然资源和环境质量的实际问题的学科。地球化学是其理论基础。 2、应用地球化学研究内容: 元素分布与矿产资源 元素在各介质中的含量 元素的分布与分配 地球化学异常与指标 矿床的成因(矿床学为主) 矿床的储量(找矿勘探课程为主) 3、地球化学找矿与其它探矿方法的比较: (1)与地球物理相比,地化方法已成为其有效的辅助手段之一,在评价和解释地球物理异常时,可排除其多解性。 在某种意义上说是一种直接的找矿方法,因而成果的推断解释较物探法简单、直接。 (2)同时,它较地质钻探等投资少。 (3)地质物化探综合运用,则更能提高找矿的效果。 (4)传统的地质找矿方法,以矿物学和岩石学的观察为基础,要求要有可见标志。所以必须要求矿物的粒度在光学显微镜的分辨能力以上。而地球化学方法是依靠分析测试手段探测其微观标志 (5)任何一种找矿方法,都有一个应用条件问题,都要根据研究区地形地貌自然景观条件的不同,以及目标矿种的地球化学特征的不同,选择相宜的方法技术。 4、应用地球化学研究领域 第一章 1、地球化学旋回:地幔物质分异出的岩浆及地壳重熔物质形成的岩浆上升结晶形成岩浆岩,经构造运动进入表生环境,经风化剥蚀,搬运沉积,形成沉积岩,沉积岩经沉降或俯冲作用到达地壳深部,发生变质或重熔作用,形成岩浆,完成一个大循环。 2、常组组分分布特征: 地壳的物质成分与上地幔最有成因联系。起源于地幔。 地壳:便于采样→数据较多。 地幔:不能采样→数据少。 遵循化学计量原则形成自然矿物 地壳:易熔的硅铝长英质成分(Si、Al、Ca)和K、Na、水增加,以长英质浅色矿物为主。 地幔:难熔组分Mg、Fe、Ni、Co、Cr;以铁镁暗色矿物为主。 岩石圈中十余种常量元素占总量的绝大部分。 常量元素在地壳中总量占99. 9%以上 3、微量元素的分布规律:(判断/填空) 不受化学计量原则控制 ?微量元素分布服从概率分布规律,既有随机性,又有统计性。 ?从地核到地壳的垂直方向上,分散在结晶矿物中的微量元素在地球化学旋回中产生了分异作用,有些元素(亲石元素)具有明显的从地核,下地幔向上地幔,最终在地壳中富集。 ?微观上受元素类质同象置换条件制约,少部分以超显微非结构混入物(在矿物结晶生长时混入晶格缺陷或机械包裹)。 ?宏观上受元素分配系数制约,以某种统计规律反映富集贫化趋势。 元素的地球化学分类 4、谢尔巴科夫分类方法: 谢尔巴科夫用元素的向心力和离心力描述这种向地球外圈贫化或富集的趋势 谢尔巴科夫分类方法:向心元素、最弱离心元素、弱离心元素、离心元素 ?每次重熔,不相容元素和相容元素都产生一次分离,从而使晚期的岩浆较早期的岩浆更富集不相容元素。5、巴尔科特把岩浆岩演化的这种规律总结为极性演化,即酸性岩越来越酸性,基性岩越来越基性。这为矿产评价 与找矿提供了思路,即在时代最新的花岗岩类岩体中寻找不相容元素的矿床。 6、戈尔德施密特提出划分为亲铁、亲硫(亲铜)、亲氧(亲石)、亲气、亲生物元素的分类方案 7、从超基性岩到酸性岩,还具有由相容元素组合变为不相容元素组合的特征。 8、正常分布与异常分布: 一般将遵从常规、不悖常理、无特别异举即为正常,其核心是从众,相反即为异常。 地球化学的正常分布,也就是某一空间中多数位置上元素含量所具有的相对波动不大的特征。 地球化学中的异常,是指某一区段的地球化学特征明显不同于周围无矿背景区的现象。 9、背景区元素含量:背景上限、背景值、背景下限 10、把异常区内高于正常上限Ca的样品数n’与总样品数n的比值n’/n称为异常率。 异常率的大小,不仅与成矿作用的强度、规模有关,成矿作用越强,越接近矿化中心,异常率越高。 11、背景值分为四级:全球的背景值、地球化学省的背景值、区域的背景值、局部的背景值。 12、地球化学省:在地壳的某一大范围内,某些成分富集特征特别明显,不止是一两类岩石中元素丰度特别高,而 且该种元素的矿床常成群出现,矿产出现率也特别高。通常将地壳的这一区段称为地球化学省。地球化学省实质上是一种地球化学异常,它是以全球地壳为背景的规模巨大的一级地球化学异常。 13、地球化学指标:是指一切能提供地球化学信息或地质信息的,能直接或间接测定的地球化学变量。地球化学指 标在三度空间和时间上的分布与演化称为地球化学场。 14、地球化学场有以下特征: (1)与地球物理场相比,它没有严格的数学公式或化学定律进行准确的描述、推断、或延拓,它是具体点上地球化学环境(化学、热力学、动力学)综合制约的结果,可以定性推测而不能准确推算。 (2)地球化学场是一个连续的非均匀场。 (3)地球化学场是一个不可逆动态演化的非稳定场。 (4)地球化学场的指标不具有传递性。 15、地球化学障:凡是浓度梯度极大值所在的点,叫做地球化学障,其实质就是地球化学环境发生骤然变化,元素 活动性发生急剧改变的地段(A·И·彼列尔曼)。它是一种地球化学环境的边界。 16、50年代阿伦斯(1954,1957)提出常量元素服从正态分布,微量元素服从对数正态分布规律,概括了当时最 有影响的认识。地质体中元素含量的概率分布型式与该地质体经历的地质作用过程有关。 维斯捷里斯(V.B.Visteeius.1960)的“地球化学过程的基本定律”最有代表性:单一地球化学过程所形成的地质体,元素含量服从正态分布;由数个地球化学作用过程叠加所形成的复合地质体中元素含量偏离正态分布,并且多为正偏分布(其中有些服从对数正态分布)。 应用地球化学复习题总结 1、化探:地球化学找矿法简称化探,是以地球化学和矿床学为理论基础,以地球化学分散晕(流)为主要研究对象,利用矿床在形成及以后的变化过程中,成矿元素或伴生元素所形成的各种地球化学分散晕进行找矿的方法。 2、元素的地球化学亲合性:在自然体系中元素形成阳离子的能力和所显示出的有选择地与某种阴离子结合的倾向性。 3、Goldschmit 的元素地球化学分类:亲石元素(即亲岩元素或亲氧元素) 、亲硫元素(即亲铜元素)、亲铁元素、亲气元素、亲生物元素 4、地球化学异常:是相对于地球化学背景区而言的,是指与地球化学背景区相比有显著差异的元素含量富集区或贫化区 5、地球化学指标:指一切能提供找矿信息或者其他地质信息的、能够直接或间接测量的地球化学变量。 6、地球化学场:如果把地球化学背景和发育在其中的地球化学异常当作一个整体看待,元素在该体系中的分布构成了地球化学场。 7、勘查地球化学:是地球化学的实践应用,是一门运用地球化学基本理论和方法技术,解决人类生存的自然资源和环境质量等实际问题的科学。是研究地球表层系统物质组成与人类生存关系,并能产生经济效益和社会效益的学科。 8、原生环境:指天然降水循环面以下直到岩浆分异和变质作用发生的深部空间的物理化学条件的总和。 9、次生环境(或表生环境):是地表天然水、大气影响所及的空间所具有物理化学条件的总和。 10、地壳元素丰度:是指地壳中化学元素的平均含量,也称克拉克值,是为了表彰在这方面作出卓越贡献的美国化学家克拉克而命名的。 11、浓度克拉克值(相对丰度):化学元素在某一局部地段或某一地质体中的平均含量与地壳丰度的比值。 12、矿石浓集系数:矿石的平均品位与该元素地壳丰度之比。 13、最低浓集系数:矿床的最低可采品位与其地壳丰度之比。 14、表生地球化学环境的特点:是一个温度压力低,以含二氧化碳和多组分水为介质的物理化学综合环境。 15、地球化学景观:是指所有影响表生作用的外部元素的总和。 16、景观地球化学:就是研究化学元素在各种景观条件下迁移沉淀的规律。 17、检出限:定义为某一分析方法或分析仪器能可靠地测试出样品中某一元素的最小重量或质量(μg或n g)。 大学学委学期末总结 大学学委学期末总结 大学学委学期末总结似水的大学生活过得匆匆而又无情,暮然回首,你我即将挥手告别大一上学期,透视过去的一学年,身为班级学习委员,这一年工作的点点滴滴时常在脑海中浮现。自从进入福建机电技术学院,进入数控系 (1)班,我学到了很多,也感受到了很多。现在,只有几天就要结束自己本学年的班级学习委员的工作了,回望这一年自己走过的路、留下的或深或浅的足迹,不仅充满了欢愉、也充满了淡淡的苦涩。一学年的工作,让我学到了很多很多,我现就这学年的工作情况向老师作如下汇报:大一第一学期,在全体同学及辅导员的支持下,我积极培养自己的组织领导能力和执行能力,带领全班共同建设良好的学风班风(虽有不好之处)。作为班委要认真负责、态度踏实,要有一定的组织、领导、执行能力,并且做事情要公平、公开、公正,积极落实学校及班级的具体工作任务。这是我们身为班干部必须首先认识到的。作为班级的学习委员,在学习工作方面给我的感触最多了:首先,我收集学生对老师的意见和老师的教学动态。因为在很多情况下,老师无法和那么多学生直接打交道,很多老师也无暇顾及那么多的学生,特别是大家刚进入大学,很多人一时还不适应老师的教学模式。所以,作为学习委员我有及时地向任科老师提出同学们的建议、疑问。其次,为了带领全班共同建设良好的学风班风,我带领班级中的成绩优良者成立了学习兴趣小组。而且,有不定时的开展活动等。在这一学年中,我见到了学习兴趣小组的成长历程——从刚开始的 “不知所谓”到现在的“有声有色”。最后,我也在班上积极开展一些教育讲座等。当然,同学们的反映还是不错的。总之,在一学年的班级工作中,我懂得如何落实各项工作,如何和班委有效地分工合作,如何和同学沟通交流并且提高大家的学习积极性,开展丰富的班级活动。当然,我的工作还存在着很多的不足之处。比如: 有的时候得不到大家的响应,大家不积极主动支持我的工作;学习委员的任务比较重,时传达到个人;在收集同学们对自己工作意见方面做得不够,有些事做错了,没有周围同学提醒,自己没有发觉等等。不过,我想在以后的班级工作中,我会进一步改正的。即使以后不再是一名班委,但我仍然可以作为一名普通学生的身份和大家进一步沟通交流,和所有数控系 (1)班成员一道把我们班建设成为具有良好的班风学风的班级体而努力奋斗。同时,感谢数控系 (1)班给我这个展示自我、锻炼自我、提高自我的平台。在此,我衷心的希望我们可以携手共进,建设良好的班风学风;同时,我也希望每个同学都可以从数控系 (1)班,从福建机电技术学校这个新起点,展翅高飞!最终找到属于自己的天空。最后我要感谢辅导员在这一学年中对我的工作的关心与支持!大学学委学期末总结大学生活已过了一年,在这一年的时间里,我一直担任着班上的学习委员这一职务。首先感谢当初竞选的时候同学们都很支持我。在这一年的工作和学习中,我的处事能力和工作能力都得到了很大的提高。我和各位老师以及同学们的感情也增进了不少。以下我对我这一年的工作做一个总结。有些工作是我做得比较满意的:1.能够积极地配合老师工作,安排课代表按时收发作大学学期末班级工作总结
有机化学知识点全面总结
地球化学复习总结题
地球化学心得
高校期末考试工作总结范文
(完整版)高中有机化学基础知识点归纳(全)
生态系统知识点的总结1
大学生培养工作总结
高中化学有机化学知识点总结
高二生物必修《生态系统及其稳定性》知识点总结
地球化学期末考试总结
大学教师期末个人工作总结
高中有机化学基础知识点归纳小结
应用地球化学考试重点(经典)
应用地球化学复习题总结
大学学委学期末总结
