高中化学离子浓度大小比较练习题(附答案)

高中化学离子浓度大小比较练习题
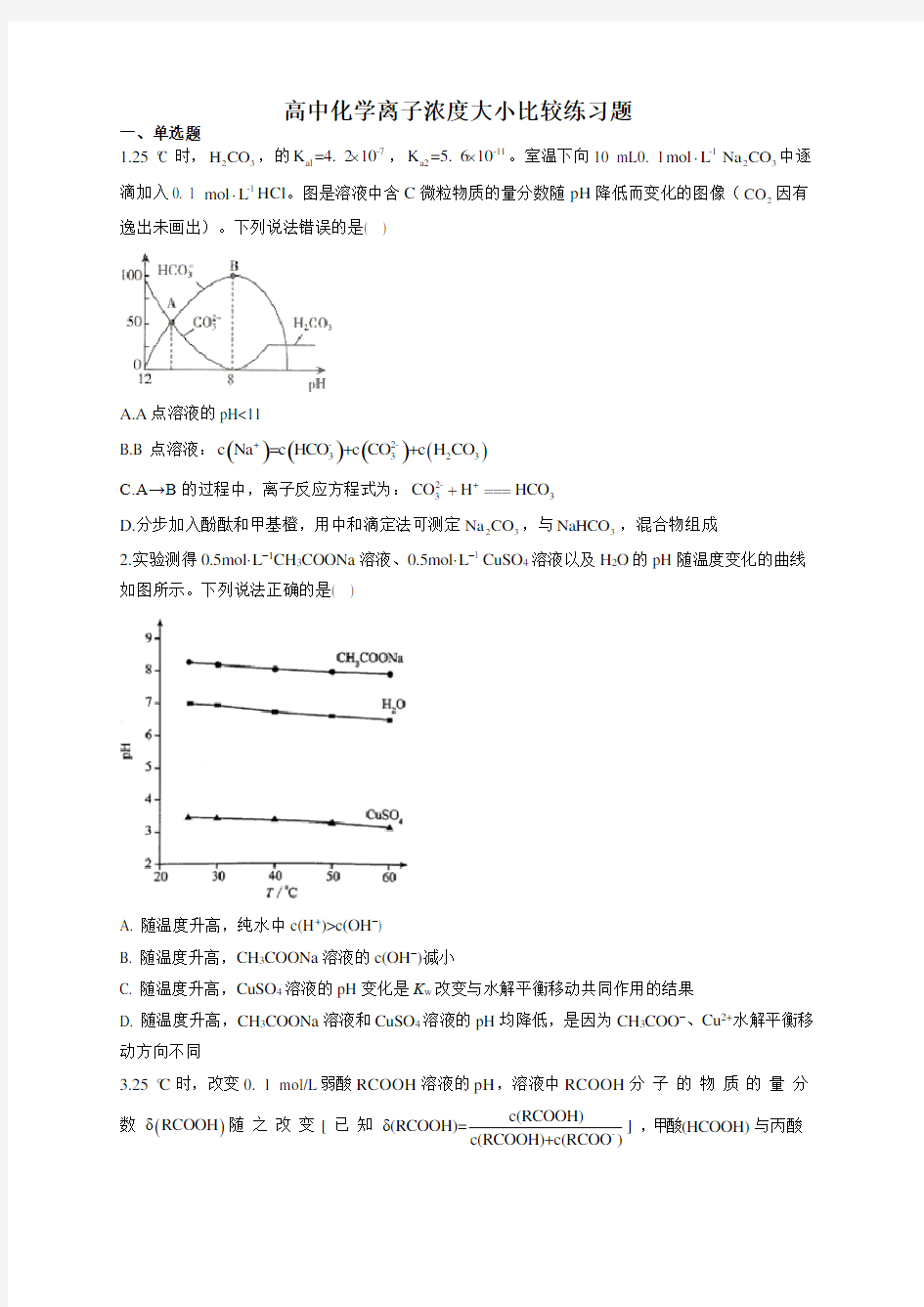
一、单选题 1.25 °C 时,23H CO ,的-7al K =4. 210?,-11a2K =5. 610?。室温下向10 mL0. 1-1mol L ?23Na CO 中逐滴加入0. 1 -1mol L ?HCl 。图是溶液中含C 微粒物质的量分数随pH 降低而变化的图像(2CO 因有逸出未画出)。下列说法错误的是( )
A.A 点溶液的pH<11
B.B 点溶液:()()()
()-2-33+23c Na =c HCO +c +c H O CO C
C.A→B 的过程中,离子反应方程式为:2-+3
3C H HCO O +=== D.分步加入酚酞和甲基橙,用中和滴定法可测定23Na CO ,与3NaHCO ,混合物组成
2.实验测得0.5mol·L ?1CH 3COONa 溶液、0.5mol·L ?1 CuSO 4溶液以及H 2O 的pH 随温度变化的曲线如图所示。下列说法正确的是( )
A. 随温度升高,纯水中c(H +)>c(OH ?)
B. 随温度升高,CH 3COONa 溶液的c(OH ?)减小
C. 随温度升高,CuSO 4溶液的pH 变化是K w 改变与水解平衡移动共同作用的结果
D. 随温度升高,CH 3COONa 溶液和CuSO 4溶液的pH 均降低,是因为CH 3COO ?、Cu 2+水解平衡移动方向不同
3.25 °C 时,改变0. 1 mol/L 弱酸RCOOH 溶液的pH ,溶液中RCOOH 分子的物质的量分数()δRCOOH 随之改变[已知-c ()
δ()c RCOOH RCOOH =
RCOOH RC )+c(OO ()
],甲酸(HCOOH)与丙酸
32CH CH C )OOH (溶液中()δRCOOH 与pH 的关系如图所示。下列说法正确的是( )
A.图中M 、N 两点对应溶液中的-c(OH )比较:前者>后者
B.丙酸的电离常数K= 4.8810-
C.等浓度的HCOONa 和32CH CH COONa 两种榕液的pH 比较:前者 > 后者
D.将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶液等体积混合,所得溶液
中:()()()()()
--+>c H C O O H >c H
C O O >c O c N H a >c H + 4.常温下,K sp(CaF 2)=4×10-9,K sp (CaSO 4)=9.1×10-6。取一定量的CaF 2固体溶于水,溶液中离子浓度的变化与时间的变化关系如图所示。下列有关说法正确( )
A.M 点表示CaF 2的不饱和溶液
B.常温下,CaF 2的饱和溶液中,c(F -) = 10-3 mol/L
C.温度不变,t 时刻改变的条件可能是向溶液中加了KF 固体, CaF 2的K sp 增大
D.常温下,向100 mL CaF 2的饱和溶液中加入100 mL 0.2 mol/L Na 2SO 4溶液,平衡后溶液中的c (Ca 2+)约为9. 1×10-5 mol/L
5.常温下将NaOH 溶液滴加到己二酸(2H X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.()a22H X K 的数量级为-610
B.曲线N 表示pH 与()()
2HX lg
H X c c -的变化关系
C.NaHX 溶液中()()
H OH c c +->
D.当混合溶液呈中性时,()()()()()
2-Na HX X OH H c c c c c +--+>>>=
6.常温下,钠盐(Na 2XO 3)溶液中微粒浓度的变化关系如图所示[pOH=-lg c (OH -)]。下列说法正确的是( )
A.曲线N 表示1g
()
()
233H XO HXO c c -
与pOH 的变化关系
B.常温下,K a2(H 2XO 3)=10-10
C.当pOH=2时;NaHXO 3溶液中:
()()
2323
H XO XO
c c -
=10-8
D.向Na 2XO 3溶液中滴加稀盐酸至中性时,溶液中:c (Na +)=2c(3HXO -
)+2c(23XO -
) 7.常温下,向20 mL 0. 1 mol ?L -1
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子
浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )
A.常温下,0.1 mol ? L -1氨水中NH 3 ? H 2O 的电离常数K 约为1×10-5
B.a 、b 之间的点一定满足:c (+4NH )>c (Cl - )>c (OH - )>c (H +
) C.c 点溶液中c (+4NH )=c (Cl - )
D.d 点代表两溶液恰好完全反应
8.根据下列各图曲线表征的信息。得出的结论正确的是( )
A.图1表示常温下向体积为10 mL 0.1 mol ?L -1 NaOH 溶液中逐滴加入0.1 mol ?L -1 CH 3COOH 溶液后
溶液的pH 变化曲线,则b 点处有:c(CH 3COOH)+c(H +)
c(OH -)
B.图2表示用水稀释pH 相同的盐酸和NH 4Cl 溶液时,溶液的pH 变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH 4Cl 溶液,且溶液导电性:b>c>a
C.图3表示的是Al 3+与OH -反应时含铝微粒浓度变化曲线,图中a 点溶液中大量存在Al 3+
D.由图4得出若除去Fe 2(SO 4)3溶液中的Cu 2+,可采用向溶液中加入适量Fe 2O 3,调节溶液的pH 至4左右
9.下列说法正确的是( )
A.ph=1的4NaHSO 溶液:()()()
+24H SO OH
c c c --
<+ B.室温下,Ph=3的3CH COOH 溶液与pH=11的NaOH 溶液等体积混合后,因生成的3CH COONa 水解,所以由水电离出的()
+-3-1c H 10mol L ?>
C.已知常温下()()a 3a CH COOH HCN K K >,则等体积等浓度的NaCN 和3CH COONa 溶液中,3CH COONa 溶液所含的离子数比NaCN 溶液多
D.室温下,pH=11和pH=13的NaOH 溶液等体积混合后,则混合后的溶液中
()1113+
-11010H mol L 2
c --+?=
10.已知34H PO 是一种三元中强酸。25 °C 时,向某浓度34H PO 溶液中逐滴加入NaOH 溶液,滴加
过程中各种含磷微粒的物质的量分数δ随溶液pH 的变化曲 线如右图所示。下列说法正确的是( )
A.曲线2和曲线4分别表示2-4δHPO ()和s 3-4δ(PO )变化
B.25 ℃时,34H PO 的电离常数5112K :K =10
C.pH = 7. 2 时,浴液屮由水电离出的()
+-7.2 c H =10m ol /L
D.PH = 12. 3 时,()
+2-3-442c Na 5c HPO +5c PO ()+()
11.常温下,分别向NaA 溶液和MCl 溶液中加入盐酸和NaOH 溶液,混合溶液的pH 与离子浓度变化关系如下图所示。下列说法不正确的是( )
A.曲线1L 表示+c(M )lg c(MOH)
与pH 的变化关系
B.() 5.5a K HA =110?-
C.a 点时两溶液中水的电离程度相同
D.0.01-1mol L ? MA 溶液中存在:()()
++c M >c A >c ()(OH H )>c --
12.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl 气体分子在253K 冰表面吸附和溶解过程的示意图,下列叙述错误的是( )
A.冰表面第一层中,HCl 以分子形式存在
B.冰表面第二层中,+H 浓度为31510mol L --??(设冰的密度为30.9g cm -?)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应+H l C +C H l -
垐?噲?
13.根据下列图示所得出的结论不正确的是( )
A.图甲是()()()()222CO g +H O g =CO g +H g 的平衡常数与反应温度的关系曲线,说明该反应的
0H ?<
B.图乙是室温22H O 催化分解放出氧气的反应中22()H O c 随反应时间变化的曲线,说明随着反应的进行22H O 分解速率逐渐减小
C.图丙是室温下用0.1000mol·L -1 NaOH 溶液滴定20.00mL0.1000mol·L -1某一元酸HX 的滴定曲线,说明HX 是一元强酸
D.图丁是室温下用24Na SO 除去溶液中2+Ba 达到沉淀溶解平衡时,溶液中2+()Ba c 与2-4()SO c 的关系曲
线,说明溶液中2-4()SO c 越大2+()Ba c 越小
二、实验题
14.pH 相等的NaOH 溶液与3CH COONa 溶液,分别加热到相同的温度后 3CH COONa 溶液的pH NaOH 溶液的pH (填“>”“=”或“<”)。
(2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的()()
4NH Cl
c c +-
=,则盐酸的体积 氨水的体积(填“>”“=”或“<”)。
(3)将-10.2mol L ?溶液与-10.1mol l ? NaOH 溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中()()
Na A c c +->,则:
①混合溶液中,()
A c - ()c HA (填“>”<”或“=”,下同)。 ②混合溶液中,()()
HA A c c -+ -10.1mol L ?
(4)常温时,取-10.1mol L ?溶液与10.1mol L -? NaOH 溶液等体积混合,测得混合溶液的pH =8 ①混合溶液中由水电离出的()
OH c -与-10.1mol L ? NaOH 溶液中由水电离出的()
OH c -之比为 ②已知4NH X 溶液呈中性,又知将HX 溶液加入23Na CO 溶液中有气体放出,试推断()432NH CO 溶液的Ph 7(填“>”“<”或“=”)。
15.砷()As 是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效
吸附剂X ,吸附剂X 中含有2-
3CO ,其中原因是________ .
(2)33H AsO 和34H AsO 水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度
之和的分数)与pH 的关系分别如图-1和图-2所示。
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH 溶液逐滴加入到33H AsO 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______.
②34H AsO 第一步电离方程式34
H AsO -+24H AsO +H 的电离常数为al K ,则
al pK =_______()al al pK =-1gK .
(3)溶液的pH 对吸附剂X 表面所带电荷有影响. pH=7.1时,吸附剂X 表面不带电荷; pH>7.1时
带负电荷, pH 越高,表面所带负电荷越多; pH<7.1时带正电荷, pH 越低,表面所带正电荷越多. pH 不同时吸附剂X 对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X 吸附砷的质量)如图-3所示.
①在pH 7~9之间,吸附剂X 对五价砷的平衡吸附量随pH 升高而迅速下降,其原因是_____. ②在pH 4~7之间,吸附剂X 对水中三价砷的去除能力远比五价砷的弱,这是因为_____。提高吸附剂
X 对三价砷去除效果可采取的措施是_____.
参考答案
1.答案:B
解析:A.A 点(
)(
)-2-3
3
c HCO c CO
=,所以()()
2-311a2
-3c CO () 5.610c CO c H H K
+-?=
=?,所以
11
-1() 5.610mol L c H -+=??,pH 逐滴加入-10.1mol L ?HCl ,B 点溶液中钠离子的物质的量浓度是备碳粒子浓度的2倍,即 ()()()()-2-3233c Na 2c HCO 2c CO 2c H CO +=++,选项 B 错误;C. A→B 的过程中,2-3CO 逐渐减小,-3HCO 逐渐增加,所以发生 反应的离子方程式为:2-+-33CO H HCO +===,选项C 正确; D.23Na CO 溶液中逐滴加入盐酸,用酚酞作指示剂,滴定产物是碳酸氢钠,用甲基橙作指示剂滴定时碳酸氢钠与盐酸反应产物时碳酸,所以分布加入酚酞和甲基橙,用滴定法可测定23Na CO 与混合物 组成,选项D 正确。 2.答案:C 解析:A.水的电离为吸热过程,升高温度,平和向着电离方向移动,水中c(H +).c(OH -)=Kw 减小,故pH 减小,但c(H +)=c(OH -),故A 不符合题意; B.水的电离为吸热过程,升高温度,进水的电离,所以c(OH -)增大,醋酸根水解为吸热过程,CH 3COOH -+H 2O CH 3COOH+OH -,升高温度促进盐类水解,所以c(OH -)增大,故B 不符合题 意; C.升高温度,促进水的电离,故c(H +)增大;升高温度,促进铜离子水解Cu 2++2H 2O=Cu(OH)2 +2H +,故c(H +)增大,两者共同作用使pH 发生变化,故C 符合题意; D.盐类水解为吸热过程,升高温度促进盐类水解,故D 不符合题意; 综上所述,本题应选C 。 3.答案:B 解析: A.M 点的pH 小于N 点的pH 值,即M 点c(H )+大于N 点c(H )+,所以溶液中的-c(OH )应该是M 点小于N 点,故A 错误;B. pH=4.88时,丙酸的酸分子的物质的量分数为 50%,即-3232 c C H C H C O O H =()c CH CH COO (),针对-3232+c()(CH CH COOH c CH CH COO )+H 电离过程可知,+(lgK = lgc H )=-4.88,即丙酸的电离常数 4.88K = 10-,故B 正确;C.由图中信息可知,相同pH 时,丙酸的酸分子的物质的量分数大,说明电离程度小,故其酸性比甲酸弱,即-HCOO 的水解程度小于-32CH CH COO 的水解程度,等浓度的HCOONa 和23CH CH COONa 两种溶 液的pH 比较应是pH ()32HCOONa -(O )H )c c(H +<,D 错误;故选B 。 4.答案:D 解析:由图可知,一定量的CaF 2固体溶于水达到溶解平衡后,t 时刻增大溶液中c (F -),c (Ca 2+)减小,但温度不变,CaF 2的溶度积K sp 不变。A.由图可知,M 点时c (F -)不变,为CaF 2的饱和溶液,故A 错误;B.CaF 2的饱和溶液中,K sp (CaF 2)=c 2(F -)c (Ca 2+),c (F -)=2c (Ca 2+),则c (F - ) ==2×10-3 mol/L ,故B 错误;C.向溶液中加入KF 固体,增大溶液中c (F -),c (Ca 2+)减小,但温度不变,CaF 2的溶度积K sp 不变,故C 错误,D. 向100 mLCaF 2的饱和溶液中加入100 ml 0.2 mol/LNa 2SO ,溶液,Q c >K sp ,产生CaSO 4沉淀,c (Ca 2+ )=()() 4sp 24CaSO SO K c - ≈6 9.1100.1-?=9.1×10-5 mol/L ,故D 正确。 5.答案:D 解析:本题以酸碱中和滴定为载体,考查学生的数据处理和识图能力。因二酸是二元弱酸,其一级电离程度较大,故曲线M 表示()() 2-X lg HX c c - 与pH 的关系,曲线N 表示()() -2HX lg H X c c 与pH 的关系,B 项正确;已二酸的二级电离平衡常数的表达式为()()() 2-a2H X HX c c K c ++?= ,则()() () 2a2 X lg lg HX H c K c c --+==1 即()() 2-X lg 0HX c c - =时,pH 5.37≈, 5.37a2110K -?= ,A 项正确;根据图像取点(0.6,5.0),()() -0.62HX lg 10H X c c =,() 5.0 -1 H 10 mol L c + -?=,代入()()() 0.6 5.0 4.a 421HX H 101010H X c c c K -+--??=== ,所以HX - 的水解常数为14 9.6 5.37a24.410101010 K ----<==,则NaHX 溶液显酸性,即()() H OH c c +->,C 项正确; 溶液呈中性时,( )() OH H c c - + =,()() 2X lg HX c c -->0,即()( ) 2X HX c c -->,D 项错误。 6.答案:B 解析:A.Na ?XO 3为强碱弱酸盐,23XO - 水解使溶液显碱性,分2步水解: 23XO -+H 2O 3HXO -+OH -,3HXO - +H 2O H 2XO 3+OH -。两步水解中,水解第一步程度较 大,因此pOH 相同时,lg ()() 323HXO XO c c - -的值大,所以实线M 表示pOH 与 () ()233H XO HXO c c - 的变化关系, A 项错误;B.根据图象可知,当pOH=0时,即c (OH -)=1 mol/L 时,lg ()() 323HXO XO c c --=-4即 () () 323 HXO XO c c - - =10-4,根据电离方程式:3 HXO - H ++23XO - ;得 K a2= ()() 214 31443(H )XO (H )101010 HXO c c c c +- +---- ===10-10,B 项正确;C.当pOH=2时,根据图象可知,此时1g ()() 233 H XO HXO c c - =-7,lg ()() 323HXO XO c c --=-2,所以有 ()() 233 H XO HXO c c -=10-7, ()() 323HXO XO c c - -=10-2,二者相乘得 ()() 2323 H XO XO c c - =10-9,C 项错误;D.向Na 2XO 3溶液中滴加稀盐酸至中性时,据溶液中电荷守恒有: c (Na +)+c (H +)=( )3HXO c - +( )232XO c - +c (OH -)+c (Cl -),又因中性而有c (H + )=c (OH -),所以有 c (Na +)=( )3HXO c - +( )232XO c - + c (Cl - )。 7.答案:A 解析:A.常温下,0. 1 mol/L -1的氨水溶液中c (H +)=10-11mol/L 则 +-33-5432(NH )(OH )1010==mol/L=110mol/L (NH H O)0.1 a c c K c --??,所以 A 选项是正确的;B.a 、 b 之间的任意一点,溶液都呈碱性,则 c(H +) c 点c (H +) > 10-7mol/L ,c(OH )<10-7mol/L ,溶液呈酸性,结合电荷守恒得: c(+4NH ) ) ?c (OH -) =K W =10-14,所以c (H +)=c (OH -),溶液呈中性,如果氨水和盐酸恰好完全反 应生成氯化铵,氯化铵为强酸弱碱盐,其溶液显酸 性,故D 错误。 8.答案:A 解析:体积10 mL 0.1mol·L ?1 NaOH 溶液中逐滴加入0.1 mol·L ?1 CH 3COOH 溶液后,所得的溶液是醋酸钠溶液,存在质子守恒c (CH 3COOH)+c (H +)=c (OH -),A 正确。用水稀释pH 相同的盐酸和NH 4Cl ,盐酸的pH 变化较大,NH 4Cl 的pH 变化小,溶液的导电能力取决于自由移动离子的浓度的大小,即其中Ⅰ表示盐酸,Ⅱ表示NH 4Cl ,且溶液导电性:a>b>c ,B 错误;Al 3+与OH -反应时,先生成氢氧化铝沉淀,而后沉淀溶解生成偏铝酸根,a 点对应的碱性较强,铝元素应以偏铝酸根的形式存在,C 错误;若除去Fe 2(SO 4)3溶液中的Cu 2+,加入适量Fe 2O 3,调节溶液的pH 至4左右,此时会生成氢氧化铁沉淀,不能除去Cu 2+,反而把Fe 3+除去,D 错误。答案选A 。 9.答案:C 解析:4NaHSO 溶液中,()()()() +24Na H 2so OH c c c c +--++=,()() 24 Na SO c c +-=,故()()()2-4H SO OH c c c +-=+,A 不正确;3CH COOH 为弱酸,pH =3的3CH COOH 溶液与pH =11的 NaOH 溶液等体积混合后,3CH COOH 大量剩余,溶液显酸性,水的电离受抑制,所以水电离出的 H +浓度不可能大于-3-110mol L ?,B 不正确;等体积等浓度的NaCN 和3CH COONa 溶液中分别存在 ()()()()++Na H CN OH c c c c --+=+,()()()()3Na H CH COO OH c c c c ++--+=两种溶液中() Na c +相同,由于酸性3CH COOH HCN >,所以水解程度3CH COONa NaCN <溶液中()H c +较大,故3CH CONa 溶液中()() Na H c c +++大于NaCN 溶液中()() Na H c c +++,所以3CH COONa 溶液中所 含的离子数比NaCN 溶液多,C 正确;两种强碱溶液混合后应先求混合后溶液中( ) OH c -,再根据()() W - H OH K c c += 求() +H c ,D 不正确。 10.答案:B 解析:A.起始时段附近浓度较高的为34H PO 随pH 缓慢增大,溶液中34H PO 浓度降低, 24HPO -浓度增大,然后24HPO -浓度降低,24HPO -浓度增大,然 后24HPO -浓度降低,34PO - 浓度 增大,所以曲线1表示()34δH PO ,曲线2表示()24δH PO -,曲线3表示() 24δHPO -,曲线4表示()34δPO -,故A 错误。B.根据图象,溶液中-3424c H PO c(H =PO ())时,即()() 3424δH PO δH PO -=时,溶液的 PH = 2. 1,则34H PO 的电离常数-24134c H c H PO K c H ()()() PO +?== 2.1()=10c H -+;pH = 7. 2 时,溶液中()() 2244 δH PO δHPO --=,则()() 2244 c H PO c HPO -- =,() -2247.24 2c H K c H c H P ()c HPO ()10()O +- +-?= ==;则 2.17.2 5.112:10:101K K 0--== 故B 正确C. pH = 7. 2 时.溶 液中()() 2244δH PO δHPO --=,则()() 2244 c H PO c HPO -- =,溶液呈碱性,说明以水解为主,促进了水的电离,溶液中氢氧根离子来自水的电离,则水电离 的 6.8()1c 0H -+=mol/L ,故 C 错误;D. pH=12. 3 时,溶液中()() 2344HPO δPO δ-- =,则()()23-4-4c HPO =PO c ,即()()4342c Na PO =c a HPO N ,根据物料守恒可得: ()()2-3-44+-2434()()+c HP 5c Na =2c H PO 22+2c H O c PO (PO +),故 D 错误。 11.答案:C 解析:C 解析:A. MCl 溶液中加入NaOH 溶液,溶液pH 逐渐增大+M 离子逐渐减小,MOH 的浓度逐渐增大,则()() +g c M l c MOH ,则曲线1L 表示()() +g c M l c MOH 与pH 的变化关系,故A 正确;B. 曲线2L 表示()() -c A lg c HA 与pH 的关系,()() -c A lg c HA =0时,()() -c A lg c HA = 1,此时pH = 5.5,c(H )+ = 5.5 110 -?-1 mol L ?,则()()() -+ 5.5a c H K ()c A HA = 110c HA -?=?,故B 正确;C. a 点溶液的pH>7,对于曲 线2L ,由于A -离子水解导致溶液呈碱性,促进了水的 电离;而对于曲线1L ,MCl 溶液呈酸性,a 点时呈碱性,说明MOH 的电离程度大于+M 离子水解程度, 抑制水的电离,所以两溶液中水的电离程度不同,故C 错误;D ,曲线1L 中,()() +g c M l c MOH =0时,()() +g c M l c MOH =l , ()()-b 5 5.511K MOH =010c OH 1-->?>?,根据() b h W a K K = K K 或,可知,电离平衡常数越大,对应 离子的水解程度越小,则水解程度+A > VI -,则MA 溶液呈碱性,则 ()()-++-c H >c H c M (O )()c A 、,溶液中离子浓度大小为:()()+--(O c M )c A )H H (c c +>>>,故 D 正确。 12.答案:D 解析:A 对,由图示可知,第一层中,HCl 以分子形式存在。B 对,第二层中,已知 -42Cl:H O=10:1,+-HCl=H +Cl ,+H 和-Cl 的物质的量是相同的,设2H O 的物质的量为1mol,则 () + 4 H 10mol n -=,()3 23 0.1mol 18g/mol H O 20cm 0.02L g c 9m V -?==?=,故() 314mol 10mol L 0.02L 105c H --+-==??。C 对,第三层中,只有2H O 分子存在,所以冰的氢键网络结构保持不变。D 错,由A 项、C 项分析可知, 第一层和第三层中的物质均以分子形式存在,故均不存在可逆反应+-HCl H +Cl 垐?噲?。 13.答案:C 解析:图甲中,升高温度,lg K 减小,即K 减小,说明升高温度平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,该反应的0H ?<,A 项正确;图乙中,随着反应的进行,H 2O 2分解速率逐渐减小,B 项正确;图丙中,没有滴入NaOH 溶液时,0.1000mol/LHX 溶液的pH >1,HX 为一元弱酸,C 项错误;图丁中,横坐标越小,纵坐标越大,即-lg c (2- 4SO )越小,-lg c (Ba 2+)越大,说明c (2- 4SO )越大c (Ba 2+)越小,D 项正确, 综上所述,本题正确答案为C 。 14.答案:(1)>(2)<(3)①<②=(4)①710:1②> 解析:(1)pH 相等的NaOH 溶液与3CH COONa 溶液中() c OH -相等,分别加热到相同的温度后,NaOH 溶液中()c OH -不变,而3CH COONa 溶液中3CH COO -的水解平衡正向移动,() OH c - 增大,则3CH COONa 溶液中() c OH -大于NaOH 溶液中() c OH -,故3CH COONa 溶液的pH 大。 (2)物质的量浓度相同的盐酸与氨水混合后,溶液中的()() -4NH Cl c c +=,据电荷守恒可得()()()()4NH H Cl OH c c c c ++--++=,则有()()H OH c c +- =,此时溶液呈中性;若两溶液恰好完全 反应则生成4NH Cl ,所得溶液呈酸性,要使溶液呈中性,则有V (盐酸)<V (氨水)(3)①-10.2mol L ? HA 溶液与-10.1mol L ? NaOH 溶液等体积混合,二者充分反应后得到等浓度的HA 和 NaA 混合液,据电荷守恒可得()()()() Na H A OH c c c c ++--+=+,测得混合溶液中 ()()+Na A c c ->,则有()()H OH c c +-<,溶液呈碱性,说明-A 的水解程度大于HA 的电离程度, 故溶液中()()A HA c c -<。②据物料守恒可得,混合溶液中()() -1HA A 0.1mol L c c -?+=。 (4)10.1mol L -? HX 溶液与-11mol L ? NaOH 溶液等体积混合,二者恰好完全反应生成NaX ,测得混合溶液的pH =8,说明X -发生了水解反应,则HX 为一元弱酸。①混合溶液中NaX 发生水解反应,促进了水的电离,则由水电离出的() 6-1c OH 10mol L --?=;-10.1mol L ?溶液中OH -抑制了水的电离,则由水电离出的() 6-1OH 10mol L c --?=,故两溶液中由水电离出的() OH c -之比为710:1.②HX 为弱酸,4NH X 溶液呈中性,说明4NH +和X -的水解程度相同;将HX 溶液加入23Na CO 溶液中有气体放出,说明HX 的酸性强于23H CO ,根据盐类“越弱越水解”的规律可知,23CO -的水解程度大于X -,从而推知()432NH CO 溶液中23CO -的水解程度大于4NH +,故该溶液呈碱性,即pH >7. 15.答案:(1)酸性溶液吸收了空气中的2CO (2)①-33 OH +H AsO - 232H AsO +H O ②2.2 (3)①在pH 7~9之间,随pH 升高-24H AsO 转变为2- 4HAsO ,吸附剂X 表面所带负电荷增多,静电斥力增加; ②在pH 4~7之间,吸附剂X 表面带正电,五价砷主要以-24H AsO 和2-4HAsO 阴离子存在,静电引力较大;而三价砷主要以33H AsO 分子存在,与吸附剂X 表面产生的静电引力小;加入氧化剂,将三价砷转化为五价砷; 解析:(1)碱性溶液易吸收空气中的CO 2,CO 2与碱发生反应CO 2+2OH -=CO 32-+H 2O,故吸附剂X 中含有CO 32- (2)①观察图1知,在pH 为8~10之间,H 3AsO 3的分布分数逐渐减小,H 2AsO 3-的分布分数逐渐增大,故该过程中,NaOH 与H 3AsO 3反应生成NaH 2AsO 3和水,离子方程式为OH -+H 3AsO 3=H 2AsO 3-+H 2O ②由34H AsO 的第一步电离方程式知, ()() () 2434a c H c H AsO K c H AsO +- ?= ,观察图2知,当pH=2.2,即 () 2.210/c H mol L +-=时, 34H AsO 的分布分数和24H AsO -的分布分数相等,即2210a K -=,故 1 2.2lg10 2.2a a pK lgK -=-=-= (3)①吸附剂X 表面所带负电荷增多,静电斥力越大,在pH7~9之间,随pH 升高- 24H AsO 转变为 2-4HAsO ,吸附剂X 表面所带负电荷增多,静电斥力增加,导致在pH7~9之间,吸附剂X 对五价 砷的平衡吸附量随pH 升高而迅速下降, 故答案为:在pH7~9之间,随pH 升高-24H AsO 转变为2- 4HAsO ,吸附剂X 表面所带负电荷增多,静电斥力增加; ②在pH4~7之间,吸附剂X 表面带正电,五价砷主要以-24H AsO 和2- 4HAsO 阴离子存在,pH<7.1时带正电荷,pH 越低,表面所带正电荷越多,所以静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X 表面产生的静电引力小,所以在pH4~7之间,吸附剂X 对水中三价砷的去除能力远比五价砷的弱; 在pH4~7之间,吸附剂X 对水中三价砷的去除能力远比五价砷的弱,如果能将三价砷转化为五价砷,能有效的去除三价砷,所以采取的措施是加入氧化剂,将三价砷转化为五价砷, 故答案为:在pH4~7之间,吸附剂X 表面带正电,五价砷主要以-24H AsO 和2- 4HAsO 阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X 表面产生的静电引力小;加入氧化剂,将三价砷转化为五价砷。 必修一化学方程式及离子方程式小结 1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓ 2、碳酸根离子的检验:CaCl2 + N a2CO3 = CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓ 3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+== CO2↑+ H2O 4、木炭还原氧化铜:2CuO + C 2Cu + CO2↑ 5、钠与非金属单质反应: 4Na+O2=2Na2O 2Na+O2 Na2O2 Cl2 +2Na 2NaCl 6、钠与水反应:2Na+2H2O=2NaOH+H2↑ 2Na + 2H2O == 2Na+ + 2OH-+ H2↑ 7、氧化钠的主要化学性质:2Na2O+O2 2Na2O2 Na2O+H2O=2NaOH Na2O+SO3=Na2SO4 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O 8、过氧化钠的主要反应:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2 9、氯气的主要化学性质: Cl2 +H2 2HCl (或光照) 3Cl2 +2P 2PCl3 Cl2 +PCl3 PCl5 3Cl2 +2Fe 2FeCl3 Cl2 +2Na 2NaCl Cl2+Cu CuCl2 Cl2 +2FeCl2 =2FeCl3 Cl2 + 2Fe2+ == 2Fe3+ + 2Cl- 2Cl2+2NaBr=2NaCl+Br2 Cl2 + 2KI =2KCl + I2 Cl2 + 2I- == 2Cl - + I2 Cl2+H2O=HCl +HClO Cl2 + H2O == Cl- + H+ + HClO Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 + SO2 + 2H2O == 2Cl- + SO42- + 4H+ Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2 + 2OH- == Cl- + ClO- + H2O 10、铁及其化合物的主要化学性质:2Fe + 3Cl2 2FeCl3 3Fe + 2O2 Fe3O4 Fe + S FeS 3Fe+4H2O(g) Fe3O4+4H2 Fe+2HCl=FeCl2+H2↑ Fe+2H+ = Fe2+ + H2↑ Fe + CuSO4 = FeSO4 + Cu Fe + Cu2+ = Fe2+ + Cu 4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O 2FeCl2 + Cl2=2FeCl3 2FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2 FeCl3 + 3KSCN == Fe(SCN)3 + 3KCl 高二化学溶液中离子浓度大小比较专题(用) 一、相关知识点梳理: 1、电解质的电离 强电解质在水溶液中是完全电离的,在溶液中不存在电解质分子。弱电解质在水溶液中 是少部分发生电离的。多元弱酸如H 2CO 3 还要考虑分步电离: H 2CO 3 H++HCO 3 -;HCO 3 -H++CO 3 2-。 2、水的电离 水是一种极弱的电解质,它能微弱地电离, H 2 O H++OH-。水电离出的[H+]=[OH-] 在一定温度下,纯水中[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。 在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大。 3、盐类水解 在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。关于盐的水解有这么一个顺口溜“谁弱谁水解,谁强显谁性” 多元弱酸盐还要考虑分步水解,如CO 32-+H 2 O HCO 3 -+OH-、HCO 3 -+H 2 O H 2 CO 3 +OH-。 4、电解质溶液中的守恒关系 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。 如Na 2CO 3 溶液中:[Na+]+[H+]=[HCO 3 -]+2[CO 3 2-]+[OH-] 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。 如Na 2CO 3 溶液中n(Na+):n(c)=2:1,推出: c(Na+)=2c(HCO 3 -)+2c(CO 3 2-)+2c(H 2 CO 3 ) 水的电离守恒(也称质子守恒):是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。 如在0.1mol·L-1的Na 2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H 2 S)。 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH 4 HCO溶液中H O+、H CO为得到质子后的产物;NH、OH-、CO2-为失去质子后的产物,故有以下关系: c(H 3O+)+c(H 2 CO 3 )=c(NH 3 )+c(OH-)+c(CO 3 2-)。 列守恒关系式要注意以下三点: ①要善于通过离子发生的变化,找出溶液中所有离子和分子,不能遗漏。 ②电荷守恒要注意离子浓度前面的系数;物料守恒要弄清发生变化的元素各离子的浓 度与未发生变化的元素之间的关系;质子守恒要找出所有能得失质子的微粒,不能遗漏。 ③某些关系式既不是电荷守恒也不是物料守恒通常是两种守恒关系式通过某种变式 而得。 解题指导 电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。多年以来全国高考化 离子浓度大小比较练习 鲁迅中学城南校区王芳 1.下列溶液中微粒的物质的量浓度关系一定正确的是()。 A.25 ℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH+4) B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) C.在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c(NH+4)>c(OH-)=c(H+) 2.在25 ℃下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 A.混合溶液中由水电离出的c(OH-)小于0.2 mol·L-1HX溶液中由水电离出的c(H+) B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 C.c(Na+)-c(X-)=9.9×10-7mol·L-1 D.c(OH-)=c(HX)+c(H+)=1×10-8mol·L-1 3.下列有关电解质溶液中微粒的物质的量浓度关系正确的是 A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) B.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH+4)>c(H+)>c(OH -) C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和K W均增大 D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO2-4)>c(NH+4)>c(H+)>c(OH-) 4.下列浓度关系正确的是()。 A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) 高中化学方程式及离子方程式大全 1、向氢氧化钠溶液中通入少量CO2:2NaOH + CO2 ==== Na2CO3+ H2O 2、在标准状况下 2.24LCO2通入1mol/L 100mLNaOH溶液中:CO2+NaOH NaHCO3 3、烧碱溶液中通入过量二氧化硫:NaOH +SO2==NaHSO3 4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 5、氨水中通入少量二氧化碳:2NH3?H2O+CO2== (NH4)2 CO3+ H2O 6、用碳酸钠溶液吸收少量二氧化硫:Na2CO3+ SO2Na2SO3+ CO2↑ 7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc 9、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3 10、氯化铁溶液中通入碘化氢气体:2FeCl32Fe Cl2+ I2+2 H Cl 11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4 12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4 13、氯气通入水中:Cl2+H2O HCl+HClO 14、氟气通入水中:2F2+2H2O 4HF+O2↑ 15、氯气通入冷的氢氧化钠溶液中:Cl2+2 NaOH══NaClO+NaCl+ H2O 16、FeBr2溶液中通入过量Cl2:2FeBr2+ 3Cl2══2FeCl3+2 Br2 17、FeBr2溶液与等物质的量Cl2反应:6FeBr2+ 6C124FeCl3+2FeBr3+ 3Br2 18、足量氯气通入碘化亚铁溶液中:3Cl2+2FeI22FeCl3+2I2 19、在FeI2溶液中滴入少量溴水:FeI2 +Br2FeBr2+ I2 20、氯化亚铁溶液中滴入溴水:6FeCl2 + 3Br2══4FeCl3+2 FeBr3 21、钠与水反应:2Na+2H2O 2NaOH +H2↑ 22、铝片投入氢氧化钠溶液:2Al+ 2NaOH +6H2O 2 Na [Al(OH)4]+3H2↑ 23、氯化铁溶液中加入铁粉:2FeCl3+ Fe 3 FeCl2 24、FeCl3溶液与Cu反应:2FeCl3+ Cu CuCl2+2FeCl2 25、硫氢化钠溶液与碘反应:NaHS+I2S↓+ HI+NaI 26、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑ 27、铜与浓硝酸:Cu+4HNO3(浓)Cu(NO3)2+ 2NO2↑+ 2H2O 高中化学离子浓度大小比较练习题 一、单选题 -7 -11 -1 1.25 C° 时,H2CO3 ,的K al =4. 2 10-7,K a2=5. 6 10-11。室温下向10 mL0. 1 mol L-1 Na2CO3 中逐滴加入0. 1 mol L-1HCl 。图是溶液中含 C 微粒物质的量分数随pH 降低而变化的图像( CO2 因有逸出未画出)。下列说法错误的是( ) A. A 点溶液的pH<11 B. B 点溶液:c Na+=c HCO3-+c CO32-+c H2CO3 2- + C. A →B 的过程中,离子反应方程式为:CO23-H+HCO 3 D. 分步加入酚酞和甲基橙,用中和滴定法可测定 Na2CO 3 ,与NaHCO 3 ,混合物组成 - 1 -1 2.实验测得0.5mol L·- 1CH 3COONa 溶液、0.5mol L·-1 CuSO4 溶液以及H2O 的pH 随温度变化的曲线如图所示。下列说法正确的是( ) +- A. 随温度升高,纯水中c(H+)>c(OH - ) c R( COOH ) c(RCOOH)+c(RCOO -) CH 3CH 2COOH)溶液中 δRCOOH 与 pH 的关系如图所示。下列说法正确的是 ( ) A. 图中 M 、N 两点对应溶液中的 c(OH )比较:前者 >后者 B. 丙酸的电离常数 K= 10 4.88 C. 等浓度的 HCOONa 和CH 3CH 2 COONa 两种榕液的 pH 比较:前者 > 后者 D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液 中 : c Na >c H COOH >c H - COOH - >cc HO + 4. 常温下 ,Ksp(CaF 2)=4×10-9,Ksp (CaSO 4)=9.1×10-6。取一定量的 CaF 2固体溶于水 ,溶液中离子浓度 的 变化与时间的变化关系如图所示。下列有关说法正确 ( ) A. M 点表示 CaF 2 的不饱和溶液 B. 常温下 ,CaF 2的饱和溶液中 ,c(F -) = 10-3 mol/L C. 温度不变, t 时刻改变的条件可能是向溶液中加 了 KF 固体, CaF 2的 K sp 增大 D. 常温下 ,向 100 mL CaF 2的饱和溶液中加入 100 mL 0.2 mol/L Na 2SO 4溶液,平衡后溶液中的 c(Ca 2+) 约为 9. 1× 10-5 mol/L 5. 常温下将 NaOH 溶液滴加到己二酸( H 2X )溶液中,混合溶液的 pH 与离子浓度变化的关系如图 所 示。下列叙述错误的是( ) B. 随温度升 高, CH 3COONa 溶液的 c(OH )减小 C. 随温度升高, CuSO 4 溶液的 pH 变化是 K w 改变与水解平衡移动共同作用的结果 D. 随温度升高, 动方向不 CH 3COONa 溶液和 CuSO 4 溶液的 pH 均降低,是因为 CH 3COO - 、 Cu 2+水解平衡 移 3.25 C °时,改变 0. 1 mol/L 弱酸 RCOOH 溶液的 pH ,溶液中 RCOOH 分 子 的 物 质 的 量 分 数 δRCOOH 随 之 改 变 [ 已 知 δ(RCOOH )= ] ,甲酸 (HCOOH) 与丙酸 高二化学盐溶液中离子浓度大小比较练习题 一、单选题 1.下列说法正确的是( ) A.常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定等于7 B.在相同温度下,浓度均为0.1mol·L-1的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH4+)相同 C.在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.将CH3COOH和NaOH混合后,离子浓度有可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 2.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份溶液进行如下实验: (1)第一份加入AgNO3溶液有沉淀产生 (2)第二份加足量NaOH溶液加热后,收集到无色刺激性气味气体 (3)第三份加足量BaCl2溶液后,得白色沉淀,经足量盐酸洗涤后,沉淀部分溶解。 根据上述实验,以下推测正确的是( ) A.K+一定存在 B.CO32-一定存在 C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在 3.水的电离平衡曲线如图所示,下列说法正确的是( ) A.图中五点K W间的关系:B=C=A=D=E B.若从A点到D点,可采用:温度不变在水中加入少量的酸 C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 4.下列叙述正确的是( ) A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 D.向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液PH值增大 5.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 c(H+)/c(CH3COOH)值增大,可以采取的措施是( ) A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水 6.已知①氢硫酸是具有较强还原性的二元弱酸,②CuSO4+H2S=CuS↓+H2SO4。在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4。能使溶液中的c(H+)增大的是( ) A.①② B.②④ C.②③④ D.① 高中化学方程式 1、向氢氧化钠溶液中通入少量CO2: 2NaOH + CO2 ==== Na2CO3+ H2O 离子方程式:CO2+ 2OH- CO32-+ H2O 2、在标准状况下过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3 离子方程式:CO2+ OH- HCO3- 3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3 离子方程式:OH- +SO2 HSO3- 4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 离子方程式:CO2+ OH- HCO3- 5、氨水中通入少量二氧化碳: 2NH3?H2O+CO2== (NH4)2 CO3+ H2O 离子方程式:2NH3?H2O+CO2== 2NH4++2H2O 6、用碳酸钠溶液吸收少量二氧化硫: Na2CO3+ SO2 Na2SO3+ CO2↑ 离子方程式:CO32-+ SO2 SO32-+ CO2↑ 7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 离子方程式:CO32-+ CO2 +H2O══HCO3- 8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc 离子方程式:Pb(Ac)2+H2S=PbS↓+2HAc 9、苯酚钠溶液中通入少量二氧化碳: CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3 离子方程式:CO2+H2O+C6H5O-→C6H5OH+ HCO3- 10、氯化铁溶液中通入碘化氢气体: 2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl 离子方程式:2Fe3++2 H++2I- 2Fe 2++ I2+2 H+ 11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4离子方程式:2Fe3++ H2S== 2Fe 2++ S↓+2 H+ 12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2SO4+ 2HCl+H2SO4离子方程式:2ClO- +2SO2+ 2H2O══SO42-+ 2Cl-+2 H++SO42-13、氯气通入水中:Cl2+H2O HCl+HclO 离子方程式:Cl2+H2O H++Cl-+HClO 14、氟气通入水中:2F2+2H2O 4HF+O2↑ 离子方程式:2F2+2H2O 4HF+O2↑ .离子浓度大小比较专练 1(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列 叙述正确的是 A .在通入少量氯气,) ()(-+ClO c H c 减小 B .通入少量SO 2,溶液的漂白性增强 C .加入少量固体NaOH ,一定有c(Na +)=c(Cl -)+c(ClO -) D .加入少量水,水的电离平衡向正反应方向移动 解析:在氯水中存在如下平衡:Cl 2+H 2O 错误!未找到引用源。HCl +HClO 、H 2O 错误! 未找到引用源。H ++OH -、HClO 错误!未找到引用源。H ++ClO - 。A 中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B 中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C 中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。溶液中阴阳离子所带正负电荷总数相等,故存在 c(H +)+c(Na +)=c(OH -)+c(Cl -)+c(ClO -),但是c(H +)应该大于c(OH -),故此等式不成立,错误;D 中加水,即稀释氯水溶液的酸性减弱,即c(H +)减小,所以水的电离平衡向正向移动,正确。答案:D 2.(07年广东化学·15)下列各溶液中,微粒的物质的量浓度关系正确的是 A .0.1mol·L -1 Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H + )+2c (H 2CO 3) B .0.1mol·L -1NH 4Cl 溶液:c (NH 4+)=c (Cl -) C .向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c (Na +)>c (CH 3COO -)>c (H +)>c (OH -) D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液: C (Na +)=c (NO 3-) 溶液中离子浓度大小比较专题(用) 相关知识点: 1、电解质的电离 电解质溶解于水或受热熔化时,离解成能自由移动的离子的过程叫做电离。 强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子。弱电解质在水溶液中是少部分发生电离的。25℃0.1mol/L的如CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。多元弱酸如H2CO3还要考虑分步电离: H2CO3H++HCO3-;HCO3-H++CO32-。 2、水的电离 水是一种极弱的电解质,它能微弱地电离,生成H3O+和OH-,H2O H++OH-。在25℃(常温)时,纯水中[H+]=[OH-]=1×10-7mol/L。 在一定温度下,[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。 在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,水电离出的[H+]水和[OH-]水均小于10-7mol/L。在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大,水电离出的[H+]水或[OH-]均大于10-7mol/L。 3、盐类水解 在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。 强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。多元弱酸盐还要考虑分步水解,如CO32-+H2O HCO3-+OH-、HCO3-+H2O H2CO3+OH-。 4、电解质溶液中的守恒关系 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数 相等。 如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-] 如Na2CO3溶液中:c(Na+) +c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等, 但离子或分子中某种特定元素的原子的总数是不会改变的。 如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) =c(HAc)+c(Ac-); 如HAc 溶液中:c(HAc) 总 水的电离守恒(也称质子守恒):是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。 如在0.1mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)。 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的 溶液中的守恒规律及离子浓度大小的比较(两课时) 学习目标: 1、复习巩固弱电解质的电离和盐的水解的规律 2、学会书写电荷守恒,物料守恒,质子守恒的关系式 3、掌握单一溶液和混合溶液中离子浓度大小的比较规律 一、溶液中的守恒规律 1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷总数与所有的阴离子所带的负电荷总数相等。如:CH3COONa溶液中,n(Na+)+n(H+)=n(Ac-)+n(OH-) 推导出: c(Na+)+c(H+)=c(Ac-)+c(OH-) 一般用物质的量浓度表示等式关系 Na2CO3溶液,电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) 练习写出下列溶液的电荷守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 【注意】书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷的关系。【应用练习】: ①25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是 A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-) C.c(NH4+) 但离子或分子中某种特定元素的原子的总数是不会改变的。如Na2CO3溶液中n(Na+):n(c)=2:1,推出:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) CH3COONa溶液中物料守恒 c(Na+)=c(CH3COO-)+c(CH3COOH) 练习写出下列溶液的物料守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 3.质子守恒: 如碳酸钠溶液中由电荷守恒和物料守恒两式联立,将Na+离子消掉可得: c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。可以用图示分析如下: 由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。 练习:写出下列溶液的质子守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 达标练习: 写出下列溶液的三大守恒关系式 Na2S 电荷守恒 物料守恒 质子守恒 二、溶液中离子浓度大小的比较规律 (1)不同物质同种离子浓度比较型 离子浓度大小比较专题 一、电离理论和水解理论 1.电离理论: ⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。 【分析】由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O NH4++OH-, H2O H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)> c(NH4+)>c(H+)。 ⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。 【分析】由于H2S溶液中存在下列平衡:H2S HS-+H+,HS-S2-+H+, H2O H++OH-,所以溶液中微粒浓度关系为:c(H2S)>c(H+)>c(HS-)> c(OH-)。 2.水解理论: ⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。 ⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-, + 2H2O 2OH-+2H+, 2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。 ⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)> c(OH-),水解呈碱性的溶液中c(OH-)>c(H+); ⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如 Na2CO3溶液中微粒浓度关系。 下列反应是离子反应的写出离子方程式, 如不是离子反应写出化学方程式 1、氯化钠溶液滴加硝酸银溶液 2、钠与水反应 3、钠与硫酸铜溶液 4、过氧化钠与水反应 5、碳酸氢盐溶液与强酸溶液混合 6、碳酸氢盐溶液与醋酸溶液混合 7、氢氧化钙溶液与碳酸氢镁反应 8、向碳酸氢钙溶液中加入过量的氢氧化钠 9、向碳酸氢钙溶液中加入少量的氢氧化钠 10、澄清石灰水与少量小苏打溶液混合 11、澄清石灰水通入少量CO2 12、澄清石灰水通入过量CO2 13、碳酸氢钠溶液与少量石灰水反应 14、碳酸氢钠溶液与过量石灰水反应 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合 16、碳酸钠溶液与盐酸反应 17、向氢氧化钠溶液中通入少量的CO2 18、过量的CO2通入氢氧化钠溶液中 19、碳酸氢铵溶液中加入过量氢氧化钠溶液 20、碳酸钙与盐酸反应 21、碳酸钙与醋酸反应 22、澄清石灰水与稀盐酸反应 23、磷酸溶液与少量澄清石灰水 24、磷酸溶液与过量澄清石灰水 25、碳酸镁溶于强酸 26、硫酸镁溶液跟氢氧化钡溶液反应 27、硫酸溶液跟氢氧化钡溶液反应 28、硫酸氢钠溶液与氢氧化钡反应至中性 29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀 30、硫酸铝溶液中加入过量氢氧化钡溶液 31、氢氧化镁与稀硫酸反应 32、铝跟氢氧化钠溶液反应 33、物质的量之比为1:1NaAl合金置于水中 34、氧化铝溶于强碱溶液 35、氧化铝溶于强酸溶液 36、氢氧化铝与氢氧化钠溶液 37、氢氧化铝与盐酸溶液反应 38、硫酸铝溶液与碳酸氢钠溶液 39、硫酸铝溶液与碳酸钠溶液 40、氯化铝溶液中加入过量氨水 41、明矾溶液加热水解生成沉淀 42、氯化铝溶液与偏铝酸钠溶液 43、偏铝酸钠溶液中加入氯化铁溶液 44、偏铝酸钠溶液中加入少量盐酸 45、偏铝酸钠溶液中加入过量盐酸 46、偏铝酸钠溶液中加入氯化铵溶液 47、金属铁溶于盐酸中 48、铁粉与氯化铁溶液反应 49、铜与氯化铁溶液反应 50、硫化亚铁与盐酸反应 51、硫化钠与盐酸反应 52、硫化钠溶液中加入溴水 53、氯化亚铁溶液中通入氯气 54、向硫酸铁的酸性溶液中通入足量的H2S 55、氯化铁溶液中滴加少量硫化钠溶液 56、硫化钠溶液中滴加少量氯化铁溶液 57、氯化铁溶液中滴加少量碘化钾溶液 58、氯化铁溶液与氢氧化钠溶液反应 59、氯化铁溶液跟过量氨水反应 60、氯化铁溶液与硫氰化钾溶液 离子浓度大小比较专题 一、电离理论和水解理论 1.电离理论: ⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的 电离的存在;例如 NH3·H2O 溶液中微粒浓度大小关系。b5E2RGbCAP 【分析】 由于在 NH3· H2O 溶液中存在下列电离平衡: NH3· H2O NH4++OH-, H2O 第六讲:《离子浓度大小比较》 一、解题思路 大小关系:盐溶液中的离子 > 水解平衡或电离平衡产生的离子 1.无反应:电荷守恒 三等式:原子守恒 质子守恒 2.有反应:先反应后比较 二、分类比较 (一)无反应的溶液中离子浓度大小比较 1.CH3COONa 溶液 2.Na2CO3溶液 3.NaHCO3溶液 4.H2SO3溶液 5.浓度相同的下列溶液中NH4+浓度最大的是 A. NH4Cl B. NH4HSO4 C. CH3COONH4 D. (NH4)2 SO4 (二)与反应有关的溶液中离子浓度大小比较 6.0.1mol/L HAC与0.1mol/L NaOH溶液等体积混合,混合后溶液中离子浓度关系: 7.0.2mol/L HAC与0.1mol/L NaOH溶液等体积混合,混合后溶液中离子浓度关系:8.0.2mol/L NaAC与0.1mol/L HCl溶液等体积混合,混合后溶液中离子浓度关系:9.pH=3的HAC与pH=11的NaOH溶液等体积混合,混合后溶液中离子浓度关系: 10.向10mL0.1mol/L HAC中加入0.1mol/L的NaOH 使溶液呈中性,混合后溶液中离子浓度关系如何? 加入NaOH溶液的体积 10mL(填大于,小于或等于) 11.向150mL1 mol/L的NaOH溶液中通入标准状况下2.24L 的CO2 ,充分反应后溶液中离子 浓度关系如何? 12.某溶液中含有Na +、 AC -、 H +、OH - 四种离子,溶液中溶质可能是什么?对应溶液的酸碱 性如何? 三、同步练习 1.下列溶液,阴离子总浓度最小的是 A. 0.2 mol / L NaCl B. 0.1 mol / L Mg(OH)2 C. 0.2 mol / L K 2S D. 0.2 mol / L (NH 4)2SO 4 2.硫化钠水溶液中存在着多种离子和分子,下列关系式正确的是 A. c (OH -)=c (HS -)+c (H +)+c (H 2S ) B. c (OH -)=c (HS -)+c (H +)+2 c (H 2S ) C. c (Na +)=c (S 2-)+c (HS -)+c (H 2S ) D. c (Na +)=2 c (S 2-)+2 c (HS -)+2 c (H 2S ) 3.将0.1mol ·L -1的醋酸钠溶液20mL 与0.1mol ·L -1盐酸10mL 混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是 A .c (CH 3COO -)>c (Cl -)>c (CH 3COOH )>c (H +) B .c (CH 3COO -)>c (Cl -)>c (H +)> c (CH 3COOH ) C .c (CH 3 COO -)= c (Cl -)>c (H +)> c (CH 3COOH ) D .c (Na +)+c (H +)= c (CH 3COO -)+ c (Cl -)+c (OH -) 4.将相同物质的量浓度的某弱酸HX 与NaX 溶液等体积混合,测得混合溶液中C (Na +)> C(X -),则下列关系错误的是 A .C (OH -) 离子浓度大小的比较 1?关于小苏打水溶液的表述不正确的是 ( ) A 、C ( Na +)=C(HCO 3-)+C(CO 32-)+C(H 2CO 3) B 、 C ( Na + ) +C(H +)=C(HCO 3-)+C(CO 32-)+C(OH -) D 、存在的电离有 :NaHCO 3 = Na + + HCO 3 , HCO 3 H + + OH 2?常温下,将PH = 2的盐酸与 PH = 12的氨水等体积混合后,离子浓度的关系正确的是 ( ) A 、 C ( C 「) >C(NH 4+)>C(H +)>C(OH -) B 、 C(NH 4+)> C ( Cl -) > C(H +)>C(OH -) C 、C ( Cl -) =C(NH 4+)>C(H +)=C(OH -) D 、C(NH 4+)>C ( Cl -) >C(OH -)>C(H +) 3. (09四川卷12)关于浓度均为0.1 mol/L 的三种溶液:①氨水、②盐酸、③氯化铵溶液, 下列说法不正确的是 A. c ( NH +4厂③〉① B 水电离出的c (H +):②〉① C. ①和②等体积混合后的溶液:c ( H + )= c(OH l+c(NH 3H 2O) D. ①和③等体积混合后的溶液:c ( NH +4 )> c(Cl ")>c(OH ")> c(H +) 4. 已知乙酸(HA )的酸性比甲酸 (HB )弱,在物质的量浓度均为 0.1mol/L 的NaA 和 NaB 混合溶液中,下列排序正确的是 ( ) 5 .常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH = 7 ,则此溶液中 c 、HCO 3 —的电离程度小于 HCO 3—的水解程度 H ++ CO 32—, H 2O A. c (OH)> c (HA)> c (HB)> c (H + ) C . c (OH -)>c (B -)> c (A -)> c (H +) B. C (OH -)>C (A -)>C (B -)> c (H + ) D . c (OH -)> c (HB)> c (HA)> c (H + ) A. [CH3COO — ] > [Na + ] B. [CH3COO — ]v [Na + ] 资料收集于网络,如有侵权请联系网站删除 .离子浓度大小比较专练 1(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是 ?)(Hc A.在通入少量氯气,减小?c(ClO)B.通入少量SO,溶液的漂白性增强2+- +c(ClOC.加入少量固体NaOH,一定有c(Na)=c(Cl D.加入少量水,水的电离平衡向正反-) ) 应方向移动 +HCl+HClOO解析:在氯水中存在如下平衡:Cl+H、H222-+H+ClO。+-、OHOH A中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增HClO多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。溶液中阴阳++---+)c(H,)+c(ClO离子所带正负电荷总数相等,故存在c(H)+c(Na但是)=c(OH))+c(Cl-),故此等式不成立,错误;c(OHD中加水,即稀释氯水溶液的酸性减弱,应该大于+)减小,所以水的电离平衡向正向移动,正确。答案:D 即c(H2.(07年广东化学·15)下列各溶液中,微粒 的物质的量浓度关系正确的是 -1--+)COH)+2c(H)+Lc NaCO溶液:(OH)=c(HCOc(0.1mol·A.33223-1+-))=c(Cl.0.1mol·L 溶液:NHClc(NHB44C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: ()OHHCOOcc(Na)>(CH)>c()>3 5的混合溶液:.向硝酸钠溶液中滴加稀盐酸+-+-c 得到的DpH=-+)NOcNaC()=(3 只供学习与交流. 资料收集于网络,如有侵权请联系网站删除 解析:溶液中离子浓度大小比较要综合运用电离平衡,盐类水解知识,要记住三个守恒:电+- 的物质的量相等,OH根据质子守恒,水电离出的H和荷守恒、物料守恒、质子守恒。A++-+(NH 水解,cB中由于NHH溶液中分别以HCO、H、HCO形式存在,故A对,NaCO4243323-+++--,因为)+ c(CHCOO)错,C中根据电荷守恒有:c(Na)+ c(H)==c(OH(Cl与c)不等,B3-+--++c(H)>c(OH),故c(CHCOO)>c(Na),C错。D中Na、NO不水解加入稀盐酸后二33者的物质的量浓度比仍是1:1,故D对。答案:AD 3.(08年广东化学·17)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是 2--和,溶液中的阴离子只有COOHA.在NaHCO溶液中加入与其等物质的量的NaOH33+-) c(OHc(HCO.BNaHCO溶液中:c(H)=)+332-1CHCOOH溶液加入等物质的量的10 mL0.10 mol·LNaOH后,溶液中离子的浓度C.3+--+) c(H)(CHCOO>)>c(OH由大到小的顺序是:c(Na)>c3D.中和体积与pH都相同的HCl溶液和CHCOOH溶液所消耗的NaOH物质的量相同3 2--,所以ACO溶液,CO错;会发生水解,生成HCO解析:A中,生成Na33322++-- 电荷守恒:C(H)+C(Na332+-+-)+C(HC(COCO) 物料守恒: -) )=C(HCO)+2C(CO)+C(OH C(Na)=C(HCO) 33322+--所以B错误。CO)=C(CO) )+C(OHH两式相减得:C()+C(H323-,高一必修一化学方程式及离子方程式总结
高二化学溶液中离子浓度大小比较专题
离子浓度大小比较练习
高中化学方程式与离子方程式大全
高中化学离子浓度大小比较练习题(附答案)
高二化学盐溶液中离子浓度大小比较练习题(附答案)
高中化学离子方程式大全
高中化学离子浓度大小比较专练
化学选修4溶液中离子浓度大小比较专题复习资料
溶液中的守恒规律和离子浓度大小的比较
高中化学《离子浓度大小比较》专题讲解及例题分析
高中化学离子方程式书写汇总练习题
高中化学《离子浓度大小比较》专题讲解及例题分析
H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。p1EanqFDPw ⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如 H2S 溶液中微粒浓度大小关系。 【分析】由于 H2S 溶液中存在下列平衡:H2S HS-+H+,HSS2-+H+,H2O
H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。DXDiTa9E3d 2.水解理论: ⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如 NaHCO3 溶液中有:c(Na+)>c(HCO3-)。 ⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及 产生 H+的(或 OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的 酸性溶液中 c(H+) (或碱性溶液中的 c(OH-)) 总是大于水解产生的弱电解质的浓度; 例如 (NH4) 2SO4 溶液中微粒浓度关系。RTCrpUDGiT 【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-, + 2H2O 2OH-+2H+,
2 NH3·H2O,由于水电离产生的 c(H+)水=c(OH-)水,而水电离产生的一部分 OH-与 NH4+结合产生 NH3·H2O,另一部分 OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-) >c(H+)>c(NH3·H2O)>c(OH-)。5PCzVD7HxA ⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中 c(H+)>c(OH-),水解呈碱 性的溶液中 c(OH-)>c(H+);jLBHrnAILg ⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如 Na2CO3 溶液中微 粒浓度关系。 【分析】 因碳酸钠溶液水解平衡为: CO32-+H2O HCO3-+OH-, H2O+HCO3H2CO3+OH-,
xHAQX74J0X
所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)>c(OH-)。 二、电荷守恒和物料守恒 1.电荷守恒:专题复习6:离子浓度大小比较
离子浓度大小的比较练习题(精选)
高中化学离子浓度大小比较专练
